两种瑶药酊剂微生物限度检查方法适用性试验及结果分析
刘康连 庞云娟 龙文洲 颜金兰 庞兰英 莫海涛


【摘 要】 目的:按照《中国药典》2020年版对两种瑶药酊剂抗风湿骨痛酊和抗骨质增生酊的微生物限度检查进行适用性试验,为有较强抑菌作用冲洗量较大的酊剂提供适用性试验的方法参考。方法:对有较强抑菌作用的抗风湿骨痛酊、抗骨质增生酊,按照《中国药典》2020年版四部中相关的规定,采用稀释法结合薄膜过滤法进行需氧菌总数、霉菌和酵母菌总数的计数方法适用性试验。控制菌采用增菌液常规法、增菌液稀释法和薄膜过滤法循序、科学、合理地进行适用性研究试验。 结果:采用优选的方法进行微生物限度检查验证时,两种酊剂的计数方法回收比值均在0.5~2.0范围内,控制菌适用性试验中试验组均能检出所加试验菌相应的反应特征。结论:所采用的方法符合《中国药典》2020年版四部通则的有关规定。
【关键词】 酊剂;微生物限度检查;适用性试验;薄膜过滤法
【中图分类号】R29 【文献标志码】 A【文章编号】1007-8517(2022)14-0026-05
Experimental Study on Applicability of Microbial Limit Test for 2 Kinds of Yao Medicine Tinctures and Result Analysis
LIU Kanglian1PANG Yunjuan1*LONG Wenzhou1YAN Jinlan2PANG Lanying1MO Haitao3
1.Yulin Center for Food And Drug Control, Yulin 537000,China;
2.Guilin Medical University, Guilin 541004,China;
3. Guangxi Zichi Pharmaceutical Technology Co., Ltd. Nanning 530299,China
Abstract: Objective According to the Chinese Pharmacopoeia 2020 edition, the applicability of Microbial Limit Test for two kinds of Yao medicine tinctures was studied and the results were analyzed, it provides a reference for the establishment of the method of microbial limit test for Chinese Patent Medicine Capsules, reduces the Times of test and improves the efficiency of test. Methods In accordance with the relevant provisions of the 2020 edition of the Chinese Pharmacopoeia in four volumes, the anti-rheumatic Gutong tincture and anti-bone Hyperplasia tincture, which have strong bacteriostatic effect, the count method of aerobic bacteria, mould and yeast was carried out by dilution method and membrane filtration method. In order to control bacteria, routine method, dilution method and membrane filtration method were used to study the applicability of the control bacteria. Results The recovery ratios of the two tinctures were all in the range of 0.5-2.0, in the control bacteria suitability test, the test group could detect the corresponding response characteristics of the tested bacteria.Conclusion The method adopted is in accordance with the relevant provisions of the four general principles of the 2020 edition of the Chinese Pharmacopoeia.
Key words:Tinctures;Microbial Limit Test ; Applicability Test;Membrane Filtration
抗風湿止痛酊和抗骨质增生酊均为玉林市中医医院院内制剂,为瑶方外用液体制剂,疗效确切,可广泛应用于临床。目前中药外用酊剂疗效显著,前景广阔[1], 对其进行微生物限度的检查是控制药品质量的重要检查项目之一,控制其质量是保证临床安全用药的前提[1-4]。本研究根据其给药途径和处方,按照《中华人民共和国药典》(以下简称《中国药典》)2020年版四部通则1107的有关规定[4],对其进行需氧菌总数、霉菌和酵母菌总数进行计数方法的适用性试验以及控制菌——金黄色葡萄球菌、铜绿假单胞菌的检查的适用性试验,建立抗风湿止痛酊和抗骨质增生酊的微生物限度检查法并加以验证,保证微生物限度检查方法的科学性、可靠性和准确性,为确保其微生物限度检查指标符合要求,更好地控制其质量提供标准依据。
1 材料与仪器
1.1 实验菌株 枯草芽孢杆菌[CMCC(B)63501],金黄色葡萄球菌[CMCC(B)26003],铜绿假单胞菌[CMCC(B)10104],白色念珠菌[CMCC(F)98001],黑曲霉[CMCC(F)98003],大肠埃希菌[CMCC(B)44102],从广东环凯微生物科技有限公司购买西林瓶冻干粉菌种,实验室进行复活传代并制备成甘油冻存管保存。其中铜绿假单胞菌、大肠埃希菌、黑曲霉使用的是第二代,枯草芽孢杆菌、白色念珠菌使用的是第三代,金黄色葡萄球菌使用的是第四代。
1.2 培养基与试剂 胰酪大豆胨琼脂培养基TSA、胰酪大豆胨液体培养基TSB、沙氏葡萄糖琼脂培养基SDA,沙氏葡萄糖液体培养基SDB、pH 7.0无菌氯化钠-蛋白胨缓冲液、甘露醇氯化钠琼脂培养基、溴化十六烷基三甲铵琼脂培养基、(北京陆桥技术有限责任公司所产);0.9%无菌氯化钠溶液(广东光华科技股份有限公司)、吐温80(天津市大茂化学试剂厂)。
1.3 仪器 霉菌培养箱(广东省医疗器械厂,型号LRH-150-M),SPX-150F-Ⅱ型生化培养箱(上海龙跃仪器有限公司),生物安全柜(苏州安春游空气技术有限公司,型号BHC-1300HA2),立式压力蒸汽灭菌器(雅马拓科技贸易有限公司,型号SQ810C),真空泵两头套装(密理博Milliflexplus)S25型圆周振荡器(德国IKA),电动助吸器Eppendorf Easypet 3(德国Eppendorf)、艾本德移液器(100~1000 μL,德国Eppendorf)等。
1.4 试验样品 抗风湿骨痛酊(批号:200403、200410、200417),抗骨质增生酊(批号:200424、200508、200515),均由广西玉林市中医医院提供。
2 方法
2.1 菌悬液的制备 按照《中国药典》2020年版四部关于菌种的培养制备要求,并参考菌悬液制备方法进行制备,制备成每1mL含菌数不大于100cfu的菌悬液,备用。
2.2 实验方法[5-6]2.2.1 方法1 1∶10供试液10mL(即原液1mL)/膜。取本品10mL加至90mL含1%聚山梨酯80的pH 7.0无菌氯化钠蛋白胨缓冲液中,制成1∶10的供试液,1∶10供试液10mL薄膜过滤,冲洗量从100mL开始,以2倍递增的冲洗量至800mL。
2.2.2 方法2 1∶10供试液10mL(即原液1mL)/膜。取1∶10供试液10mL加至90mL0.9%无菌氯化钠溶液中,薄膜过滤,用0.9%氯化钠溶液冲洗,每次冲洗100mL,以2倍递增的冲洗量至800mL。
2.2.3 方法3 1∶10供试液1mL/膜。取1∶10供试液1mL加至100mL0.9%无菌氯化钠溶液中,薄膜过滤,冲洗量从100mL开始。
2.3 回收率试验[6-8]试验组:取已灭菌的薄膜过滤器,每个滤器先加入约20mL稀释液润湿滤膜,再分别按“2.2”中方法操作加入供试液后,分别取不大于100 cfu的菌液1mL,并缓慢地把菌液分散打进薄膜过滤器中与稀释液、供试液相混,抽滤。再分别按照上述冲洗量进行冲洗,滤干后,取膜贴种于提前准备好的琼脂培养基平板。
菌液组:不含聚山梨酯80的稀释液替代供试液,按试验组操作,將相应菌液按照薄膜过滤法过滤,每一种培养基的菌液组平行制备2张膜,将膜贴种于相应培养基。
中和剂对照组:用稀释液替代供试液,同试验组操作,将相应菌液按照薄膜过滤法过滤,每一种培养基的菌液组平行制备2张膜,将膜贴种于相应培养基。
供试品对照组:除不加菌液外,其余操作同试验组,按照一定的冲洗量冲洗,每一种培养基的供试品对照组平行制备2张膜,将膜贴种于相应培养基。
需氧菌总数计数相应的培养基为胰酪大豆胨琼脂培养基,试验菌预实验选金黄色葡萄球菌作为敏感菌株,验证试验为金黄色葡萄球菌、枯草芽胞杆菌、铜绿假单胞菌、白色念珠菌、黑曲霉。霉菌和酵母菌总数计数倾注的计数培养基为沙氏葡萄糖琼脂培养基,试验菌株预实验为白色念珠菌,验证试验为白色念珠菌、黑曲霉。待培养基凝固后,胰酪大豆胨琼脂培养基平板于33 ℃培养,沙氏葡萄糖琼脂培养基平板于23 ℃培养,其中试验菌为枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌的胰酪大豆胨琼脂培养基平板培养不超过3 d,试验菌为白色念珠菌和黑曲霉的培养基平板培养不超过5 d。
结果判断:中和剂对照组和试验组的加菌回收比值均在0.5~2范围内则照该供试液制备方法和计数法测定供试品的需氧菌总数、霉菌和酵母菌总数的回收比值,若任一次试验中比值低于0.5,应采用适宜的方法重新进行方法验证。
中和剂对照组加菌回收比值=中和剂对照组的菌落数-菌液对照组的菌落数/菌液对照组菌落数。试验组加菌回收比值=试验组菌落数-供试品组菌落数)/菌液对照组菌落数。
3 微生物计数法适用性试验结果[7-10]3.1 需氧菌总数计数方法预试验结果 取每个品种的1个批号按“2.1”至“2.3”的顺序进行加菌预试验,预试验结果见表1。
根据预试验金黄色葡萄球菌回收比值结果,1∶10供试液10mL 直接薄膜过滤和1∶10供试液10mL加至90mL稀释液中薄膜过膜,冲洗量800mL/膜时,抗风湿骨痛酊和抗骨质增生酊的金黄色葡萄球菌回收比值均小于0.5,说明抗风骨痛酊和抗骨质增生酊对金黄色葡萄球菌有较强的抑菌作用,此两法仍未能消除供试品溶液对金黄色葡萄球菌的抑菌作用。而采用 1∶10供试液1mL加至100mL稀释液中,过膜、冲洗量100mL/膜的方法,抗风湿止痛酊和抗骨质增生酊试验组中金黄色葡萄球菌回收比值分别为0.86和0.77,而且中和剂对照组的菌落数与菌液对照组的菌落数比值为0.98,在0.5~2范围内,表明两种瑶药酊剂采用该方法进行需氧菌总数计数应该可行。
3.2 霉菌和酵母菌总数计数方法预试验结果 选白色念珠菌作为霉菌和酵母总数计数方法的预试验菌,取每个品种的1个批号按照“2.2.1”进行预试验。预试验结果见表2。
根据预试验白色念珠菌回收比值结果,抗风湿骨痛酊1∶10供试液10mL,薄膜过滤,冲洗量100mL/膜的试验组白色念珠菌回收比值为0.91,在0.5~2范围内,采用该方法进行霉菌和酵母菌总数计数应该可行。抗骨质增生酊1∶10供试液10mL,薄膜过滤,冲洗量200mL/膜的试验组白色念珠菌回收比值为0.58,而且中和剂对照组的菌落数与菌液对照组的菌落数比值为1.02,在0.5~2范围内,采用该方法进行霉菌和酵母菌总数计数应该可行。
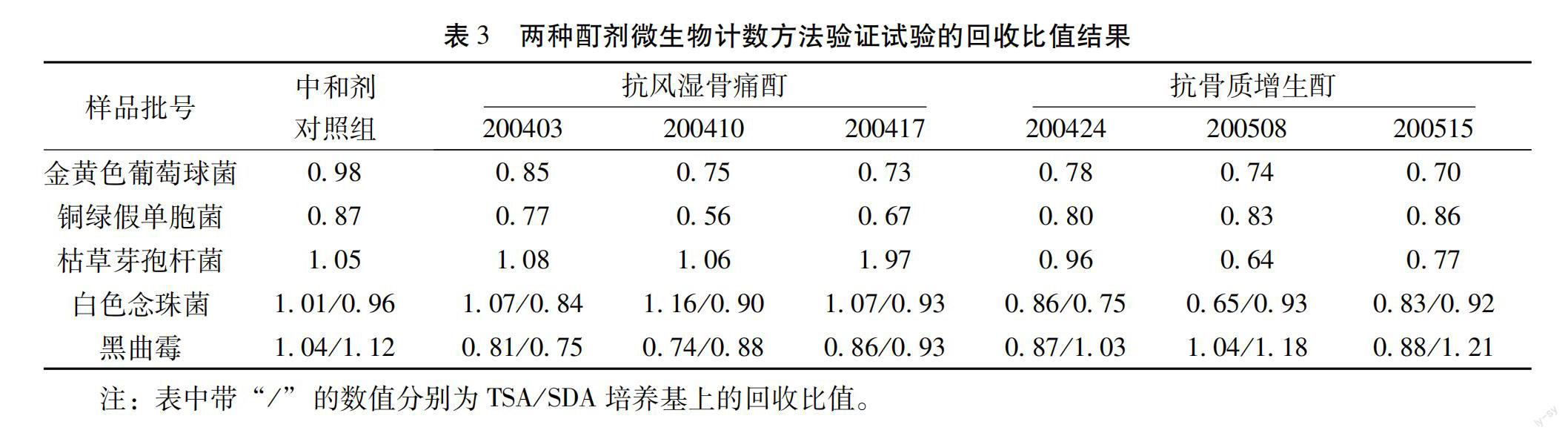
3.3 微生物计数法验证试验结果 根据预试验的结果,需氧菌总数计数:抗风湿骨痛酊和抗骨质增生酊按照薄膜过滤法(1∶10供试液1mL加至100mL稀释液中,冲洗量100mL/膜)进行3个批号5种试验菌的加菌回收试验;霉菌和酵母菌总数计数:抗风湿骨痛酊按照薄膜过滤法(1∶10供试液10mL,冲洗量100mL/膜)、抗骨质增生酊按照薄膜过滤法(1∶10供试液10mL,冲洗量200mL/膜)进行3个批号2种试验菌的加菌回收试验。结果见表3。
验证试验结果表明,采用薄膜過滤法(1∶10供试液1mL加至100mL稀释液中,冲洗量100mL/膜)对抗风湿骨痛酊和抗骨质增生酊需氧菌总数的测定进行加菌回收,胰酪大豆胨琼脂培养基(TSA)规定的5种试验菌回收比值均在0.5~2范围内;抗风湿骨痛酊采用采用薄膜过滤法(1∶10供试液10mL,冲洗量100mL/膜)进行霉菌和酵母菌总数的测定进行加菌回收,抗骨质增生酊采用薄膜过滤法(1∶10供试液10mL,冲洗量200mL/膜)进行霉菌和酵母菌总数的测定进行加菌回收,沙氏葡萄糖琼脂培养基(SDA)规定的两种试验菌的回收比值均在0.5~2范围内。符合《中国药典》2020年版四部通则1105(非无菌产品微生物:微生物计数法)的有关规定,方法可行。
3.4 样品需氧菌总数、霉菌和酵母菌总数检查结果 分别取抗风湿止痛酊和抗骨质增生酊各3批,按上述确定的方法进行需氧菌总数、霉菌和酵母菌总数的检查,结果样品中需氧菌总数菌均小于10 cfu/mL,霉菌和酵母菌总数均小于1 cfu/mL,符合相关规定。
4 控制菌检查方法适用性试验及结果
4.1 金黄色葡萄球菌
4.1.1 直接接种法[9-12]试验组:分别取1∶10供试液10mL接种至100mL、200mL、300mL、400mL、500mL胰酪大豆胨液体培养基(TSB)中,同时加入金黄色葡萄球菌不大于100 cfu,30~35 ℃培养18~24 h。取培养物划线接种于甘露醇氯化钠琼脂培养基平板,30~35 ℃培养18~72 h,观察其菌落形态。阴性菌对照组:取大肠埃希菌作为阴性对照试验菌,方法同试验组。
4.1.2 薄膜过滤法[13-15]试验组:分别取1∶10供试液10mL过膜,分别冲洗100mL/膜、200mL/膜、300mL/膜,在最后一次冲洗液中加入不大于100 cfu金黄色葡萄球菌,滤膜接种至100mL胰酪大豆胨液体培养基(TSB)中, 余下操作同直接接种法。
4.2 铜绿假单胞菌 试验组:分别取1∶10供试液10mL接种至100mL、200mL胰酪大豆胨液体培养基(TSB)中,同时加入金黄色葡萄球菌不大于100 cfu,30~35 ℃培养18~24 h,按药典规定检查。阴性菌对照组:取大肠埃希菌作为阴性对照试验菌,方法同试验组。
4.3 控制菌适用性试验结果 两种酊剂分别先取其中1个批号按上述方法进行预试验,试验结果为阴性对照组菌无菌落生长。两种酊剂试验组结果见表4。再根据预实验结果各取3个批号的样品,进行加菌验证试验。结果见表5。
3批样品的控制菌适用性试验结果表明,采用薄膜过滤法(1∶10供试液10mL过膜,冲洗量300mL/膜,滤膜接种至100mLTSB)对抗风湿骨痛酊、抗骨质增生酊的金黄色葡萄球菌的测定进行加菌验证试验,采用直接接种法(1∶10供试液10mL接种至200mLTSB)对抗风湿骨痛酊、抗骨质增生酊的铜绿假单胞菌的测定进行加菌验证试验,符合《中国药典》2020年版四部通则1106(非无菌产品微生物限度检查:控制菌检查法)的有关规定,方法可行。
4.4 样品控制菌检查结果 分别取抗风湿止痛酊和抗骨质增生酊各3批,按上述确定的方法进行控制菌金黄色葡萄球菌、铜绿假单胞菌的检查,结果样品中均未检出金黄色葡萄球菌和铜绿假单胞菌(1mL)。
5 结果分析和讨论[16-17]5.1 计数方法适用性试验方法的选择 抗风湿止痛酊和抗骨质增生酊均为液体外用制剂,其微生物限度标准如下:需氧菌总数不超过102cfu/mL;霉菌和酵母菌总数不超过101cfu/mL;不得检出金黄色葡萄球菌、铜绿假单胞菌(1mL)。两种酊剂的溶剂均为55%乙醇,有一定的抑菌作用,用1%聚山梨酯80的pH7.0无菌氯化钠蛋白胨缓冲液作为稀释液样品容易过滤,所以在确定需氧菌总数计数、霉菌和酵母菌总数计数的测定方法时,在供试液容易过膜的情况下,优先采用薄膜过滤法。
5.2 稀释剂的选择 抗风湿骨痛酊、抗骨质增生酊处方及工艺中并未加入油性物质,但是用pH 7.0无菌氯化钠蛋白胨缓冲液作为稀释液时,所制备供试液难以过膜,且后续冲洗液也是很难过滤冲洗,而用1%吐温80的pH 7.0无菌氯化钠蛋白胨缓冲液作为稀释液时,则供试液很容易过膜且后续冲洗液过滤是顺畅快速的。笔者查阅了按照2015年《中国药典》进行研究的相关文献以及工作中收到药品生产企业的微生物限度方法学研究资料结合笔者在酊剂微生物限度检查适用性试验中发现,采用薄膜过滤法对酊剂进行微生物限度检查时,用含1%吐温80的pH 7.0无菌氯化钠蛋白胨缓冲液作为稀释液时,可解决酊剂供试液堵膜、过滤不畅这一难题。
5.3 冲洗量的选择以及加菌环节的选择 抗风湿骨痛酊、抗骨质增生酊计数方法预实验结果显示:方法1、方法2冲洗量至800mL时,回收比值均小于0.5,表明两种酊剂均对金黄色葡萄球菌有较强的抑制作用,而方法3冲洗量为100mL时,回收比值均能到达要求。所以对于抑菌作用较强的酊剂验证方案可采用1∶10供试液10mL直接过滤、1∶10供试液10mL加至90mL稀释液中混匀过滤、1∶10供试液1mL加至100mL稀释液中混匀过滤的顺序进行。采用薄膜过滤法进行药品微生物限度检查适用性试验时,冲洗量可以选择每次100mL,最大冲洗量为500mL为宜。这样可以更快速试验出酊剂科学、快捷、有效的微生物限度检查计数方法。
目前药典并未明确薄膜过滤法在计数方法适用性试验的加菌环节,抗风湿骨痛酊、抗骨质增生酊两种瑶药酊剂的计数方法适用性試验均采用前加菌,即在供试液或稀释后的供试液中加菌后过滤,再进行冲洗。前加菌更能反映药品本身抑菌作用的强弱,在样品的特性允许以及冲洗量不大于500mL的情况下可尽量选择前加菌试验。
参考文献
[1]马林纳,白明,苗明三. 中药酊剂临床外用现状与分析[J]. 中华中医药杂志,2021,36(1):532-535.
[2]庞云娟, 樊文研, 刘康连, 等. 药品微生物限度检查方法学验证的研究进展[J]. 中成药, 2017, 39(10):2137-2140.
[3]胡昌勤.药品微生物控制现状与展望[J]. 中国药学杂志, 2015, 50(20):1747.
[4]国家药典委员会. 中华人民共和国药典(2020年版四部)[M]. 北京:中国医药科技出版社, 2020:160-171.
[5]赵雪卫,王红然,张西果. 滴眼用利福平微生物限度检查方法的建立[J]. 化工管理,2013(12):130.
[6]庞云娟, 刘康连, 周晓婷. 4种口服液微生物限度检查法验证[J]. 医药导报, 2017, 36(8)增刊: 82-85.
[7]徐晖. 止得咳颗粒剂制备工艺及质量标准的研究[D]. 南宁:广西中医药大学,2019.
[8]王玲,郭志廷,杨峰,等. 薄膜过滤法在中药常山散微生物限度检查中的应用研究[J]. 中国兽医杂志,2019,55(5):99-103.
[9]刘康连, 庞云娟, 周晓婷.5种同名异型中药制剂微生物限度检查法的建立与结果分析[J]. 中成药, 2017, 39(70): 1515-1518.
[10]夏天,崔迎,任文鑫,等. 清火片(胶囊)微生物限度检查方法适用性试验[J]. 安徽医药,2021,25(6):1114-1117.
[11]迟雪洁, 刘欣. 活血通络搽剂微生物限度检查方法的建立[J]. 山东中医药大学学报, 2018, 42(1): 83-85.
[12]滕钰, 徐洪, 邹莉, 等. 重楼解毒酊微生物限度检查方法适用性探讨[J]. 中成药, 2019, 41(4): 951-953.
[13]汪琦, 李雄英, 吴智娟, 等. 肤宁洗剂微生物限度检查方法的建立及验证[J]. 浙江中西医结合杂志, 2017, 27(8): 713-716.
[14]关迪, 曹晓云. 风油精微生物限度检查方法适用性的建立[J]. 中国药品标准, 2020, 21(3): 239-243.
[15]王俊. 伤痛克酊微生物限度检查方法建立[J]. 中国民族民间医药, 2017, 26(23): 34-38.
[16]杨群, 肖文涛. 两种中药酊剂微生物限度检查方法适用性研究[J]. 药品评价, 2020, 17(17): 30-32.
[17]张秀花,刘艳平,任仲丽. 10组同名异型中药制剂微生物限度检查方法的建立[J]. 中国药物经济学,2021,16(5):118-124
(收稿日期:2021-11-28 编辑:刘 斌)

