金丝桃苷对黄嘌呤氧化酶的抑制作用及分子机理
王 敏,徐国辉,赵一灵,王刚强,黄赣辉,
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.江西省抚州市检验检测认证中心,江西抚州 344000;3.四川乐山天马晨达农业有限公司,四川乐山 614500)
黄嘌呤氧化酶(Xanthine oxidase,XOD)是动物机体内催化黄嘌呤和次黄嘌呤生成尿酸的关键酶[1]。过多的尿酸会进一步造成高尿酸血症,长远来看,高尿酸血症还可诱发高血压、糖尿病和肾功能衰竭等疾病[2]。如何有效抑制XOD活性一直是国内外研究的热点。目前,市场上用于治疗高尿酸血症的西药主要为别嘌呤醇和非布索坦(Febuxostat)等,这类药物虽然可以有效地抑制XOD活性从而降低体内尿酸的含量,但长期服用会伴随腹泻、皮疹和头晕等副作用的产生[3]。因此,寻找天然、有效、安全和廉价的XOD抑制剂至关重要。
金丝桃苷(Hypericin,HYP)是一种广泛存在于黄蜀葵花中的天然膳食黄酮,其化学结构为槲皮素-3-O-β-D-吡喃半乳糖苷[4]。现代研究表明金丝桃苷具有抗氧化、抗癌、抗疲劳等多种功效[5-6],关于其抑制XOD的特性尚缺乏报道。因此,研究金丝桃苷与XOD的相互作用在XOD抑制剂的挑选中具有重要意义。目前,国内外主要利用酶动力学[7]、多光谱法[8]和分子对接[9]技术由表及里、从现象到机理来系统地分析小分子物质与蛋白酶的相互作用,通过这些方法可以分析得到小分子与蛋白酶的结合常数、结合位点、作用力类型以及作用过程中发生的构象变化等信息。而在实际应用中,除上述方法外,三维荧光光谱法可以利用三维投影图和二维等高线图提供直观的猝灭信息[8]。如胡鹏[10]利用三维荧光光谱法研究了几种多酚对牛乳蛋白的猝灭机制。但三维荧光光谱法、酶动力学法和分子对接还尚未应用于金丝桃苷和XOD的相互作用之中。因此,有必要结合多种研究方法从分子相互作用角度系统研究金丝桃苷对XOD活性的抑制作用,从而拓宽和提升金丝桃苷在膳食和医药领域的资源化利用。
本文以金丝桃苷和XOD为对象,采用酶抑制动力学来分析金丝桃苷对XOD活性的抑制作用,并通过多种荧光光谱法、紫外吸收光谱法和圆二色谱法探究金丝桃苷对XOD空间构象的影响,进一步采用分子对接技术预测金丝桃苷与XOD相互作用过程中分子作用力类型、结合位点、结合能量的变化。该研究旨在从分子层面上初步揭示金丝桃苷抑制XOD活性的机理,为金丝桃苷在开发具有潜力的功能性食品或药品方面提供实验和理论基础。
1 材料与方法
1.1 材料与仪器
金丝桃苷(纯度98%) 上海源叶生物科技有限公司;黄嘌呤氧化酶(Grade 1,from bovine milk,≥0.4 units/mg protein)、非布索坦和黄嘌呤 美国Sigma公司。
BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;Multiskan FC酶标仪 上海赛默飞仪器有限公司;F-4500荧光分光光度计 日本日立有限公司;Cary 60紫外可见分光光度计 美国安捷伦公司;J-1700圆二色谱 日本分光(JASCO)公司;Auto Dock Tool软件。
1.2 实验方法
1.2.1 抑制动力学 参照Lin等[11]方法,并作适当修改。将金丝桃苷(200 μL,0~200 μmol/L),黄嘌呤(400 μL,2 mmol/L)和XOD(50 μL,0.5 U/mL)进行混合。孵育10 min后加入NaOH(100 μL,1.0 mol/L)终止反应。利用酶标仪在295 nm处测定吸光值。抑制率计算公式为:
式中:A1为不含金丝桃苷的阳性空白体系的吸光度;A2是样本组的吸光度;非布索坦为阳性对照。
参照上述方法,固定黄嘌呤浓度(2 mmol/L),随着XOD浓度(0~0.5 U/mL)的增加,分别测定不同浓度下金丝桃苷抑制XOD的酶促反应速率;固定XOD的浓度(0.5 U/mL),随着黄嘌呤浓度(10~80 μmol/L)的增加,分别测定不同浓度反应体系下的酶促反应速率。由酶促反应速率(v)与XOD浓度[XOD]绘制的曲线可以评价抑制XOD的可逆性,以Lineweaver-Burk双倒数作图法可以判断抑制类型,具体计算公式为[12-13]:

式中:v为有无金丝桃苷时XOD的催化反应速率;Km和Ki代表Michaelis-Menten常数和抑制常数;Vmax为XOD的最大反应速率;[I]和[S]分别为金丝桃苷和黄嘌呤的浓度;α是表观系数。经二次计算后,斜率和y轴截距与[I]的曲线是线性拟合的,表明此时只有一种或一类抑制位点存在[14]。
1.2.2 普通荧光光谱分析 参考Liu等[15]的方法,并作适当修改。金丝桃苷(100 μL,100~500 μmol/L)和XOD(2 mL,0.1 U/mL)充分混合,空白对照是Tris-HCI缓冲液。将各反应溶液置于298、305和312 K温度下孵育5 min后进行扫描。激发和发射波长分别设置为280、300~500 nm,狭缝宽度为5 nm,扫描速率为700 nm/min。
1.2.3 同步荧光光谱分析 溶液配制方法同1.2.2。不同的是,在250~350 nm的波长范围内,Δλ(λem~λex)值调整为15和60 nm。由如下公式计算同步荧光猝灭率(RSFQ):

式中:F和F0分别为有无金丝桃苷时XOD的荧光强度。
1.2.4 三维荧光光谱分析 参照Li等[8]的方法,并作适当修改。金丝桃苷(100 μL,300 μmol/L)和XOD(2 mL,0.1 U/mL)充分混合,空白溶液代表XOD的荧光光谱。在发射波长和激发波长范围分别为230~600、200~360 nm,增量10 nm的条件下测定各反应溶液的荧光强度。
1.2.5 紫外吸收光谱 参照Sarmah等[16]的方法,并作适当修改。金丝桃苷(200 μL,100~500 μmol/L)和XOD(3 mL,0.1 U/mL)充分混合后孵育5 min。波长范围设置为200~500 nm,用紫外吸收光谱仪对各反应溶液进行测定。
1.2.6 圆二色谱 参照Li等[17]的方法,并作适当修改。简而言之,金丝桃苷(0.5 mL,12.5~100 μmol/L)与XOD(0.5 mL,0.1 U/mL)的混合物在波长为200~250 nm,扫描速度100 nm·min-1条件下进行扫描。测定结果导入SELCON3应用程序(http://dichr oweb.cryst.bbk.ac.uk/html/home.shtml),分 析XOD不同二级结构的含量变化。
1.2.7 分子对接 Auto Dock Tool软件可以预测金丝桃苷与XOD的相互作用信息[18]。配体小分子从ZINC数据库中获取,XOD(PDB code:1FIQ)的三维晶体结构从Protein Data Bank数据库下载。在对接软件上删除XOD的A、B链以及原始配体非布索坦,仅保留C链和MOS,并设置C链的活性中心坐标为(X,Y,Z)=(24.645,15.383,108.204)。经前处理和指令运行后,根据结合能(Eb)越低,结合越稳定的原理对对接结果进行分析[19]。将HYP-XOD配合物的主导构象导入PYMOL软件进行绘图[20]。
2 结果与分析
2.1 金丝桃苷对XOD的抑制分析
体外测定不同浓度金丝桃苷对XOD的抑制结果表明,金丝桃苷的IC50值为(162.059±2.291)μmol/L,远高于阳性对照非布索坦(0.222±0.019)μmol/L。这说明金丝桃苷具有一定的抑制作用,可能是一种有效的XOD抑制剂。推测其抑制能力与化学结构有关:金丝桃苷A环的5',7'位置和B环的3',4'位置上含有羟基,以及C环3'位置上连接的葡糖基外围有四个羟基,这些有利的羟基可能决定着XOD的抑制能力[12,21]。
金丝桃苷介导的抑制剂的抑制可逆性由酶动力学曲线图判断。图1A显示,每条直线都经过原点,且随着金丝桃苷浓度的增加,其斜率逐渐减小,这表明金丝桃苷以可逆的方式抑制XOD活性,且金丝桃苷抑制XOD是由黄嘌呤氧化引起的酶活性总体下降引发的,而不是有效酶数量的减少[22]。
Lineweaver-Burk图可判断金丝桃苷对XOD的抑制类型。由图1B可看出,每条直线的斜率和截距都不同,但都相交于第二象限,这说明金丝桃苷是通过混合竞争的方式来抑制XOD的。对斜率Slope(1C)和y轴截距Y-intercept(1D)与抑制剂浓度[I]进行二次计算后,得知Ki值和α值分别为(18.079±0.154)和(8.027±0.031)μmol/L,这表明金丝桃苷与游离XOD的结合比与XOD配合物的结合更容易且更紧致。此外,斜率Slope与抑制剂浓度[I]线性拟合状态良好,表明金丝桃苷对XOD只有一个或一类抑制位点[11]。
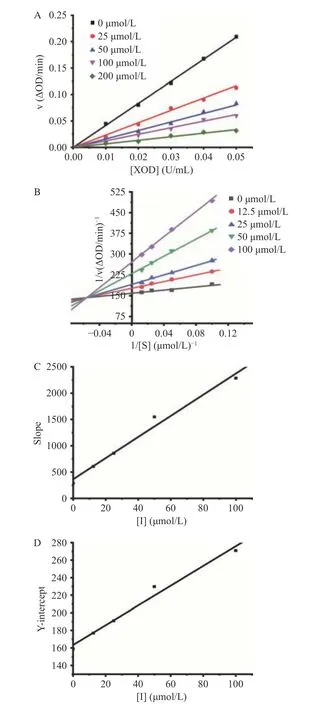
图 1 不同金丝桃苷浓度下的动力学曲线图Fig.1 Enzyme kinetic curves of hypericin at different concentrations
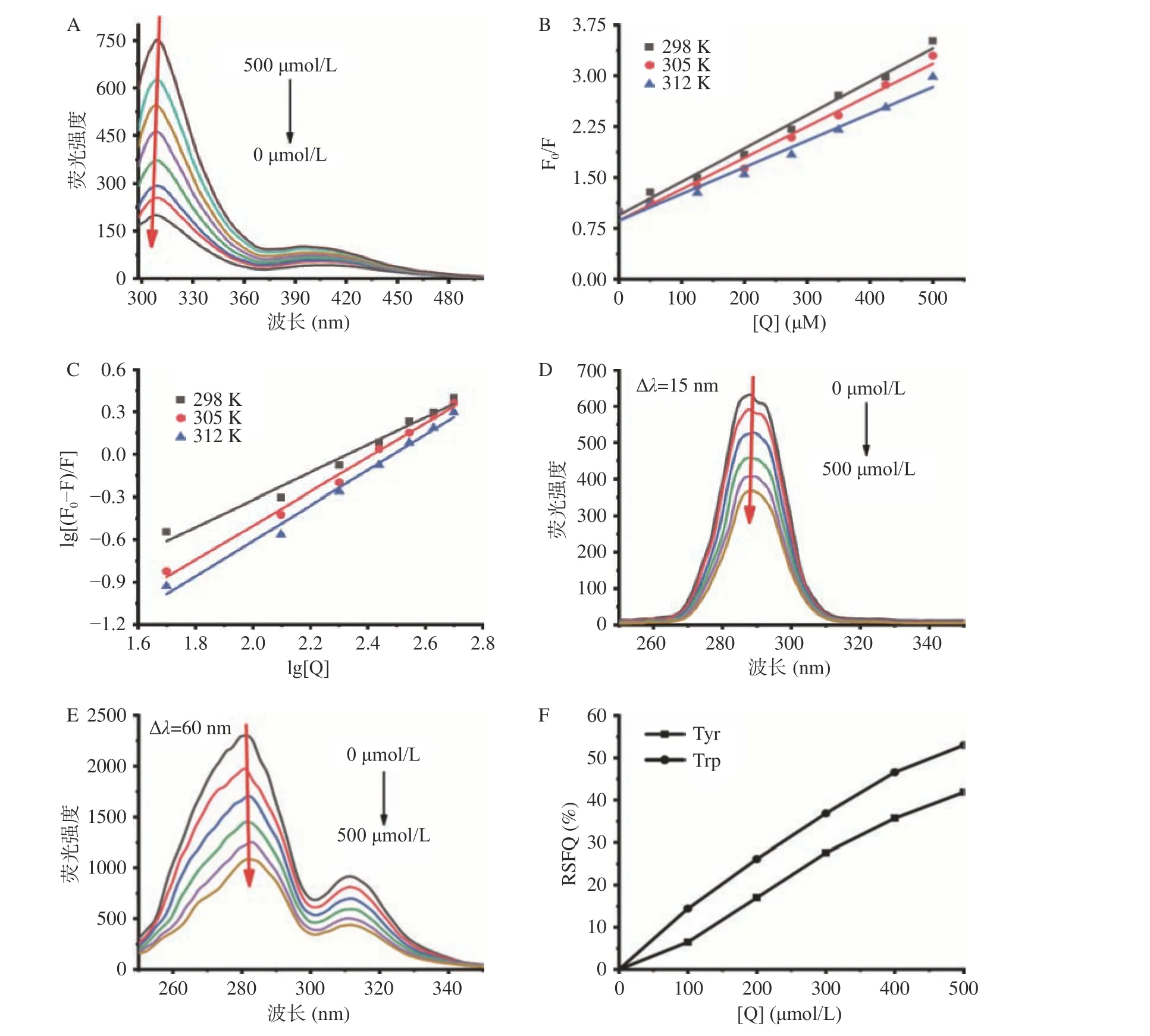
图 2 不同金丝桃苷浓度下的荧光猝灭曲线图Fig.2 Fluorescence quenching curves of hypericin at different concentrations
2.2 荧光猝灭分析
基于上述实验中测定的抑制动力学结果,荧光猝灭分析将提供更多关于相互作用过程中的信息,如结合机制、结合常数和结合位点等[23]。众所周知,荧光猝灭是指由于某些过程使样品的荧光强度减弱,包括多种分子相互作用,如激发态络合物形成(静态猝灭)和碰撞淬灭(动态淬火)。当激发波长为280 nm时,可测定色氨酸(Trp)和酪氨酸(Tyr)两种氨基酸残基的荧光强度,由Stern-Volmer方程表示为:
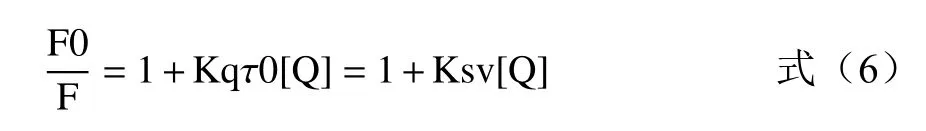
式中:F0为XOD的荧光强度;F为加入猝灭剂后的荧光强度;[Q]为金丝桃苷的浓度;Kq为猝灭速率常数;τ0(10-8s)为未加入猝灭剂时荧光团的平均寿命;Ksv是Stern-Volmer猝灭常数。
如图2A所示,随着金丝桃苷浓度的增加,XOD的荧光强度逐渐被猝灭,发射峰的位置略有移动,这是金丝桃苷与XOD发生相互作用的直接证据。由图2B可知,随着温度的升高,Kq值(在298、305和312 K下,分别为4.92、4.63和3.94×1010L·mol-1·s-1)远大于最大散射碰撞猝灭常数(2×1010L·mol-1·s-1),说明金丝桃苷对XOD的荧光猝灭机制为静态猝灭而非动态猝灭,且进一步说明了金丝桃苷与XOD形成了配合物,在较高温度下,HYP -XOD配合物的稳定性会减弱。
结合强度(结合常数Ka)和结合位点(n)由双对数方程得到:
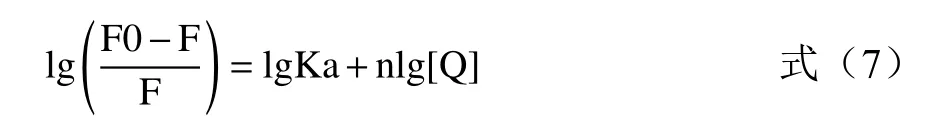
根据图2C中lg[(F0-F)/F]与lg[Q]的回归曲线的截距和斜率,计算出三种温度下HYP-XOD配合物的Ka和n值(见表1)。较高的Ka值(105L/mol)和较高的线性相关系数表明HYP-XOD配合物具有很强的亲和力;n值在不同温度下近似等于1,这些结果说明金丝桃苷在XOD上只有一个或一类结合位点,该实验结论与上述酶动力学实验结果一致。
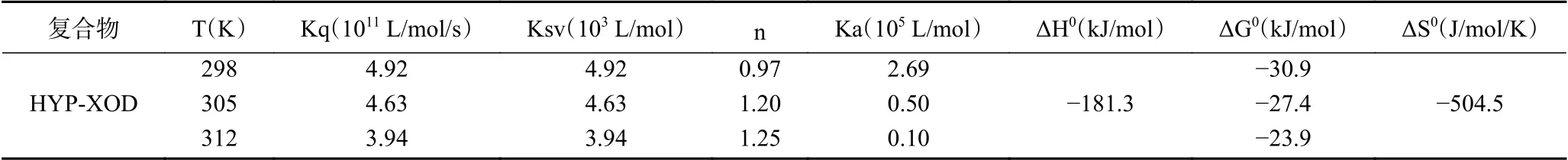
表1 不同温度下金丝桃苷与XOD相互作用的结合常数和热力学参数Table 1 Bind constants and thermodynamic parameters for the interaction of XOD with hypericin at different temperatures
2.3 热力学参数测定
配体与大分子结合的驱动力主要有氢键、范德华力、静电引力和疏水作用力[24]。反应系统的热力学参数如焓变(△H0)、熵变(△S0)和自由能变化(△G0),通常是判断作用力类型的主要依据,由Van’t Hoff方程可得:

式中:Ka为结合常数(298、305、312 K);T为实验温度;R为气体常数,8.314 J/mol·K。
当ΔH0>0和ΔS0>0时,表示主要驱动力为疏水作用力;ΔH0<0和ΔS0<0则表示主要驱动力为范德华力和氢键;ΔH0<0和ΔS0>0则为静电相互作用[25]。通过计算ΔH0和ΔS0的正负性可以发现(表1),范德华力和氢键是HYP-XOD配合物形成的主要驱动力;ΔG0<0说明金丝桃苷与XOD的结合过程是自发的。这些结果表明,金丝桃苷在与XOD结合的过程中通过形成范德华力和氢键作用力改变了XOD的空间构象,在此有必要进一步探讨金丝桃苷对XOD构象的影响。
2.4 同步荧光光谱分析
同步荧光光谱已成为一种观测蛋白酶构象变化的理想手段。当设置测量波长间隔(Δλ)分别为15和60 nm时,可以提供XOD中酪氨酸(Tyr)和色氨酸(Trp)残基的特征信息,从而可以解释发色团分子周围极性和疏水性的变化[15]。
图2D和图2E显示了金丝桃苷在XOD上的同步荧光光谱。由图可知,XOD的荧光强度随金丝桃苷的加入而有规律地降低,这再一次说明了结合过程中发生了荧光猝灭。随着金丝桃苷的加入,亲水性氨基酸Tyr残基的最大荧光发射峰没有发生位移,而疏水性氨基酸Trp残基的最大荧光发射峰则出现轻微的红移(281.2到282.0 nm)。这一现象表明:金丝桃苷的加入改变了XOD中疏水性氨基酸Trp残基附近的微环境,使得Trp残基所处的微环境疏水性略微增强,从而影响XOD的空间构象。此外,通过计算Tyr和Trp残基的RSFQ值(图2F)发现,在同样的条件下,Trp的RSFQ值显著(P<0.05)高于Tyr,说明Trp残基对XOD的荧光猝灭有较好的促进作用,金丝桃苷与XOD活性部位的Trp残基接近,而不靠近Tyr残基[26]。

图 3 XOD体系和HYP-XOD体系的三维荧光光谱及二维等高线图Fig.3 Three-dimensional fluorescence spectra and corresponding contour maps of XOD and HYP-XOD systems
2.5 三维荧光光谱
三维荧光光谱可以充分显示蛋白酶的荧光信息[27]。由XOD(图3A和图3B)和HYP-XOD配合物(图3C和图3D)的三维荧光光谱可以看到,有一个类似“脊”的瑞利散射峰(峰a)和两个类似“竹笋”的荧光峰(峰1和峰2)。峰1代表蛋白酶上的内源荧光特征峰,峰1的变化反映了蛋白酶三级结构的变化;峰2是由蛋白质多肽的碳骨架π→π*跃迁引起的,峰2的强度反映蛋白酶二级结构的变化[11]。其中XOD和HYP-XOD配合物的荧光强度分别为411.0和272.5;随着金丝桃苷的加入,峰1和峰2强度明显降低。HYP-XOD配合物强度变化越大,表明金丝桃苷可能极大的改变了XOD的空间构象。此外,随着金丝桃苷的加入,峰1和峰2的位置有轻微移动,说明金丝桃苷和XOD相互作用导致蛋白质多肽链发生轻微的解折叠,从而使XOD的空间构象发生变化,这和文献报道的茶多酚能和乳球蛋白相互作用导致蛋白发生解折叠的结论一致[28]。
2.6 紫外吸收光谱
为了进一步验证猝灭机制,紫外可见吸收光谱已经成为评估蛋白酶构象变化的有用方法[15]。如图4A所示,XOD的紫外可见吸收光谱图中有两个明显的吸收峰,最大吸收峰分别位于Band Ⅰ的376 nm和Band Ⅱ的266 nm处。随着金丝桃苷浓度的增加,Band Ⅰ和Band Ⅱ的吸收值逐渐增大。据了解,静态猝灭可以增加或减少蛋白酶的吸收光谱,而动态猝灭只会影响荧光团的激发态,不改变蛋白酶的吸收光谱[15]。吸光值的增加可能是由于金丝桃苷与XOD相互作用时引起某些氨基酸残基的结构发生变化所致。由此可知,结果再次证明金丝桃苷与XOD结合是静态猝灭过程。
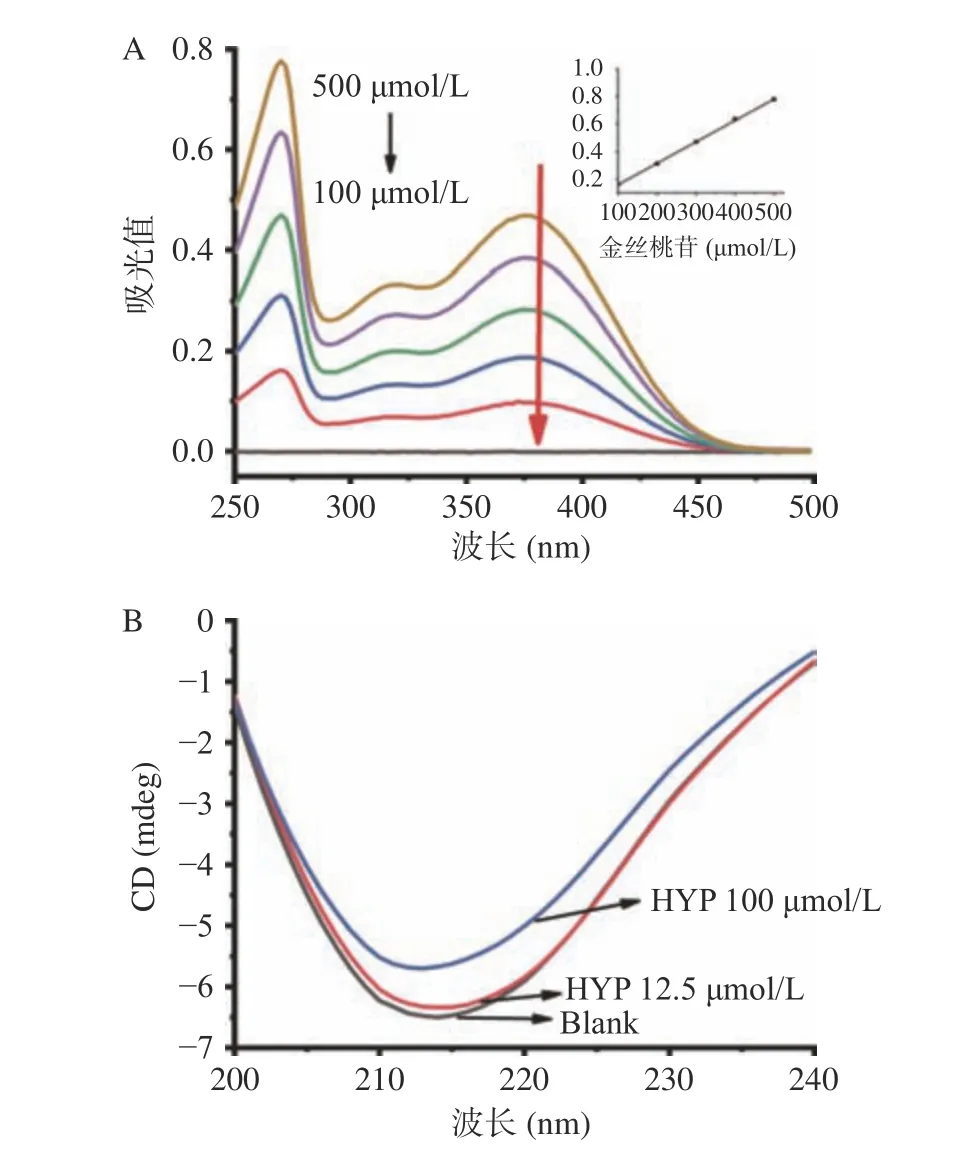
图 4 不同金丝桃苷浓度下的紫外吸收光谱和圆二色谱图Fig.4 UV-vis absorption spectra and CD spectra of hypericin at different concentrations
2.7 圆二色谱分析
CD光谱可以定量分析金丝桃苷介导的XOD的二级结构,详细阐述XOD二级结构的具体变化值[16]。在216 nm附近有一个负峰(图4B),这是二级结构β-折叠的特征峰,负峰强度随着金丝桃苷浓度的增加而逐渐降低,说明金丝桃苷可以改变XOD的二级结构。由表2可知,α-螺旋和无规则卷曲的含量分别从8.2%增加到17.5%、26.4%增加到34.2%;β-折叠和β-转角的含量分别从44.8%减少到29.9%、20.6%减少到18.3%。由此推测,金丝桃苷引起的构象变化可能会阻止黄嘌呤(底物)与XOD活性域(Mo-pt)的结合,从而阻止催化反应的发生。此外,我们还发现XOD以β-折叠结构为主,这与Zhang等[1]的报道一致。

表2 CD光谱分析金丝桃苷对XOD二级结构含量的影响Table 2 Effect of the content secondary structure of hypericin on XOD by CD spectra
2.8 分子对接
分子对接可以预测小分子(膳食黄酮)与XOD之间的相互作用,且可直观看到两者间相互作用的具体形式。从理论上讲,活性中心一旦与抑制剂结合,周围的大部分空间就会被堵塞,此时将会阻碍黄嘌呤(底物)的着落,最终阻止XOD发生催化反应[10]。图5显示了金丝桃苷与XOD的结合,金丝桃苷与大量氨基酸残基(GLN767, GLY797, PHE798, GLY913,MET1038, GLN1040, LEU1042, LYS1045, ALA 1078, ALA1079, SER1080, VAL1081, SER1082,ASP1084, GLN1194, ALA1258, GLU1261)形成范德华力,这些范德华力可能有利于形成稳定空腔,相关残基均在活性域内。C-4'上的羟基与残基THR1083形成氢键(Å=2.3),说明氢键是金丝桃苷与XOD结合的另一个主要作用力。这些结果表明,在金丝桃苷与XOD的非共价相互作用中,范德华力和氢键是主要作用力,证实了上述热力学参数分析的正确性。
3 结论
本研究发现,金丝桃苷主要以氢键和范德华力与XOD的催化活性区域发生相互作用,并以混合竞争的方式抑制XOD的活性;金丝桃苷在与XOD结合的过程中使得发色团XOD发生荧光猝灭效应,且随着猝灭剂浓度的增加,XOD的荧光强度逐渐减弱;金丝桃苷的加入改变了XOD的二级结构,其中α-螺旋和无规则卷曲的含量增加,β-折叠和β-转角的含量减少。这些结果均说明金丝桃苷能够有效地抑制XOD活性。接下来将进一步通过动物实验及临床研究对金丝桃苷抑制XOD的药代动力学以及药物安全性进行探讨,希望能将金丝桃苷作为一种有用的膳食黄酮真正应用于高尿酸血症患者的饮食当中。

