高铁酸盐氧化降解农村养猪废水中抗生素磺胺的生态学效应
吴康 叶舟 华飞 张忠亮 姚有智




摘 要:利用高铁酸盐催化氧化农村养猪废水中的抗生素磺胺(SA),可以达到高效降解效果;通过TOC/TOC0指标可以反映高铁酸盐在降解过程中的矿化效果。为了评价高铁酸盐的生态学效应,结果表明,在反应60min后,高铁酸盐对E. coli的抑制率逐渐降低。高铁酸盐可有效去除农村养猪废水中SA,且降解过程中不会产生二次污染,或降解中间产物毒性低于有机污染物本身。采用LC-MS分析,磺胺的主要降解产物是苯磺酸和对硝基苯酚。
关键词:高铁酸盐;抗生素磺胺;医院废水;生态学;降解产物
中图分类号 X703.1 文献标识码 A 文章编号 1007-7731(2022)09-0144-04
Application and Ecological Effect of Ferrate Catalyzed Oxidation on Degradation of Antibiotic Sulfanilamide
WU Kang YE Zhou HUA Fei ZHANG Zhongliang YAO Youzhi
(School of Resources and Environment Science, Anhui Agricultural University, Hefei 230036, China)
Abstract: Advanced ferrate oxidation technology can effectively degrade the antibiotic sulfanilamide (SA) in the pig industry wastewater. The TOC/TOC0 index shows that ferrate can achieve goodmineralization effect in the degradation process. Later, evaluate the ecological effect of ferrate, the result showed that the inhibition rate of ferrate on E. coli gradually decreased after 60min of reaction. Ferrate can effectively remove SA from the pig industry wastewater, and in the degradation process, there will be no secondary pollution, or the toxicity of degradation intermediates is lower than the organic pollutants themselves. Finally, the degradation products of sulfanilamide by the potassium ferrate were analyzed by LC-MS, which suggested that the degradation of sulfanilamide was mainly catalytic oxidation reaction, the degradation product was benzenesulfonic acid and p-nitrophenol.
Key words: Potassium ferrate; Antibiotic sulfanilamide; Hospital wastewater; Ecology; Degradation product
抗生素磺胺對人类疾病有着良好的治疗效果,但是治疗过后抗生素磺胺并不能完全被人体吸收,会随着人体排泄物进入到环境中。随着环境中抗生素磺胺浓度的不断增加,必然会对一些低等生物造成危害,甚至会对人类健康造成伤害,从而对整个生态系统造成危害。农村养猪业产生的废水中含有大量的兽药抗生素及其代谢物,使养猪业废水成为抗生素污染环境的重要来源之一[1]。因此,抗生素磺胺的生态毒性及其风险评价尤为重要,是目前很多学者的研究热点之一。高铁酸盐是一种新型环境友好型的材料,与传统氧化剂相比,高铁酸盐的氧化还原电位最高[2]。
目前,国内外对于磺胺类抗生素的水生生态毒性评价,主要以短期的急性毒性试验方式,通过观察生长发育,死亡等指标进行评价。Reinthaler等从污水处理厂中筛选出767株大肠杆菌,结果发现其中部分均具有一定的耐药性,并且四环素的耐药性高达57%[3]。Jiang等利用发光菌对四环素、磺胺类和喹诺酮类抗生素的毒性进行评价,结果也证明这几种抗生素对发光菌有一定的毒性[4]。De Liguoro等以大型蚤为目标,观察6种常见的磺胺类抗生素对它的急性毒性(48h),结果也证明磺胺类抗生素对生态系统中生物具有毒害作用[5]。
本研究旨探究高铁酸盐对农村养猪废水中的SA的去除情况,探索高铁酸盐氧化方式对SA的矿化效果,并通过大肠杆菌的毒性实验,评价高铁酸盐氧化方式的生态学效应。
1 材料与方法
1.1 药品与试剂 磺胺(Sulfanilamide,SA),含量均大于98%,购自于中国上海的阿拉丁公司;试验所需试剂:甲醇、乙酸和乙腈均为色谱纯试剂,其他试剂为分析纯。大肠杆菌(No.1.1564)购自于中国微生物菌种保藏管理委员会普通微生物中心。LB培养基(g/L):牛肉浸膏5.0,蛋白胨10.0,NaCl 5.0,pH=7.0;固体培养基中琼脂粉的加入比例为1.8%,121℃高压灭菌30min。
1.2 主要仪器设备 高效液相色谱仪:Agilent 1220美国安捷伦;超声波清洗机:SB25-12DTN宁波新芝生物科技股份有限公司;pH计:雷磁PHS-3C上海仪电科学仪器股份有限公司;超净工作台:SW-CJ-FI,上海华光仪器仪表厂;电热恒温培养箱:DNP-9028AE,上海三发科学仪器有限公司;全自动菌落计数器:30D,杭州通信科技有限公司;TOC/TN分析仪:3100,德国耶拿。
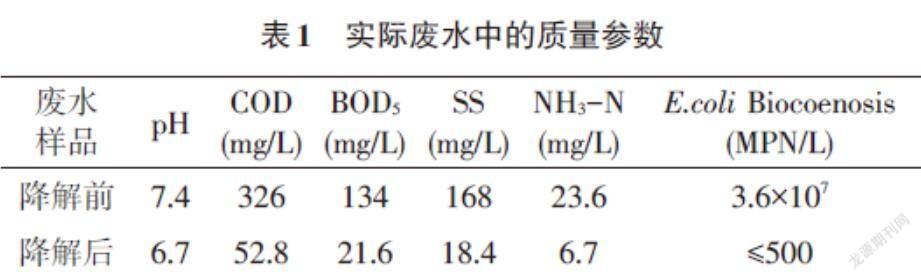
1.3 环境废水的收集 本试验所采用的农村养猪废水,收集于位于安徽省农村某一大型养猪场,该养猪场平时养猪量大,用药量大。降解前后实际废水中的质量参数如表1所示。
1.4 试验方法 K2FeO4与农村养猪废水的反应在500mL锥形瓶中进行,试验采用恒温平衡振荡法(25±2℃,180r/min),100mL的医院废水首先加入锥形瓶,之后添加100mLK2FeO4溶液,在不同反应时间点进行取样,为终止反应会加入1mL水杨酸,过0.45μm滤膜,利用高效液相色谱仪进行测样。反应液的pH使用磷酸盐缓冲液进行调节。
TOC/TN试验:试验收集25mL反应60min后的样品,使用TOC/TN分析仪,对其矿化效果进行检测。
大肠杆菌(E.coli)试验:E.coli利用LB培养基进行培养,37℃振荡培养至对数生长期备用。将部分细菌接种到一定体积、含有不同浓度的氧化剂的新鲜培养基中,在电热恒温培养箱中37℃进行培养,测定大肠杆菌的菌落数。
1.5 分析方法 磺胺抗生素采用Agilent 1220高效液相色譜仪(紫外检测器)测定,色谱柱为Agilent HC-C18色谱柱(4.6mm×250mm,5μm)。流动相采用乙腈和0.4%乙酸溶液,两者体积比为70∶30;流动相流速:1mL/min;柱温:40℃;检测波长:270nm;进样量:20μL。
利用液相色谱三重四级杆串联质谱仪(Agilent 1290+G6460)对磺胺抗生素降解产物进行分析。采用C18柱(2.1×100mm,1.7µm),流动相(乙腈和0.4%乙酸,30:70)流速0.2mL/min,电喷雾电离正离子模式,毛细管电压4.0kV,喷雾器压力45psi,气体流量6.0L/min,气体温度325℃。
利用TOC/TN分析仪对高铁酸盐降解SA后的矿化效果进行测定。TOC/TN分析仪中竖炉温度:800°C;样品进样量:500μL;润洗量:1000μL;最大积分时间:180s,重复检测3次。
1.6 数据分析 大肠杆菌(E. coli)抑制率用下列公式进行计算:
Y(%)=[(Ymax−Yt)/Ymax]×100
式中,Yt为不同Fe(VI)投加量时E.coli的菌落数,Ymax为空白实验中E. coli的最大菌落数[6]。
2 结果与分析
2.1 高铁酸盐对医院废水中抗生素磺胺的降解动力学 通过前期研究可以发现,Fe(VI)可以作为化学氧化剂催化降解SA,因此本研究考察了Fe(VI)在农村养猪废水中对SA的降解效率。检测到农村养猪废水中SA的浓度为12ng/L,由于浓度过低,本研究向农村养猪废水中添加SA溶液,浓度分别为0.1、0.2、0.4、0.8和1.6mg/L。如图1所示,降解10min后,初始浓度为0.1mg/L的废水,溶液中的SA的降解率为95.9%;当初始浓度升高到1.6mg/L时,SA的去除率下降至92.0%。可见,Fe(VI)可作为去除农村养猪废水中SA污染的有效氧化剂。
2.2 高铁酸盐对废水中抗生素磺胺的机理
2.2.1 矿化效果 通过对TOC/TOC0和E. coli抑制率的测定,考察了高铁酸盐催化氧化降解磺胺类抗生素的应用和生态学效应。Fe(VI)可以作为化学氧化剂去除SA,因此,Fe(VI)也可被用来降解农村养猪废水中SA。Yang等报道称,自然水体中有一个初始TOC值,因此悬浮于自然水体中的颗粒会降低对污染物的去除效率[7-9]。本研究采用TOC相对浓度(TOC/TOC0)指标,考察Fe(VI)对环境废水中SA的去除效果。反应60min后,环境废水中TOC相对浓度(TOC/TOC0)如图2所示。由图2可知,随着Fe(VI)浓度的增加,TOC/TOC0逐渐降低。当Fe(VI)浓度为2.50mmol/L时,TOC/TOC0为0.2019,证明Fe(VI)可以将SA完全氧化,并且矿化效果明显。这一现象可能与Fe(VI)较强的氧化能力有关,使SA更容易被氧化降解。之前报道指出,Fe(VI)能够将印刷废水中的污染物完全矿化,因其具有很强的氧化能力[10],与试验结果一致。因此,通过对TOC相对浓度(TOC/TOC0)指标的考察,证明Fe(VI)可以有效地去除环境废水中的SA。
2.2.2 降解机理 Fe(Ⅵ)通过还原途径容易转化为Fe(Ⅲ),并且可以产生[·OH],之后[·OH]进攻磺胺类抗生素上的不同位点,从而降解磺胺类抗生素(1~4)[11];大部分的[·OH]重新聚合形成H2O2,Fe(Ⅲ)可以进行芬顿反应,进而产生更多的[·OH],促进磺胺类抗生素的降解(5~6)[12]:
[2FeO2-4+3H2O2Fe(OH)3+5[O]] (1)
[[O]+H2O2·OH] (2)
[2·OHH2O2] (3)
[2H2O22H2O+O2 ] (4)
[Fe3++H2O2Fe2++HO2·+H+] (5)
[HO2·+H2O2O2+H2O+·OH] (6)
2.3 高铁酸盐对废水中抗生素磺胺的生态学效应 采用E.coli抑制率指标来考察Fe(VI)对农村养猪废水中SA降解实验的毒性效应。反应60min后,随着Fe(VI)浓度的增加,对E. coli抑制率如图3所示。如图3所示,随着Fe(VI)浓度的增加,对E. coli的抑制率逐渐降低。Fe(VI)浓度为0mmol/L时,SAs对E. coli的抑制率为96.27%。随着Fe(VI)浓度增加到2.50mmol/L时,E. coli的抑制率逐渐降低至10.28%,相对应的TOC/TOC0降低至0.2019,说明Fe(VI)对环境废水中SA的氧化过程,导致SA抗菌性能消失[13-14]。这一结果的出现,可以归因于农村养猪废水中SA的浓度较低,或任何氧化产物的抗菌性能仍可能低于最低的抑菌浓度。
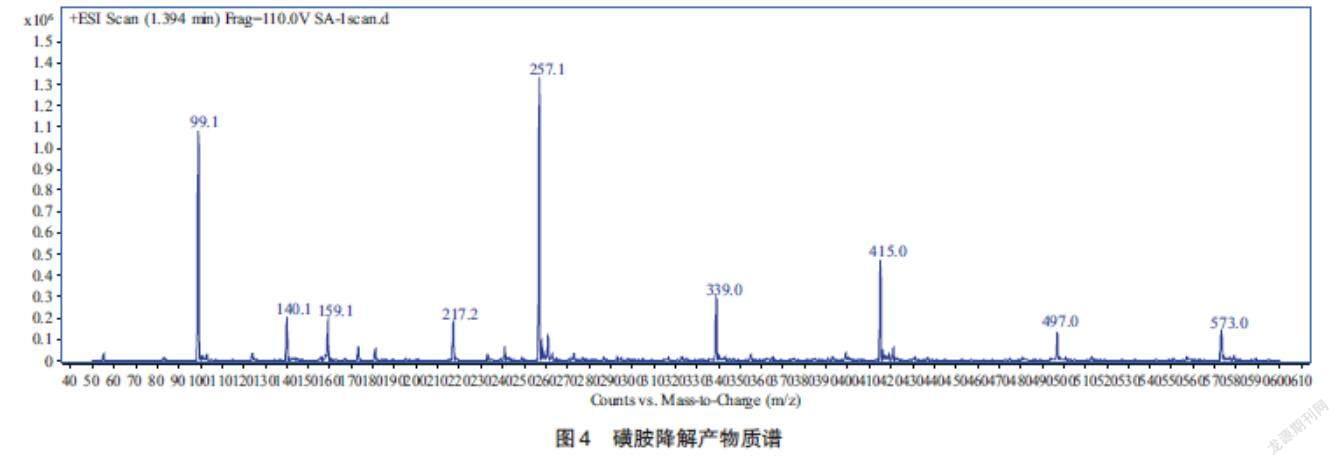
2.4 降解途徑及产物 利用LC-MC对高铁酸盐氧化磺胺的产物进行分析,并分析与推测磺胺氧化反应途径。从图4可以看出,高铁酸盐氧化磺胺的主要产物为核质比(m/z)140和159的物质;图5为推测的高铁酸盐降解磺胺反应途径。Sesegma和Dong等提出Fe(Ⅵ)催化产生的·OH可以攻击磺胺上的多个位点,促使C-N键断裂,也可进攻磺胺分子上的对位氨基(-NH2)[15-16]。本实验中,·OH首先进攻磺酰基上的氨基,使其被氧化成硝基,由于高铁酸盐氧化能力很强,产生的·OH会继续将硝基氧化成羟基,并进攻对位上的氨基,使C-N键断裂,形成核质比为159的苯磺酸;同时,产生的·OH会进攻苯环使C-S键断裂,并将对位上的氨基氧化成硝基,从而形成核质比为140的对硝基苯酚。
通过TOC检测结果发现,高铁酸盐氧化技术对磺胺的降解不彻底,无法将磺胺的苯环打开,矿化程度低。但高铁酸盐催化氧化产生的·OH可以进攻磺胺上的多个位点,主要是由于高铁酸盐酸性条件下氧化还原电位可达到+2.20V,高于其他所有应用于水处理工艺的氧化剂。
3 结论
(1)高铁酸盐对抗生素磺胺的降解是一个非生物作用的化学降解,降解10min后,初始浓度为0.1mg/L的废水,农村养猪废水中的SA的降解率可达到95.9%。因此,Fe(VI)可作为去除实际废水中SA污染的有效氧化剂。
(2)生态系统中,磺胺抗生素对大肠杆菌有一定的抑制作用,利用大肠杆菌毒性实验,证明高铁酸盐可以降解抗生素磺胺。
(3)采用LC-MS对磺胺的降解产物进行分析,结果表明,利用高铁酸盐降解磺胺的主要降解产物是苯磺酸和对硝基苯酚。
参考文献
[1]王健,贲伟伟,强志民,等. 我国养猪业废弃物中四环素类、磺胺类抗生素及相关抗性基因污染研究进展[J]. 生态毒理学报,2015,10(5):2-10.
[2]Jiang Jiaqian. Advances in the development and application of ferrate(Ⅵ) for water and wastewater treatment[J]. Journal of Chemical Technology & Biotechnology,2014,89(2):165-177.
[3]Reinthaler F.,Posch J.,Feierl G.,et al. Antibiotic resistance of E. coli in sewage and sludge [J]. Water Research,2003,37(8):1685-1690.
[4]Jiang L.,Lin Z.,Hu X.,et al. Toxicity prediction of antibiotics on luminescent bacteria,Photobacterium phosphoreum,based on their quantitative structure-activity relationship models[J]. Bulletin of Environmental Contamination and Toxicology,2010,85(6):550-555.
[5]De Liguoro M.,Fioretto B.,Poltronieri C.,et al. The toxicity of sulfamethazine to Daphnia magna and its additivity to other veterinary sulfonamides and trimethoprim[J].Chemosphere,2009,75(11):1519-1524.
[6]George A.K.,Virender K.S.,Andrew D.K. Oxidation of Trimethoprim by Ferrate(Ⅵ):kinetics,products,and antibacterial activity[J]. Environmental Science & Technology,2011,45:10575-10581.
[7]Yang B.,Ying G.G.,Chen,Z.F. et al. Ferrate(VI) oxidation of tetrabromobisphenol A in comparison with bisphenol A [J]. Water Research,2014,62:211-219.
[8]Lee Y.,Von,G.U. Oxidative transformation of micropollutants during municipal wastewater treatment:comparison of kinetic aspects of selective (chlorine,chlorine dioxide,ferrateVI,and ozone) and non-selective oxidants (hydroxyl radical) [J]. Water Research,2010,44(2):555-566.
[9]Lee Y.,Zimmermann S.G.,Kieu A.T.,et al. Ferrate (Fe(VI)) application for municipal wastewater treatment:a novel process for simultaneous micropollutant oxidation and phosphate removal[J]. Environmental Science & Technology,2009,43 (10):3831-3838.
[10]Ciabatti I.,Tognotti F.,Lombardi,L. Treatment and reuse of dyeing effluents by potassium ferrate [J]. Desalination,2010,250:222-228.
[11]Zhang P,Zhang G,Dong J,et al. Bisphenol A oxidative removal by ferrate(Fe(VI))under a weak acidic condition[J]. Sep. Purif. Technol. 2012(84):46–51.
[12]Zhang K J,Luo Z,Zhang T Q,et al. Degradation Effect of Sulfa Antibiotics by Potassium Ferrate Combined with Ultrasound (Fe(VI)-US) [J]. BioMed Research International,2015,11:1-12.
[13]Martinez C.,Canle L.M.,Fernandez M.I.,et al. Aqueous degradation of diclofenac by heterogeneous photocatalysis using nanostructured materials[J].Applied Catalysis B:Environmental,2011,107:110-118.
[14]Pera-Titus M.,Garcı́a-Molina V.,Baños M.A.,et al. Degradation of chlorophenols by means of advanced oxidation processes:a general review[J]. Applied Catalysis B:Environmental,2004,47:219–256.
[15]Khankhasaeva,Sesegma T,Dambueva D V,et al. Fenton degradation of sulfanilamide in the presence of Al,Fe-pillarede clay:Catalytic behaviour and identification of the intermediates [J]. Journal of Hazardous Materials,2015,293:21-29.
[16]Dong S Y,Pi Y Q,Li Q L,et al. Solar photocatalytic degradation of sulfanilamide by BiOCl/reduced graphene oxide nanocomposites:Mechanism and degradation pathways [J]. Journal of Alloys and Compounds,2015,663:1-9.
(責编:张宏民)

