DADS抑制XIAP介导的人胃癌HGC27细胞增殖、迁移和侵袭
刘芳, 李志敏, 曹振华, 何慧, 苏琦, 苏波
(南华大学衡阳医学院 1.肿瘤研究所,2.基础医学院应用解剖与生殖医学研究所,3.药学院药物药理研究所,湖南省衡阳市 421001)
胃癌是中国第二大常见癌症,是所有癌症类型中的第三大死因[1]。大蒜素的抗癌作用高于其他化疗药物,毒性和不良反应相对较小,二烯丙基二硫(diallyl disulfide,DADS)是由大蒜素分解的活性产物之一[2]。DADS具有抗胃癌细胞增殖、迁移和侵袭的作用[3]。
X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)通过作用凋亡蛋白Caspases抑制凋亡、促进肿瘤细胞增殖,并且参与信号通路调节、促进肿瘤转移[4]。DADS抑制胃癌细胞XIAP表达[5],本文在此基础上研究DADS是否通过下调XIAP抑制XIAP过表达胃癌细胞增殖、迁移和侵袭。
1 材料和方法
1.1 主要试剂
新生小牛血清(杭州四季青生物工程公司);嘌呤霉素(Invitrogen公司);DADS(Sigma公司);CCK-8细胞增殖检测试剂盒(Dojindo公司);BCA蛋白定量试剂盒(Promega公司);抗XIAP、β-actin抗体(Abcam公司);ECL发光试剂盒(Santa Cruz公司);Matrigel基质胶(BD公司)。
1.2 细胞培养和XIAP过表达细胞株构建
人胃癌HGC27细胞(中山大学肿瘤防治中心馈赠)置于5%CO2、饱和湿度的37 ℃培养箱,用含10%小牛血清的RPMI 1640培养基培养。GV358慢病毒空载体(Vector)和XIAP过表达载体(XIAP)购自上海吉凯基因公司。胃癌细胞接种于24孔板,将XIAP-GV358慢病毒转染HGC27细胞,48 h后倒置荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)表达情况;用嘌呤霉素(0.3 mg/L)筛选稳定转染的细胞株;以未转染(Control组)和Vector组为对照,Western blotting鉴定XIAP表达。过表达实验分为Vector组、Vector+DADS组、XIAP组、XIAP+DADS组。Vector组、XIAP组未用DADS处理,Vector+DADS组、XIAP+DADS组DADS(30 mg/L)处理24 h。
1.3 Western blotting
用RIPA溶液4 ℃裂解细胞,提取蛋白,BCA法检测蛋白水平,各组取等量样本凝胶电泳,转移至PVDF膜,置于脱脂牛奶封闭1 h,4 ℃孵育一抗过夜,TBST洗膜3次,二抗孵育1 h,TBST洗膜3次,加ECL发光液,X片曝光、显影、定影。扫描灰度值,以β-actin作为内对照计算相对蛋白表达水平。
1.4 MTT检测
96孔板中接种各组细胞,每组设置6个重复孔,用DADS(30 mg/L)处理细胞24、48、72 h后,每孔加入10 μL CCK-8溶液后置于培养箱2 h,酶联免疫检测仪中测定OD450值。细胞增殖率(%)=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.5 平板克隆形成实验
6孔板中接种各组细胞,每孔200个细胞,每组设置3个重复孔,处理细胞后放置培养箱培养14天,PBS洗3次,4%多聚甲醛固定30 min,PBS洗3次,自然风干后用结晶紫染色。克隆形成率(%)=(克隆数/接种细胞数)×100%。
1.6 迁移和侵袭实验
在Transwell上层小室接种各组细胞,将1640培养基(含10%胎牛血清)加入下室,DADS(30 mg/L)处理细胞24 h后,拭去小室上层膜表面的细胞,用4%多聚甲醛溶液固定小室下表面的细胞,结晶紫溶液(0.1%)染色。倒置显微镜下随机选择4个高倍视野,计数迁移的细胞数量,计算平均值。进行侵袭实验前,将Matrigel基质胶铺在小室上层膜表面,之后的实验步骤与上述迁移实验相同。
1.7 统计学分析
采用SPSS 17.0统计软件。数据用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 XIAP过表达胃癌HGC27细胞株的建立及鉴定
HGC27细胞转染慢病毒48 h后,光学显微镜下观察到细胞状态良好,荧光显微镜下观察到GFP荧光信号强,提示XIAP-GV358慢病毒载体转染细胞效率较高(图1A);继续用嘌呤霉素筛选细胞株2周,Western blotting鉴定Control组、Vector组、XIAP组的XIAP蛋白表达情况,结果显示XIAP组蛋白水平明显高于Control和Vector组(P<0.05;图1B),成功建立XIAP稳定过表达HGC27细胞株。

图1 慢病毒转染HGC27细胞及Western blotting检测XIAP表达A为光学显微镜下(左)和荧光显微镜下(右)观察慢病毒转染的HGC27细胞;B为Western blotting检测XIAP表达。a为P<0.05,与Control组和Vector组比较。
2.2 DADS对胃癌HGC27细胞XIAP表达的影响
Vector+DADS组XIAP蛋白水平低于Vector组(P<0.05;图2);XIAP+DADS组XIAP蛋白水平高于Vector+DADS组,但低于XIAP组(P<0.05)。

图2 DADS对胃癌HGC27细胞XIAP表达的影响1为Vector组;2为Vector+DADS组;3为XIAP组;4为XIAP+DADS组。a为P<0.05,与Vector组比较;b为P<0.05,与Vector+DADS组和XIAP组比较。
2.3 DADS对XIAP过表达胃癌HGC27细胞增殖及克隆的影响
Vector+DADS组细胞增殖率呈时间依赖性下降(P<0.05;表1);与Vector组比较,Vector+DADS组增殖率、克隆形成率降低,而XIAP组增殖率、克隆形成率升高;XIAP+DADS组细胞增殖率、克隆形成率高于Vector+DADS组,低于XIAP组(P<0.05;表1和图3)。
2.4 DADS对XIAP过表达胃癌HGC27细胞迁移及侵袭的影响
与Vector组比较,细胞迁移、侵袭数量Vector+DADS组明显减少,XIAP组增加(P<0.05);XIAP+DADS组细胞迁移、侵袭数量高于Vector+DADS组,低于XIAP组(P<0.05;表2和图4)。
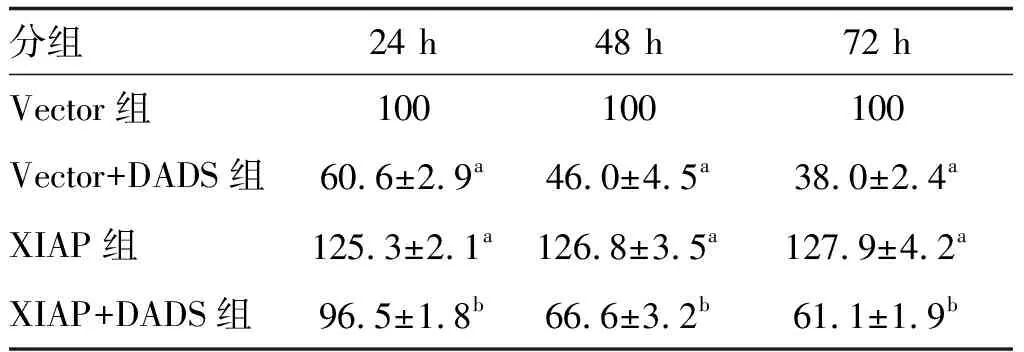
表1 DADS对XIAP过表达HGC27细胞增殖的影响 单位:%
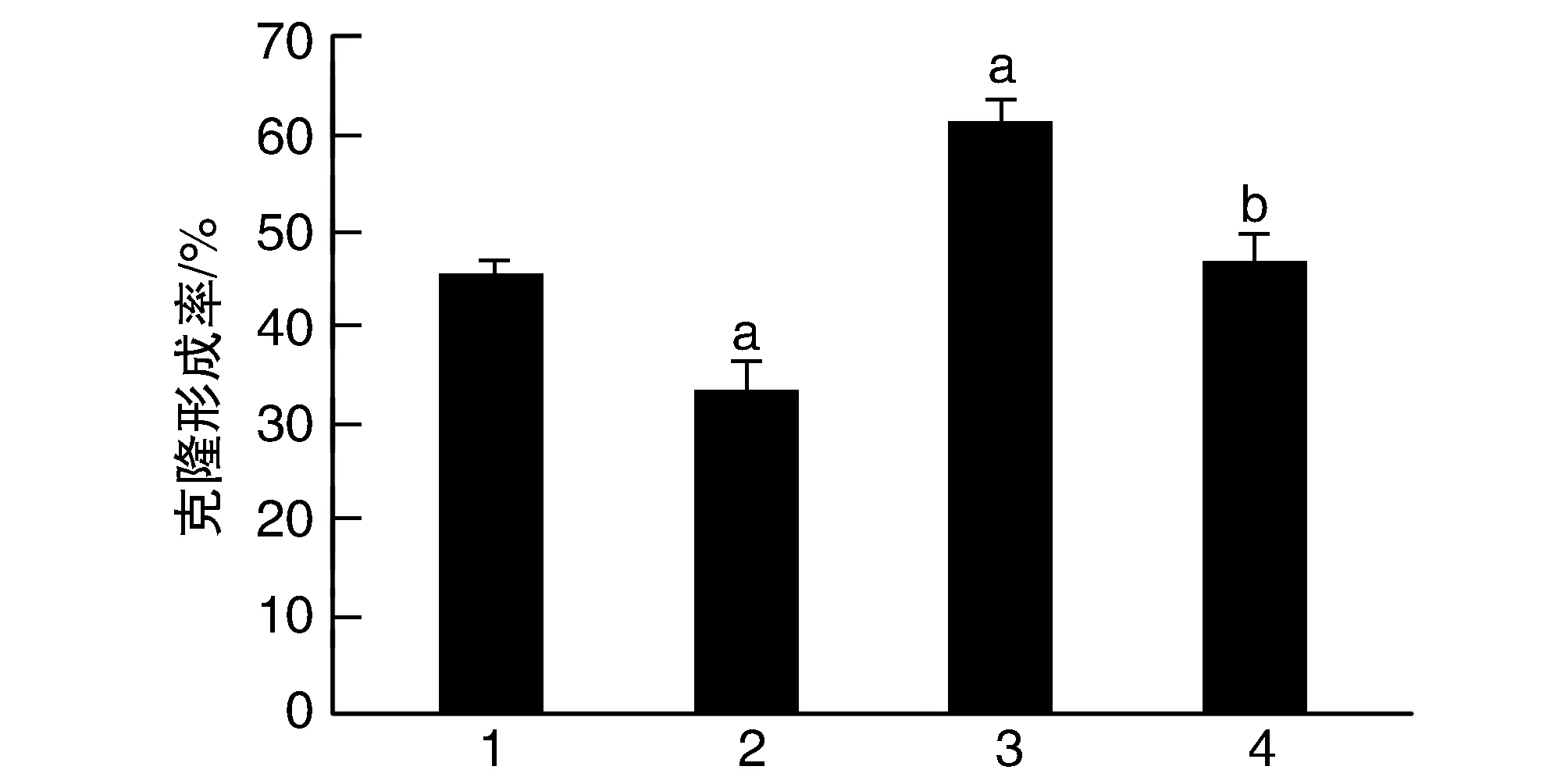
图3 DADS对XIAP过表达HGC27细胞克隆形成的影响1为Vector组;2为Vector+DADS组;3为XIAP组;4为XIAP+DADS组。a为P<0.05,与Vector组比较;b为P<0.05,与Vector+DADS组和XIAP组比较。
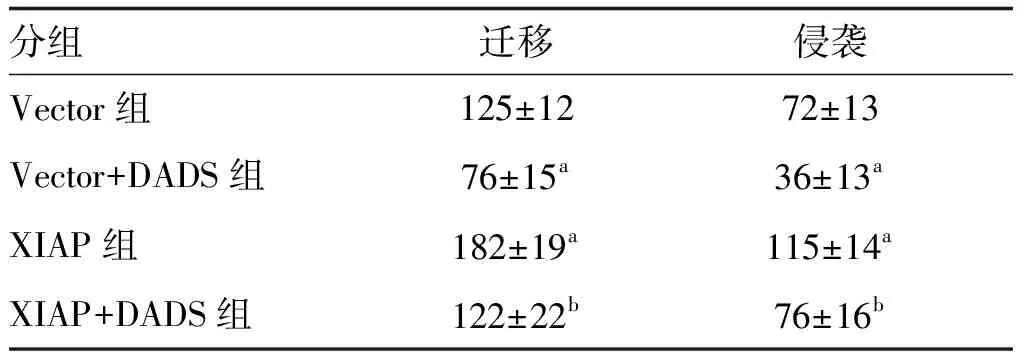
表2 DADS对XIAP过表达HGC27细胞迁移和侵袭的影响 单位:个
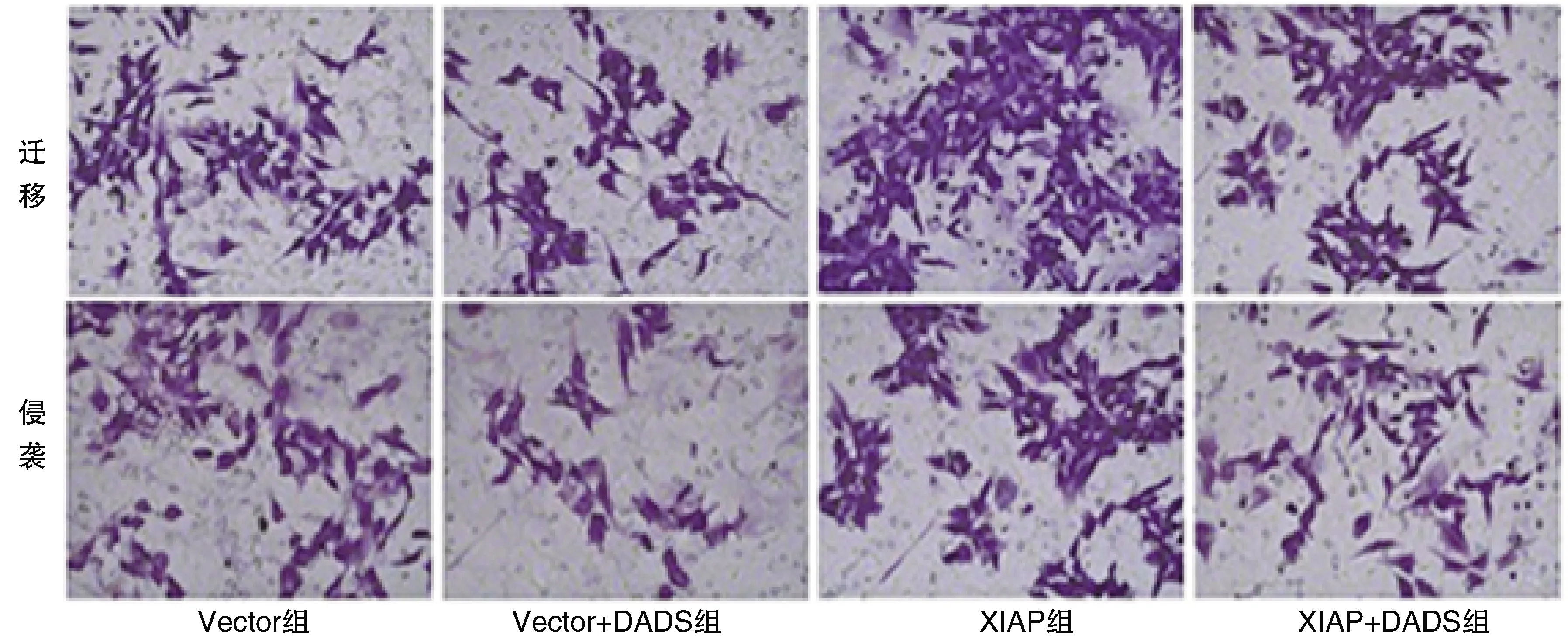
图4 DADS对XIAP过表达HGC27细胞迁移及侵袭的影响(结晶紫染色,40×)
3 讨 论
胃癌的早期诊断和治疗可提高患者生存率[6],但因复发和转移,患者预后差[7]。研究干预胃癌发生的药物对于胃癌防治具有重要意义。
XIAP表达与胃癌生长、侵袭和转移具有相关性,癌组织XIAP表达较高的患者预后较差,说明XIAP与胃癌临床进展密切相关[8]。本实验结果显示,XIAP过表达增强胃癌HGC27细胞增殖和迁移侵袭能力,证实XIAP表达增高可促进胃癌细胞恶性表型。Li等[8]报道,siRNA下调XIAP表达可抑制HGC27细胞增殖、诱导凋亡。Sun等[9]发现XIAP是MicroRNA-509-3p作用靶点,后者抑制胃癌HGC27和MKN45细胞迁移和侵袭能力。上述研究表明,下调XIAP是抗胃癌增殖和转移潜能的有效策略。
DADS可干预多条信号通路、发挥肿瘤防治作用,它通过下调癌基因、上调抑癌基因诱导细胞周期阻滞,抑制增殖[10]。DADS诱导G2/M期阻滞可抑制胃癌干细胞增殖[11]。本实验室通过差异蛋白质谱分析发现,DADS影响LIMK1、RORα、XIAP等多个基因表达[5],证实DADS下调LIMK1、上调RORα可诱导G2/M期阻滞、抑制胃癌细胞增殖[3]。本实验在证实过表达XIAP促细胞增殖的基础上,进一步明确DADS通过下调过表达细胞XIAP表达、抑制胃癌HGC27细胞增殖。文献报道,XIAP抑制剂可干预JAK/STAT、PI3K/Akt、p53、p38等信号通路,发挥抗胃癌生长的作用[12];大麻酚下调XIAP表达可抑制胃癌细胞增殖、诱导凋亡[13]。XIAP参与多条信号通路的调节,DADS可能通过抑制XIAP表达影响其介导的促胃癌细胞增殖的信号通路。
转化生长因子-β(transforming growth factor,TGF-β)可通过非Smad依赖性信号通路诱导肿瘤细胞由上皮细胞向间质细胞转化(EMT),使肿瘤细胞获得转移能力[14]。XIAP介导TGF-β诱导食管癌细胞EMT,增强其迁移侵袭能力[15]。本实验结果证实,XIAP过表达可增强HGC27细胞迁移侵袭能力,而DADS下调过表达细胞XIAP的表达、降低细胞迁移和侵袭能力。前期研究证实,DADS通过抑制EMT降低胃癌细胞迁移侵袭能力[3];DADS下调TGF-β可抑制EMT相关信号通路分子Rac1和β-catenin表达[16]。DADS可能通过下调XIAP抑制TGF-β诱导胃癌细胞EMT,从而使XIAP介导的细胞迁移侵袭能力降低。

