急性髓系白血病动物模型及中药干预的研究进展
李位智子 余湘雪 高姚 余文超 伍振辉 曾英坚
〔摘要〕 急性髓系白血病(acute myeloid leukemia, AML)是一种恶性增殖性疾病,发病机制尚未明确,目前临床治疗措施有限且进展缓慢。中药治疗AML具有一定优势,但其作用机制仍有待深入探讨。理想的实验动物模型有助于揭示AML发生发展的关键机制,对于潜在靶点的发现、治疗方法的开发及中药抗AML机制的研究至关重要。近年来,众多学者为阐明AML的发病机制及中药抗AML作用机制做了大量研究,并取得相关成果。在此基础上,本文系统总结了AML实验动物的选择、动物模型的制备方法以及各自的特点和评价方法,并总结了AML动物模型的中药干预研究进展,为今后AML动物模型研究及中医药治疗AML提供理论参考。
〔关键词〕 急性髓系白血病;动物模型;评价方法;中药;作用机制
〔中图分类号〕R285 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.06.029
Research progress of acute myeloid leukemia animal models and
intervention with traditional Chinese medicine
LI Weizhizi1, YU Xiangxue1, GAO Yao1, YU Wenchao1, WU Zhenhui1,2*, ZENG Yingjian1,2*
(1. Jiangxi University of Chinese Medicine, Nanchang, Jiangxi 330000, China; 2. The Affiliated Hospital of Jiangxi
University of Chinese Medicine, Nanchang, Jiangxi 330006, China)
〔Abstract〕 Acute myeloid leukemia (AML) is a malignant proliferative disease, and its pathogenesis is not clear, which led to the limited and tardy progress of treatment measures. Traditional Chinese medicine (TCM) has certain advantages in the treatment of AML, but its mechanism of action needs further exploration. The ideal experimental animal model is helpful to reveal the key mechanism of the occurrence and development of AML and play an important role in the discovery of potential targets, the development of therapeutic approaches and the study of anti-AML mechanism of TCM. In recent years, many scholars have done a lot of research to elucidate the pathogenesis of AML and the mechanism of anti-AML action of TCM, which have achieved relevant results. On this basis, this review summarizes the selection of experimental animals for AML, animal model preparation methods for AML, as well as their respective advantages and disadvantages and evaluation methods, and summarizes the research progress of TCM intervention in animal models of AML, providing theoretical reference for future research on animal models of AML and TCM treatment of AML.
〔Keywords〕 acute myeloid leukemia; animal model; evaluation method; traditional Chinese medicine; mechanism of action
急性髓系白血病(acute myeloid leukemia, AML)以髓系祖細胞的异常增殖导致正常成熟血细胞生成不足并引起骨髓浸润为主要特征,以出血、发热、骨痛为主要表现,部分患者还伴有中枢神经受损,大多病情危急,预后较差,严重者威胁生命[1]。我国1991—2015年白血病死亡率总体呈上升趋势,且年龄成为影响病情预后的重要因素[2]。
中医学将AML归属于“血癌”“虚劳”等范畴。多数医家认为其病位在骨髓,病因病机可归纳为精气内虚、复感外邪,内外相合,导致骨髓受损、脏腑功能失调,以祛邪解毒、攻补兼施、健脾益肾为主要治法[3-4]。AML的发病机制涉及髓系干细胞克隆群的异常增殖和分化、染色体易位和重排、基因突变等方面,但其根本的发病机制尚未完全明确[5]。当前的治疗手段仍然基于阿糖胞苷联合蒽环类药物疗法以及同种异体干细胞移植,但是AML患者仍存在生存率低、缓解率低、复发率高等问题,寻求新的有效治疗方法是临床治疗AML迫切需要解决的问题,而建立合适的动物模型是实现这一目标的重要基础。因此,本文系统总结了近些年AML动物模型的研究进展,旨在为AML的病理机制及防治策略提供理论支撑和实验依据。
1 实验动物
1.1 啮齿类动物
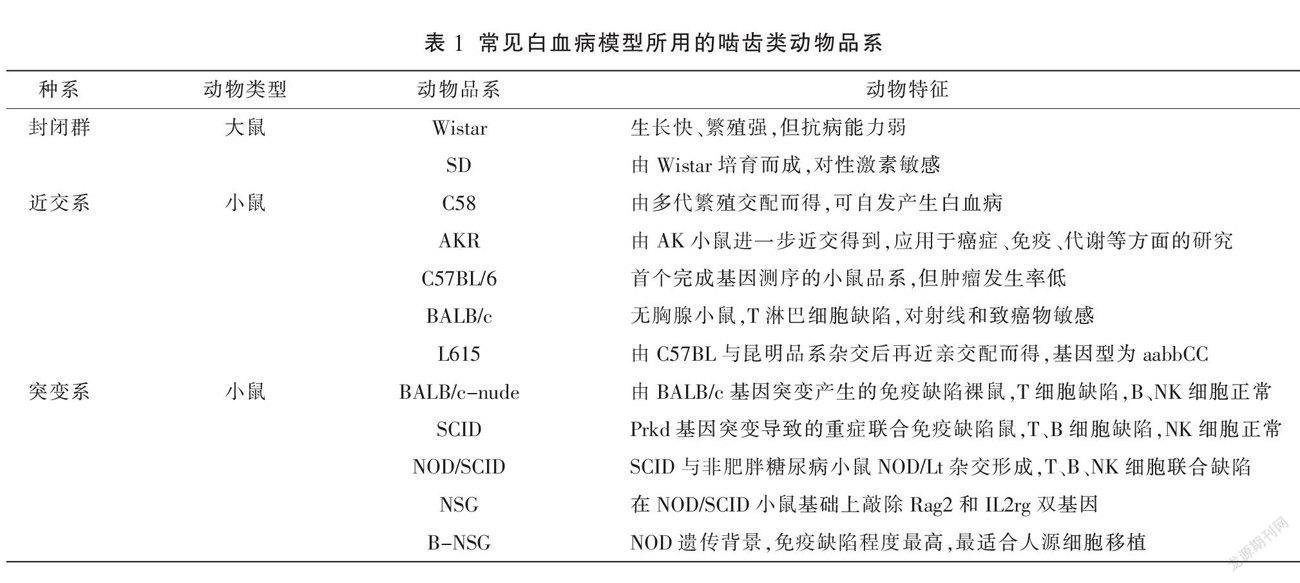
目前,应用于AML造模的实验动物以啮齿类为主,啮齿类动物具有易于获取、价格较低、模型稳定且繁殖速度快等优势[6],受到广大实验者的青睐。现将常见白血病模型所用的啮齿类动物品系简要总结。详见表1。
1.2 非啮齿类动物
斑马鱼的造血系统和分子遗传机制与人类高度相合,并且易于观察肿瘤细胞的扩散及转移[7],除了应用于研究血液相关疾病,还可以研究与肿瘤相关的分子途径、细胞环境在肿瘤进展中的作用以及鉴定抗肿瘤分子等[8]。果蝇具有遗传简单、操作方便的优势,是研究白血病染色体复杂易位的良好模型[9]。另外,灵长类动物由于获取困难,在建模中较少选用。
2 白血病模型的分类
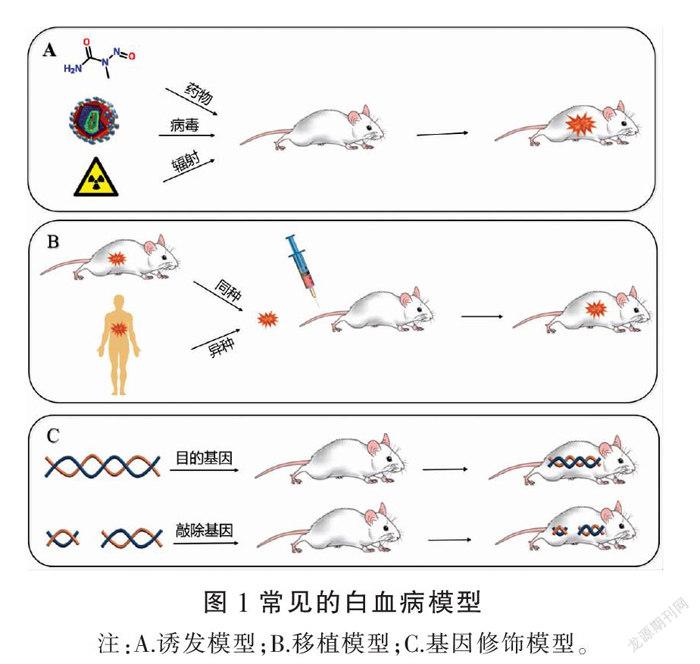
常用的白血病模型有4种:自发模型、诱发模型、移植模型、基因修饰模型。详见图1。
2.1 自发模型
建立自发模型最为简单,某些小鼠可不经人工处理而自发产生白血病,只需在饲养过程中定期观察即可。自发模型可以较好地模拟人类白血病的产生以及发生发展过程。但它也存在某些缺陷,例如:实验周期长,所耗费用较高;个体之间白血病发病情况难以统一,不易大批量获得病程相似的实验动物等。因此,很少应用于抗白血病药物临床前药物筛选研究。常用的实验小鼠有C58小鼠、AK小鼠、AKR小鼠,其中C58小鼠12月龄时白血病发病率高达90%[10]。
2.2 诱发模型
2.2.1 化学诱发模型 小鼠长期接触具有致癌作用的化学制剂可诱发产生白血病,如苯、亚硝胺类化合物、3-甲基胆蒽等。HE等[11]利用苯诱发CBA/Ca小鼠产生与AML相似的异常症状,包括肝脾肿大、骨髓中CD34+髓系细胞升高等,成功建立了单一骨髓免疫表型特征苯诱导的CBA/Ca小鼠AML模型,并发现NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)基因的过表达与其密切相关,为进一步研究苯诱导白血病的具体机制及对应治疗提供了良好基础。
2.2.2 病毒诱发模型 逆转录病毒介导的小鼠模型因具有周期短、耗时少、易于检测癌基因功能的优势[12],受到广大研究者的青睐。惠心慧等[13]通过利用逆转录病毒载体MLL-AF9构建小鼠AML模型,受体小鼠移植MLL-AF9感染的骨髓Lin-细胞后,出现白血病细胞浸润及白血病靶基因表达明显上调。这为研究白血病的生理病理机制及靶向白血病药物的筛选提供了基础平台。
2.2.3 辐射诱发模型 常用的电离辐射有X射线、γ射线,对辐射敏感的小鼠品系有BF小鼠、SJL/J小鼠、CH3小鼠、CBA小鼠[14]。有研究表明,它们的共同特征为小鼠del2缺失[15],其中,SJL/J雌性小鼠全身经3 Gy剂量X线照射后,部分小鼠出现与人AML相似的症状,并且患病比例随着辐射时间的延长而增加[16]。王存邦等[17]将BALB/c小鼠暴露于2-3 Gy剂量X线照射下,并通过尾静脉接种K562细胞,结果显示小鼠外周血和骨髓中的原始及早幼粒样白血病细胞明显升高,发病率为100%且无自发缓解,提示小鼠白血病建模成功。据相关文献报道,长期低剂量辐射也可增加患病风险[18]。STOUTEN等[19]将CBA/H小鼠暴露于低剂量辐射下诱导AML产生,以此研究低剂量电离辐射暴露与白血病发生率之间的关系,结果显示发病率与辐射暴露后小鼠所携带Sfpi1基因缺失细胞的数量成正比。
2.3 移植模型
2.3.1 同种移植模型 构建同种移植模型需要先通过辐射诱发、病毒诱发、基因剔除等方法使小鼠体内产生白血病细胞,然后在同基因型小鼠中连续传代,使后代小鼠发生白血病。与异种移植模型相比,同种移植模型可以避免移植后免疫排斥反应的产生[20]。在白血病移植模型构建当中,一般选择同种移植来构建急性淋巴细胞白血病模型,而构建AML模型时较少选用。
2.3.2 异种移植模型 异种移植模型将人源白血病细胞或原代细胞系移植于免疫缺陷小鼠体内[21],是目前最常用的动物模型。随着研究人员的不断探索和实验需要,人源肿瘤组织异种移植(patient-derived xenografts, PDX)模型应运而生,它将患者新鲜肿瘤组织直接移植于小鼠体内[22],不经过体外培养,高度保留了原始肿瘤的异质性和干细胞特性[23],使得肿瘤生长微环境更接近于患者体内微环境,与临床最为接近。叶永斌等[24]通过显微注射法将KG-1a细胞经MitoRed荧光标记后植入受精后48 h的AB系斑马鱼的卵黄囊中,观察到经标记的KG-1a细胞可在斑马鱼体内存活并侵袭组织器官,并检测到卵黄囊中增殖的细胞与植入前的KG-1a细胞在形态上具有相似性,成功建立异种异体AML斑马鱼模型。ZHOU等[25]将THP-1-GFP細胞尾静脉注射于NSG小鼠建立异种移植模型,以此来评估去泛素酶抑制剂WP1130抗白血病能力。通过分析实验条件,发现在建模过程中应用相同的小鼠品系、接种方法、接种细胞及细胞浓度,其模型成功率也会有差异。谭霖等[26]将HL-60细胞腹腔接种于经环磷酰胺预处理的雌性SCID小鼠,第34天时骨髓切片观察到HL-60细胞浸润且外周血CD33的阳性率明显升高,模型成功率高达100%。然而,杨红等[27]腹腔注射HL-60于雄性SCID小鼠和NOD/SCID小鼠,比较不同品系免疫缺陷鼠的成瘤率,结果发现构建NOD/SCID小鼠AML模型的成瘤率为100%,但SCID小鼠的成瘤率只有30%。两位研究者的实验结果存在差异,可能是因为未对SCID小鼠进行预处理,小鼠体内仍存有部分免疫功能且非特异性免疫功能正常,导致成瘤率低;选用性别不同的SCID小鼠,成瘤率可能也不同,具体原因及机制有待进一步深入研究。
2.4 基因修饰模型
2.4.1 转基因模型 转基因模型是指将所需的目的基因导入受体动物基因组,改变受体动物的遗传信息而建立的动物模型。目前,应用的转基因技术方法有显微注射法、逆转录病毒转染法、畸胎瘤细胞植入法、胚胎干细胞法。YANG等[28]建立了Vav1启动子驱动的Flag-ASXL1Y588X转基因小鼠模型,使其在造血系统中表达FLAG-ASXL1aa1-587蛋白,并证实在本次模型中靶向ASXL1截断突变为髓系恶性血液肿瘤的治疗提供研究思路。叉头盒蛋白M1(forkhead box protein M1, FOXM1)作为转录致癌基因参与白血病的发生发展以及耐药等过程[29]。陈谨等[30]初步证实FOXM1通过靶向调控B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)的表达来促进AML的发生发展。此外,KHAN等[31]利用FOXM1过表达转基因小鼠模型,证实了FOXM1过表达可诱导AML对阿糖胞苷的耐药性。因此,在抗AML基础研究中,这些转基因小鼠模型可作为强大的实验工具,为研究AML的发生机制提供了新思路与新方法。
2.4.2 基因敲除模型 基因敲除模型主要用于研究特定基因在体内的生物学功能[32]。彭璐芸等[33]通过建立敲除RNA特异性腺苷脱氨酶(adenosine deaminase
acting on RNA 1, ADAR1)的小鼠MLL-AF9融合基因AML模型,发现敲除ADARl能够改善AML的发病情况,并增加白血病细胞的凋亡。在基因敲除基础上发展而来的条件基因敲除技术,能够对动物的基因修饰进行时间和空间上的调控[34]。GREENBLATT等[35]利用条件基因敲除小鼠研究组蛋白精氨酸甲基转移酶1(calcium release-activated calcium channel protein 1, CARM1)基因在正常造血和恶性造血中的不同作用,结果显示敲除CARM1基因在正常造血系统中几乎不产生影响,但在恶性造血中能够对细胞周期进程产生损害作用,并最终诱导细胞凋亡。
3 白血病动物模型评价
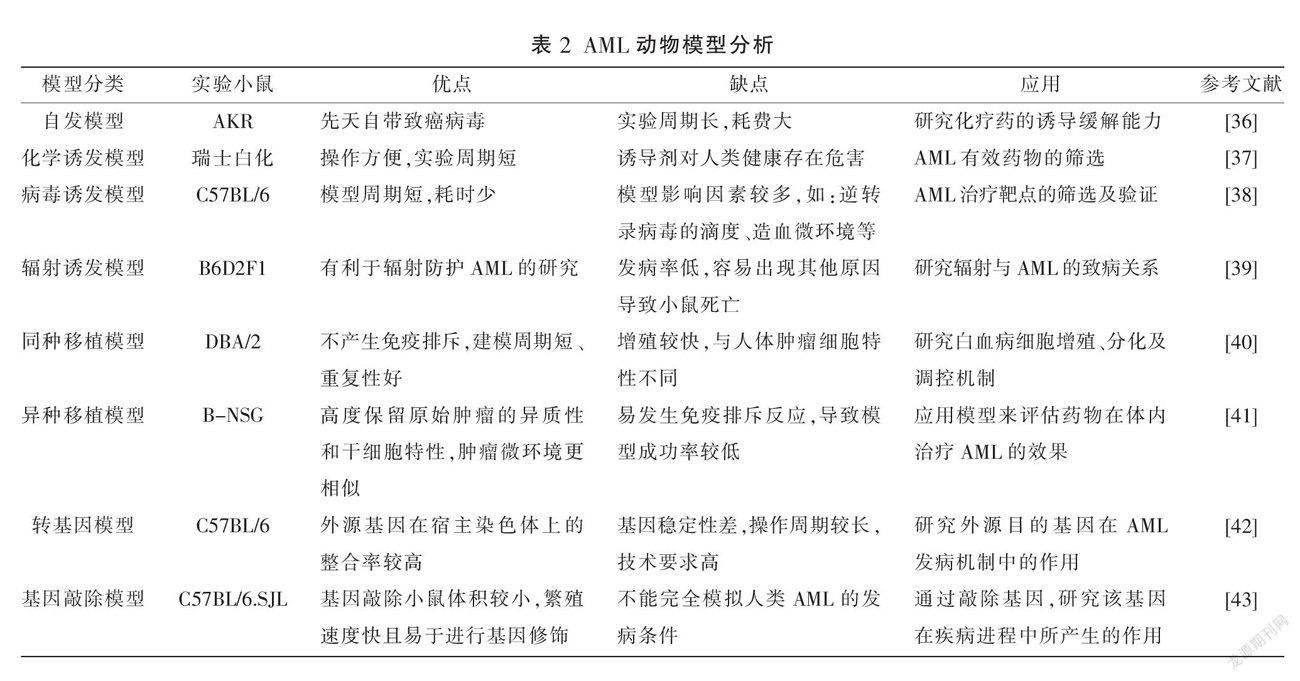
AML发病机制的探索及药物疗效的评价离不开动物模型的建立,模型评价指标主要有:(1)体貌体征观察包括精神、行为活动、体质量、食欲等;(2)外周血檢查包括白细胞、血红蛋白、血小板;(3)形态学检查包括外周血及骨髓涂片;(4)病理组织学检查包括制作小鼠肝、脾、肾病理切片,观察白血病细胞浸润情况;(5)免疫学检查包括流式细胞仪检测小鼠CD33、CD13阳性表达率。虽然动物在造血、遗传、免疫等方面与人类高度相似,但依旧无法完全体现白血病症状的复杂性和病情变化的多样性。目前,对于动物模型的评价指标没有统一的标准。现将AML动物模型进行分类和总结,旨在为模型标准化提供理论参考。详见表2。
4 动物模型在中医药研究中的应用
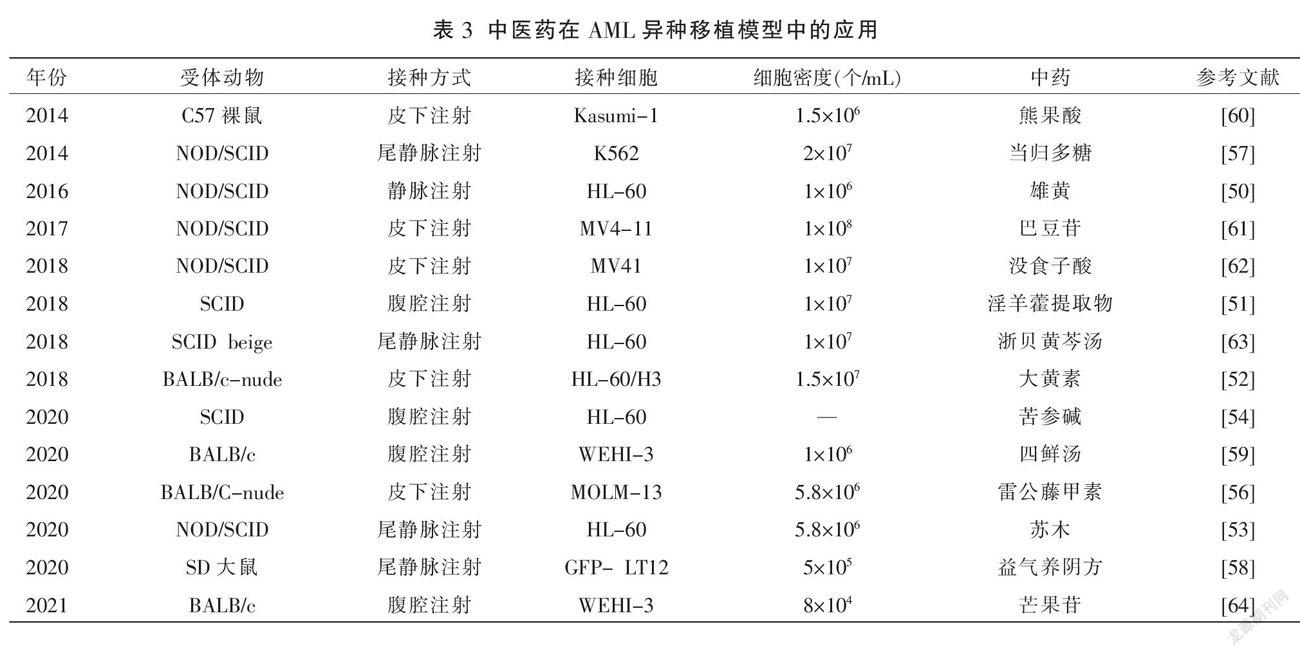
尽管在临床上采用化疗等传统西医治疗来缓解AML已被证实有效,但依然存在很多不足,例如化疗毒副作用强、老年患者耐受性差、易发生耐药和感染[44]等。近年来,中医药通过辨证分析和应用中药活性成分来治疗AML取得显著疗效[45-46]。单味中药、中药单体、中药复方也具有抑制细胞增殖、促进细胞凋亡、诱导细胞分化、逆转细胞耐药等作用[47-48],这使得中药联合化疗逐步成为当前治疗AML的热点方案。在中药研究中,多采用异种移植动物模型来探索具体的作用机制。
4.1 单味中药及提取物
目前,基于AML动物模型的中药功效研究逐步增多。研究已证实雄黄对AML-M3细胞具有诱导凋亡和促进分化双重效应[49],但雄黄的溶解性差,需要长期高剂量给药才能产生药效。MA等[50]将HL-60细胞静脉接种于NOD/SCID小鼠,发现制备水溶性聚合物包封的雄黄能够在一定程度上解决溶解性差的问题,有效地提高了雄黄的生物利用度。此外,针对中药提取物的抗AML活性研究也已得到相关证实。柯鸿等[51]研究淫羊藿提取物对AML模型小鼠的细胞生物学影响,发现其药理作用类似于阿糖胞苷,通过下调CD13和CD71以诱导HL-60细胞凋亡,增强PTEN蛋白表达以抑制HL-60细胞增殖。同时,基于NOD/SCID-AML小鼠模型观察防风提取物减毒增效功能的实验研究,发现防风提取物具有增强三氧化二砷对NOD/SCID-AML小鼠模型的治疗作用,并能改善小鼠脏器受损情况[52]。上述研究表明,基于AML小鼠模型的相关中药单药研究仍以中药提取物为主。
4.2 中药单体
CHEN等[53]通过构建异种移植模型发现大黄素可能是通过阻滞AML细胞介导的(protein kinase B, Akt)和蛋白激酶B 细胞外信号调节激酶(extracellular signal-regulated kinases, ERK)信号通路来发挥抗增殖和促凋亡作用。MA等[54]通过体内实验证实苏木乙酸乙酯提取物具有抑制AML细胞增殖、诱导AML细胞线粒体凋亡和分化的作用。王颖等[55]发现苦参碱抑制HL-60细胞增殖的机制可能与增强PTEN蛋白表达及调整Th1/Th2细胞平衡相关。此外,中西医联合治疗AML也取得显著疗效,研究表明雷公藤甲素联合维奈托克通过相互调节Bcl-2蛋白并激活内源性凋亡通路来产生抗AML作用[56]。而当归多糖联合阿糖胞苷通过调节衰老相关蛋白P16、Rb、CDK4及Cyclin D1表达,进而促进白血病细胞衰老[57]。
4.3 中药复方
祝龙等[58]研究发现益气养阴方(黄芪、生地黄、旱莲草、天冬、白术、甘草、太子参、黄精、麦冬、云苓、白花蛇舌草、蒲公英、女贞子)灌胃用于白血病大鼠中,能降低炎症因子水平,减轻白细胞组织浸润。张瑾等[59]研究发现四鲜汤鲜药汁(鲜生地、鲜小蓟、鲜蒲公英、鲜白茅根)能够改善AML模型小鼠的活动情况以及相应免疫功能,刺激细胞发挥肿瘤作用。
上述总结详见表3。因此,基于各种AML动物模型的优缺点以及实验目的,研究中药及复方治疗AML的作用特点,揭示其分子机制,有利于挖掘中药潜在的功效价值,为加快中医药现代化发展提供了实验基础。
5 总结与展望
立足于中医药基础理论,将动物模型应用于中医药抗AML的研究受到众多研究者的青睐,但大多数都局限于中药药理研究。近年来,病证结合模型作为连接中医临床与基础研究的桥梁,逐步成为中医药动物模型的发展趋势,但由于其模型建立尚存在疾病与证型关联性弱、实验动物与患病人群存在体质差异、证型维持易受环境因素影响、模型成功与否缺乏系统的评价等问题,目前,AML病证结合动物模型研究较少。因此,如何根据中医证候的不同特点、密切联系“病”与“证”,优化建模方法,规范模型应用,使病证结合模型既符合中医学理论和临床实际,又能充分体现证候实质是中西医学者探求和努力的方向之一。
综上所述,在揭示AML的发病机制、药物的活性评价、中医药的潜在作用靶点等方面,这些动物模型发挥了不可替代的重要作用。但需要注意的是,每种动物模型都有各自的特点及适用范围,目前还没有一种动物模型可以完全概括AML的所有特征,而是对AML某个特定方向进行模拟。因此,基于各种模型的局限性,确保所用模型符合实验目的,根据研究方向应用模型才是至关重要的。
参考文献
[1] DE LIMA M C, DA SILVA D B, FREUND A P, et al. Acute Myeloid Leukemia: Analysis of epidemiological profile and survival rate[J]. Jornal De Pediatria, 2016, 92(3): 283-289.
[2] 李 莹,李小燕,燕 虹,等.1991—2015年中国白血病死亡趋势APC模型分析[J].中华肿瘤防治杂志,2019,26(5):285-289.
[3] 张晓丹,周永明,严静贤.中医药治疗急性髓系白血病的研究进展[J].中国中医急症,2020,29(5):925-929.
[4] 刘彦权,周华蓉,付海英,等.白血病的传统中医临床诊疗研究进展[J].中国医药指南,2020,18(12):30-32.
[5] DE KOUCHKOVSKY I, ABDUL-HAY M. ‘Acute myeloid leukemia: A comprehensive review and 2016 update’[J]. Blood Cancer Journal, 2016, 6(7): e441.
[6] 孙浩然,徐艳玲,李长江,等.创伤后应激障碍的啮齿类动物模型研究进展[J].中国实验动物学报,2020,28(2):254-259.
[7] 钟 敏,张 勇,陈芳源.斑马鱼:人类血液疾病的良好模型[J].中华血液学杂志,2010,31(6):426-429.
[8] GARBER K. Driving T-cell immunotherapy to solid tumors[J]. Nature Biotechnology, 2018, 36(3): 215-219.
[9] SKAYNEH H, JISHI B, HLEIHEL R, et al. A critical review of animal models used in acute myeloid leukemia pathophysiology[J]. Genes, 2019, 10(8): E614.
[10] MASSEY A C, COPPOLA M A, THOMAS C Y. Origin of pathogenic
determinants of recombinant murine leukemia viruses: Analysis of Bxv-1-related xenotropic viruses from CWD mice[J]. Journal of Virology, 1990, 64(11): 5491-5499.
[11] HE J, ZANG S L, JI M, et al. Development of a benzene-induced AML model in CBA/Ca mice with bone marrow immunophenotypic features[J]. International Journal of Clinical and Experimental Medicine, 2018, 11(8): 7710-7718.
[12] 施 琳,王月英,陳赛娟.逆转录病毒介导的髓系白血病小鼠模型研究的最新进展[J].中国实验血液学杂志,2011,19(4):1058-1063.
[13] 惠心慧,万晓玲,於芳芳,等.小鼠急性髓系白血病模型的构建[J].中国细胞生物学学报,2019,41(5):942-949.
[14] RIVINA L, DAVOREN M, SCHIESTL R H. Radiation-induced mye⁃loid leukemia in murine models[J]. Human Genomics, 2014, 8: 13.
[15] BROWN N, FINNON R, MANNING G, et al. Influence of radiation quality on mouse chromosome 2 deletions in radiation-induced acute myeloid leukaemia[J]. Mutation Research Genetic Toxicology and Environmental Mutagenesis, 2015, 793: 48-54.
[16] RIVINA L, DAVOREN M J, SCHIESTL R H. Mouse models for radiation-induced cancers[J]. Mutagenesis, 2016, 31(5): 491-509.
[17] 王存邦,白 海,葸 瑞,等.应用X线照射后的Balb/c小鼠制备白血病模型的方法学研究[J].现代肿瘤医学,2011,19(2):226-228.
[18] GILLIES M, HAYLOCK R, HUNTER N, et al. Risk of leukemia associated with protracted low-dose radiation exposure: Updated results from the national registry for radiation workers study[J]. Radiation Research, 2019, 192(5): 527-537.
[19] STOUTEN S, VERDUYN LUNEL S, FINNON R, et al. Modeling low-dose radiation-induced acute myeloid leukemia in male CBA/H mice[J]. Radiation and Environmental Biophysics, 2021, 60(1): 49-60.
[20] 蔡学瑜,陈志哲.同种移植性小鼠白血病模型的建立及应用[J].医学综述,2007,13(16):1222-1225.
[21] 杨 翔,袁永平,陈懿建.白血病异种移植模型的应用研究进展[J].中国实验血液学杂志,2019,27(4):1348-1352.
[22] 童 文,杨 龙,张雅敏.人源性肿瘤组織异种移植模型的构建方法及最新应用[J].中华实验外科杂志,2020,37(8):1552-1555.
[23] HASSAN N, YANG J, WANG J Y. An improved protocol for establishment of AML patient-derived xenograft models[J]. STAR Protocols, 2020, 1(3): 100156.
[24] 叶永斌,张明宛,邱大发,等.斑马鱼异种异体急性髓系白血病模型的建立[J].中国实验血液学杂志,2017,25(1):35-41.
[25] ZHOU B, JIN X H, JIN W W, et al. WT1 facilitates the self-renewal of leukemia-initiating cells through the upregulation of BCL2L2: WT1-BCL2L2 axis as a new acute myeloid leukemia therapy target[J]. Journal of Translational Medicine, 2020, 18(1): 254.
[26] 谭 霖,陈日玲,田 川,等.急性髓系白血病小鼠模型建立及其生物学特性的研究[J].广东医学院学报,2015,33(5):546-550.
[27] 杨 红,刘建兴,周泽平,等.应用SCID和NOD/SCID小鼠构建急性髓系白血病模型成瘤率的比较[J].中国实验血液学杂志,2015,23(2):328-334.
[28] YANG H, KURTENBACH S, GUO Y, et al. Gain of function of ASXL1 truncating protein in the pathogenesis of myeloid malign⁃
ancies[J]. Blood, 2018, 131(3): 328-341.
[29] 伊英杰,贾秀红.FOX基因与白血病相关性研究进展[J].国际儿科学杂志,2015,42(4):397-399.
[30] 陈 谨,王晓明,周敏然,等.FoxM1靶向调控bcl-2促进急性髓系白血病发生[J].中国病理生理杂志,2016,32(8):1383-1388.
[31] KHAN I, HALASI M, PATEL A, et al. FOXM1 contributes to treatment failure in acute myeloid leukemia[J]. JCI Insight, 2018, 3(15): 121583.
[32] 张 剑,杨晓梅,高建刚.小鼠基因敲除的研究进展[J].山东大学学报(理学版),2011,46(10):183-196.
[33] 彭路芸,杨 鑫,张英驰,等.RNA腺苷脱氨酶在MLL-AF9诱导的小鼠急性髓系白血病发病中的作用[J].中华血液学杂志,2015,36(5):383-388.
[34] 王超玄,孙 航.基因敲除小鼠技术的研究进展[J].生物工程学报,2019,35(5):784-794.
[35] GREENBLATT S M, MAN N, HAMARD P J, et al. CARM1 is essential for myeloid leukemogenesis but dispensable for normal
hematopoiesis[J]. Cancer Cell, 2019, 35(1): 156.
[36] MC CORMACK E, BRUSERUD O, GJERTSEN B T. Animal models of acute myelogenous leukaemia-development, application and future perspectives[J]. Leukemia, 2005, 19(5): 687-706.
[37] MUKHOPADHYAY M K, SHAW M, NATH D. Chemopreventive potential of major flavonoid compound of methanolic bark extract of Saraca asoca (roxb.) in benzene-induced toxicity of acute myeloid leukemia mice[J]. Pharmacognosy Magazine, 2017, 13(Suppl 2): S216-S223.
[38] GAO Y N, GAO J, LI M H, et al. Rheb1 promotes tumor progression through mTORC1 in MLL-AF9-initiated murine acute myeloid leukemia[J]. Journal of Hematology & Oncology, 2016, 9: 36.
[39] CHAN L S A, GU L C, WELLS R A. The effects of secondary iron overload and iron chelation on a radiation-induced acute myeloid leukemia mouse model[J]. BMC Cancer, 2021, 21(1): 509.
[40] 姚苗苗,赖永洪,翟莺莺.槲皮素抗小鼠P388白血病的作用[J].广州医学院学报,2008,36(1):18-22.
[41] JIN Y X, YANG Q, LIANG L, et al. Compound Kushen injection suppresses human acute myeloid leukaemia by regulating the Prdxs/ROS/Trx1 signalling pathway[J]. Journal of Experimental & Clinical Cancer Research, 2018, 37(1): 277.
[42] STAVROPOULOU V, KASPAR S, BRAULT L, et al. MLL-AF9 expression in hematopoietic stem cells drives a highly invasive AML expressing EMT-related genes linked to poor outcome[J]. Cancer Cell, 2016, 30(1): 43-58.
[43] MAN N, TAN Y R, SUN X J, et al. Caspase-3 controls AML1-ETO-driven leukemogenesis via autophagy modulation in a ULK1-dependent manner[J]. Blood, 2017, 129(20): 2782-2792.
[44] 孙 璐,陈仙度,黄奕庆,等.急性白血病住院患者医院感染的临床特点及危险因素分析[J].湖南中医药大学学报,2012,32(2):58-59,71.
[45] 佟 丽,王茂生,仲召玲,等.内外合治法防治急性髓细胞白血病化疗性消化道反应临床观察[J].中国中医急症,2015,24(1):163-165.
[46] 镇 涛,陈赛娟.中药成分靶向治疗急性髓系白血病研究进展[J].中国中西医结合杂志,2009,29(1):14-18.
[47] 杨 茜,杜青容,吴娟丽,等.中药治疗白血病的研究进展[J].新疆中医药,2019,37(3):86-89.
[48] 申振铭,庄步玺,赵 瑶,等.复方中药制剂对急性髓系白血病细胞诱导分化与增殖的作用[J].中国实验血液学杂志,2019,27(2):403-408.
[49] 陈思宇,刘陕西,李信民.雄黄对急性早幼粒细胞白血病细胞诱导凋亡和促进分化的双重作用[J].西安交通大学学报(医学版),2002,23(4):401-404.
[50] MA Q, WANG C, LI X J, et al. Fabrication of water-soluble polymer-encapsulated As4S4 to increase oral bioavailability and chemotherapeutic efficacy in AML mice[J]. Scientific Reports, 2016, 6: 29348.
[51] 柯 鸿,武 伦,王 黎.淫羊藿提取物对急性髓系白血病SCID小鼠模型细胞生物学特性的影响[J].中国中医急症,2018,27(3):389-393.
[52] 魏玉娜.防风提取物联合三氧化二砷對急、慢性髓系白血病体内外实验研究[D].北京:中国中医科学院,2015.
[53] CHEN Y Y, GAN D H, HUANG Q H, et al. Emodin and its combination with cytarabine induce apoptosis in resistant acute myeloid leukemia cells in vitro and in vivo[J]. Cellular Physiology and Biochemistry, 2018, 48(5): 2061-2073.
[54] MA H Y, WANG C Q, HE H, et al. Ethyl acetate extract of Caesalpinia sappan L. inhibited acute myeloid leukemia via ROS-mediated apoptosis and differentiation[J]. International Journal of Phytotherapy and Phytopharmacology, 2020, 68: 153142.
[55] 王 颖,阿茹娜,吕 鹏.苦参碱对急性髓系白血病SCID模型鼠细胞生物学特性的影响[J].世界中医药,2020,15(4):543-546.
[56] SHI Y F, LIU L, HE L L, et al. Combining triptolide with ABT-199 is effective against acute myeloid leukemia through reciprocal regulation of Bcl-2 family proteins and activation of the intrinsic apoptotic pathway[J]. Cell Death & Disease, 2020, 11(7): 555.
[57] 徐春燕,賈道勇,景鹏伟,等.当归多糖与阿糖胞苷联合注射对人白血病模型小鼠骨髓单核细胞的影响[J].中草药,2014,45(23):3418-3423.
[58] 祝 龙,詹其林,王飞娟,等.益气养阴方灌胃在白血病大鼠中的作用机制及对白血病抑制因子影响的研究[J].中华中医药学刊,2020,38(5):212-214,282.
[59] 张 瑾,康 乐,李秀敏,等.四鲜汤鲜药汁对急性粒单核白血病细胞WEHI-3小鼠模型的影响[J].重庆理工大学学报(自然科学),2021,35(7):209-215.
[60] MA D, FANG Q, LI Y, et al. Crucial role of heme oxygenase-1 in the sensitivity of acute myeloid leukemia cell line Kasumi-1 to ursolic acid[J]. Anti-Cancer Drugs, 2014, 25(4): 406-414.
[61] LI Y Z, YU S, YAN P A, et al. Crotonoside exhibits selective post-inhibition effect in AML cells via inhibition of FLT3 and HDAC3/6[J]. Oncotarget, 2017, 8(61): 103087-103099.
[62] GU R X, ZHANG M Q, MENG H, et al. Gallic acid targets acute myeloid leukemia via Akt/mTOR-dependent mitochondrial respiration inhibition[J]. Biomedecine & Pharmacotherapie, 2018, 105: 491-497.
[63] 张 坤.浙贝黄芩汤通过调控Wip1对白血病模型化疗效果的影响[D].北京:北京中医药大学,2018.
[64] SHANG H S, CHEN C J, SHIH Y L, et al. Mangiferin induces immune responses and evaluates the survival rate in WEHI-3 cell generated mouse leukemia in vivo[J]. Environmental Toxicology, 2020,36:77-85.

