基于网络药理学结合GEO数据探讨木白散治疗消化性溃疡的作用机制*
白童瑜,吴宿慧
河南中医药大学,河南 郑州 450046
消化性溃疡是临床常见的消化系统疾病,包括胃溃疡、十二指肠溃疡以及复合性溃疡[1]。消化性溃疡与胃酸分泌过多、饮食因素以及压力有关,会造成胃、十二指肠的酸性消化而导致黏膜糜烂,目前往往以幽门螺杆菌(helicobacterpylori,Hp)感染发病率增高、非甾体抗炎药的广泛使用以及酗酒和吸烟为主要诱发因素[2]。此外在治疗不及时的情况下容易并发溃疡穿孔、出血和幽门梗阻,甚至引起溃疡癌变,严重威胁患者健康[3]。西医对于Hp感染消化性溃疡患者以四联药物治疗为主,虽可在一定程度上减轻相关症状,但却伴随Hp耐药性增高而疗效逐渐降低[4-5]。
消化性溃疡属于中医学“胃痛”“反酸”“嘈杂”“痞满”等范畴,以规律性的上腹疼痛、烧心、反酸、恶心、呕吐、腹胀、黑便等症状为主。《灵枢·邪气脏腑病形》云:“胃病者,胃脘当心而痛,上支两胁……取之足三里[6]。”《灵枢·胀论》云:“脾胀者善哕;胃胀者,腹满胃脘痛。寒气逆上,真邪相攻,两气相搏,乃合为胀也[6]。”首次提出胃脘疼痛、胀满与脾胃之经气寒凝壅塞不通相关。《素问·太阴阳明论》[7]云:“太阴阳明为表里,生病而异者……是以犯贼风虚邪者阳受之;食饮不节起居不时,阴受之。”阳明胃为水谷之海,脾为胃之使,胃为脾之市,故外犯虚邪贼风,内伤于饮食劳倦,两虚相得脾胃乃伤。《伤寒论·辨太阳病脉证并治》曰:“但满而不痛者,此为痞……腹满而吐……自利不渴者属太阴,以其脏有寒故也,当温之,宜服四逆辈。”指出脾胃虚寒,中阳不足则导致脾胃升降不衡,则发为痞满,治以四逆辈温补中焦,如理中汤温阳散寒并举,标本兼治[8]。
木白散为王国斌教授辨治消化性溃疡的自拟经验方,方中荜茇、白术健运脾气而祛寒,木香、草豆蔻、槟榔、甘松、砂仁醒脾开胃而行气止痛,以复脾胃升降之机能。以中焦虚寒为本、浊瘀阻滞为标辨证,临床取得良好效果,但其作用机制未明。
网络药理学是在高通量组学数据分析、计算机模拟计算及网络数据库检索的基础上,融合了系统生物学、生物信息学、网络科学等学科,具有系统层次和生物网络相结合的优势,可以解析药物与疾病之间的分子关联,进行药物作用机制的研究并且能够发现创新药物[9]。而高通量基因表达数据库(gene expression omnibus,GEO)中具有真实临床样本基因芯片数据,能够通过筛选差异表达基因准确、可靠、高效地反映疾病本质特征和规律[10]。因此本文拟从网络药理学和GEO数据库研究木白散治疗消化性溃疡的作用机制,为日后进行实验研究提供参考。
1 资料与方法
1.1 筛选木白散中药活性成分以及靶点信息利用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://tcmspw.com/tcmsp.php),筛选木香、白术、荜茇、槟榔、草果、甘松、砂仁、半夏、草豆蔻、白芍、瓦楞子、甘草的活性成分,根据口服生物利用度OB≥30%,类药性DL≥0.18为条件筛选有效活性成分,并筛选靶基因信息,其中草豆蔻、瓦楞子的有效活性成分和靶基因运用ETCM中医药百科全书数据库(http://tcmip.cn/ETCM/index.php)结合文献研究进行检索,然后利用Unipront数据库将靶基因进行标准化。
1.2 搜索消化性溃疡疾病靶基因,获取药物-疾病互作基因利用GeneGards 疾病数据库(https://www.genecards.org/)、OMIM 疾病数据库(https://www.omim.org/)以“Peptic ulcer”为关键词筛选消化性溃疡的疾病靶基因,去除重复靶基因。利用Venny2.1数据库(https://bioinfogp.cnb.csic.es/tools/venny/index.html 2.1) 将药物靶基因与消化性溃疡靶基因取交集,绘制韦恩图,得到药物-疾病共同基因。
1.3 制作木白散中药-成分-靶基因-疾病网络图利用筛选好的中药活性成分、靶基因以及药物-疾病互作基因,在Cytoscape3.7.2软件上绘制中药-成分-靶基因-疾病网络图。
1.4 绘制蛋白互作(protein-protein interaction,PPI)网络图,获取关键基因利用String平台,对药物-疾病共同基因进行蛋白互作分析,选择蛋白质属种为“Homo sapiens”,最低相互作用阈值“medium confidence”为0.4,其他参数选择默认参数。输出PPI蛋白互作网络信息,利用Cytoscape3.7.2软件中CytoNCA进行网络拓扑分析,根据度中心性DC、介度中心性BC、接近中心性CC、特征向量中心性EC、局部边连通性LAC等数值,其中选DC为2倍中位值,其他选中位值,筛选核心基因。
1.5 进行基因本体(gene ontology,GO)功能注释和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析利用R3.5.2软件对药物-疾病共同基因进行GO和KEGG富集分析,分析结果筛选q值≤0.05的数据进行可视化,GO数据选择前20组,KEGG选择前20组,绘制柱状图和气泡图,并绘制相关通路的通路图。
1.6 基于GEO数据库分析基因芯片获取消化性溃疡差异基因基于Gene Expression Omnibus数据库(GEO,http://www.ncbi.nlm.nih.gov/geo)计算机检索,以“Peptic ulcer”为检索式,选择“Homo scapiens”人类样本。通过阅读摘要,以如下标准选择:①样本量20例以上;②正常人作为对照组;③临床样本为血清。使用GEO2R工具,对GSE60427芯片中mRNA测序数据进行差异表达分析,采用logFC和adj.P.Val作为筛选条件,并绘制火山图。
1.7 绘制热图和小提琴图验证部分核心基因的差异表达提取部分核心基因表达矩阵的基因表达数据,利用R软件的“pheatmap”和“ggpubr”包绘制核心基因的差异表达热图和小提琴图。在基因表达数据中如果输入文件的数值很大,需要对数据取log2。其中热图中以“green”和“red”分别代表基因呈低表达和高表达。
2 结果
2.1 木白散活性成分结果通过TCMSP网站筛选出活性成分152个,相关靶基因335个,其中木香6个、白术4个、荜茇10个、槟榔7个、草果5个、甘松4个、砂仁8个、半夏12个、草豆蔻11个、白芍8个、瓦楞子2个、甘草88个。可知木白散能够通过多成分、多靶点发挥作用,部分成分信息如表1所示。

表1 木白散部分活性成分信息表
2.2 药物-疾病互作基因经过Genecards、OMIM数据库筛选并去除重复基因,得到消化性溃疡靶基因1 015个。将药物基因与疾病基因在Venny2.1网站上获取药物潜在基因位点92个,见图1。
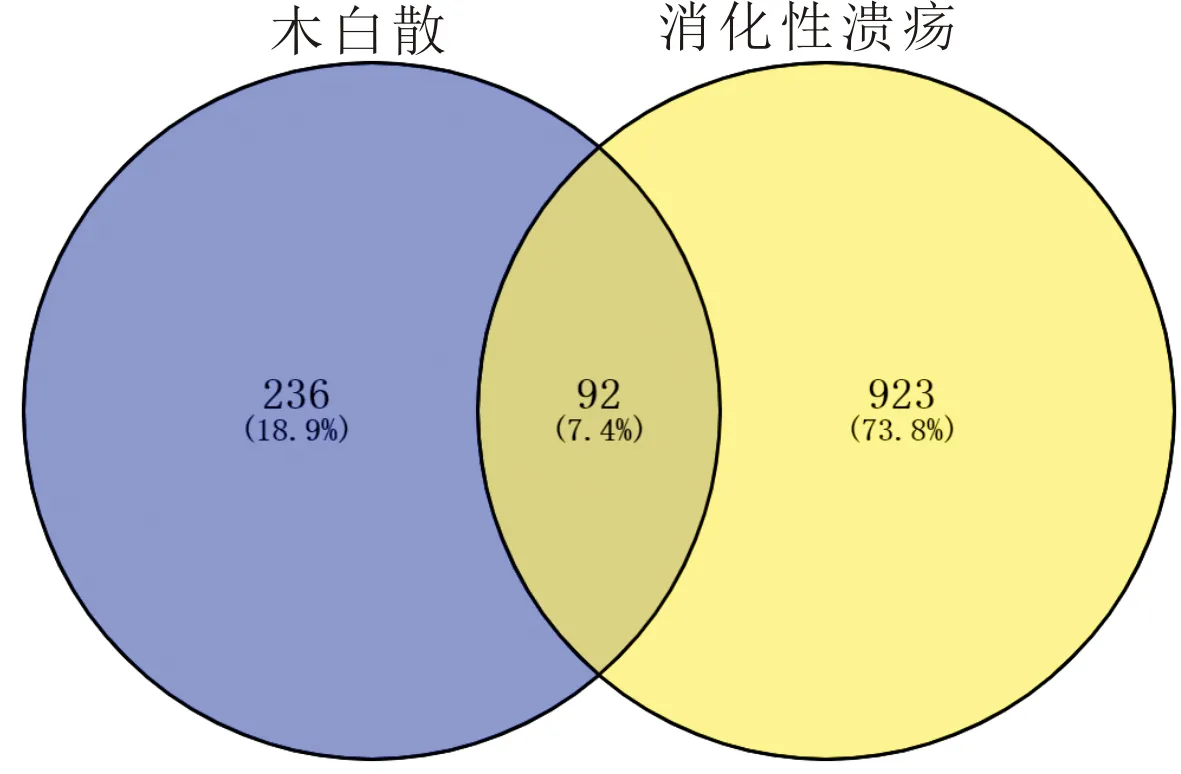
图1 木白散-消化性溃疡互作基因韦恩图
2.3 中药-成分-靶基因-疾病网络图通过Cytoscape3.7.2绘制中药-成分-靶基因-疾病网络图,结果如图2所示。其中木香、砂仁、半夏共有豆甾醇(Stigmasterol)、白芍、半夏、砂仁共有β谷甾醇(beta-sitosterol)、白芍、甘草共有山柰酚(kaempferol)、草果、甘草共有槲皮素(quercetin)、半夏含有黄芩素(baicalein)。

图2 中药-化合物-靶基因-疾病网络图
2.4 PPI蛋白互作网络结果,药物-疾病核心基因靶点通过CytoHubba插件得到药物-疾病核心基因PPI蛋白互作网络信息,筛选出35个基因为核心基因,根据GEO基因表达矩阵分析发现,核心基因中前列腺素G/H合酶2(prostaglandin G/H synthase 2,PTGS2)、白细胞介素-6(interleukin- 6,IL-6)、干扰素γ(interferon-γ,IFN-γ)、IL-10、C-C基序趋化因子2(C-C motif chemokine ligand 2,CCL2)、胞间黏附分子1(cell adhesion molecule1,ICAM1)、血管细胞黏附蛋白1(vascular cell adhesion molecule-1,VCAM1)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)8个基因为核心基因在消化性溃疡患者中差异表达,如图3所示。
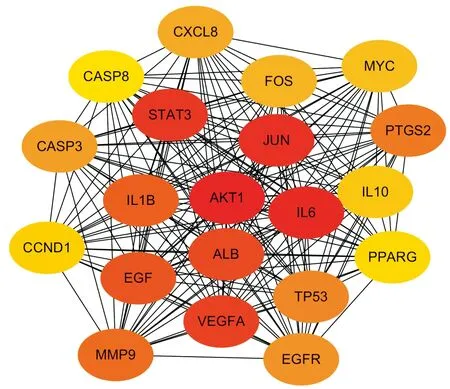
图3 Cytohub筛选核心基因结果示意图
2.5 GO基因功能注释结果在R4.0.2软件上进行GO功能注释得到共同基因聚集在生物过程(Biological Process)对脂多糖的反应(response to lipopolysaccharide)、对细菌源性分子的反应(response to molecule of bacterial origin)、细胞对化学应激的反应(cellular response to chemical stress);细胞组成(Cell Composition)囊腔(vesicle lumen)、分泌颗粒腔(secretory granule lumen)、血小板α颗粒腔(platelet alpha granule lumen);分子功能(Molecular Function)核受体活性(nuclear receptor activity)、配体激活转录因子活性(ligand-activated transcription factor activity)抗氧化活性(antioxidant activity)如图4所示。

图4 药物-疾病共同基因GO功能注释结果图
2.6 KEGG富集通路分析结果木白散-消化性溃疡疾病基因在R4.0.2软件上进行KEGG通路富集分析,结果得出互作基因主要富集在MAPK信号通路(MAPK signaling pathway)、NF-κB信号通路(NF-kappa B signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、HIF-1信号通路(HIF-1 signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway),如图5所示。其中 NF-κB 信号通路的通路图信息见图6。

图5 药物-疾病共同基因KEGG富集分析结果图

图6 NF-κB信号通路示意图
2.7 消化性溃疡GEO数据差异基因结果通过GEO2R工具,对GSE60427芯片中mRNA测序数据进行差异表达分析,发现消化性溃疡患者中差异基因为1 822个。上调的为1 391个,下调的为431个,如图7火山图所示。

图7 GSE60427芯片消化性溃疡患者差异基因火山图
2.8 部分核心基因差异表达的热图和小提琴图利用R软件对提取部分核心基因表达矩阵的基因表达数据,绘制热图和小提琴图,发现消化性溃疡患者PTGS2、IL-6、IL-10等部分核心基因显著高表达,且P<0.001,差异具有统计学意义。如图8、图9所示。

图8 部分核心基因热图

图9 部分核心基因小提琴图
3 讨论
目前认为消化性溃疡的发病机制为药物损伤、Hp感染等致病因素造成的胃酸、胃蛋白酶对胃黏膜的侵袭作用与黏膜屏障的防御能力失衡所致[11]。而Hp等侵袭因子引起的IL-1β、TNF-α、IL-17以及IFN-γ等黏膜促炎细胞因子的增加则会导致溃疡的恶化[12]。随着质子泵抑制剂、胃黏膜保护剂以及抗Hp耐药的出现,新的研究发现配合中药治疗不但能够提高Hp的根除率、促进溃疡的愈合而且能够降低西药的耐药性[13]。
王国斌教授辨治消化性溃疡多以中焦虚寒为本,浊瘀阻滞为标,根据临床经验在理中汤的基础上自拟经验方木白散,方中荜茇、白术健运脾气而祛寒;木香、草豆蔻、槟榔、甘松、砂仁醒脾开胃而行气止痛以复脾胃升降之机能;瓦楞子制酸止痛以化瘀;槟榔消积导滞止痛,以温中补虚、行气化浊、理气止痛、消积除胀,还能够改善胃脘痛并促进溃疡创伤面的修复[14]。研究发现内服槟榔煎剂则可以通过杀灭Hp,从而切断Hp的感染途径,清除Hp对胃肠黏膜的损伤,使胃黏膜糜烂灶和十二指肠溃疡灶得以自行修复[15]。临床研究发现木白散加减联合三联方案治疗消化性溃疡,可以通过改善炎症细胞浸润、黏膜厚度及腺体形态,以促进胃黏膜组织修复,并提高临床症状改善程度和Hp根除率[16]。
通过中药-化合物-靶基因-疾病网络分析得到,木白散可以通过槲皮素、豆甾醇、β谷甾醇、山柰酚、黄芩素等成分治疗消化性溃疡。研究发现吲哚美辛可以引起大鼠胃黏膜表面损伤,造成黏膜充血、糜烂以及炎性细胞浸润,而槲皮素相对于法莫替丁能够阻止吲哚美辛引起的胃溃疡胃黏膜损伤[17]。另有研究发现纳米槲皮素能够通过下调基质 MMP-9和NOS-2的表达以阻断乙醇诱导的胃溃疡的氧化应激反应[18]。研究发现山柰酚能够通过抑制中性粒细胞积累和髓过氧化物酶(myeloperoxidase,MPO)活性,调节促炎细胞因子(TNF-α和IL-1β)水平,并改善NO的产生以降低溃疡指数,保护胃黏膜免受损伤[19]。研究发现黄芩素可以通过降低还原型谷胱甘肽(reduced glutathione,GSH)和MPO活性,抑制乙醇诱导的小鼠急性溃疡形成、减少炎症过程、刺激细胞抗氧化机制和增加黏液量[20]。由此可知,木白散可以通过多种成分抑制乙醇等诱导的消化性溃疡中的炎症反应,从而保护胃黏膜免受损伤。
通过PPI蛋白互作网络分析筛选,GEO基因表达矩阵分析发现,木白散治疗消化性溃疡的靶点可能为PTGS2、IL-6、IFN-γ、MMP-9、CCL2、ICAM1、VCAM1等蛋白。非甾体抗炎药通过阻断前列腺素合酶1和合酶2同工酶环氧合酶的活性抑制前列腺素的合成,最终诱导胃黏膜损伤而导致胃溃疡的发生,而研究表明PTGS2选择性抑制剂NS-398能够导致溃疡愈合的显著延迟[21-22]。另有研究表明益气活血方能够通过增加消化性溃疡黏膜组织中的环氧合酶的活性和前列腺素2的分泌以促进消化性溃疡的愈合[23]。IL-6是一种多功能因子,可以通过中性粒细胞、巨噬细胞和淋巴细胞释放各种有害产物、活性氧自由基以及溶酶体等炎症因子,以调节炎症反应,使胃溃疡中的胃黏膜损伤向愈。研究发现在遗传诱导的小鼠胃溃疡模型中IL-6表达水平升高,而氧白藜芦醇可以抑制IL-6的表达,从而治疗消化性溃疡[24]。Hp能够在小鼠胃溃疡的胃黏膜中触发CD+T细胞反应,释放IFN-γ和其他促炎因子,并且IFN-γ在Hp诱导的胃炎中发挥重要作用[25]。MMPs能够选择性降解胃组织的细胞外基质(extracellular matrix,ECM)而调节ECM重塑参与胃溃疡的形成,而活性氧和氮物质则能够通过破坏MMP活化和失活的平衡,参与胃溃疡在内的多种疾病发病机制[26]。另外在乙醇诱导的小鼠胃溃疡模型中发现MMP-9的活性增强与小鼠胃黏膜损伤的程度呈正相关,而作为一种抗炎剂,褪黑素可以通过降低MMP-9的活性发挥抗溃疡的作用[27]。通过对核心靶基因进行绘制热图和小提琴图发现,上述核心基因在消化性溃疡患者中表达增高,由此可知木白散可以通过调节上述核心基因以抑制炎症反应干预胃溃疡的胃黏膜损伤。
通过GO生物功能注释和KEGG通路富集分析得知,木白散治疗消化性溃疡可能与脂多糖的反应、对细菌源性分子的反应、抗氧化活性等生物学过程,以及MAPK、NF-κB、IL-17、HIF-1、肿瘤坏死因子等信号通路有关。活性氧(reactive oxygen species,ROS)能够导致线粒体功能障碍和氧化应激反应而损伤胃黏膜细胞,在胃溃疡的发生过程中发挥重要作用。而氧化应激能够通过激活NF-κB、IFN-γ 以及IL-1β等炎症通路以增强炎症反应损伤细胞,在吲哚美辛诱导的大鼠胃溃疡研究中发现,N-乙酰半胱氨酸能够通过抑制IFN-γ以及 IL-1β 的表达,发挥抗氧化作用治疗消化性溃疡[28]。非甾体抗炎药能够诱导胃黏膜大鼠胃腺细胞坏死、胃黏膜弥漫性出血,以及TNF-α、IL-6等炎性因子的增高[29]。IL-17作为一种炎症因子,能够募集中性粒细胞向炎症部位聚集,在许多慢性炎症性疾病的发病机制中起关键作用。有研究证明Hp感染后小鼠胃黏膜中IL-17水平升高,而IL-17基因敲除后的小鼠可以免受Hp诱导的胃黏膜损伤[30]。由此可知,预测木白散治疗消化性溃疡的生物过程和富集分析通路,涉及通过抑制炎症反应和氧化应激防止胃黏膜损伤。
综上所述,木白散能够通过山柰酚、槲皮素、黄芩素等成分作用于PTGS-2、IL-6、MMP-9等基因,调控MAPK、NF-κB、IL-17等信号通路,抑制炎症反应,抑制内皮细胞增生,治疗消化性溃疡,其具体调控机制尚待实验的进一步验证。

