DWI联合DCE-MRI对前列腺肿瘤术前鉴别诊断的效能分析
卢晓冬 杨 明 杨 维 何业银
江苏省泗阳县人民医院影像中心(江苏 223700)
良性前列腺增生症(Benign prostatic hyperplasia,BPH)和前列腺肿瘤(Prostate cancer,PCa)是老年男性较为常见的疾病,近年来前列腺肿瘤发病率呈上升趋势,早期诊断和治疗是影响预后的重要因素[1]。目前临床上诊断PCa的影像学方法主要有经直肠超声检查(Transrectal ultrasonography,TRUS)、电子计算机断层扫描(Computed Tomography,CT)、磁共振成像(Magnetic resonance imaging,MRI)、正电子发射计算机断层显像(Positron Emission Computed Tomography,PET)等。TRUS对前列腺的细微病变难以显示,限制了对早期PCa的诊断;CT的软组织对比分辨率低,对PCa早期诊断无明显优势;PET是肿瘤诊断和分期评估的先进影像学技术,但其价格昂贵,设备普及率低,目前多用于检查有无全身转移的中晚期肿瘤患者。MRI具有较好的软组织分辨率,可对病变组织多角度、多序列、多参数成像,随着影像学技术的发展,弥散加权成像(Diffusion-weighted imaging,DWI)和MRI动态增强扫描(Dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)在临床的应用日益深入,增加了诊断恶性肿瘤的准确性[2-4]。本研究对92例前列腺病变患者的MRI影像学资料进行分析,旨在探讨DWI和DCE-MRI对PCa的鉴别诊断价值。
资料与方法
一、一般资料
以2019.1-2020.3在我院接受手术治疗的前列腺病变患者为研究对象。纳入:①经肛门直肠指检发现前列腺结节;②B超检查发现前列腺低回声结节;③实验室检查发现前列腺特异性抗原(Prostate specific antigen,PSA)异常升高。满足以上任一条件即可入选。排除标准:①急性前列腺炎患者;既往有前列腺手术史者;②合并其他恶性肿瘤疾病者;③MRI检查前已接受穿刺活检、激素疗法或放化疗者;④有MRI检查禁忌症者或拒绝行增强检查者;⑤无最终病理结果者。最终纳入有效病例92例,且MRI影像学资料完整,根据术后病理检查结果分为PCa组和BPH组。PCa组患者36例,年龄60~76(68.35±3.53)岁,病程3~17个月,平均(8.85±1.71)月;BPH组患者56例,年龄60~77(69.28±3.47)岁,病程4~18个月,平均(8.19±1.82)月。两组患者年龄、病程比较差异无统计学意义(P>0.05)。均知情同意,本研究经医学伦理委员会批准(批号:20180402)。
二、检查方法
所有患者术前接受MRI检查,仪器为美国GE 1.5THDXT磁共振扫描仪,8通道腹部相阵控线圈。患者空腹检查,膀胱中度充盈,取仰卧位,横断面对前列腺及精囊腺范围进行扫描,冠状面及矢状面自盆底至腹主动脉分叉水平进行大范围扫描。(1)常规扫描。先进行三维定位像,再行横断面抑脂T2加权(TSE-FST2WI),要求垂直于前列腺外周带后缘长轴,重复时间(Time of Repetition,TR)4300ms,回波时间(Time of Echo,TE)140ms,层厚4mm,层间隔0.1mm,激励次数(Number of signal averaged,NEX)=4,视野(field of view,FOV)=32×32mm。然后行矢状面和冠状面T2WI,横断面T1WI,TR440ms,TE7.8ms,层厚4mm,层间隔0.1mm,NEX=2,FOV=32×32mm。成像序列:快速自旋回波(Fast spin echo,FSE)序列,轴位T1WI、T2WI、抑 脂T2WI,矢状面和冠状面T2WI。参数:T1WI(TR600ms,TE10ms),T2WI(TR4060ms,TE97ms),采集带宽15.6~41.9kHz,矩阵320×256,FOV=320×320mm,层厚4mm,层间隔0.1mm,信号平均次数=4。(2)DWI扫描。以前列腺为中心采取单次激发自旋回波-回波平面成像(Spinecho echo planar imaging,SE-EPI)序列,根据MRI显示的可疑病灶定域采样位置,TE66.8~75ms,TR3000~4000ms,FOV=320×320mm,矩阵320×256,层厚4mm,层间隔0.1mm,NEX=4~6,b值选取1000s/mm2、600s/mm2两个参数。(3)DCE-MRI扫描。运用3D-LAVA技术行前列腺及精囊腺范围内轴位扫描,TR/TE/TI=5.4/2.0/5.0ms,层厚/层间距=4/0mm,FOV=320×320mm,矩阵320×256。经左肘前静脉10s快速注入钆喷替酸葡甲胺(Gd-DTPA)0.2mmol/kg,注射前先扫描2个空白时相,注射开始10s后连续扫描24期,扫描一期12s。
三、图像观察和处理
由2位经验丰富的影像学医师采用盲法共同阅片,如意见不同则协商达成一致。将扫描得到的数据传送至工作站,观察病灶的形态、大小、数目、边缘、信号特点、浸润程度、淋巴结转移等情况。分别在DWI、DCE-MRI图像上选取感兴趣区(Region of interest,ROI),大小约30mm×30mm,尽量避免脂肪、空气、囊变、钙化等因素的干扰。采用相关软件对DWI数据进行处理,测量ROC区的表观弥散系数(Apparent Diffusion Coefficient,ADC),自动重建ADC图。利用功能软件处理DCE-MRI数据,得到时间-信号(SI-T)曲线,分为三型:Ⅰ型为早期快速强化后仍稳定强化或缓慢强化型,Ⅱ型为早期快速强化后出现平台期,Ⅲ型为早期快速强化后随即下降。选定右侧股动脉获得AIF曲线模型,绘制ROI,获得动态增强的药代动力学参数,包括容积转运常数(Volume transfer constant,Ktrans)、速 率 常 数(Rate constant,Kep)、血管外细胞外间隙体积百分数(Extravascularextracellular volume fraction,Vc)。
四、统计学方法
用SPSS21.0进行数据分析。等级资料以(%)表示,组间比较采取秩和检验;符合正态分布的计量数据以(±s)表示,组间比较采取独立样本t检验;用受试者工作曲线(Receive operating characteristic curve,ROC)分析ADC值和DCE-MRI参数对前列腺肿瘤的诊断效能,记录曲线下面积(Area Under the Curve,AUC)、敏感度、特异度。以P<0.05有统计学意义。
结 果
一、两组不同b值下ADC值比较
b值取1000s/mm2、600mm2时,PCa组患者ADC值均低于BPH组(P<0.05),表1。
表1 两组不同b值下ADC值比较(±s,×10-3mm2/s)
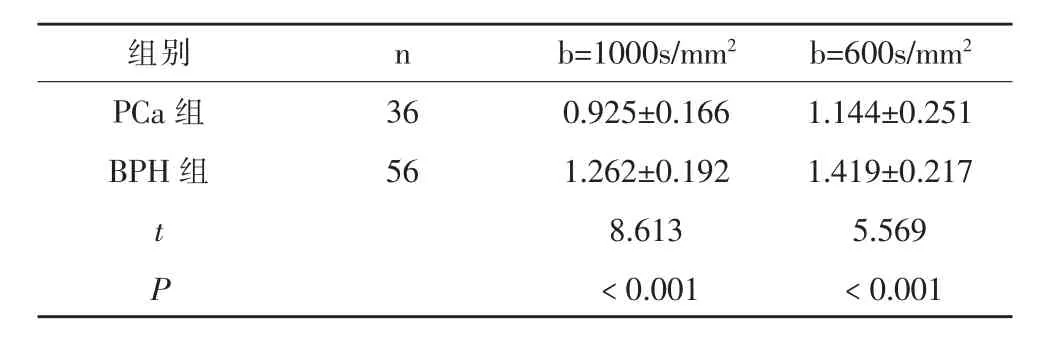
表1 两组不同b值下ADC值比较(±s,×10-3mm2/s)
组别 n b=1000s/mm2 b=600s/mm2 PCa组 36 0.925±0.166 1.144±0.251 BPH组 56 1.262±0.192 1.419±0.217 t 8.613 5.569 P<0.001 <0.001
二、不同b值下ADC值的诊断效能比较
b=1000s/mm2时,ADC值诊断前列腺肿瘤的AUC值为0.905,ADC值为1.011×10-3mm2/s时诊断效能最大,敏感度为77.78%,特异度为91.07%;b=600mm2时,ADC值诊断前列腺肿瘤的AUC值为0.805,ADC值为1.301×10-3mm2/s时诊断效能最大,敏感度为77.78%,特异度为75.00%。表2和图1,b值取1000s/mm2时诊断效能大于600s/mm2。
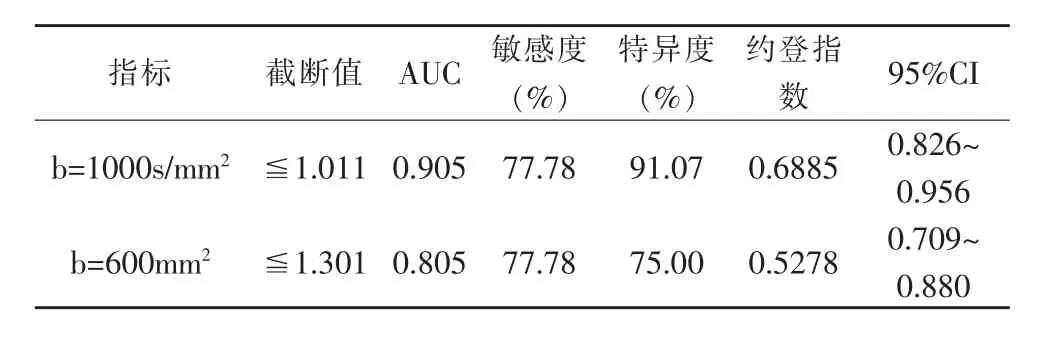
表2 不同b值下ADC值的诊断效能比较

图1 不同b值下ADC值诊断前列腺肿瘤的ROC曲线
三、两组患者SI-T曲线类型比较
PCa组患者以Ⅲ型曲线为主,BPH组患者以Ⅱ型为主,两组曲线类型比较差异有统计学意义(P<0.05),见表3。
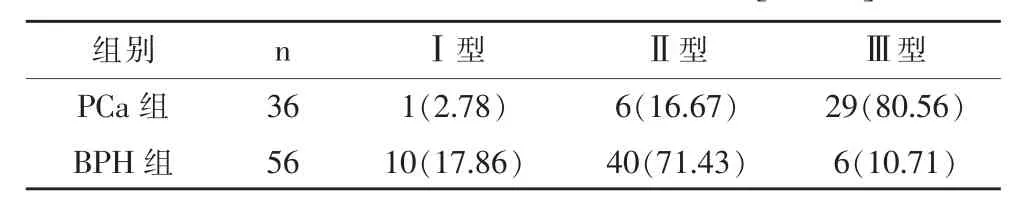
表3 两组患者SI-T曲线类型比较[n(%)]
四、两组DCE-MRI参数比较
PCa组患者Ktrans、Kep、Vc水平均高于BPH组(P<0.05),见表4。
表4 两组DCE-MRI参数比较(±s)

表4 两组DCE-MRI参数比较(±s)
组别 n Ktrans(min-1) Kep(min-1) Vc PCa组 36 0.35±0.07 0.85±0.15 0.31±0.06 BPH组 56 0.27±0.05 0.65±0.12 0.23±0.05 t 6.503 7.045 7.575 P<0.001 <0.001 <0.001
五、DCE-MRI参数的诊断效能分析
Ktrans诊断前列腺肿瘤的AUC值为0.828,以0.31min-1为临界值时诊断效能最大,敏感度、特异度为69.44%、83.93%;Kep诊断AUC值为0.857,以0.73min-1为临界值时诊断效能最大,敏感度、特异度为83.33%、78.57%;Vc诊断AUC值为0.874,以0.27为临界值时诊断效能最大,敏感度、特异度为77.78%、82.14%。具体见表3和图2。
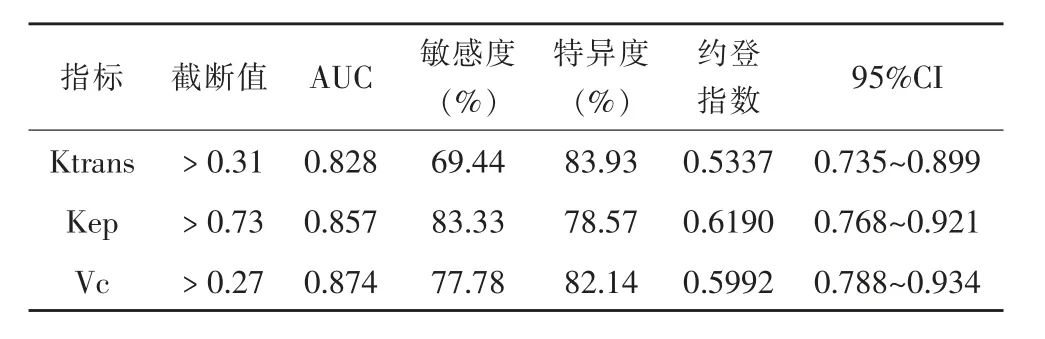
表5 DCE-MRI参数的诊断效能分析

图2 DCE-MRI参数诊断前列腺肿瘤的ROC曲线
讨 论
前列腺肿瘤多发于中老年男性,近年来其发病率有上升趋势,早期诊断和治疗有利于获得良好预后。MRI检查对PCa有较高的诊断价值,传统的T2WI序列可以很好的显示前列腺解剖结构,对癌症的检出、定位、分期有重要意义[5]。PCa在T2WI序列上表现为低信号,但与背景组织缺乏对比,且前列腺炎、纤维化、出血、钙化等表现均可显示为低信号,因此T2WI序列单独诊断的特异性较低[6]。另外,常规MRI图像的诊断准确性较大的依赖于医师的个人水平及经验,容易导致主观上的偏差,因此临床上需要寻找更客观、准确的影像学技术,以提高对PCa的诊断。
DWI作为一种无创磁共振功能成像技术,可以实现在分子水平上反映病理生理过程,ADC值用来描述组织内水分子弥散强度的高低,通过该参数的测量可以对病变进行定量分析[7]。正常前列腺外周组织富含大量腺体和腺管结构,水分较多,细胞外间隙大也利于水分子自由运动,因此正常外周带的ADC值较高[8]。恶性肿瘤发生时会破坏前列腺的正常结构,细胞排列紊乱、密实,肿瘤细胞结构也发生改变,多种因素影响下水分子弥散受限,ADC值明显降低[9,10]。本研究显示,b值取1000s/mm2、600s/mm2时,PCa组患者ADC值均低于BPH组。分析原因认为,前列腺增生组织的细胞仍保持分泌功能,同时细胞大量增殖,腺体内液体明显增大,水分子运动增强则ADC值偏高。前列腺肿瘤细胞排列紧密且包裹腺体,腺体分泌的液体量减少,影响水分子的弥散运动,因此ADC值偏低。b值是反映扩散梯度和持续时间的参数,影响对水分子弥散运动的敏感性,b值越高则ADC值越低。高b值可降低血流灌注产生的影响,测定的ADC值更接近于真实的扩散系数,可较好的反映组织内水分子的扩散运动,但b值增高会加重伪影,信号衰减加大,图像质量会下降[11],因此需根据设备和检查部位选择合适的b值。ROC曲线分析结果显示,b值取1000s/mm2时DWI具有更高的诊断效能,AUC值为0.905,敏感度为77.78%,特异度为91.07%。
DCE-MRI可较好的评价病变的血流动力学,对较小的肿瘤也有较高的敏感性,SI-T曲线反映信号强度与时间变化的关系,可直观的连续反映病变组织的强化特点[12,13]。本研究中,PCa组患者以Ⅲ型曲线为主,强化方式以“快进快出”最多,符合典型的恶性肿瘤强化方式;BPH组患者以Ⅱ型为主,增生组织强化较慢且多为持续强化。由于前列腺良恶性疾病的强化方式存在明显差异性,SI-T曲线可作为前列腺肿瘤诊断的重要参考指标之一。DCE-MRI对前列腺疾病的定量分析法需计算药代动力学参数,以反映患者血管通透性。Ktrans指单位时间内对比剂从血浆经毛细血管壁进入组织间隙的剂量,Kep为单位时间内对比剂从组织间隙返回血管内的剂量,Vc指血管外细胞外间隙体积百分数[14,15]。本研究定量分析结果显示,PCa组患者Ktrans、Kep、Vc水平均高于BPH组。分析原因认为,肿瘤组织血管生成速度过快,毛细血管壁不成熟,其内皮细胞间隙较正常细胞间隙大,因此肿瘤血管的通透性增加。ROC曲线分析结果发现,Ktrans诊断AUC值为0.828,敏感度、特异度为69.44%、83.93%;Kep诊断AUC值为0.857,敏感度、特异度为83.33%、78.57%;Vc诊断AUC值为0.874,敏感度、特异度为77.78%、82.14%。上述结果表明DCE-MRI各项定量参数可对前列腺肿瘤做出诊断。
总结,DWI和DCE-MRI对前列腺肿瘤有较高的鉴别诊断价值,可提供丰富的诊断信息,结合ADC值、SIT曲线类型及Ktrans、Kep、Vc等参数做出综合判断,有利于提高诊断准确性。

