清中愈疡汤对脾胃湿热型胃溃疡作用的实验研究
傅斌 陈建章 范姝 包奇昌 万军 洪建勋



【摘要】 目的:探討清中愈疡汤对脾胃湿热型胃溃疡的治疗作用,为临床用药提供实验依据。方法:将60只Wistar大鼠随机分为6组,正常对照组、模型对照组、清中愈疡汤高剂量组、清中愈疡汤中剂量组、清中愈疡汤低剂量组、奥美拉唑组,每组10只。正常对照组正常饲养,其余各组均制作为实验性脾胃湿热型胃溃疡大鼠模型。造模成功予以持续治疗30 d后,处死大鼠取其血样和胃黏膜组织。测量计算大鼠溃疡面积及溃疡抑制率;将胃黏膜组织制成病理切片行苏木素伊红(HE)染色,在显微镜下观察各组大鼠胃黏膜组织的病理学变化,并检测大鼠血清中肿瘤坏死因子(TNF-α)、白介素-8(IL-8)、胃动素(MTL)、前列腺素E2(PGE2)等水平,比较干预前后各组相关指标变化情况。通过Western blot法检测大鼠胃黏膜组织中核转录因子κB(NF-κB)通路相关蛋白水平,包括磷酸化核因子κB亚基65(p-NF-κB p65)、磷酸化核因子κB抑制蛋白(p-IκBα)。结果:与正常对照组比较,模型对照组胃黏膜发生明显病理变化,黏膜上皮细胞明显缺损,可见黏膜组织充血及水肿现象,并存在明显炎性细胞浸润。干预后,各组溃疡面积、溃疡抑制率、TNF-α、IL-8、MTL及PGE2水平、NF-κB p65、p-NF-κB p65、IκBα、p-IκBα蛋白表达水平比较,差异均有统计学意义(P<0.05);干预后,与正常对照组比较,模型对照组溃疡面积增加,NF-κB p65、IκBα蛋白表达水平均降低,p-NF-κB p65、p-IκBα蛋白表达水平均升高(P<0.05);干预后,与模型对照组比较,清中愈疡汤高、中、低剂量组及奥美拉唑组溃疡面积均明显减少,TNF-α、IL-8水平均下降,MTL、PGE2水平均升高,(P<0.05);与奥美拉唑组比较,清中愈疡汤高、中剂量组溃疡面积均明显减少,溃疡抑制率均明显增加(P<0.05);与清中愈疡汤低剂量组比较,清中愈疡汤高、中剂量组溃疡面积均明显减少,溃疡抑制率均明显增加(P<0.05)。与清中愈疡汤中剂量组比较,清中愈疡汤高剂量组明显减少,溃疡抑制率明显增加(P<0.05)。与模型对照组比较,清中愈疡汤高、中、低剂量组均出现不同程度的NF-κB p65、IκBα蛋白表达水平升高、p-NF-κB p65下降;清中愈疡汤高剂量组p-IκBα蛋白表达水平低于模型对照组(P<0.05)。结论:清中愈疡汤可通过抑制炎症因子释放以及抑制NF-κB信号通路相关蛋白表达,以减少溃疡面积,并促进胃黏膜内源性物质分泌以及胃活动功能,从而达到对脾胃湿热型胃溃疡的治疗作用,促进溃疡愈合。
【关键词】 胃溃疡 脾胃湿热型 清中愈疡汤 大鼠模型
Experimental Study on the Effect of Qingzhong Yuyang Decoction on Gastric Ulcer of Spleen and Stomach Damp-heat Type/FU Bin, CHEN Jianzhang, FAN Shu, BAO Qichang, WAN Jun, HONG Jianxun. //Medical Innovation of China, 2022, 19(16): 0-034
[Abstract] Objective: To explore the therapeutic effect of Qingzhong Yuyang Decoction on gastric ulcer of spleen-stomach damp-heat type, and to provide experimental basis for clinical medication. Method: A total of 60 Wistar rats were randomly divided into 6 groups: normal control group, model control group, high-dose Qingzhong Yuyang Decoction high-dose group, Qingzhong Yuyang Decoction medium-dose group, Qingzhong Yuyang Decoction low-dose group, Omeprazde group, 10 animals in each group. The normal control group was fed normally, and the other groups were used as experimental gastric ulcer rat models of spleen-stomach damp-heat type. After successful modeling and continuous treatment for 30 days, the rats were sacrificed to obtain blood samples and gastric mucosal tissue. The ulcer area and the ulcer inhibition rate of the rats were measured and calculated; the gastric mucosa tissue was made into pathological sections and stained with hematoxylin and eosin (HE), the pathological changes of the gastric mucosa tissue of the rats in each group were observed under a microscope, and the serum levels of the rats were detected. The levels of tumor necrosis factor (TNF-α), interleukin-8 (IL-8), motilin (MTL), and prostaglandin E2 (PGE2) were compared, and the changes of related indicators in each group before and after the intervention were compared. Western blot was used to detect the levels of nuclear factor κB (NF-κB) pathway-related proteins in rat gastric mucosa, including phosphorylated nuclear factor κB subunit 65 (p-NF-κB p65), phosphorylated nuclear factor κB inhibitory protein ( p-IκBα). Result: Compared with normal control group, gastric mucosa in model control group showed obvious pathological changes, with obvious defect of epithelial cells, hyperemia and edema of mucosal tissue, and obvious inflammatory cell infiltration. After intervention, there were significant differences in ulcer area, ulcer inhibition rate, TNF-α,
IL-8, MTL and PGE2 levels, and protein expression levels of NF-κB p65, P-NF -κB p65, IκBα and P-I κBα among all groups (P<0.05). After intervention, compared with normal control group, ulcer area increased, NF-κB p65 and IκBα protein expression decreased, and P-NF -κB p65 and P-I κBα protein expression increased in model control group (P<0.05). After intervention, compared with model control group, ulcer area in Qingzhong Yuyang Decoction high-dose, medium-dose and low-dose groups and Omeprazole groups were significantly reduced, TNF-α and IL-8 levels were decreased, MTL and PGE2 levels were increased (P<0.05). Compared with omeprazole group, ulcer area in Qingzhong Yuyang Decoction high-dose and medium-dose groups was significantly reduced, and ulcer inhibition rate was significantly increased (P<0.05). Compared with the Qingzhong Yuyang Decoction low-dose group, the ulcer area in the Qingzhong Yuyang Decoction high-dose and medium-dose groups were significantly reduced, and the ulcer inhibition rate were significantly increased (P<0.05). Compared with Qingzhong Yuyang Decoction medium-dose group, the ulcer inhibition rate in Qingzhong Yuyang Decoction high-dose group was significantly increased (P<0.05). Compared with model control group, protein expression levels of NF-κB p65 and IκBα were increased and p-NF-κB p65 was decreased in Qingzhong Yuyang Decoction high-dose, medium-dose and low-dose groups. The protein expression level of P-I κBα in Qingzhong Yuyang Decoction high-dose group was lower than that in model control group (P<0.05). Conclusion: Qingzhong Yuyang Decoction can reduce the ulcer area by inhibiting the release of inflammatory factors and inhibiting the expression of NF-κB signaling pathway-related proteins, and promote the secretion of endogenous substances in gastric mucosa and gastric motility function, so as to achieve the therapeutic effect on gastric ulcer of spleen-stomach damp-heat type, and promote ulcer healing.
[Key words] Gastric ulcer Spleen and stomach damp-heat type Qingzhong Yuyang Decoction Rat model
First-author’s address: Jiangxi College of Traditional Chinese Medicine, Fuzhou 344000, China
doi:10.3969/j.issn.1674-4985.2022.16.007
胃潰疡(gastric ulcer,GU)是常见的消化系统疾病,该病迁延难愈、反复发作,且易引起各种并发症,严重危害患者健康,其中引起过度炎症反应的因素主要为核转录因子κB(NF-κB)及其抑制蛋白α(IκBα)异常表达。现代医学在治疗过程中常采用H2受体拮抗剂以及奥美拉唑等质子泵抑制剂进行治疗,但依然存在易产生副作用以及复发率较高的情况[1-2]。中医学认为,胃溃疡属于“胃脘痛”范畴,临床辨证分型以脾胃湿热型较为常见,其发生机制一般与外邪侵袭、饮食不节、脾胃虚弱等因素相关,湿热内蕴脾胃则运化受阻,日久可损伤血络以致化腐成疡,需要辨证论治[3],中医通过清热化湿、理气和胃,可减轻临床症状[4]。本研究通过在清代中医著作《医宗金鉴》中“清中汤”方药基础上加味形成“清中愈疡汤”,并通过制备脾胃湿热型胃溃疡大鼠模型观察清中愈疡汤对胃溃疡的治疗效果以及作用机制,以期为临床用药提供实验依据。现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 Wistar大鼠60只,雄雌各半,体重为180~220 g,由江西中医药高等专科学校实验动物中心提供,该实验经江西中医药高等专科学校实验动物伦理委员会审核批准。
1.1.2 药物 清中愈疡汤方药组成:白豆蔻10 g、法半夏10 g、陈皮10 g、茯苓10 g、佩兰10 g、黄连6 g、栀子6 g、生甘草6 g、蒲公英20 g、马勃6 g、吴茱萸2 g、白及10 g、海螵蛸20 g。由本校制剂室煎成汤剂,放置冰箱低温保存备用。奥美拉唑(生产厂家:北京协和药厂,批准文号:国药准字H11021000,规格:20 mg)。
1.1.3 试剂 肿瘤坏死因子(TNF-α)、白介素-8(IL-8)大鼠ELISA试剂盒购于上海酶联生物科技有限公司;胃动素(MTL)、前列腺素E2(PGE2)大鼠ELISA试剂盒购于武汉华美生物工程有限公司;NF-κB p65、磷酸化NF-κB p65(p-NF-κB p65)IκBα、磷酸化IκBα(p-IκBα)等兔多克隆抗体购于美国Cell Signaling公司。
1.1.4 仪器 Multiskan MK3酶标仪(芬兰雷柏公司);Centrifuge 5810R型高速冷冻离心机(德国Eppendorf公司);CX23型光学显微镜(日本Olympus公司)。
1.2 方法
1.2.1 分组与模型制备 将60只Wistar大鼠随机分为6组,正常对照组、模型对照组、清中愈疡汤高剂量组、清中愈疡汤中剂量组、清中愈疡汤低剂量组、奥美拉唑组,每组10只。正常对照组于正常环境中饲养,同时予以正常饮食。其余各组均制成脾虚湿热型大鼠模型,将其养育于潮湿环境中,隔日喂养进食,可自由饮水,并从第5天起将饮水替换为10%蜂蜜与10%白糖混合饮料50 mL。自第5日起,隔日给予每只大鼠猪脂20 g,直至第29日;自第5日起,每隔3日用1 mL酒精含量为56%的白酒对大鼠进行灌胃。于造模第30天,除正常对照组,其余各组均灌无水乙醇1 mL/200 g,灌无水乙醇前禁食24 h。
1.2.2 给药方法 模型建立后,正常对照组与模型对照组灌胃等体积0.9%氯化钠溶液,1次/d。清中愈疡汤煎剂按《动物与人体每公斤体重剂量折算系数表》中成人用药量与大鼠等效剂量(普通人60 kg服药量为120 mL/d,即2 mL/kg)换算,以成人用药量的6倍作为大鼠用药剂量,即大鼠用药量为
1.2 mL/100 g,并以此作为清中愈疡汤高剂量组用药量;以高剂量的0.5倍作为清中愈疡汤中剂量组用药量,即0.6 mL/100 g;以中剂量的0.5倍作为清中愈疡汤低剂量组用药量,即0.3 mL/100 g。清中愈疡汤高、中、低剂量组灌胃均2次/d。同时,取奥美拉唑按成人日剂量40 mg换算为大鼠日剂量0.4 mg/100 g,奥美拉唑水溶液400 mg/L折算为1 mL/100 g。奥美拉唑组1 mL/100 g灌胃,1次/d。以上各组均连续用药14 d。
1.2.3 标本采集及溃疡指标计算 末次给药后禁食12 h,经大鼠腹主动脉穿刺采血后分离血清。采血完毕后处死大鼠,摘取全胃,沿胃大弯剪开并用0.9%氯化钠冲洗干净胃内容物,将其置于玻璃板上观察记录胃黏膜溃疡情况。用游标卡尺测量溃疡组织的最大横径及最大纵径数据,计算溃疡面积和溃疡抑制率。溃疡面积=π×最大横径/2×最大纵径/2;溃疡抑制率=(模型对照组溃疡面积-给药治疗组溃疡面积)/模型对照组溃疡面积×100%[5]。测量完毕后用手术刀切取溃疡组织,正常对照组切取胃前部近幽门处组织。
1.2.4 苏木素伊红(HE)染色 将大鼠胃黏膜常规脱水、石蜡包埋、切片后进行HE染色,光学显微镜下观察组织病理学结构变化。胃黏膜病理显示明显充血、黏膜固有层存在大量炎症细胞浸润,黏膜层腺体缺损及溃疡形成,主细胞和黏液细胞形态不完整等系列变化,则提示GU造模成功。
1.2.5 血清TNF-α、IL-8、MTL、PGE2水平测
定 将采集到的血样进行血清分离,采用3 000 r/min转速离心10 min,严格按照各试剂盒具体操作步骤对血清中TNF-α、IL-8、MTL、PGE2水平进行相应检测。
1.2.6 Western blot检测NF-κB通路相关蛋白表达水平 将取材好的胃黏膜組织剪碎,加入500 μL的RIPA裂解液进行约30 min的裂解并离心,收集上清液,则可得到总蛋白提取液。将十二烷基硫酸钠(SDS)缓冲液加入同等体积样品中,通过SDS-PAGE转模,接着使用封闭液封闭1 h。加入合适浓度的一抗溶液,于室温下孵育2 h。利用TBST漂洗3次,10 min/次。最后通过ELC发光法进行蛋白表达检测,显影冲洗。
1.3 观察指标 比较干预前后各组溃疡面积、溃疡抑制率变化,TNF-α、IL-8、MTL、PGE2水平以及NF-κB p65、p-NF-κB p65、IκBα、p-IκBα等相关通路蛋白水平。
1.4 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组内比较采用配对t检验,多组数据比较采用单因素方差分析(F检验),两两比较采用SNK-q检验。计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果 正常对照组大鼠胃黏膜结构完整,细胞排列整齐,黏膜肌层清晰分明,未见炎症细胞浸润等现象;模型对照组大鼠黏膜明显损伤,黏膜肌层大面积坏死病变,溃疡病灶形成,溃疡处上皮层及肌层消失,出现不同程度充血及水肿现象,可见大量炎症细胞渗出;奥美拉唑组胃黏膜上皮细胞少量缺损,存在少量炎症细胞及水肿情况,但形态较为完整;清中愈疡汤低、中、高剂量组黏膜下层微血管充血及水肿、炎症细胞浸润等情况均有所改善,黏膜组织形态改善,溃疡组织呈现不同程度修复与愈合,溃疡周围组织出现再上皮化,且随剂量增加愈合效果越明显,见图1。
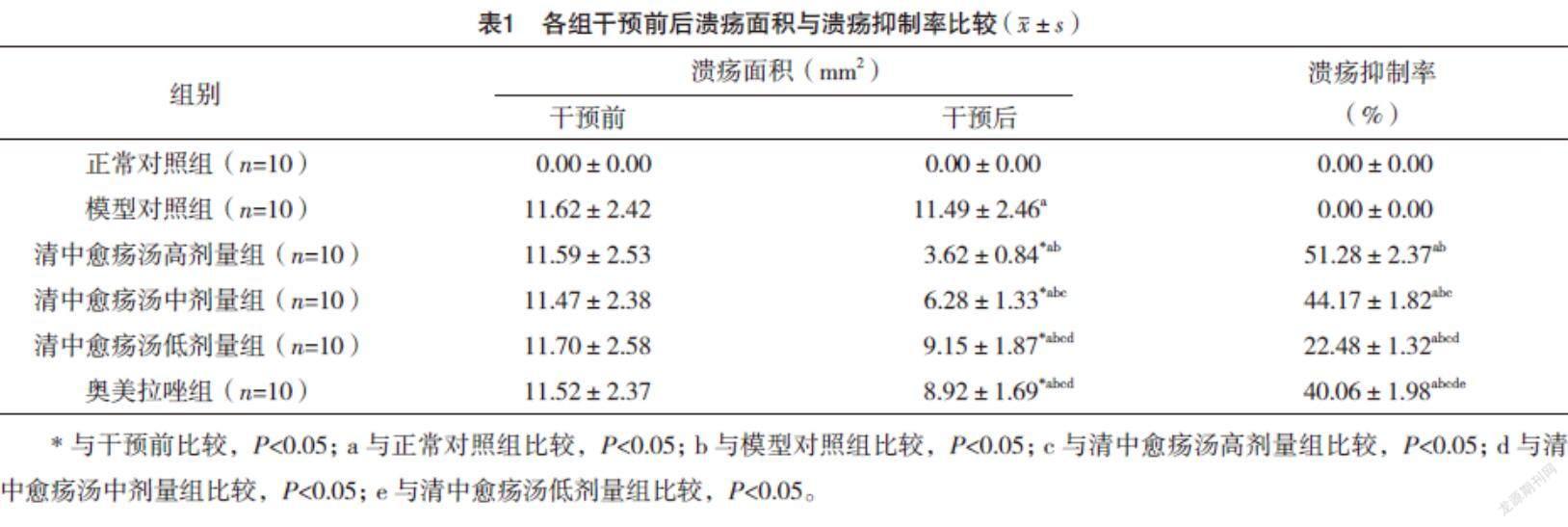
2.2 各组干预前后溃疡面积与溃疡抑制率比较 干预后,各组溃疡面积与溃疡抑制率比较,差异均有统计学意义(F=30.608、411.703,P=0.000、0.000);干预后,与正常对照组比较,模型对照组溃疡面积增加(P<0.05);与模型对照组比较,清中愈疡汤高、中、低剂量组及奥美拉唑组溃疡面积均明显减少(P<0.05);与奥美拉唑组比较,清中愈疡汤高、中剂量组溃疡面积均明显减少,溃疡抑制率均明显增加(P<0.05);与清中愈疡汤低剂量组比较,清中愈疡汤高、中剂量组溃疡面积均明显减少,溃疡抑制率均明显增加(P<0.05)。与清中愈疡汤中剂量组比较,清中愈疡汤高剂量组明显减少,溃疡抑制率明显增加(P<0.05)。见表1。
2.3 各组干预前后TNF-α、IL-8、MTL及PGE2水平比较 干预后,各组TNF-α、IL-8、MTL及PGE2水平比较,差异均有统计学意义(F=30.548、57.136、7.861、49.691,P=0.000、0.000、0.000、0.000);正常对照组和模型对照组干预前后上述指标比较,差异均无统计学意义(P>0.05);干预后,与模型对照组比较,清中愈疡汤高、中、低剂量组及奥美拉唑组TNF-α、IL-8水平均下降,MTL、PGE2水平均升高,差异均有统计学意义(P<0.05)。见表2。
2.4 各组NF-κB通路相关蛋白表达水平比较 各组NF-κB p65、p-NF-κB p65、IκBα、p-IκBα蛋白表达水平比较,差异均有统计学意义(P<0.05);与正常对照组比较,模型对照组NF-κB p65、IκBα蛋白表达水平均降低,p-NF-κB p65、p-IκBα蛋白表达水平均升高(P<0.05);与模型对照组比较,清中愈疡汤高、中、低剂量组均出现不同程度的NF-κB p65、IκBα蛋白表达水平升高、p-NF-κB p65下降;清中愈疡汤高剂量组p-IκBα蛋白表达水平低于模型对照组(P<0.05)。奥美拉唑不作用于NF-κB通路,故不与奥美拉唑组进行比较。见表3。
3 讨论
各种致病因子通过共同作用可引起炎症反应、黏膜肌层局限性组织缺损坏死等病理改变,导致GU发生。研究指出,GU病位在胃肠道,与肝、脾、胃等脏腑功能失调相关[6]。GU活动期病因主要为“热毒”壅滞于脾胃,湿热内蕴,气机不畅,中焦脾胃受困,湿热蕴久而肉腐,终成溃疡。近年来中医药逐渐被广泛应用于临床消化系统疾病的治疗中,并取得不错的疗效,相较于抗生素的副反应,中医药遵循急则治其标、缓则治其本的原则,在临床治疗中显示出一定优势[7-8]。
本研究结果显示,HE染色结果可见经药物干预后的清中愈疡汤高、中、低剂量组及奥美拉唑组大鼠胃黏膜组织形态明显改善,充血及水肿状态减轻,炎症细胞浸润情况好转,溃疡组织呈现不同程度修复与愈合,提示选择合适剂量的清中愈疡汤治疗脾胃湿热型胃溃疡具有较好的效果。本研究结果显示,干预后,各组溃疡面积、溃疡抑制率、TNF-α、IL-8、MTL及PGE2水平比较,差异均有统计学意义(P<0.05);与正常对照组比较,模型对照组溃疡面积增加,TNF-α、IL-8水平均升高,MTL、PGE2水平均降低(P<0.05)。其中正常对照组大鼠干预前后溃疡观察指标无明显变化,胃黏膜表面光滑完整,黏膜组织局部颜色红润且褶皱纹理清晰;模型对照组大鼠干预前后溃疡观察指标无明显变化,可见较大面积糜烂溃疡,胃窦处出现椭圆形溃疡凹陷缺损,溃疡周边皱襞消失;干预后的清中愈疡汤高、中、低剂量组及奥美拉唑组大鼠溃疡观察指标较干预前呈现不同程度改善,溃疡面积缩小,尤以清中愈疡汤高剂量组溃疡抑制率最高。溃疡愈合情况随剂量增加而治疗效果越明显,说明选择合适剂量的清中愈疡汤治疗脾胃湿热型胃溃疡具有较好的效果。TNF-α是导致溃疡生成的烈性介质,也是主要的致炎因子,并促进IL-8或其他炎性因子的释放,加强T细胞和B细胞的增殖与分化,从而促进中性粒细胞聚集,以及启动血管内凝血引起局部血液循环障碍,进一步影响黏膜血氧供给,加重机体内炎症反应,损伤胃肠黏膜,最终发展成溃疡[9-10]。IL-8是一种具有免疫调节和炎症介导等多功能细胞因子,在人体免疫系统和内分泌系统中发挥调控作用[11]。MTL则是由M细胞合成及分泌的多肽,广泛分布于十二指肠、胃窦等,可增强胃窦蠕动和胃肠道收缩活动[12-13]。PGE2是胃黏膜中具有细胞保护作用的内源性物質,研究指出PGE2可通过调节胃黏膜上皮黏液和碳酸氢盐分泌以及胃黏膜血液循环、维持其完整性以及调节胃酸分泌[14],从而进一步避免溃疡损伤胃黏膜。通过刺激胃黏膜黏液分泌,形成黏液-碳酸氢盐屏障,并通过增加胃黏膜血流量刺激基底细胞上移,促进胃黏膜细胞增殖和抑制胃黏膜细胞凋亡,以保护胃黏膜组织及其功能[15]。
清中愈疡汤方中白豆蔻化湿行气,黄连清热燥湿、泻火解毒,二者起清热祛湿解毒之功,用为君药。佩兰醒脾化湿;湿困脾胃易聚而生痰,法半夏燥湿化痰;陈皮理气健脾、燥湿化痰;茯苓渗湿健脾。四味合用,共助君药起祛湿化痰之效,用为臣药。蒲公英清热解毒,是湿热证脾胃病的常用治疗药物;栀子清热化痰;马勃清热解毒、止血敛疮;白及、海螵蛸收敛止血、愈疡生肌,白及成分中白及多糖可有效降低TNF-α水平,抑制炎症反应,海螵蛸通过中和胃酸以促进PGE2对胃黏膜的保护作用[16];吴茱萸性味辛辣,使黄连、栀子等苦寒药物清热燥湿而不伤正。上六味共同辅佐君臣清热解毒,用为佐药。生甘草补中解毒、调和诸药,用为使药。诸药合用,标本兼顾,君臣佐使诸药协同作用,共奏清热化湿、愈疡生肌之效。“多因、多效、多靶点”的作用特点使其在治疗过程中通过多种机制综合调控,已达到最佳的整体效应[17]。因此,本研究以清中愈疡汤用于治疗湿热内蕴型胃溃疡,可有效清热解毒、燥湿化浊,减少溃疡组织面积,提高溃疡抑制率。并在一定程度上促进炎症修复,受损胃黏膜修复后,可正向调控炎症细胞凋亡,达到抑制TNF-α、IL-8等炎症因子异常分泌以及降低其水平的功效,并激发免疫系统进一步促进溃疡愈合,缓解胃黏膜损伤状态,也使得MTL、PGE2水平升高。
NF-κB信号通路与炎症反应的发生发展以及胃黏膜损伤联系密切,通过NF-κB p65结合IκBα,覆盖NF-κB p50的核定位信号,从而无法正常进行转录调节。外界刺激可使上游级联反应进一步诱导IκBα磷酸化以及NF-κB p65亚基磷酸化,并释放NF-κB p50的核定位信号,从而激活炎症基因的转录与表达,导致炎症发生[18]。同时,炎症或免疫反应发生時,NF-κB被激活,从细胞质进入细胞核中进一步调控TNF-α、IL-8等炎症因子的表达,并在外周血中释放大量炎症介质,加剧炎症浸润。清中愈疡汤通过降低大鼠胃黏膜组织中的NF-κB p65和IκBα磷酸化表达,进一步抑制NF-κB信号通路所介导的炎症反应,并在一定程度上起到保护胃黏膜作用。因此,清中愈疡汤可在一定程度上起到预防胃溃疡的作用,同时本研究也为胃溃疡生物学机制探索和临床中药方治疗脾胃湿热型胃溃疡提供实验基础。
综上所述,清中愈疡汤可通过抑制炎症因子释放以及抑制NF-κB信号通路相关蛋白表达,以减少溃疡面积,并促进胃黏膜内源性物质分泌以及胃活动功能,从而达到对脾胃湿热型胃溃疡的治疗作用,促进溃疡愈合。
参考文献
[1]张昊,褚梦慧,王诗琦,等.基于p62/Keap1/Nrf2信号通路探讨香砂愈疡汤对胃溃疡大鼠氧化损伤的保护作用[J].中国实验方剂学杂志,2021,27(4):56-63.
[2]白敏,段永强,杨晓轶,等.基于网络药理学探讨黄芪建中汤对胃溃疡的保护作用及机制研究[J].中药药理与临床,2020,36(4):75-80.
[3]杨双丽,吴艳兰,王文闻,等.自拟胃复汤治疗消化性溃疡脾胃湿热证的临床观察[J].云南中医中药杂志,2021,42(9):58-62.
[4]王开英,陈柯婷,毛炜,等.胃溃疡验方剂联合奥美拉唑治疗胃溃疡的疗效及对胃肠激素水平影响[J].中华中医药学刊,2019,37(10):2526-2528.
[5]尤思路,李娟,晏陶,等.黄连-白术复方对小鼠胃溃疡模型的预防作用[J].中南大学学报(医学版),2020,45(1):8-16.
[6]宋雪莉,石晓如,张昊,等.李郑生教授运用脾胃肝动态辨证方法治疗消化性溃疡经验[J].中医研究,2019,32(8):34-35.
[7]沈文娟.清热化湿汤联合西药治疗脾胃湿热型消化性溃疡临床观察[J].新中医,2018,50(2):25-28.
[8]夏子健,李亚桐,刘晓露,等.槐绛方调控NLRP3/Caspase-1通路抗溃疡性结肠炎损伤的机制研究[J].中草药,2021,52(23):7221-7228.
[9]樊静娜,赵继亭,闫华,等.安肠愈疡汤联合美沙拉秦治疗脾虚湿阻型溃疡性结肠炎的疗效评价及对炎性因子的影响[J].中华中医药杂志,2020,35(7):3765-3770.
[10]周克平,宋文龙,肖林秀,等.四君子汤通过影响TNF-α、IL-6干预脾虚大鼠胃黏膜损伤的实验研究[J].实用中西医结合临床,2021,21(19):4-7,16.
[11]张霞,季淦,陈俊,等.不同病变程度溃疡性结肠炎患者的血清IL-8及TNF-α表达研究[J].名医,2020(16):154-155.
[12]王璟,万春平,杨榆青,等.香苓开胃方对功能性消化不良大鼠干预效应及机制研究[J].中华中医药杂志,2020,35(8):4129-4132.
[13]范明明,林伟,韩海瑞,等.柴术理胃饮对肝郁脾虚型功能性消化不良大鼠血清MTL、GAS的影响[J].中医药信息,2021,38(10):18-22.
[14]宋厚盼,陈小娟,曾梅艳,等.理中汤调控Raf/MEK/ERK信号通路抗大鼠胃溃疡的效应与机制[J].中国药理学通报,2021,37(9):1291-1298.
[15]卞银燕,王玉宗,徐燕芳,等.健脾愈疡方联合雷贝拉唑三联疗法治疗消化性溃疡临床研究[J].新中医,2020,52(9):70-73.
[16]范珉珏,段永强,李能莲,等.基于网络药理学及动物实验探讨景芪愈溃胶囊提高胃溃疡黏膜愈合质量的作用及机制[J].中国中药杂志,2022,47(5):1350-1358.
[17]罗蔚,唐友明,韩叶芬,等.基于iTRAQ技术的安胃汤干预胃溃疡肝郁脾虚证大鼠蛋白质组学研究[J].中药新药与临床药理,2019,30(1):72-81.
[18]邓连力,张金娟,梁冰,等.苗药良姜胃疡胶囊对胃溃疡模型大鼠的预防作用及机制研究[J].中国药房,2019,30(7):946-950.
(收稿日期:2022-04-12) (本文编辑:姬思雨)

