牦牛源C型产气荚膜梭菌动物致病性及其β毒素基因生物信息分析
吴 丹,黄家旗,罗润波,郭欣冉,吕家煌,2,宋仁德,索朗斯珠* (.西藏农牧学院 动物科学学院,西藏 林芝 860000;2.江苏农业科学研究院 兽医研究所,江苏 南京 2004;.青海玉树藏族自治州畜牧兽医工作站,青海 玉树 85000)
C型产气荚膜梭菌(Clostridiumperfringenstype C,CpC)属革兰阳性产芽胞杆菌[1],环境耐受性强[2],致病因子多种多样,为典型的条件致病菌[3]。C型产气荚膜梭菌主要产生α和β 2种重要外毒素,其中β毒素具有细胞毒性和致死性,是该菌的重要致病因子[4]。当宿主生活环境发生不适变化或机体健康状况下降时该菌大量增殖并产生毒素,常引起牦牛腹泻、坏死性肠炎、肠毒血症以及猝死等疾病[5],由此造成的巨大经济损失常年困扰着养殖户[6]。
产气荚膜梭菌β毒素可由B型产气荚膜梭菌和C型产气荚膜梭菌分泌,由HUNTER等[7]最早从1株C型产气荚膜梭菌的培养液中纯化得到。编码β毒素的cpb基因在一种含有IS1151的质粒上,其开放阅读框(ORF)位于该质粒的333~1 340 位之间,共编码336个氨基酸。该基因前1~27个氨基酸组成一段信号肽,可引导β毒素穿过细胞膜并排出到细胞外,在外排过程中信号肽被酶解切除,形成一段含有309个氨基酸的成熟β毒素蛋白分子[8]。β毒素的抗原基因定位和致病机理尚不清楚,本试验以牦牛源C型产气荚膜梭菌菌株Qinghai-06(GenBank登录号:MW980095)为研究对象,从分子生物学信息的角度对成熟的β毒素基因及其编码蛋白结构进行分析,为下一步构建牦牛源重组β毒素基因、表达牦牛源重组β蛋白、以及为后续更深入地研究β毒素细胞毒作用乃至致病机理提供重要理论依据。
1 材料与方法
1.1 菌株来源与实验动物2020年夏末秋初,青海玉树自治州多地发生牦牛腹泻疫病,西藏农牧学院预防兽医实验室从腹泻粪样中成功分离出牦牛源产气荚膜梭菌多株,本试验选取其中1株牦牛源C型产气荚膜梭菌菌株Qinghai-06(GenBank登录号:MW980095)进行动物致病性研究并对其β毒素基因作生物信息分析。选取4周龄、SPF级、体质量18~22 g的昆明系小鼠100只,购自河南斯克贝斯生物科技有限公司。
1.2 主要试剂和仪器高纯度dNTPs、DNA聚合酶、细菌DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒购自北京TIANGEN生化科技有限公司;胰胨-亚硫酸盐-环丝氨酸琼脂培养基(TSC)、梭菌增菌培养基(RCM)、厌氧肉汤培养基(FT)、羊血琼脂培养基均购自青岛高科技工业园海博生物技术有限公司;无菌脱纤维绵羊血购自北京索莱宝科技有限公司;微量分光光度仪由杭州奥盛仪器有限公司生产;凝胶成像系统,上海天能科技有限公司;核酸蛋白检测仪、高速离心机由德国艾本德公司生产。
1.3 细菌DNA提取及PCR扩增将保存的菌株解冻后接种于羊血琼脂培养皿,随后挑取单菌落于FT培养基,41℃恒温箱中厌氧培养16 h,制得种子液。使用细菌DNA提取试剂盒提取DNA,-20℃冻存备用。根据参考文献合成产气荚膜梭菌16S rDNA细菌通用引物[9]、4种常见致死性毒素(α、β、ε、ι)引物[10]、肠毒素(CPE)[11]、坏死性肠炎B样毒素(NetB)[12]及β毒素基因引物(不含信号肽和终止密码子)[13]对菌株DNA进行PCR扩增。PCR扩增采用50 μL总体系,引物信息见表1。将PCR产物琼脂糖凝胶电泳后利用凝胶成像系统拍照。

表1 PCR引物信息
1.4 菌株生长特性按体积分数5%接种量吸取1.3中种子液转接150 mL无菌FT培养基,振荡混匀后分装至15支试管中,放入41℃恒温箱中连续培养。每隔2 h取出1只试管,吸取适量菌液,12 000 r/min 离心10 min,弃去上清,用等量无菌生理盐水悬浮。以无菌生理盐水做空白对照对微量分光光度仪进行调零,测定菌液D600 nm值,连续测量24 h。以培养时间为横坐标,菌液D600 nm值为纵坐标,在坐标纸上绘制出牦牛源C型产气荚膜梭菌的生长曲线。另取适量对数生长期菌株的菌液,测定相应稀释倍数所对应的D600 nm值,用平板菌落计数法测出相应D600 nm值所对应的CFU值。绘制D600 nm与稀释倍数和D600 nm与活菌菌落CFU的相关曲线及关系式。

1.6 小鼠内脏组织的病理变化观察选取攻毒后急性死亡(24 h内)小鼠和慢性死亡(72 h后)小鼠内脏组织于4%多聚甲醛中进行固定,经脱水、石蜡包埋、切片和H.E染色后,光镜下观察小鼠内脏组织病理变化。
1.7 β毒素基因克隆将PCR扩增出的β毒素基因凝胶电泳条带切下,严格按照胶回收试剂盒操作说明进行DNA胶回收纯化,并利用核酸蛋白检测仪测定DNA浓度和纯度。利用pMDTM18-T Vector克隆试剂盒,将回收的β毒素基因DNA片段与pMDTM18-T载体连接,通过热激法将其转化至DH5α感受态细胞内,随后利用含有Amp+的LB培养基进行筛选。经PCR鉴定为阳性的菌液,按照质粒提取试剂盒操作说明提取质粒,并委托擎科生物科技有限公司进行测序。
1.8 β毒素基因编码蛋白分析利用生物软件分析β毒素蛋白:DNAMAN 4.0软件将β毒素基因碱基序列翻译成氨基酸序列;在线软件ProtParam分析β毒素基因的一级结构;在线软件ProtScale分析β毒素蛋白的亲水性;在线软件SOPMA分析β毒素蛋白的二级结构;在线软件NetPhos分析β毒素蛋白的磷酸化位点;IEDB和BCPREDS分析β毒素蛋白的抗原表位;在线软件SWISS-MODEL建立β毒素蛋白的三维空间结构模型。
2 结果
2.1 细菌各基因PCR扩增结果PCR扩增结果显示(图1):16S rDNA PCR引物扩增出1 465 bp的条带;4种常见致死性毒素PCR扩增结果凝胶电泳图在325(α毒素)、196 bp(β毒素)出现条带;肠毒素(CPE)和坏死性肠炎B样毒素(NetB)PCR扩增结果凝胶电泳图未出现条带;β毒素基因PCR扩增结果凝胶电泳图在927 bp处出现条带。结果表明,16S rDNA PCR、毒素分型、CPE、NetB以及β毒素基因扩增条带与预期条带相符合,本试验所用菌株Qinghai-06为牦牛源C型产气荚膜梭菌,可用于下一步试验研究。

M.DL2000 DNA Marker;N.阴性对照;1.16S rDNA;2~5.4种常见致死性毒素α、β、ε、ι;6.肠毒素(CPE);7.坏死性肠炎B样毒素(NetB);8.β毒素基因图1 细菌各基因PCR扩增电泳图
2.2 生长曲线牦牛源C型产气荚膜梭菌菌株Qinghai-06的生长曲线见图2。由图可知,0~2 h为细菌繁殖较少的迟缓期;2~6 h为细菌几何级数增长的对数期;6~20 h为菌群生长平衡的稳定期,菌液D600 nm值最大值为2.242;20~24 h为细菌死亡数大于繁殖数的衰亡期。

图2 牦牛源C型产气荚膜梭菌菌株Qinghai-06生长曲线
2.3 菌液D600 nm与稀释倍数、菌落数CFU的关系经SPSS 19.0软件分析得出,菌液D600 nm与稀释倍数成指数关系(图3A),其关系式为:y=-0.857ln(x)+2.236,R2=0.995,P<0.01为极显著,表明试验操作准确,数据可靠;菌液D600 nm与菌落数CFU成线性关系(图3B),其关系式为:y=0.881x-0.017,R2=0.999,P<0.01为极显著,可用于菌液D600 nm与菌落数CFU之间相互换算。
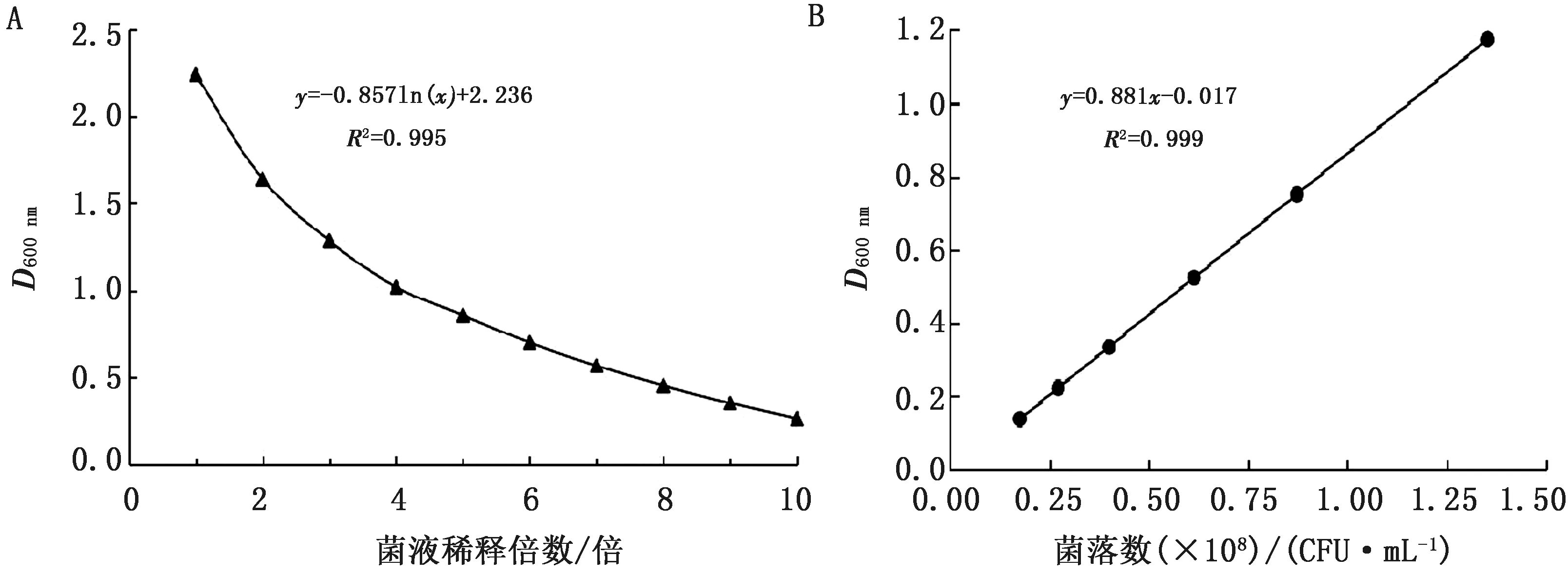
图3 菌液D600 nm与稀释倍数(A)、菌落数CFU(B)的关系

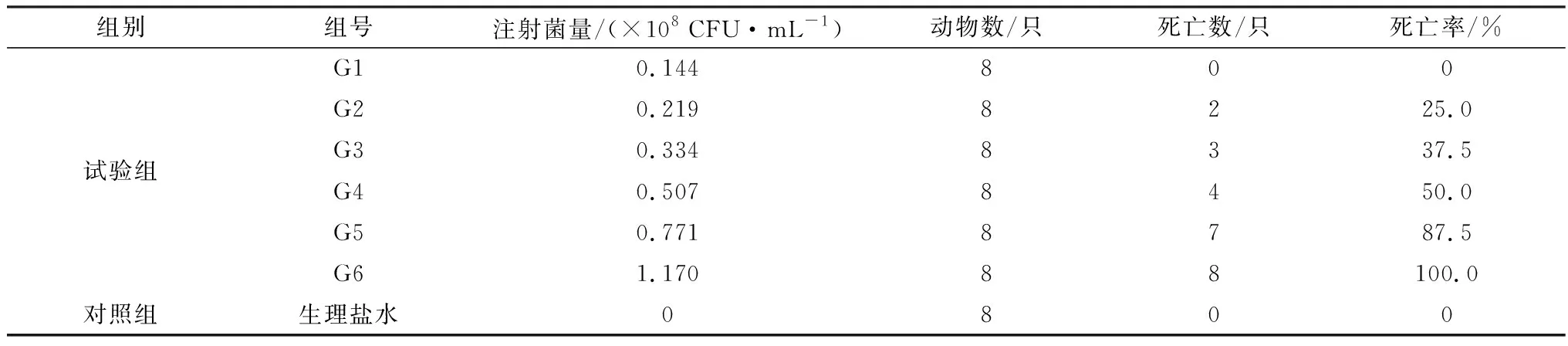
表2 LD50试验各组剂量与小鼠死亡情况
经SPSS 19.0软件分析(表3),牦牛源C型产气荚膜梭菌对感染小鼠的LD50为0.408×108CFU/mL,95%置信区间为0.308×108~0.549×108CFU/mL。

表3 SPSS软件对LD50的计算结果
2.5 死亡小鼠病理剖检
2.5.1一般剖检 攻毒后小鼠精神萎靡、饮食量下降、行动迟缓。低浓度攻毒组,小鼠逐渐出现神经症状、肌肉颤抖、眼睑下垂、流泪、腹部胀大、阴道出血,慢性死亡。高浓度攻毒组,基本无任何症状就急性死亡。对急性死亡和慢性死亡小鼠进行剖检,发现腹腔都有积液,小肠出血。对照组未见任何异常。小鼠腹腔解剖见图4。

A.对照组;B.急性死亡组;C.慢性死亡组图4 攻毒小鼠腹腔解剖图
2.5.2组织病理变化 由小鼠组织病理变化切片(图5)可知:通过切片、染色后和对照组相比,观察到急性死亡小鼠各脏器基本未见明显病理改变。慢性死亡小鼠肠道有不同程度的细胞溶解现象;脑部神经元未见变性、坏死,间质血管见轻微充血;肾小管见变性伴有透明管型,间质未见充血、水肿和炎细胞浸润;肝脏细胞见空泡变性;脾脏巨噬细胞和组织细胞增生,红髓见轻微淤血。心脏、肺脏、胃均未出现病理变化。
2.6 β毒素蛋白一级结构分析经过DNAMAN软件翻译得出:β毒素基因序列长927 bp,共编码309个氨基酸,其中核苷酸序列不包含信号肽序列和终止密码子。氨基酸序列如表4所示。

表4 牦牛源CpC β毒素基因氨基酸序列
经过在线软件Prot-Param对β毒素蛋白一级结构分析可知:牦牛源CpC β毒素基因分子式为C1535H2396N406O502S9,相对分子质量为34.9 ku,pI=5.52,负电荷(Asp+Glu)残基总数36个,正电荷(Arg+Lys)残基总数31个,脂肪指数:72.52。该基因编码蛋白含有全部20种氨基酸(表5),其中S(Ser)和T(Thr)含量最高,均占10.7%;C(Cys)含量最少,仅1个,占0.3%。在体外培养的哺乳动物网织红细胞内半衰期为1.4 h,在酵母体内半衰期3 min,大肠杆菌体内的半衰期>10.0 h。不稳定指数为 35.91,属稳定蛋白。
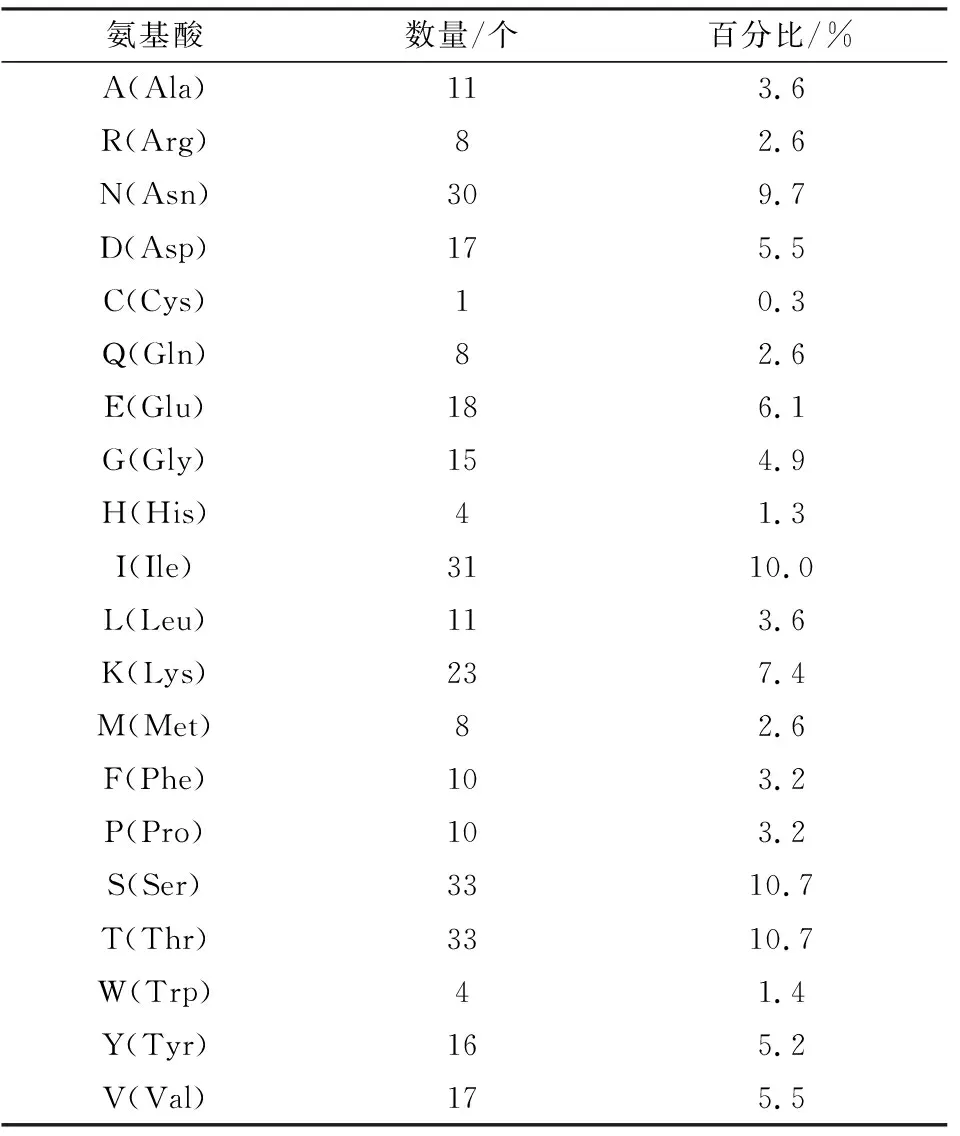
表5 牦牛源CpC β毒素蛋白氨基酸含量
2.7 β毒素蛋白二级结构预测及分析利用在线软件SOPMA对β毒素蛋白的二级结构预测情况(图6)分析可知,β毒素蛋白有4种二级结构存在(表6),其中无规则卷曲结构(占53.07%)最多,α-螺旋(2.59%)最少。α-螺旋分布区域:3~4,90~92,206,230,265;β-转角分布区域:24~25,68~69,73~74,137,166~167,204,225~226,234~235,238~239,264,301~303;β-折叠分布区域:5~9,18~23,29~33,45~53,61~67,76~78,93,99~104,113~117,125~136,140~142,156~157,160~163,169~173,181~188,202~203,205,207~210,231~233,240~245,254~259,266~270,294~299,306~309;无规则卷曲分布区域:1~2,10~17,26~28,34~44,54~60,70~72,75,79~89,94~98,105~112,118~124,138~139,143~155,158~159,164~165,168,174~180,189~201,211~224,227~229,236~237,246~253,260~263,271~293,300,304~305。

h.α-螺旋;e.β-折叠;t.β-转角;c.无规则卷曲图6 牦牛源CpC β毒素二级结构预测

表6 牦牛源CpC β毒素蛋白二级结构组成
2.8 β毒素蛋白亲水性预测及分析经过在线软件Protscale对β毒素蛋白的亲水性分析(图7)可知,多肽链67号位的亮氨酸(L)评分最高为1.278,260号位的谷氨酸(E)评分最低为-2.356,亲水性总平均值(GRAVY):-0.567,为亲水性蛋白。其亲水性蛋白分布区域:1~17,19~31,33~45,51~60,70~90,106~110,117~135,141~166,168~204,207~218,221~230,247~252,254~275,284~292,300~304。

图7 牦牛源CpC β毒素基因亲水性分析
2.9 β毒素蛋白激酶磷酸化位点预测分析利用在线软件NetPhos 3.1 Server 对β毒素基因编码蛋白的激酶磷酸化位点预测结果显示(图8),Ser(S)得分高于0.5的个数为25个;Thr(T)得分高于0.5的个数为20个;Tyr(Y)得分高于0.5的个数为8个。表明该蛋白可能存在53个潜在磷酸化位点,当这些氨基酸残基磷酸化后,蛋白便带上电荷,从而使结构发生改变,进一步引起蛋白质活性变化以及在信号传导过程中起重要作用。
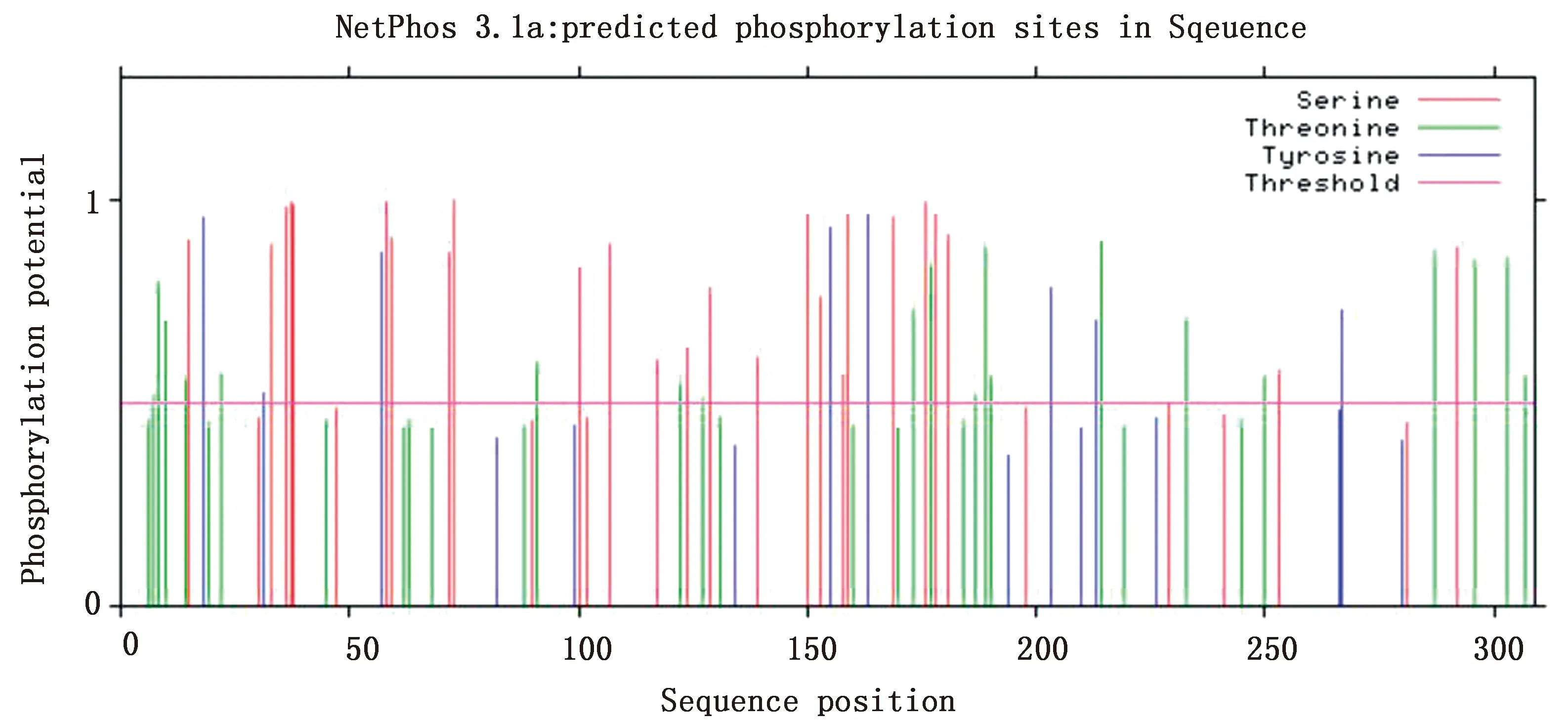
图8 牦牛源CpC β毒素蛋白激酶磷酸化位点预测
2.10 β毒素蛋白B细胞线性抗原表位预测通过在线软件 IEDB对β毒素蛋白B细胞线性抗原表位预测(图9A),最低分0.268,最高分0.677,平均分0.524,共预测到11个线性抗原表位,主要分布区域:5~45,52~59,71~96,107~129,135~155,165~179,187~205,213~236,261~272,281~292,300~305。利用在线软件BCPREDS,采用预测长度为20个氨基酸,特异性75%以上,并通过重叠过滤的方法对β毒素蛋白B细胞线性抗原表位进行预测(图9 B),共得到10个符合条件的线性抗原表位,分别起始于2,30,51,81,114,138,174,210,245,276。综合2种预测方法β毒素蛋白B细胞线性抗原表位可能存在的区域有:2~21,30~45,52~59,81~96,114~129,138~155,174~179,187~193,213~229,261~265,281~292。

A.在线软件 IEDB分析结果; B.在线软件BCPREDS分析结果图9 牦牛源CpC β毒素蛋白B细胞线性抗原表位预测
2.11 β毒素蛋白三级结构预测利用在线软件SWISS-MODEL对β毒素蛋白三级结构预测得到2个模型显示(图10)。模型1:β毒素蛋白为单体,含1个Zn2+配体,主要由β-折叠形成的β-折叠结构域和无规则卷曲形成的无规则卷曲结构域;GMQE为0.80。模型2:β毒素蛋白为单体,无配体,主要由β-折叠形成的β-折叠结构域和无规则卷曲形成的无规则卷曲结构域;GMQE为0.65。其中模型1可信度高,更接近真实结构,可用于虚拟筛选、分子对接等功能结构研究。
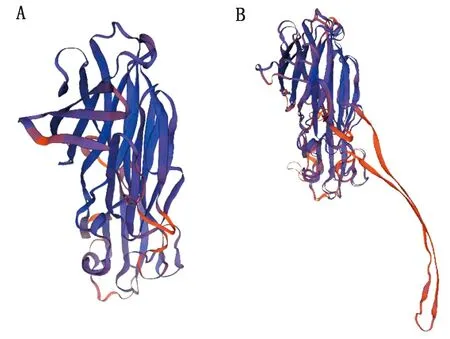
A.模型1;B.模型2图10 牦牛源CpC β毒素蛋白三级结构预测
3 讨论
首先,本试验利用振荡比浊法对牦牛源C型产气荚膜梭菌菌株Qinghai-06生长特性进行了测定,发现牦牛源产气荚膜梭菌生长速率快,对数期仅需4 h,而单雪梅等[14]研究的D型产气荚膜梭菌标准株(C60)对数期却需要8 h。牦牛源产气荚膜梭菌菌量多、浓度高,在平衡期其D600 nm值可以达到2.242,而王开功等[15]研究的A 型产气荚膜梭菌标准株(C57)在平衡期其D630 nm值最高仅达到0.95左右,单雪梅等[14]研究的D型产气荚膜梭菌标准株(C60)在平衡期其D630 nm值最高仅达到1.80左右。其原因可能是由于不同毒素型的产气荚膜梭菌生长特性不同,不同培养液也对D值有着不同影响。随后,本研究通过动物攻毒试验记录死亡小鼠,利用SPSS软件分析计算该菌株对昆明系小鼠的半数致死量,得出该菌株对感染小鼠的LD50为0.408×108CFU/mL,95%置信区间为0.308×108~0.549×108CFU/mL,属于强致死性菌株,可用于致病性研究。
随后,本试验采集攻毒后死亡小鼠内脏,制成病理切片,通过H.E染色镜检发现牦牛源C型产气荚膜梭菌可引起肠、脑、肾脏、肝脏、脾脏组织病理变化,在心脏、肺脏、胃组织未见病理变化。其主要引起小鼠肠道有不同程度的细胞溶解现象;脑部神经元未见变性、坏死,间质血管见轻微充血;肾小管见变性伴有透明管型;肝脏细胞见空泡变性;脾脏巨噬细胞和组织细胞增生,红髓见轻微淤血。通过小鼠病理切片分析可以在以后临床治疗牦牛产气荚膜梭菌疫病时采取有效的、合理的、直接的治疗措施,为提高该疫病的临床诊断水平积累了基本的技术资料。
产气荚膜梭菌β毒素是一种毒力较强的成孔毒素,具有细胞毒性和致死性,在外分泌过程被切除掉信号肽形成胰蛋白酶敏感蛋白[16]。β毒素具有细胞活性,同时能够增大毛细血管渗透性、增加血压、降低心率,也是一种非典型神经毒素[17]。了解β毒素蛋白的抗原表位,一方面有助于为β毒素致病机制的研究提供思路,另一方面可以针对性的做好β毒素的免疫预防工作[18]。本研究通过分子生物学方法对牦牛源C型产气荚膜梭菌β毒素基因及其编码蛋白分析发现:β毒素基因序列长927 bp(不包含信号肽序列和终止密码子),共编码309个氨基酸。β毒素蛋白分子式为C1535H2396N406O502S9,相对分子质量为34.9 ku,等电点为5.52,属于稳定的、含多个潜在激酶磷酸化位点的单体亲水性蛋白,含1个Zn2+配体,其中265位含有唯一的半胱氨酸。其三级结构与冶贵生等[19]预测的三级结构模型Ⅰ相似,可信度高。经生物软件预测,β毒素蛋白无规则卷曲结构主要集中于10~100区段和140~300区段;亲水性氨基酸主要集中于140~304区段;潜在磷酸化位点主要集中于10~80和150~220区段;B细胞线性抗原表位主要集中于110~290区段。综合二级结构、亲水性、磷酸化位点可以预测出牦牛源C型产气荚膜梭菌β毒素蛋白有效抗原表位主要集中于140~290区段,其结果比王玉建等[20]对菌株KP064408.1预测的β毒素蛋白有效抗原表位主要在aa108~aa320区段有所缩小,但冶贵生等[19]的预测结果190~193与211~214位氨基酸成为抗原表位的可能性最大,在本试验预测结果之内。本试验从多个角度对牦牛源C型产气荚膜梭菌β毒素进行预测,提高了预测结果的准确性和可靠性,可为下一步构建牦牛源重组β毒素基因,表达牦牛源重组β蛋白,以及为后续更深入的研究β毒素的细胞毒性作用乃至致病机理提供重要理论依据。

