右美托咪定对大鼠肝脏缺血再灌注损伤(HIRI)内质网应激的影响
李 航,张士霞,张玮琪,艾丽平,张暖暖 (河北农业大学 动物医学院,河北 保定 071000)
肝脏供血充足,质地柔软,轻微的损伤即可引起出血,术中出血不仅对患者不利,也会影响术者视野,因此在肝脏外科手术中通常需要阻断肝脏血流[1],手术结束再恢复肝脏血流,这便造成了肝脏缺血再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)。HIRI在肝脏手术中发生几率较大,对手术成功率和术后恢复程度影响也较严重,并且可通过多条途径对机体造成损伤,如何降低HIRI是目前人类医学和动物医学共同面临的难题。右美托咪定(dexmedetomidine,Dex)具有抗氧化、抗炎、抗凋亡的作用,对各种器官缺血再灌注损伤的保护作用已被广泛报道,但其具体机制尚有待深入研究。近年来内质网应激介导的细胞凋亡途径逐渐引起学者的关注,内质网途径的干预可能为HIRI提供新的保护手段。因此,本试验通过建立大鼠HIRI模型,在给予不同剂量Dex后,检测相关肝功能指标、肝脏氧化应激、细胞凋亡和内质网应激相关基因和蛋白表达情况,明确不同剂量Dex对HIRI的保护作用,探究Dex能否通过影响内质网应激相关信号通路调节内质网介导的肝细胞凋亡,为今后兽医临床开展HIRI的防治及进行相关机制研究提供理论依据及试验基础。
1 材料与方法
1.1 药品及主要试剂盐酸右美托咪定(购自上海陶素生化公司);谷丙转氨酶(ALT)试剂盒(购自美国爱德士公司);超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(购自南京建成生物工程研究所);TUNEL细胞凋亡试剂盒(购自Roche公司);PrieScriptTMRT Master Mix试剂盒和TB Green®Premix Ex TaqTMⅡ试剂盒(购自大连 TaKaRa公司);TransZol Up Plus RNA Kit试剂盒(购自北京全式金生物公司);β-actin一抗、p-PERK一抗、p-IRE-1α一抗,碱性磷酸酶标记的二抗(购自北京博奥森公司);CHOP一抗(购自美国CST生物公司)。
1.2 模型制备健康雄性SD大鼠30只(购自河北医科大学试验动物中心),体质量250~300 g,饲喂标准化鼠粮,不限饮水,试验过程中保证饲养环境不变。SD大鼠随机分为5组(6只/组):假手术组(S组)、损伤组(IR组)、Dex低剂量组(DL组)、Dex中剂量组(DM组)和Dex高剂量组(DH组)。 IR组术前30 min腹腔注射生理盐水(1 mL/kg),开腹后轻轻拉出肝脏左叶和肝脏中叶,用无损伤血管夹夹住肝左叶及肝中叶的门静脉和肝动脉,建立缺血再灌注模型,用生理盐水润湿的纱布覆盖暴露在体外的肝脏。夹闭血管30 min后,撤掉血管夹,将肝脏复位。S组术前30 min腹腔注射生理盐水(1 mL/kg),开腹后分离肝中叶及左叶至膈肌及腹壁的韧带,不夹闭任何血管,将肝脏暴露体外,用生理盐水浸湿的纱布覆盖肝脏和切口30 min。Dex低、中、高剂量组分别于肝脏缺血前30 min腹腔注射Dex 20,50,100 μg/kg。心脏采血,分离血清于-80℃ 冰箱保存,用于肝功能指标检测。断颈处死大鼠,开腹取肝中叶及肝左叶,一部分放入福尔马林中固定,用于TUNEL检测;另一部分放入-80℃冰箱保存用于氧化应激、内质网应激和内质网凋亡相关基因、蛋白检测。
1.3 肝功能检测全自动生化分析仪检测血清中ALT含量的变化水平。
1.4 肝脏氧化应激指标检测取-80℃冻存的肝脏组织100 mg加入900 μL的生理盐水制备10%肝脏组织匀浆,剪碎组织,冰水浴制备匀浆,4℃、2 500 r/min,离心10 min,取上清后采用BCA法进行蛋白定量,根据检测试剂盒说明书检测肝脏组织匀浆中氧化应激指标MDA、SOD含量的变化水平。
1.5 肝细胞凋亡率检测取肝脏组织制作病理切片,依次经二甲苯、无水乙醇、95%乙醇、90%乙醇、80%乙醇和75%乙醇脱水、3%H2O2溶液封闭、加入蛋白酶K溶液去除组织蛋白,蒸馏水漂洗。按TUNEL试剂盒说明书进行操作,光学显微镜(×400)下观察肝脏细胞凋亡情况。细胞核被染成棕色为凋亡细胞,蓝紫色为正常细胞。每张切片随机选择10个视野,记录总细胞数和凋亡细胞数,计算凋亡率。
1.6 内质网应激和相关凋亡基因的mRNA检测采用qRT-PCR方法开展基因水平检测。使用TransZol Up Plus RNA Kit试剂盒从肝脏中提取总RNA,使用PrieScriptTMRT Master Mix试剂盒将其反转录为cDNA。根据产品说明书,使用 TB Green®Premix Ex TaqTMⅡ,在LightCycler®96中实时定量PCR。引物(表1)由上海生工合成。采用两步法,扩增条件如下:95℃ 30 s预变性;95℃ 5 s变性,60℃ 30 s退火延伸,反应40个循环。使用2-ΔΔCt方法分析相对mRNA的表达。

表1 引物序列
1.7 内质网应激和相关凋亡蛋白的检测采用Western blot方法开展蛋白水平检测。使用RIPA细胞裂解液从肝脏中提取总蛋白,使用BCA试剂盒测定蛋白浓度,超纯水将各组蛋白浓度调整一致,100℃水浴5 min,使蛋白变性,加入蛋白上样缓冲液,分装保存。配制浓度为12%的分离胶,上样进行电泳。电泳停止后转膜:转膜后的PVDF膜孵育一抗二抗,将PVDF膜浸泡于BCIP/NBT显色液中,避光显色。将显色的膜扫描进电脑,使用Image J软件进行灰度分析。

2 结果
2.1 Dex对肝脏缺血再灌注大鼠肝功能的影响肝功能检测结果显示,与S组相比,IR、DL和DH组大鼠血清中ALT含量极显著升高(P<0.01),DM组差异不具有显著性(P>0.05);与IR组相比,DL、DM和DH组血清中ALT含量极显著降低(P<0.01)(图1)。

图1 血清中ALT的含量变化
2.2 Dex对肝脏缺血再灌注大鼠肝脏氧化应激的影响氧化应激检测结果显示,与S组相比,其余各组大鼠肝脏组织中MDA含量极显著增多(P<0.01),DH组大鼠肝脏组织中SOD活力显著降低(P<0.05),IR、DL组大鼠肝脏组织中SOD活力极显著降低(P<0.01);与IR组相比,各给药组大鼠肝脏组织中MDA含量极显著降低(P<0.01),各给药组大鼠肝脏组织中SOD活力极显著升高(P<0.01)(图2)。
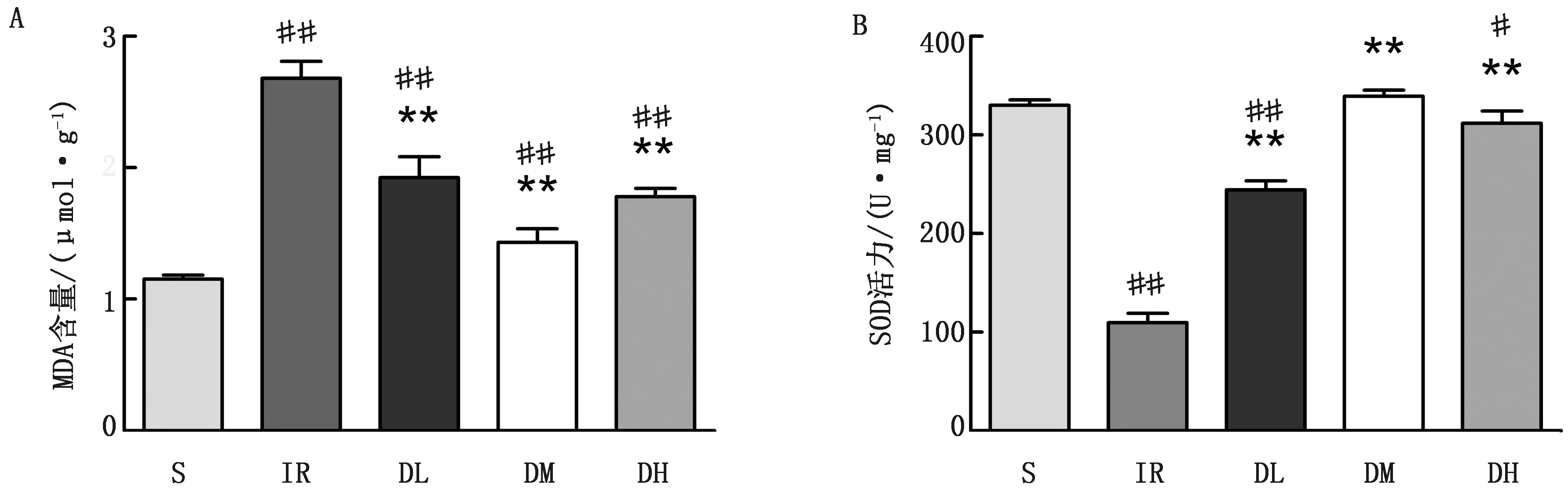
A.肝脏组织MDA含量变化;B.肝脏组织SOD活力变化图2 Dex对肝脏氧化应激的影响
2.3 Dex对肝脏缺血再灌注大鼠肝细胞凋亡率的影响TUNEL检测结果显示,与S组相比,其余各组大鼠肝细胞凋亡率均极显著升高(P<0.01);与IR组相比,DL组大鼠肝细胞凋亡率显著降低(P<0.05),DM和DH组大鼠肝细胞凋亡率极显著降低(P<0.01)(图3,4)。

图3 肝脏细胞凋亡率的变化
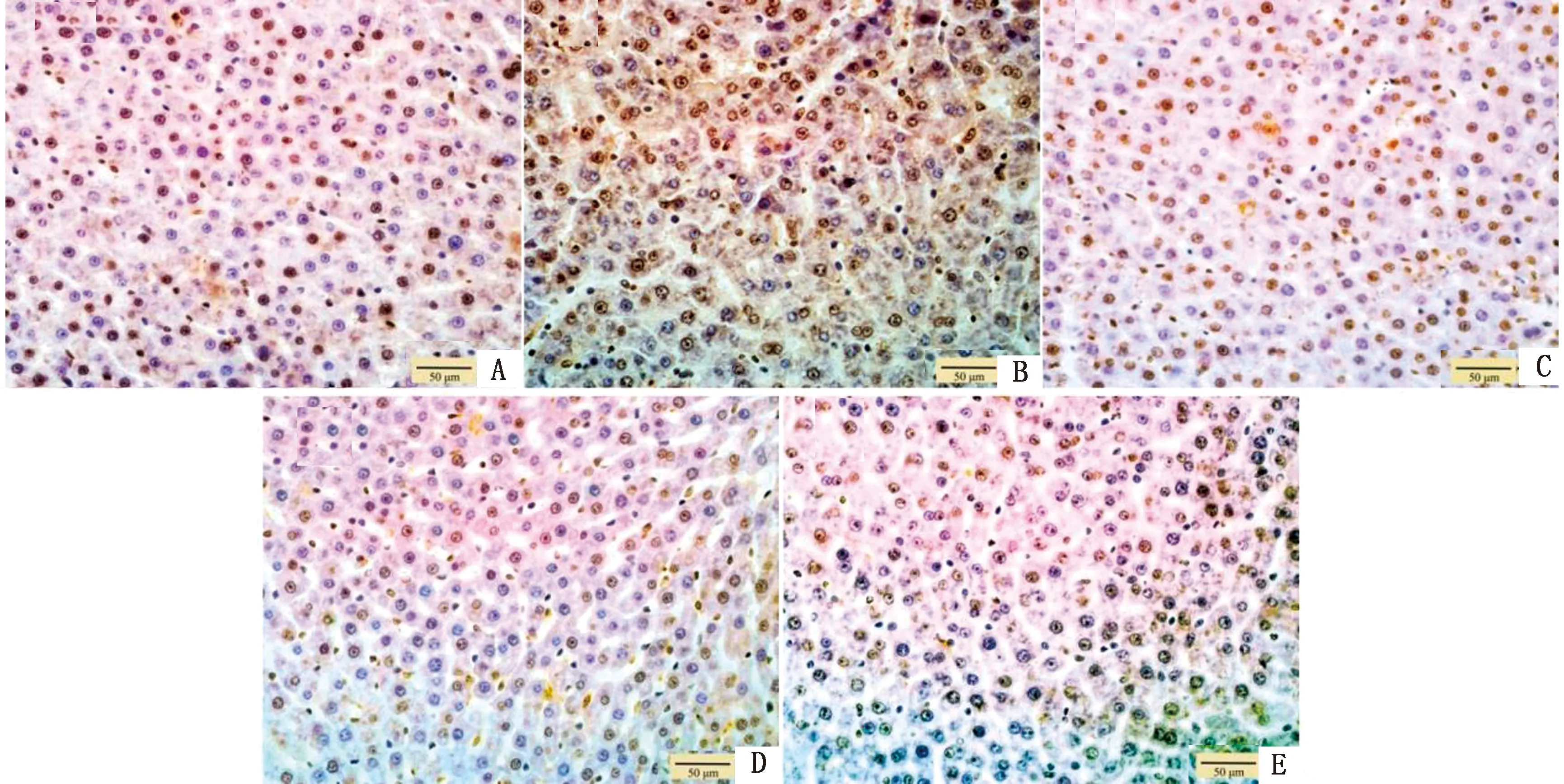
A.S组;B.IR组;C.DL组;D.DM组;E.DH组图4 肝脏细胞凋亡变化 (×400)
2.4 肝脏内质网应激和相关凋亡基因的表达水平qRT-PCR结果显示,与S组相比,IR组大鼠肝脏PERK和ATF-6 mRNA相对表达量极显著升高(P<0.01),DL组大鼠肝脏PERK和ATF-6 mRNA相对表达量显著升高(P<0.05);与IR组相比,各用药组大鼠肝脏PERK和ATF-6 mRNA相对表达量极显著降低(P<0.01),其中DM组大鼠肝脏PERK和ATF-6 mRNA表达量相对最低(图5)。

A.肝脏组织中PERK mRNA表达的变化;B.肝脏组织中ATF-6 mRNA表达的变化图5 肝脏组织中PERK和ATF-6 mRNA的表达
qRT-PCR结果显示,与S组相比,DM组大鼠肝脏Caspase-12 mRNA相对表达量显著升高(P<0.05),DM组大鼠肝脏GRP-78 mRNA相对表达量极显著升高(P<0.01),其余各组大鼠肝脏GRP-78和Caspase-12 mRNA相对表达量均极显著升高(P<0.01),DM组大鼠肝脏Caspase-12 mRNA相对表达量显著升高(P<0.05);与IR组相比,各用药组大鼠肝脏GRP-78和Caspase-12 mRNA相对表达量极显著降低(P<0.01),其中DM组大鼠肝脏GRP-78 和Caspase-12 mRNA表达量相对最低(图6)。
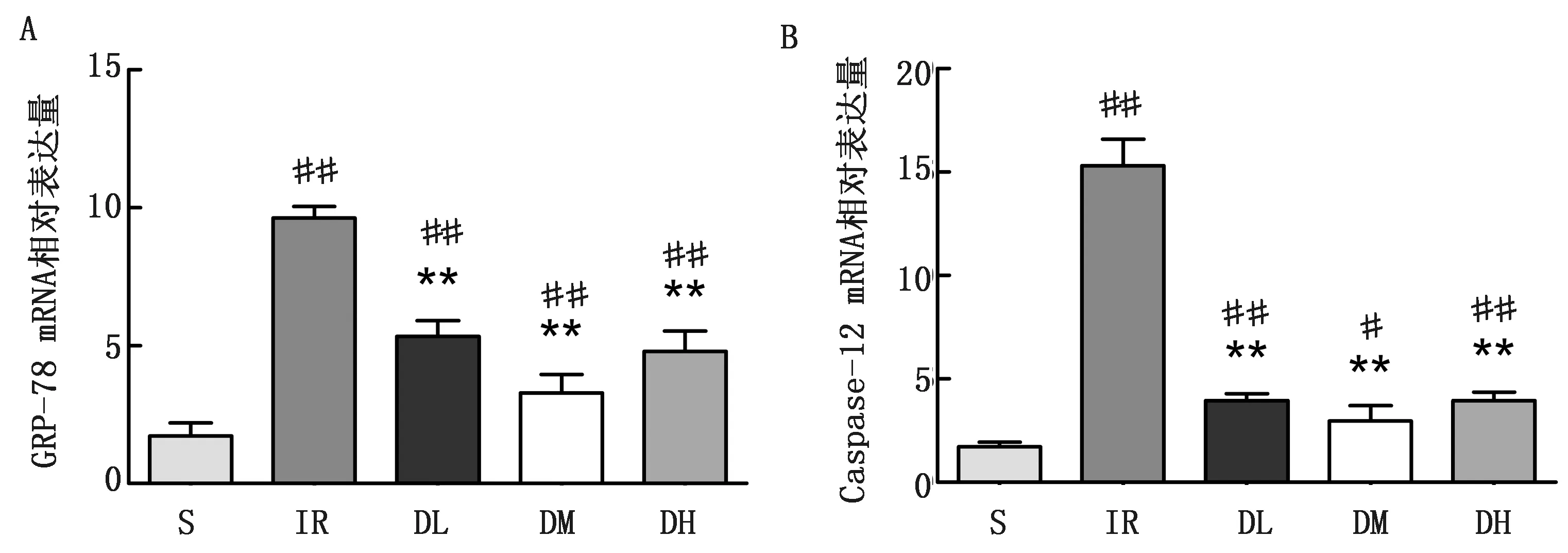
A.肝脏组织中GRP-78 mRNA表达的变化;B.肝脏组织中Caspase-12 mRNA表达的变化图6 肝脏组织中GRP-78和Caspase-12 mRNA的表达
2.5 肝脏内质网应激相关凋亡蛋白的表达水平Western blot结果显示,与S组相比,IR和DH组大鼠肝脏p-PERK、p-IRE-1α和CHOP 蛋白表达量均极显著升高(P<0.01),DL组大鼠肝脏p-PERK蛋白表达量显著升高(P<0.05),大鼠肝脏p-IRE-1α和CHOP蛋白表达量极显著升高(P<0.01),DM组大鼠肝脏p-IRE-1α、p-IRE-1α和CHOP蛋白表达量差异不具有显著性(P>0.05);与IR组相比,但各用药组大鼠肝脏p-PERK和CHOP蛋白表达量均极显著降低(P<0.01),DM和DH组大鼠肝脏p-IRE-1α蛋白表达量极显著降低(P<0.01),DL组p-IRE-1α蛋白表达量显著降低(P<0.05)。其中DM组大鼠肝脏p-PERK、p-IRE-1α和CHOP蛋白表达量相对最低(图7)。

A.肝脏组织中p-PERK蛋白表达的变化;B.肝脏组织中p-IRE-1α蛋白表达的变化;C.肝脏组织中CHOP蛋白表达的变化;D.蛋白表达图7 肝脏组织中p-PERK、p-IRE-1α和CHOP蛋白的表达
3 讨论
ALT主要存在于肝细胞中,正常生理条件下血清中含量极少,在各种病毒性肝炎的急性期或药物中毒导致肝细胞坏死时,肝细胞膜受到损坏,ALT得以被大量释放入血液中[2]。本试验中,IR组大鼠血清中ALT含量显著高于S组,说明HIRI造成了一定的肝功能损伤;用药组大鼠血清中ALT含量有降低,表明Dex能有效降低HIRI造成的肝功能损伤。
氧化应激平衡在缺血过程中起关键作用,是导致肝细胞损伤的重要途径之一[3]。MDA是氧化应激过程中脂质氧化反应的终产物,可直接损害肝细胞膜和线粒体膜等细胞膜性结构,MDA是氧化损伤的标志物[4]。SOD是机体主要的氧自由基清除酶之一,可参与清除细胞中氧自由基,是抗氧化应激的标志物[5]。本试验中IR组大鼠肝脏MDA含量最高,SOD活性最低,表明HIRI会导致肝细胞发生氧化应激反应,降低SOD活力,这与王全胜等[6]研究结果相符。各用药组大鼠肝脏MDA含量较低,SOD活性较强,表明Dex能有效降低HIRI导致的氧化应激反应。
细胞凋亡是缺血再灌注过程中细胞损伤的重要形式,是一种程序性的细胞死亡[7]。正常机体会定量引导细胞凋亡来维持内环境稳态,当机体受到伤害时,细胞凋亡增加,过量的细胞凋亡则会给机体带来损伤。在HIRI过程中氧化应激、钙超载、凋亡因子和内质网应激等多种因素都可以诱发细胞凋亡[8]。本试验中IR组大鼠肝细胞凋亡率显著高于S组大鼠肝细胞凋亡率,表明HIRI能够引起严重的肝细胞凋亡;各用药组大鼠肝细胞凋亡率均有所降低,表明Dex可有效减少HIRI造成的肝细胞凋亡。
HIRI导致的缺血缺氧及钙超载失衡会导致内质网稳态失衡,功能紊乱,进一步引起内质网应激反应(endoplasmic reticulum stress,ERS)的发生。发生ERS时,内质网分子伴侣蛋白GRP-78与内质网信号感受蛋白PERK、IRE1-α和ATF-6[9]分离,与堆积在内质网腔内的错误折叠或未折叠蛋白结合,从而清除这些蛋白[10]。与GRP-78分离后的3种信号感受蛋白开始各自感应内质网应激信号并发挥效应,开启细胞凋亡通路[11]。Caspase-12是附于内质网外膜的一种内质网应激介导的凋亡关键蛋白酶[12],它参与的IRE-1α/TRAF2/ASK1/Caspase-12通路是目前研究发现的唯一一条完整的内质网应激诱发的细胞凋亡通路[13],Caspase-12的表达水平可直接反映内质网应激介导的细胞凋亡水平。CHOP是一个特异性的内质网应激转导因子,是促凋亡的重要信号分子,在正常情况下表达水平很低,ERS时,CHOP可被内质网信号感受蛋白激活,表达量大幅增加,激活下游凋亡基因和死亡受体的表达[14]。本试验中IR组大鼠肝脏内质网应激和相关凋亡基因PERK、ATF-6、GRP-78和Caspase-12 mRNA的表达量较S组显著升高;与IR组相比,各给药组均降低。IR组大鼠肝脏内质网应激相关凋亡蛋白p-IRE-1α、p-PERK和CHOP的表达量较S组均显著升高;与IR组相比,各给药组均降低。这一结果表明Dex可有效减少HIRI造成的内质网应激。
为了探讨Dex给药剂量对保护HIRI作用的影响,本试验对不同剂量的Dex作用效果进行了研究。结果得出,不同剂量Dex对HIRI大鼠肝脏均具有一定的保护作用,低剂量Dex效果相对较差,对HIRI的保护效果不明显;中剂量Dex对HIRI的保护效果相对较好,而高剂量Dex的效果介于低剂量与中剂量之间,这与ROBERT等[15]先前的研究结果一致,由此推测Dex对HIRI的保护作用在一定剂量范围内具有剂量依赖性,但存在药物作用封顶效应,是否因为大剂量的Dex导致血压下降部分抵消了其器官保护作用,具体机制有待进一步研究。
综上所述,HIRI能导致肝功能损伤、氧化应激、内质网应激反应和细胞凋亡。Dex可以从促进肝功能恢复,减轻肝脏氧化应激,降低肝细胞凋亡率等方面减轻HIRI所致的肝脏损伤。中等剂量(50 μg/kg)Dex可对HIRI产生显著的保护作用,其保护机制可能是通过降低内质网应激标志蛋白GRP-78的表达,降低内质网感受蛋白PERK、ATF-6、IRE-1α以及凋亡信号分子Caspase-12、CHOP的表达来减轻HIRI。

