基于16S rDNA测序技术探究参苓白术散对溃疡性结肠炎小鼠肠道菌群的影响
马 琪,董 婧,翁与竞,杜红旭,2 (.西南大学 动物医学院,重庆 402460;2.西南大学 医学研究院 免疫研究中心,重庆 402460)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性炎症性肠病,本病的病变区域位于大肠黏膜及黏膜下层,主要涉及直肠和结肠,尤其是乙状结肠,有时也可能遍及降结肠乃至整个结肠。临诊主要表现为腹痛、腹泻、排血便等。目前普遍认为,UC机体存在肠黏膜炎症免疫耐受紊乱,肠黏膜免疫反应异常激活是UC发生、发展的重要因素[1]。对UC治疗的经典药物有5-氨基水杨酸、糖皮质激素、生物制剂等,该类药物在发挥功效的同时,不可避免地带来相应的副作用[2]。有研究表明,中医药对UC有良好的治疗作用,且不良反应较少[3]。
中医认为UC属于“泻下”、“痢疾”、“肠风”等范畴,并认为UC是由于感受外邪、内伤饮食、情志失调和脾胃虚弱所致,病位在脾、胃和大、小肠。其病因为外感湿热,饮食不节,导致脾、胃、小肠和大肠传导失调,水谷运行不畅,久而闭塞,伤及肠胃,气血瘀滞,以致便血。《古今医鉴》云:“夫泄泻者,注下之症也,盖大肠为传送之官,脾胃为水谷之海,或为饮食生冷所伤,或为暑湿风寒之所感,脾胃停滞,以致阑门清浊不分,发注于下,而为泄泻也。”UC证型实证中以大肠湿热为主,虚证中以脾虚证为主,在虚实夹杂证型中,多以脾虚为基础,并见湿热、寒湿、气滞和血瘀[4]。而在临床上,大肠湿热证、脾胃气虚证及脾虚夹湿热证三证型临床多见,符合中医学理论的病初起多属于实证,发展日久耗伤正气则形成虚证或虚实夹杂证的疾病发展观[5]。本研究探讨脾虚泄泻型UC的病机关键为脾虚湿盛,运化失健[6]。中医认为,脾喜燥而恶湿,外来湿邪,最易困阻脾土,以致升降失调,清浊不分,水谷杂下而发生泄泻,即所谓“无湿不成泄”,故《杂病源流犀烛·泄泻源流》说:“湿盛则飧泄,乃独由于湿耳”。因此,健脾温肾、行气导滞是中药治疗 UC 的重要原则[7]。
参苓白术散出自《太平惠民和剂局方》,是中医治疗脾虚夹湿证的经典方剂,由党参、白术、茯苓、山药、白扁豆、薏苡仁、砂仁、桔梗、莲子、炙甘草组成,诸药配伍,有健脾止泻,祛湿行滞之功。该方将补脾与祛湿合用,正邪兼顾;脾肺兼调,主在补脾,寓“培土生金”之义,常用于治疗脾虚夹湿证,近年发现其在临床消化系统、呼吸系统、内分泌系统等多个领域治疗疾病应用广泛,并取得显著成效[8]。
肠道菌群的平衡在构建肠黏膜屏障、维持正常免疫功能等方面发挥着重要作用,其机制包括产生抗菌物质、与有害菌竞争黏附、对宿主免疫调节等[2]。有研究表明中药通过口服进入消化道,一部分直接通过胃黏膜吸收入血,另一些生物利用度较低的部分未经上消化道吸收,通过小肠到达大肠,与肠道菌群接触并发生相互作用,中药有效部位成分不仅能改变肠道菌群代谢,且被肠道菌群转化或代谢[9]。中药还可以通过调节肠道菌群阻止肠道细菌和内毒素发生移位,平衡有益菌与致病菌,能明显提高黏膜细胞的再生能力,降低过高的黏膜通透性,从而改善黏膜的屏障功能[10]。因此,本研究通过探讨参苓白术散对DSS诱导的UC模型小鼠肠道菌群的影响,进一步探究参苓白术散治疗小鼠UC的机制。
1 材料与方法
1.1 实验动物32 只SPF级雄性BALB/c小鼠,6周龄,体质量18~20 g,购自湖南斯莱克景达实验动物有限公司[(湘)2019-0004],饲养于西南大学动物实验室[SYXK(渝)2019-0003]。饲养期间各组小鼠为自由饮水、采食。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在25℃ 左右。所有操作均符合西南大学动物实验伦理学要求(审批号:IACUC-20190620-02)。
1.2 试剂葡聚糖硫酸钠(DSS)(批号:S0948,MW:36000-50000)购自MP Biomedicals;联邻甲苯胺(批号:C10659221)购自上海麦克林生化科技有限公司;无水乙醇(批号:20190818)购自成都金山化学试剂有限公司;柳氮磺胺吡啶(sulfasalazine,SASP)(批号:C10865372)购自上海麦克林生化科技有限公司;过氧化氢(批号:200506)购自四川省伊洁士医疗科技有限公司;冰醋酸(批号:20170501)购自重庆川东化工有限公司。参考《太平惠民和剂局方》中参苓白术散的配方组成,药材莲子、薏苡仁、砂仁、桔梗、白扁豆、茯苓、党参、甘草、白术、山药购自重庆荣昌布美大药房,经西南大学动物医学院刘娟教授鉴定。其中莲子为睡莲科植物莲NelumbonuciferaGaertn.的干燥成熟种子,薏苡仁为禾本科植物薏苡Coix.Lacryma-jobiL.var.mayuen(Roman)Stapf的干燥成熟种仁,砂仁为为姜科植物阳春砂AmomumvillosumLour.的干燥成熟果实,桔梗为桔梗科植物桔梗Platycodongrandiflorum(Jacq.)A.DC.的干燥根,白扁豆为豆科植物扁豆DolichoslablabL.的干燥成熟种子,茯苓为多孔菌科真菌茯苓Poriacocos(Schw.)Wolf的干燥菌核,党参为桔梗科植物党参Codonopsispilosula(Franch.)Nannf.的干燥根,甘草为豆科植物甘草ClycyrrhizauralensisFisch.的干燥根茎,白术为菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎,山药为薯蓣科植物薯蓣DioscoreaoppasitaThunb.的干燥根茎。
1.3 方法
1.3.1试验试剂制备 参苓白术散制备:以《太平惠民和剂局方》中记载的处方配比为基础,称取莲子肉、薏苡仁、砂仁、桔梗(炒)各3.2 g,扁豆(炒)4.8 g,茯苓、党参、甘草、白术(炒)、山药各6.4 g,先后煎煮2次。过滤后合并滤液,用旋转蒸发仪浓缩至1 000 g/L,再用乙醇醇沉2次,所得上清液再蒸发至1 000 g/L,放入温箱烘干制得浸膏备用,灌胃时以羧甲基纤维素溶解配置为6.28 g/(kg·d)。柳氮磺胺吡啶溶液配制:灌胃时以羧甲基纤维素溶解配置为450 g/(L·d)。DSS配制:用纯净水配置为3.5%的溶液。联邻甲苯胺冰醋酸溶液配制:用1∶1无水乙醇和冰醋酸将联邻甲苯胺配置为15.0%的溶液,低温、避光保存。
1.3.2实验动物处理 将BALB/c小鼠适应性喂养7 d,采用随机数字表法把小鼠分为8 只/组:参苓白术散治疗组(SLBZS)、柳氮磺胺吡啶治疗组(SASP)、对照组、模型组(Model)。SLBZS、SASP、Model组饮用3.5% DSS 水溶液,对照组饮用纯净水。每天更换新鲜饮水,连续7 d。各组分别以参苓白术散、柳氮磺胺吡啶、羧甲基纤维素、羧甲基纤维素按10 mL/kg灌胃,共7 d。
1.4 观察指标
1.4.1小鼠临床表现观察 造模及治疗期间,观察并记录小鼠体质量、粪便、毛发状况、精神状态等变化,以此评估小鼠状态。
1.4.2小鼠结直肠长度测量 治疗结束后,颈椎脱臼处死小鼠,采集小鼠结直肠,于冰上去除肠系膜和脂肪组织,然后置于玻璃板上用直尺测量肛门到回直结合部距离。
1.4.3结肠黏膜损伤眼观评分 将小鼠结肠沿肠系膜侧纵向切开,用PBS溶液洗涤肠道内容物后进行肠黏膜损伤量化评分(表1)。

表1 结肠黏膜损伤眼观评分标准 分
1.4.4疾病活动指数(DAI)评分 通过体质量下降分数、粪便性状分数和粪便隐血分数评估小鼠的疾病活动指数(DAI)。公式为DAI=(体质量下降分数+粪便性状分数+粪便隐血分数)/3(表2)。

表2 DAI评分标准
其中小鼠粪便隐血程度采用联邻甲苯胺法判定,判定方法如下:用竹签将粪便涂于玻片或滤纸上,分别滴加15%邻甲苯胺冰醋酸溶液和3%过氧化氢液2~3滴于粪便上,根据颜色深浅和出现时间可判定,在2 min内显蓝褐色为阳性(表3,图1)。

表3 隐血检测判断标准 分

图1 隐血判定示意图
1.4.5结肠组织病理学评分 将小鼠整个结肠泡入10%中性甲醛固定后,用石蜡包埋,制成切片(约5 μm)后进行伊红-美蓝(HE)染色制成病理切片。采用Leica DFC 显微拍照系统对病理切片进行观察与拍照并进行组织病理学评分[11],评分内容包括肠上皮细胞损伤程度和炎症浸润程度,结果可用于评价结肠组织损伤程度(表4)。

表4 组织病理学评分标准 分
1.4.616S rDNA测序 采用CTAB方法对各组小鼠盲肠内容物样本的基因组DNA进行提取,并对DNA的纯度和浓度进行检测。根据测序区域的选择,使用带Barcode的特异引物和高保真DNA聚合酶对选定的V3~V4可变区进行PCR扩增。PCR产物用2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,胶回收采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)。参照电泳初步定量结果,对PCR扩增回收产物用QuantiFluorTM-ST 蓝色荧光定量系统(Promega公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合。使用NEB NextRUltraTMDNA Library Prep Kit建库试剂盒进行文库构建。构建好的文库通过Agilent Bioanalyzer 2100和Qubit进行质检,文库质检合格后进行上机测序。

2 结果
2.1 小鼠临床表现在适应性喂养期间各组小鼠进食、饮水、排便情况均正常,小鼠被毛整洁、平滑有光泽,活泼好动。Model组小鼠在造模期间随着DSS摄入逐渐表现为精神沉郁、怕冷扎堆、不愿走动、腹泻拉血便,肛周及尾根部黏附有干结的粪便,毛发逐渐变得干枯无光泽同时大量脱毛。SLBZS与SASP组随着灌胃给药,腹泻及血便情况、精神状态、毛发情况逐渐转好(图2)。
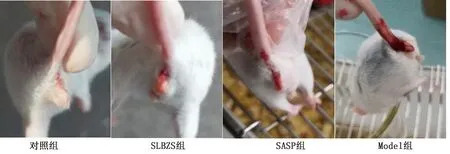
图2 小鼠一般状况
2.2 小鼠体质量及疾病活动指数(DAI)变化在试验期间,对照组小鼠的体质量基本呈上升状态,SLBZS和SASP组小鼠的体质量随着治疗进行有所恢复趋近于对照组,且均明显高于Model组,具有极显著性差异(P<0.01),说明2组的治疗均取得显著效果。但SLBZS组的体质量明显高于SASP组,且差异极显著(P<0.01),说明参苓白术散的治疗效果明显优于SASP组。同时,Model组体质量呈明显下降趋势,与对照组相比有极显著性差异(P<0.01)(图3A)。与对照组相比,Model组DAI评分极显著升高(P<0.01)。与Model组相比,SLBZS和SASP组DAI评分均明显降低(P<0.05)(图3B)。

A.小鼠体质量变化;B.DAI评分。与Model组比较,*.P<0.05, **.P<0.01;与对照组比较,#.P<0.05,##.P<0.01。下同图3 小鼠体质量变化及DAI评分
2.3 小鼠结直肠长度变化小鼠结肠长度缩短是UC炎症的重要特征[12]。与对照组相比,Model组结肠长度明显缩短(P<0.01)。与Model组相比,SLBZS组结肠长度明显增加(P<0.01)。SASP组结肠长度与Model组相比有显著性差异(P<0.05)(图4)。

A.小鼠结直肠长度;B.小鼠结直肠长度变化图4 小鼠结直肠长度变化
2.4 小鼠结肠黏膜损伤眼观评分根据小鼠结直肠剖检结果可见,Model组小鼠结直肠黏膜存在一定病变,肠壁充血肿胀,特别是结肠端有明显出血和溃疡。对照组小鼠结直肠基本无损伤,且结肠黏膜损伤眼观评分与Model组差异极显著(P<0.01)。同时SLBZS与SASP组小鼠结肠炎症状况较Model组明显改善,黏膜肿胀充血程度明显减轻(图5A)。在黏膜损伤评分中,SLBZS组相较于Model组有极显著性差异(P<0.01),SASP组相较于Model组有显著性差异(P<0.05)(图5B)。

A.小鼠结肠黏膜病变;B.结肠黏膜损伤眼观评分图5 小鼠结肠黏膜病变损伤情况
2.5 小鼠结肠组织病理切片及病理学评分HE染色结果所示(图6A),Model组小鼠结肠黏膜上皮结构破坏,正常形态消失,上皮细胞及皱襞变矮,整个肠壁变薄,黏膜下层有炎性细胞浸润,组织病理学评分与对照组相比差异显著(P<0.05) 。同时,SLBZS组小鼠结肠黏膜比较完整,与Model组相比组织病理学评分差异显著(P<0.05)(图6B)。

A.小鼠结肠组织病理切片(HE染色,×100,n=3);B.组织病理学评分图6 小鼠结肠组织病理学变化
2.6 小鼠样品16S rDNA测序质量评估及多样性分析根据各样品测序量在不同测序深度时微生物多样性指数构建Shannon 曲线,当曲线趋向平坦时,说明测序数据量足够大,可以反映样本中绝大多数的微生物信息(图7A)。采用Venn图分析 OTUs 数量及不同组之间共有、特有OTUs,Model和对照组总 OTUs 为181 727个,Model组特有OTUs为82 309个,对照组特有OTUs为79 067个,共有OTUs为20 351个,占总OTUs的11.20%。与对照组相比,Model组肠道菌群物种丰度降低(图7B)。以Observed_Species指数组间差异分析组间物种多样性,SLBZS组Observed_Species指数高于Model组,同时低于对照组(图7C)。
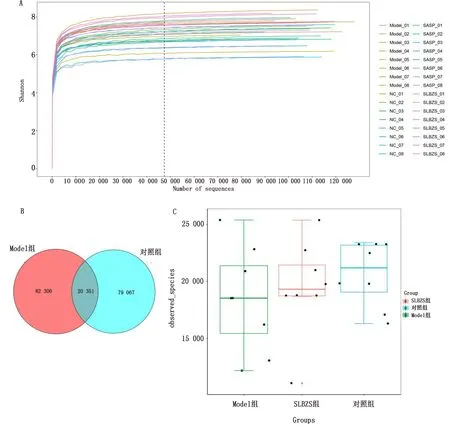
A.小鼠样品Shannon曲线;B.Venn图;C.Observed_Species指数组间差异箱形图图7 小鼠肠道菌群多样性分析
2.7 门水平小鼠肠道菌群结构组成分析选取在门水平(Phylum)上最大丰度排名前 10 的各组小鼠肠道菌群物种,首先,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)丰度最高,各组占比均在80% 以上,其次为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、脱铁杆菌门(Deferribacteres)等(图8A)。各组Firmicutes与Bacteroidetes丰度比值(即F/B值)由高到低依次为:对照组(3.37)>SLBZS组(1.70)>SASP组(1.36)>Model组(1.21)。采用heatmap在Phylum上进行物种丰度聚类情况分析,Proteobacteria的丰度在Model组中最高(0.081),SASP组次之(0.075),SLBZS组(0.042)与对照组(0.034)接近;在对照组中Deferribacteres和Actinobacteria的丰度显著高于其他各组(图8B)。
2.8 属水平小鼠肠道菌群结构组成分析选取在属水平(genus)上最大丰度排名前10的各组小鼠肠道菌群物种,在对照组中,乳杆菌属(Lactobacillus)丰度最高(18.74%),其次为Mucispirillum(3.80%)、棒状杆菌属(Corynebacterium)(3.72%);在SLBZS组中,拟杆菌属(Bacteroides)的丰度明显低于SASP和Model组;在Model组中,Lactobacillus的丰度明显低于SLBZS和SASP组(图9)。

图9 属水平小鼠肠道菌群丰度
2.9 小鼠肠道菌群组间差异分析采用基于Weighted Unifrac距离[13]构建UPGMA(unweighted pair-group method with arithmetic mean)样品聚类树分析不同样品间的相似性,与Model组相比,SLBZS和SASP组与对照组距离小,相似性较高(图10)。根据分类学组成对样本按照不同分组条件进行线型判别分析(LDA),找出对样本划分产生显著性差异影响的群落或物种[14]。Model与SLBZS组的差异类群为Lactobacillales,Model与对照组的差异类群为Proteobacteria和Firmicutes。

图10 小鼠肠道菌群组间差异分析
3 讨论
UC是一种黏膜和黏膜下层的慢性非特异性炎症,病变主要在结肠和直肠,临诊主要表现为腹痛、腹泻、排血便等。《医学心悟》指出:“湿多成五泻,泻之属湿明矣。然有湿热,有寒湿,有积食,有脾虚,有肾虚,皆能致泻,宜分而治之。”参苓白术散有健脾渗湿之功,是用于治疗脾虚泄泻型UC的有效方剂。研究表明中医药辨证治疗UC,尤其是慢性阶段的UC治疗,有药物不良反应较小、疗效显著的优势[15]。
绝大多数中药给药途径以汤剂、丸剂、散剂等口服为主,肠道菌群主要参与中药有效成分的吸收、代谢和转化[16]。近年来,越来越多的研究表明,除遗传、免疫、环境等因素外,UC的发生与肠道菌群失调密切相关[2]。健康成人肠道内约有1 000多种细菌,是人体组织细胞总数的10倍,肠道菌群同肠上皮层、黏液层、肠道淋巴系统一起构成肠黏膜机械、化学及生物屏障,该屏障有天然保护作用,可防止致病菌的入侵,维持机体内环境稳定,同时定植于肠道内的菌群可促进免疫系统发育成熟[17]。微生物菌群失调可通过破坏结肠上皮紧密连接而减少肠道屏障,从而增加肠道的供血能力,使细菌转移进入血液循环,导致毒性物质的转移[18]。
超过90%的正常人类肠道微生物群由4个主要细菌门中的物种组成:Firmicutes、Bacteroidetes、Proteobacteria和Actinobacteria[19]。而小鼠的优势菌门与人相似,测序结果表明各组在门水平丰度前10的物种中,丰度最高的均为Firmicutes和Bacteroidetes,占到80%以上,其次为Proteobacteria、Actinobacteria等。而Firmicutes和Bacteroidetes丰度比值(即F/B值)由高到低依次为对照组、SLBZS组、SASP组、Model组,在SLBZS组中,Bacteroides丰度明显低于SASP和Model组。研究表明,Firmicutes相对于Bacteroidetes的相对丰度增加被认为是肠道微生物群生态失调的一个指标[20]。同时,有研究显示肠道微生物群结构中适当数量的Firmicutes对慢性肠道炎症有保护作用,在Firmicutes中包含几种产丁酸的细菌[21],而丁酸盐是结肠上皮细胞的主要能量来源,可提供肠道内的酸性环境进而抑制有害菌生长,维持水电解质平衡,促进黏膜炎症修复[22]。
另外,16S rDNA测序结果显示在Model组中Proteobacteria的丰度最高,在对照组中Actinobacteria的丰度显著高于其他组。研究表明,放线菌在肠道内稳态的发展和维持中起着关键作用,它们产生大量短链脂肪酸的能力被认为有助于维持肠道屏障[23]。 而天然肠道菌群通常只包含一小部分的Proteobacteria,且有研究表明肠道微生物群的失调通常是由Proteobacteria丰度的持续增加引起的[20]。由于机体不能将共生的变形杆菌维持在较低的丰度,导致微生物群落的定植能力降低,引发变形杆菌的不受控制的扩张,进一步促进外来病原体的入侵或炎症的发展。因此,有学者提出可将Proteobacteria丰度的增加视为微生物群落失调的标志和疾病的潜在诊断标准[20]。
同时,在对照组中,Lactobacillus丰度最高(18.74%),其次为Mucispirillum(3.80%)、Cory-nebacterium(3.72%);在Model组中,Lactobacillus的丰度明显低于SLBZS和SASP组。Lactobacillus可以改善小鼠的肠道菌群紊乱,降低肠道通透性,抑制肠道内脂多糖移位,并减轻系统性低度炎症[22]。同时,Lactobacillus促进产丁酸菌的生长及丁酸在低丁酸菌群体中的吸收和利用,减少炎症反应[18]。覆盖于肠道表面的黏液层是肠道黏膜屏障完整性的组成部分,在阻止肠腔微生物及其产物穿过肠黏膜起到重要的作用,Lactobacillus可通过保证肠黏膜的完整性来改善肠道屏障功能[24]。另外,研究表明Mucispirillum可以帮助宿主抵御鼠伤寒沙门菌引发的肠道炎症,该菌在肠道内与沙门菌竞争厌氧呼吸底物,抑制沙门菌毒力因子的表达,从而抵御结肠炎[25]。
16S rDNA测序结果显示,Model与SLBZS组的差异类群为Lactobacillales,Model与对照组的主要差异类群为Proteobacteria、Firmicutes。同时,动物试验结果表明参苓白术散能有效改善UC小鼠的腹泻及血便情况、精神状态、毛发情况,明显恢复体质量(P<0.01)、减少结肠长度的缩短(P<0.01)、改善结肠炎症状况、降低黏膜损伤评分(P<0.01)、降低DAI评分(P<0.05)、降低组织病理学评分(P<0.05)。以上结果均表明参苓白术散可以通过提高小鼠肠道菌群中有益菌的丰度、激发有益菌的微生物活性来抑制致病菌的生长,从而调节UC小鼠肠道菌群的多样性、组成和相对丰度,同时改善屏障功能、提高免疫能力,以此达到治疗UC的效果。

