胆酸对代谢性炎症模型大鼠炎性因子及PPARα和LXRα表达与分布的影响
何秀玲,孙 苗,石琳琳,李培锋,关 红,郭凤英 (.内蒙古农业大学 兽医学院 农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 000;2.内蒙古农业大学 职业技术学院,内蒙古 包头 0409)
代谢性炎症(metaflammation)是一种慢性、低度的炎症反应,是由营养过剩引起的,机体会表现出肥胖、糖脂代谢紊乱的症状,可使得体内的代谢细胞大量募集免疫细胞,从而触发代谢性炎症,并增加TNF-α、IL-1β、IL-6、MCP-1的分泌量[1]。近几年,我国宠物代谢性炎症发病率逐年增高,严重影响宠物健康,但用于防治代谢性炎症药物的开发仍存在挑战[2]。研究表明,胆酸(cholic acid,CA)有助于胆固醇的分解和脂肪的吸收,在高脂饲料中加入胆酸可抑制小鼠肥胖的发展[3]。研究者已发现胆酸对黏膜免疫和肠道炎症中炎性因子的产生具有重要的调节作用,对小鼠因棉球导致的肉芽肿、炎性组织中PGE2的含量以及对大鼠因甲醛引起的足跖肿胀均具有极显著的抑制[4-6]。此外,胆酸可以抑制腹腔炎症[7]。胆酸对代谢性炎症的调节作用及其作用机制的研究目前尚未见有报道。据报道,参与糖脂代谢及炎症反应相关的2个受体PPARα和LXRα与胆酸密切相关[8-9],但胆酸促进脂肪分解,特别是调节代谢性炎症的作用是否受PPARα、LXRα的调节,目前尚未阐明。
本研究检测了胆酸处理的代谢性炎症模型大鼠外周血中炎性因子和肝脏组织中的PPARα、LXRα两者相关受体的变化,以期探讨胆酸对代谢性炎症的影响及其调控机理,为进一步开发宠物新型抗代谢性炎症药物提供试验依据。
1 材料与方法
1.1 实验动物SPF级健康雄性SD大鼠,4周龄,体质量110~130 g,购自北京维通利华生物技术有限公司。
1.2 主要试剂与仪器胆酸(纯度98%以上,提取于内蒙古农业大学兽医药理学与毒理学实验室);IL-1β ELISA试剂盒(ER008)购自上海依科赛生物有限公司;IL-6 ELISA试剂盒(CSB-F04640r)购自武汉华美生物试剂工程有限公司;MCP-1 ELISA试剂盒(Bsk23024)购自博奥森生物试剂有限公司;RNA提取试剂盒(AP-MN-MM-RNA-250)购自康宁科学有限公司;TB Green®Premix EX TaqTMⅡ(RR820A)、PrimeScriptTMRT Master Mix(RR-036A)购自日本TaKaRa 公司;4%多聚甲醛(BTN131248)购自索莱宝科技北京有限公司;石蜡(39601095)购自德国莱卡有限公司;无水乙醇(CFSR-10003218)、二甲苯(CFSR-100523418)购自国药集团有限公司;苏木精-伊红染液(G1006)、Anti-PPAR alpha Rabbit pAb(GB11163)、Anti-LXR alpha Rabbit pAb(GB11350)购自武汉塞维尔生物有限公司。PCR仪(DYX-Ⅲ)购自上海森信公司;RT-PCR仪(VL1A7)购自美国ABI公司;电子显微镜(BX53F)购自日本奥林巴斯株式会社。
1.3 引物的合成用于定量分析的引物均由华大基因检测公司合成,包括β-actin、IL-10、IL-8、MIP-1α、TNF-α,引物序列见表1。

表1 β-actin、IL-10、IL-8、MIP-1α、TNF-α基因引物序列
1.4 代谢性炎症模型大鼠的构建4周龄雄性SD大鼠60只,试验将12只饲喂基础饲料,48只则喂养高脂饲料并自由饮水。每日测定大鼠体质量,计算增重率。造模成功的标准为高脂饲料的大鼠体质量超过喂养普通饲料大鼠体质量的20%[10]。
1.5 试验给药持续时间将大鼠分为阴性对照组(NC)、模型组(MOD)、胆酸低剂量组(CL)、胆酸中剂量组(CM)及胆酸高剂量组(CH)。胆酸为白色粉末状药物,用纯水做溶剂,称取大鼠体质量,计算给药量。给药方式、给药剂量见表2。
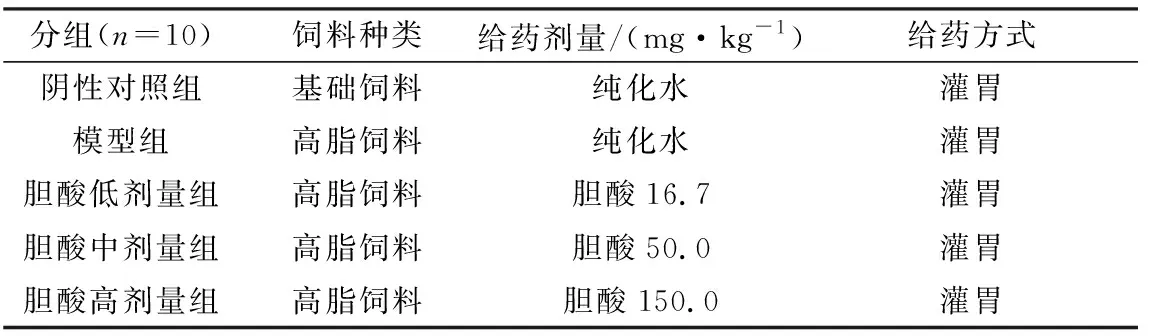
表2 试验分组及给药
1.6 代谢性炎症模型大鼠肝脏组织形态学的观察大鼠的肝脏形态以HE染色法观察。取同部位的大鼠肝脏组织,于4%多聚甲醛溶液中固定48 h,并对固定完成的组织块进行脱水、透明、包埋、切片、染色及封片,显微镜下观察肝脏组织形态。
1.7 胆酸对代谢性炎症模型大鼠相关炎性因子的影响
1.7.1胆酸对代谢性炎症模型大鼠外周血中炎性因子含量的测定 大鼠血清中IL-1β、IL-6及MCP-1的含量用ELISA法检测。根据标准孔绘制标准曲线,并根据标曲公式计算样品中的IL-6、IL-1β及MCP-1含量。
1.7.2胆酸对代谢性炎症模型大鼠肝脏中炎性因子表达量的检测 大鼠肝脏组织中IL-10、TNF-α、MIP-1α及IL-8 mRNA相对表达量用RT-qPCR法检测。将大鼠的肝脏组织研磨并提取总RNA,然后反转录为cDNA,以cDNA为模板进行扩增,目的基因mRNA的相对表达量需用2-△△Ct计算。计算公式如下:
△Ct=Ct目的基因-Ct内参基因,△△Ct=△Ct试验组-△Ct阴性对照组。
1.8 胆酸对代谢性炎症模型大鼠肝脏中PPARα和LXRα分布及表达的影响大鼠肝脏组织中PPARα和LXRα表达的分布及其表达量用免疫组化法检测。将肝脏组织切片进行脱蜡及水化、抗原修复、降低染色剂非特异性结合、孵育一抗、孵育二抗、显色及封片,然后在显微镜下观察。

2 结果
2.1 胆酸对代谢性炎症模型大鼠肝脏细胞形态的影响结果如图1所示,苏木精染液把肝脏细胞核呈现为蓝紫色,伊红染液把细胞质呈现为红色。显微镜下观察大鼠肝脏组织HE染色切片,阴性对照组大鼠的肝脏细胞核大呈现圆形、核膜界限清晰、细胞排列整齐;与阴性对照组大鼠的肝脏组织对比,模型组大鼠的肝脏组织中出现脂肪空泡以及巨噬细胞为主的炎性细胞聚集,而给予胆酸治疗的高、中、低剂量组大鼠的肝脏细胞中细胞形态和大小均正常,且炎性细胞减少以及脂肪蓄积得到改善。

注:模型组图中白色箭头所指位置有炎性细胞聚集,绿色箭头所指位置为脂肪空泡图1 肝脏组织HE染色切片结果 (HE,×40)
2.2 胆酸对代谢性炎症模型大鼠相关炎性因子的影响
2.2.1胆酸对代谢性炎症模型大鼠外周血中炎性因子的影响 结果如图2~4所示,与阴性对照组相比,模型组大鼠外周血中IL-1β的含量虽有增加的趋势,但无显著性差异(P>0.05),而MCP-1的含量则显著升高(P<0.05);与模型组相比,胆酸中、低剂量组大鼠外周血中MCP-1的含量显著降低(P<0.05),而胆酸高剂量组大鼠外周血中MCP-1的含量极显著性降低(P<0.01),且胆酸高剂量组大鼠外周血中IL-6的含量较模型组显著降低(P<0.05);胆酸高剂量组大鼠外周血中IL-6的含量组较低剂量组极显著降低(P<0.01),胆酸高剂量组大鼠外周血中MCP-1的含量较中剂量组显著升高(P<0.05)。

注:大写字母相同,小写字母不同表示差异显著(P<0.05);大小写字母均不同表示差异极显著(P<0.01);含相同小写字母表示差异不显著(P>0.05)。“##”表示模型组与阴性对照组相比差异极显著(P<0.01);“#”表示模型组与阴性对照组相比差异显著(P<0.05)。下同图2 大鼠外周血清中IL-6含量
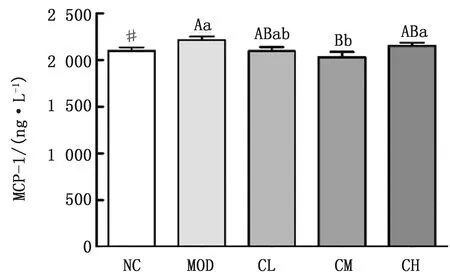
图3 大鼠外周血清中MCP-1含量
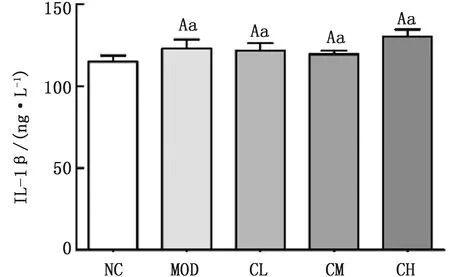
图4 大鼠外周血清中IL-1β含量
2.2.2胆酸对代谢性炎症模型大鼠肝脏中相关炎性因子表达量的影响 结果如图5~8所示,与阴性对照组相比,模型组大鼠肝脏内IL-10的表达量虽增加,但无显著性差异(P>0.05),而TNF-α的表达量显著增加(P<0.05),IL-8及MIP-1α的表达量极显著增加(P<0.01);与模型组相比,胆酸中、低剂量给药组大鼠肝脏内IL-10的表达量均显著性降低(P<0.05),胆酸高剂量组大鼠肝脏内IL-10的表达量极显著性降低(P<0.01),胆酸中剂量组大鼠肝脏内TNF-α的表达量极显著性降低(P<0.01),胆酸高、中、低剂量组大鼠肝脏内IL-8及MIP-1α的表达量极显著降低(P<0.01);胆酸中剂量组大鼠肝脏内IL-8的表达量极显著低于胆酸低、高剂量组(P<0.01)。

图5 IL-10 mRNA表达量
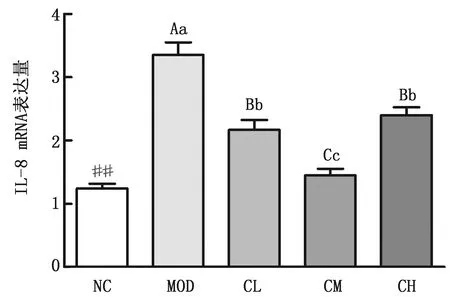
图6 IL-8 mRNA表达量

图7 TNF-α mRNA表达量
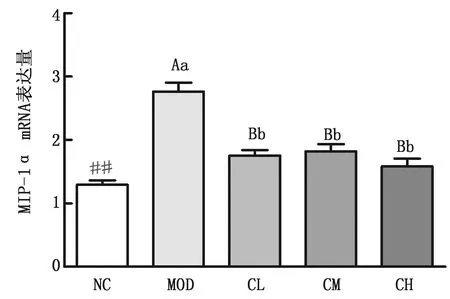
图8 MIP-1α mRNA表达量
2.3 胆酸对代谢性炎症模型大鼠肝脏中PPARα和LXRα分布和表达的影响
2.3.1大鼠肝脏中PPARα分布和表达 结果如图9所示,大鼠肝脏组织细胞内PPARα抗原与其抗体反应后,染色越深表明PPARα表达量越高;而阴性对照组,因无抗原抗体结合反应,细胞核呈蓝染。

注:图中红色箭头所指为PPARα在肝脏中的分布及表达量图9 PPARα免疫组化结果 (IHC,×40)
平均光密度分析结果如图10所示,与阴性对照组相比,模型组大鼠肝脏中的PPARα阳性表达量极显著降低(P<0.01);与模型组相比,胆酸高、中剂量组大鼠肝脏中的PPARα阳性表达量极显著升高(P<0.01),胆酸低剂量组大鼠肝脏中的PPARα阳性表达量显著升高(P<0.05);胆酸高、中剂量组大鼠肝脏中的PPARα阳性表达量极显著高于低剂量组(P<0.01)。

图10 PPARα表达量
2.3.2大鼠肝脏中LXRα分布及表达 图11结果显示,肝脏组织细胞内LXRα抗原与其抗体反应后,染色越深表明LXRα的表达量越高;而阴性对照组,无抗原抗体结合的细胞核呈蓝染。

注:图中红色箭头所指为LXRα 在肝脏中的分布及表达量图11 LXRα免疫组化结果 (IHC,×40)
图12平均光密度分析结果显示,与阴性对照组相比,模型组大鼠肝脏中的LXRα阳性表达量无显著性差异(P>0.05);与模型组相比,胆酸高、中、低剂量组大鼠肝脏中的LXRα阳性表达量极显著降低(P<0.01);胆酸高、中、低剂量组大鼠肝脏中的LXRα阳性表达量之间无显著性差异(P>0.05)。

图12 LXRα表达量结果
3 讨论
本研究观察经口服给予代谢性模型大鼠不同剂量的胆酸30 d后的肝脏组织病理形态学变化,测定了血清和肝脏中的炎性因子,结果显示,模型组大鼠肝脏组织出现了脂肪空泡及炎性细胞的聚集,血清和肝脏中TNF-α、MCP-1、IL-8、MIP-1α含量均显著升高,这与有关报道相一致。据报道,用高脂饲料喂养大鼠,持续10周左右,就会出现因肥胖造成的摄食量降低,行动迟缓,容易应激的表现,处死检测血清中IL-6、TNF-α、MCP-1、IL-1β等炎症因子的含量较普通饲料喂养的大鼠有所升高[11]。肝脏在动物体内有调节能量代谢、免疫反应和解毒的功能,而长期高脂喂养的大鼠,肝脏会随喂养时间出现不同程度脂肪变性,脂肪细胞的凋亡、细胞内JAK2酶、内质网应激都是促进炎症反应的因素[12]。本研究结果表明,胆酸可显著降低模型组大鼠IL-6含量及IL-10表达量(P<0.05),极显著降低MCP-1含量及TNF-α、IL-8、MIP-1α的表达量(P<0.05),且结合病理形态学观察,发现给予胆酸治疗的代谢性炎症大鼠,肝脏组织中炎性细胞减少,提示胆酸能降低代谢性炎症模型大鼠的炎症反应。
文献表明,胆酸通过降低代谢性炎症模型大鼠脂肪湿重、脂肪系数、TG、CHO的含量,缓解大鼠体内脂肪蓄积,从而降低大鼠增重率;伴随着脂肪含量的降低,由脂肪代谢障碍引起的炎症因子,如IL-6、MCP-1的含量、TNF-α、IL-8、MIP-1α的表达量也显著降低。肝脏作为脂肪代谢的重要调节器官,为了研究胆酸对代谢性炎症的调节机制,采用肝脏组织免疫组化试验,确定了2个与代谢性炎症相关,并且在肝脏细胞核内表达的受体PPARα和LXRα。据报道,胆酸的天然受体FXR可以介导脂肪代谢,抗炎免疫调节以及血糖调节等能量代谢[13]。PPARα及LXRα作为核受体,与FXR关系密切,同样调节体内能量代谢和抗炎免疫系统[14]。激活FXR,能上调PPARα的表达,抑制SREBP-1c及下游通路,进而降低胆固醇、脂肪酸及TG的生成,从而降低大鼠体质量的增长[15]。PPARα被激活后可以抑制NF-κB信号,降低促炎因子的分泌,阻遏炎症反应[16]。LXRα被激活后,则上调SREBP-1c及下游通路,促使HDL、LDL以及TG的生成。活化的FXR又通过激活SHP的表达,从而抑制LXRα及下游通路SREBP-1c的转录表达,降低脂肪的合成[17]。本研究对免疫组化切片做平均光密度分析的结果表明,不同剂量的胆酸给予代谢性炎症模型大鼠后,大鼠肝脏细胞内PPARα表达量上调,而LXRα的表达则受到抑制,该结果与相关报道的结果相一致,提示胆酸是通过极显著上调代谢性炎症大鼠肝脏细胞内PPARα的表达,以及极显著抑制LXRα的表达降低脂肪的生成,从而抑制代谢性炎症反应。此外,本试验建立的代谢性炎症模型大鼠PPARα表达量极显著低于阴性对照组(P<0.01),这可能与线粒体功能受损,PPARα对脂肪酸的β氧化受到抑制,引起负反馈调节,从而使PPARα的表达量下调。

