不同比例油茶饼粕自然发酵过程中的养分变化及微生物群落比较
张 晖,吴雪辉,董 斌,李荣喜,黄永芳
(1. 仲恺农业工程学院,广东 广州 510225;2. 华南农业大学,广东 广州 510642;3. 广东省油茶工程技术研究中心,广东 广州 510642;4. 广东农工商职业技术学院,广东 广州 510507)
油茶Camellia oleifera属于山茶科植物,为常绿小乔木,被国家列为大宗油料作物,与油棕、油橄榄和椰子树并称世界四大木本食用油料植物,油茶籽油不饱和脂肪酸高达90%,且含多种保健性成分。近年来,油茶在种植面积、产油量、产值上均逐年稳步提高,我国现有油茶种植面积已达到453.33 万hm2,力争到2025 年油茶种植面积达到600 万hm2[1]。在南方,油茶产业逐渐成为加快农村经济结构调整的特色产业,是脱贫攻坚和乡村振兴的支柱产业[2]
油茶籽油作为食用油占比超过1%,产量的提升使得油茶籽粕量也随之增加。油茶果去壳压榨除油后剩下的油茶粕,其中含有约10%~20%的蛋白质,10%~12%的茶皂素,6%~10%的油酸;其中蛋白质、碳水化合物、粗纤维总量可达75%[3]。油茶粕加工利用主要体现在蛋白质提取与利用[4]、多糖提取[5]、多酚的应用研究[6-7]等方面,蛋白质的提取可作为反刍动物类的饲料蛋白[8],油茶粕多糖具有抗氧化、降血糖、提高免疫活性等多种生物学功能[9-10];同时利用油茶粕为原料,制备可食性保鲜膜也成为新的开发方向[11]。目前为止,油茶饼粕的利用以茶皂素的提取和研究较为广泛,因其可直接应用于日化等高附加值产品[12]。
我国每年油茶粕产量达到5.0×105t,对于提取茶皂素后的油茶粕在过往或作废弃处理或是用作有机肥[12],本团队对毛霉Mucor roxianus、哈茨木霉Trichoderma harzianum和黑曲霉Aspergillus Niger3 种霉菌在油茶饼粕固态发酵的作用已做了相关研究[15-16],关于油茶粕有机肥的有效利用以及发酵过程中养分变化及微生物群落的构成却一直未有研究。因此,本试验通过分析不同比例油茶饼粕在自然环境发酵过程中的变化,比较养分变化与细菌微生物组成,为更好地科学利用和开发茶粕有机肥提供相关参考。
1 材料与方法
1.1 材 料
1.1.1 油茶饼粕
试验用的油茶饼粕购于广东新大地生物科技有限公司,是未脱茶皂素的饼粕。
1.1.2 油茶饼粕去茶皂素处理
通过水提法脱去茶皂素的油茶饼粕。水提法是将油茶饼粕浸泡在pH=10,固液比1∶10 的80 ℃热水中,12 h 后进行脱水,60 ℃烘干备用[17]。
1.2 方法
1.2.1 不同比例油茶饼粕配制
将已烘干的脱茶皂素油茶饼粕与黄心土分别用粉碎机碾碎,过200 目筛。按比例配制成含有油茶饼粕0%、5%、10%、20% 和100%的茶粕样品,称取50 g 混合样品装进无纺布袋(7 cm×9 cm),并用绳子系紧封口,每个处理3 重复。
1.2.2 油茶饼粕发酵处理
试验选址于仲恺农业工程学院农场内地毯草坪地进行,在去除表面植物后,挖深度为10 cm,长宽分别为15 cm×8 cm 的坑槽,然后将茶粕袋平放于坑槽中,每袋茶粕放置于1 个坑槽,然后将原土回填覆盖还原,每天往试验地浇水保湿,在试验进行的第1、2、4、8 和12 周分别取样,测定全氮、有机质、腐殖酸含量。
1.2.3 细菌16S rRNA 基因高通量测序
采用CTAB 法对样本的基因组DNA 进行提取,利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,取适量样品DNA 于离心管中,使用无菌水稀释样品至1 ng/μL。以稀释后的基因组DNA 为模板,根据测序区域的选择,使用特异引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGA CTACHVGGGTWTCTAAT-3′),对16S rRNA 基因的V3 ~V4 高变区片段进行PCR 扩增。
PCR 反应体系:2×Phusion Master Mix 15 μL,正、反向引物(2 μmol/L)各3 μL,基因组DNA(1 ng/μL)7 μL,ddH2O 2 μL。PCR 反应条件:
98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃ 5 min。使用2%的琼脂糖凝胶对PCR 产物进行电泳检测。根据PCR 产物浓度进行等量混样,充分混匀后使用1×TAE 质量百分浓度为2%的琼脂糖胶电泳纯化PCR 产物,回收目标条带。使用MiSeq/Hiseq 平台对16S rDNA 的一个或多个高变区进行双末端(paired-end)测序。
1.2.4 细菌多样性分析
使用Cutadapt 软件对Reads 进行过滤,按Barcode 拆分出各样品数据,截去Barcode 和引物序列,去除嵌合体序列[18],得到最终有效数据。使用Uparse 软件[19]对序列进行聚类,默认以97%的一致性将序列聚类成为操作分类单元(Operational taxonomic unit,OTU)。根据OTU聚类结果,利用SSUrRNA 数据库[20]对每个OTU的代表序列进行物种注释,获得分类学信息和各样本在各分类水平上的群落组。同时,使用QIIME V1.9.1 软件进行OTU 丰度与多样性指数计算,得到样品内物种丰富度信息,并基于KEGG对其代谢功能进行预测。
1.3 数据处理
采用SPSS 19.0 软件进行One-way ANOVA 单因素方差分析,采用WPS 2021 软件进行数据处理,采用SigmaPlot 软件进行制图。
2 结果与分析
2.1 油茶饼粕在自然发酵过程中相关养分变化
不同比例油茶饼粕在土壤自然发酵过程中全氮变化如图1 所示。由图1 可见,不同比例的油茶饼粕全氮随着时间的推移变化不明显,其中茶粕含量20%时在1 周后出现明显的下降,与试验前的初始含量差异性显著,随后的含量保持在0.24%~0.25%范围内,差异性不显著。即使是在100%茶粕的处理中,其总氮含量虽然在1.28%~1.29%范围内波动,但各时间段之间的差异性并不显著,总体上保持平稳。而在0%处理中,全氮总量出现明显的变化,在12 周时,全氮含量显著低于试验初始值。从表1 同一时间不同处理全氮的差异性分析结果来看,添加5%茶粕与未添加茶粕的处理在第1、2 和4 周时差异性不显著,而5%与10%的全氮含量在第1 和第2 周时差异性显著,但第4 和第8 周时差异性不显著,在第12 周时差异性显著。

图1 不同比例油茶饼粕在土壤自然发酵过程中全氮变化Fig. 1 Changes of total nitrogen in different ratio of oilcake during natural fermentation in soil
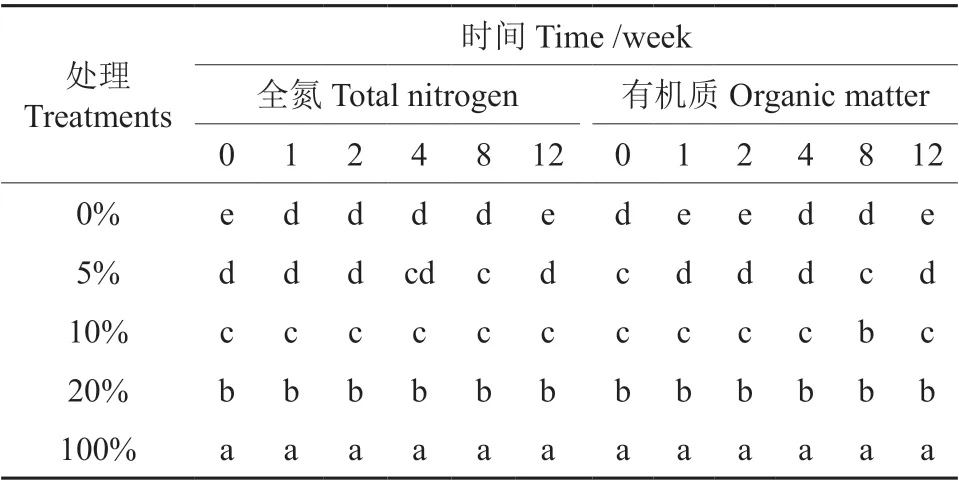
表1 同一时间不同处理差异性分析Table 1 Difference analysis of different treatments at the same time
不同比例油茶饼粕在土壤自然发酵过程中有机质变化情况如图2 所示。由图2 可见,不同比例油茶饼粕在自然发酵过程中有机质呈现出明显的变化,经过12 周的发酵过程,0%、5%、10%、20%处理的有机质含量均明显下降,较初始含量分别下降了44%、40%、21%、41%,而100%处理中的有机质降幅最小,只有3%。从表1 同一时间不同处理有机质含量分析可见,添加茶粕后,即使在最低设计含量5%时,其有机质含量与未添加茶粕的处理相比,除在第4 周时两者之间差异性不显著外,其余各处理差异性均显著高于未添加茶粕处理,而随着茶粕含量的增加,各处理之间的差异性显著。
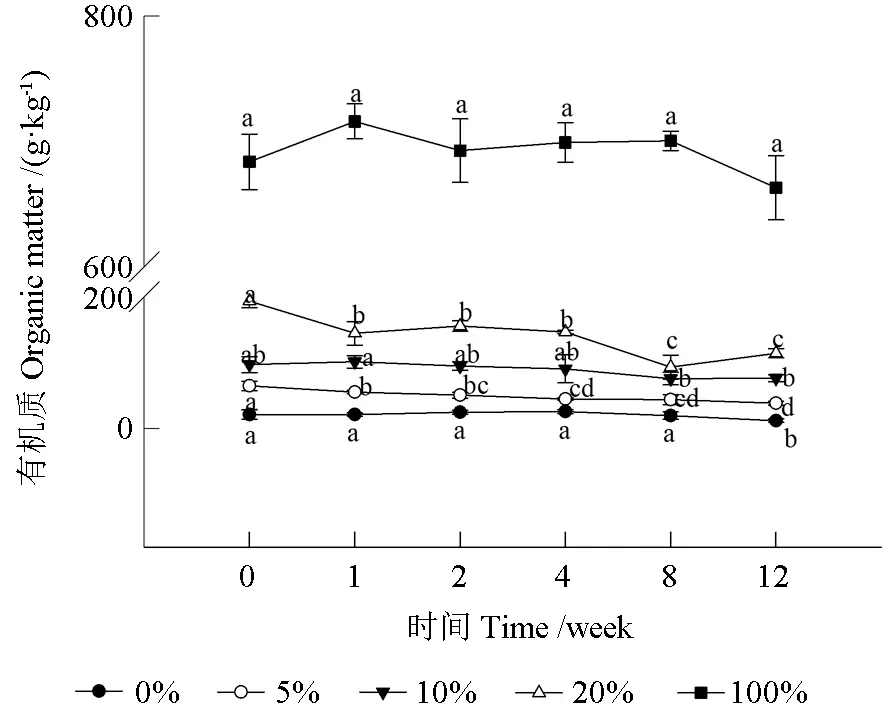
图2 不同比例油茶饼粕在土壤自然发酵过程中有机质变化Fig 2 Changes of organic matter in different ratio of oil cake during natural fermentation in soil
不同比例油茶饼粕在土壤自然发酵过程中碳氮比变化如图3 所示。从油茶饼粕在土壤中自然发酵过程中C/N 比变化(图3)可见,在0%处理中,其C/N 变化波动相对较大,C/N 变化范围在19.7 ~48.4 之间,并于试验第1 周和第4 周分别达到最低值和最高值,两者差异性显著。5%、20%和100%处理的C/N 均于试验第1 周和第2 周达到最高值,分别为34.3、35.1 和32.3,随后呈下降趋势。在第12 周,含有茶粕的处理组其C/N 介于24.5 ~38.6区间,其中10%处理组C/N 最高,为38.6。

图3 不同比例油茶饼粕在土壤自然发酵过程中碳氮比变化Fig 3 Changes of carbon-nitrogen ratio in different ratio of oil-cake during natural fermentation in soil
纯油茶饼粕在土壤自然发酵过程中腐殖酸变化如图4 所示。由图4 可见,100%处理组的腐殖酸变化呈现先升后降的趋势,于第1 周时达到最高值26%,显著高于其他时间段腐殖酸含量,之后腐殖酸含量开始下降,并且茶粕在试验第4 周时已经下降到14%,于第8 周时腐殖酸含量最小,为12%,但与第4 周和第12 周腐殖酸相比差异性不显著,总体变化相对平稳。

图4 纯油茶饼粕在土壤自然发酵过程中腐殖酸变化Fig 4 Changes of humic acid in different ratio of oil-cake during natural fermentation in soil
2.2 油茶饼粕在自然发酵过程中微生物群落组成变化
试验原料微生物门层级相对丰度如表3 所示。对比分析试验原料中的细菌微生物群落(表2),3 种原料的主要组成为变形菌门,其中配置用土的变形菌门相对丰度占95.8%,分别比试验场地和茶粕原料中的变形菌门相对丰度高2.6 和2.5 倍。试验场地土壤和茶粕原料的微生物门层级组成相似,在所统计的10 个门级,分别占两试验原料相对丰度的83.1%和82.8%,二者主要差异在放线菌门、绿弯菌门和泉古菌门,前者相对丰度分别为后者的3、2 和0.44 倍。

表2 试验原料微生物门层级相对丰度Table 2 Relative abundance of microbe phylum level of materials
门层级各处理微生物群落相对丰度如图5 所示。由图5 可见,在试验第4 周,各处理间的门水平的微生物组成发生了不同程度变化,其中茶粕含量为0%的处理组,其主要组成为变形菌门、厚壁菌门和拟杆菌门,相对丰度分别为54.7%、26%和10.9%,而处理前这3 个门级的相对丰度分别为95.8%、2.3%、1.5%(表1)。各处理组的主要组成为变形菌门,相对丰度最高的为5%的处理组,其变形菌门相对丰度为85.8%,其次为0%、10%、20%和100%处理组,呈现先高后低偏趋缓的趋势。随着变形菌门相对丰度的降低,其他菌门的相对丰度都有不同程度的提高。5%、10%和20%中厚壁菌门的相对丰度低于0%和100%处理组,前三个处理组分别为5.8%、1%和0.6%,后两者的分别为26%和13.1%。拟杆菌门的相对丰度随着茶粕含量的升高呈现出增加的趋势,5%、10%、20%和100%的相对丰度分别为4.70%、12.50%、17.90%、35.00%。疣微菌门相对丰度则呈现出先升后降的趋势,其在20%处理组中相对丰度由17.2%降到100%处理组中的5.4%。酸杆菌门虽然在5%、10%、20%处理组有1.70%、8.10%、9.10%的相对丰度,但是在100%处理组并未检测到。

图5 门层级各处理微生物群落相对丰度Fig. 5 Relative abundance of microbe phylum level in treatments
各处理组微生物科层级OTUs 数量比较如图6所示。从科水平OTUs 数量(图6)来看,随着茶粕含量的增加,科水平的OTUs 数量呈现先升再降的趋势,5%处理OTUs 数为80,10%和20%的OTUs 数分别为231 和227,但到100%处理组则为150。试验场地OTU 数量分别为385,说明即使经过4 周的自然处理,各处理组中的OTU 数量与试验地的背景值仍有差异。各处理组微生物群落多样性比较如图7 所示。由图7 可见,其结果与细菌微生物群落多样性一致。
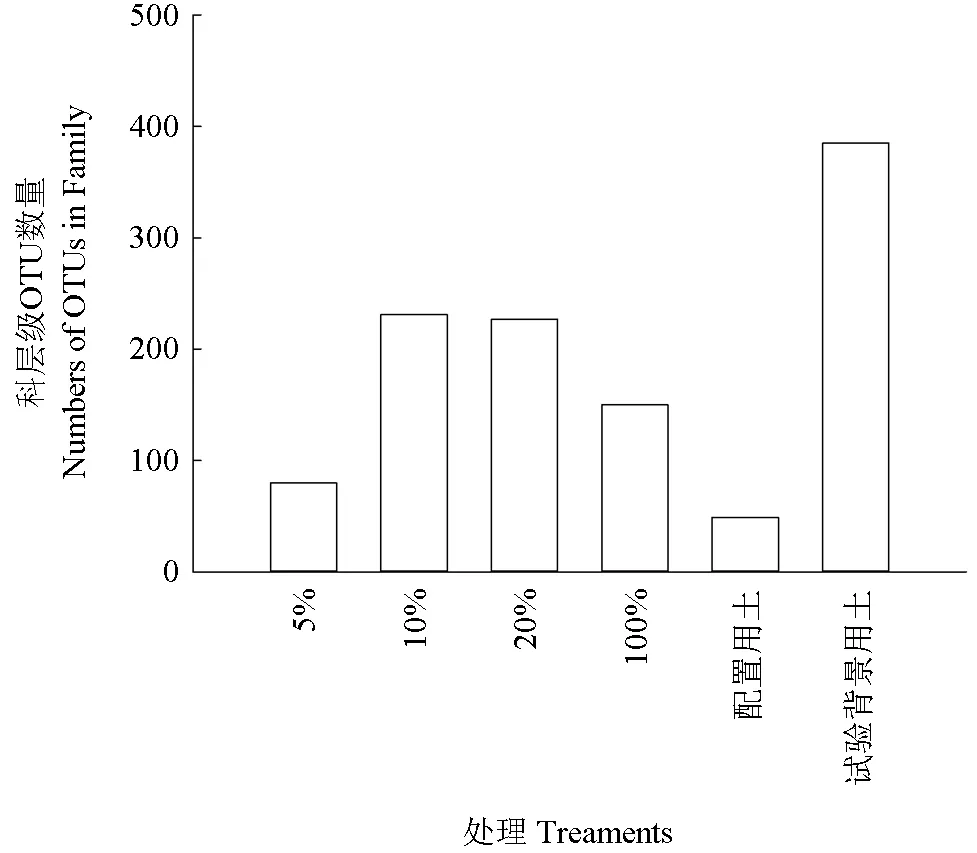
图6 各处理组微生物科层级OTUs 数量比较Fig. 6 Comparison of OTUs in family level of treaments
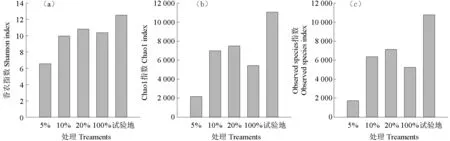
图7 各处理组微生物群落香农指数(a)、Chao1指数(b)和Observedspecies指数(c)比较Fig. 7 Comparison of bacterial community of Shannon index, Chao1 index and Observed species index in treatments
各处理组在共同科层级的细菌相对丰度如表3 所示。从4 个含有茶粕的处理组的细菌微生物科层级结果(表3)可见,在相对丰度大于1%的共有科中,噬几丁质菌科、鞘脂单胞科、黄单胞菌科的相对丰度均较高,在100%茶粕组中,其相对丰度分别为10.96%、8.32%和7.61%。在5%处理组中,鞘脂单胞菌科的相对丰度达到71%。

表3 各处理组在共同科层级的细菌相对丰度Table 3 Relative abundance of common microbe in family level of each treatment
微生物COG 功能预测如表4 所示。从样品中的COG 功能预测(表4)可见,处理间的蛋白功能基本相似,其功能可以分为3 个层次,第一层级为氨基酸的运输和代谢、转录、碳水化合物运输和代谢、细胞壁/膜信号转导机制,各功能占的比例在6%~8%之间。第二层级为能源生产和转换、翻译、核糖体结构与生物发生、无机离子转运与代谢、复制、重组和修复,辅酶运输与代谢,各功能占的比例在4%~6%之间;第三层级:其它,各功能占的比例低于4%。

表4 微生物COG功能预测Table 4 COG function prediction
3 结论与讨论
3.1 结 论
不同比例油茶饼粕在自然发酵过程中有机质含量呈下降趋势,在未有添加油茶饼粕的0%处理组,其C/N 变化波动相对较大,变幅相差29%,并于试验第1 周和第4 周分别达到最低值和最高值。5%、20%和100%处理组的C/N 均于试验第1 周和第2 周达到最高值,随后整体趋降并稳定,于第12 周,整体的C/N 介于24.5 ~38.6 区间。
100%处理组的腐殖酸变化呈现先升后降,时间的拐点出现于第1 周,腐殖酸含量达到最高值的26%,显著高于其他时间段腐殖酸含量,之后腐殖酸含量开始下降,在第4 周时已经下降到14%,到第12 周时已保持相对平稳,腐殖酸含量维持在14%。
茶粕发酵过程中细菌组成主要为变形菌门,茶粕含量5%的处理中,其变形菌门相对丰度达到85.8%。细菌群落组成的多样性与茶粕含量有一定的相关性,在10%和20%处理组的科层级的OTUs 数量为231 和227,而100%则为150。从细菌微生物科水平结果来看,茶粕在试验过程中主要集中在10 个科的细菌微生物组成,并且相对丰度较高的为噬几丁质菌科、鞘脂单胞科、黄单胞菌科。从结果来看,黄心土土壤中添加茶粕10%~20%较为合适,一方面合适的碳氮比有利于微生物生长,另一方面有机质的增加有利于土壤的保水与根系生长。同时,在茶粕含量为20%时的拟杆菌门和酸杆菌门的丰度相对高于10%和5%处理组,总体微生物多样性也较高。
3.2 讨 论
油茶饼粕含有丰富的蛋白质、多酚[21]、多糖。这些成分有利于微生物的生长,但是茶皂素存在会对微生物产生抑制作用。研究表明其对黄曲霉[22]、大肠杆菌、桔青霉、金黄色葡萄球菌、产朊假丝酵母[23]等均呈现抑制作用。前期的研究也显示在含茶皂素下,不利于油茶饼粕的固态发酵[16]。但个别特异的菌种如用黑曲霉、毛霉和117 假丝酵母等,可提高蛋白含量、分解茶粕中的纤维素、半纤维素,以及减少茶皂素及多酚类抗营养物质。在其他原料堆肥过程中,个别的优势细菌其相对丰度也会比较高,比如潘梦等[24]发现猪粪在堆肥过程中微生物的结构组成前位的是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia),与本试验中茶粕在自然发酵过程中变形菌门(Proteobacteria)占的丰富度最高相似。夏金利等[25]在园林废弃物堆肥研究结果表明拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)作为优势菌门存在于整个堆肥过程中,拟杆菌门细菌可以降解木质纤维素[26],放线菌门的相对丰度越高越利于有机物的降解[27]。茶粕在自然发酵过程中,噬几丁质菌科、鞘脂单胞科、黄单胞菌科的相对丰度均处于较高水平,因此,可利用该科属的细菌应用于饼粕类物质的有机肥研究与应用,这也是下一步茶粕有机肥发酵时可针对性地选用该类优势菌群。综合来看,本研究存在一定的局限性,试验可能在其他地方重复时结果会有差异,与试验地土壤微生物群落背景有关,如果试验地选择其他区域或者气候带,不同的微生物群落组成对茶粕产生的影响也会有差异。这是野外试验不确定性造成,而不同发酵材料在环境中富集的某类特异性微生物,可作为茶粕发酵有机把试验的菌种来源并发挥发协同作用,这种逆向思维方式有助于定向发掘茶粕有机发酵的优势种。

