1株鸽毛滴虫的分离鉴定、体外培养和感染动物模型的建立
丁 聪,翟 涛,李 玲,王晓岑,宫鹏涛,张西臣,李建华,李 新 (吉林大学 动物医学学院,吉林 长春 130062)
鸽毛滴虫(Trichomonasgallinae)是一种严重危害鸽养殖业的寄生性原虫,引起鸽消化道出现严重溃疡、黄白色的干酪性坏死病变为主要特征的鸽毛滴虫病,该病又称“鸽癀”[1-2],这种病可以阻塞雏鸽的食道和呼吸道,致使患病雏鸽死于饥饿或窒息[3-4]。鸽毛滴虫主要寄生于禽类的消化道上部,多见于咽部、食管、肝脏等部位,严重者可引起全身感染。SPRIGGS等[5]发现鸽毛滴虫可侵入禽类头部,寄生于脑部和眼部。鸽毛滴虫病呈世界性分布[6-8],对不同品种和年龄段的鸽都具有传染性,其中雏鸽和青年鸽最易感染。JIANG等[9]对山东省5个鸽场和1个鸽屠宰场进行调查,发现鸽毛滴虫感染率为33.8%,青年鸽患病率最高,为35.2%,种鸽患病率为13.6%,雏鸽患病率为4.8%。在北京地区,鸽总患病率为28.30%,雏鸽患病率最高,为33.16%,其次为青年鸽和种鸽,分别为30.05%和20.59%[10]。鸽毛滴虫病的主要传播方式为经口传播。鸽子通过采食带有鸽毛滴虫虫体的饲料、饮水而发生感染。因患鸽的毛滴虫大量聚集在口腔溃疡病灶,导致鸽口腔唾液内含有大量的毛滴虫,故而易感鸽通过和患鸽或带虫鸽子的接吻也会导致感染[11]。除发病鸽以外,无症状的带虫鸽也是重要的传染源[12],导致鸽毛滴虫病在鸽场很难被清除,给鸽养殖业造成严重的经济损失[13]。目前治疗鸽毛滴虫病主要使用甲硝唑等药物,尚无其他有效措施。
鸽毛滴虫鉴定可采用形态学观察和ITS1/5.8S/ITS2基因分析方法。形态学观察主要为咽拭子涂片镜检,当观察到活的鸽毛滴虫虫体时即可确诊。基于ITS1/5.8S/ITS2基因的系统发育分析及限制性内切酶片段长度多态性分析可进一步确定鸽毛滴虫的基因型,可将鸽毛滴虫分为3种基因型:基因型A、基因型B及基因型T.tenax(包括T.tenax-样分离株)[3,14-15]。鸽毛滴虫的体外培养主要通过采集病鸽口咽拭子,培养基可使用RPMI1640培养基、肝浸汤培养基、TYM培养基或Hollander琼脂培养基等。动物感染模型的建立是研究鸽毛滴虫病的关键途径。王飞等[16]、罗峰等[17]和YOUSSEFI等[18]成功建立了鸽毛滴虫感染动物模型。但国内外对鸽毛滴虫病的研究尚不十分系统。因此,有待加强鸽毛滴虫病的研究,以保障鸽养殖业的健康发展。
本研究从感染鸽毛滴虫的落地王鸽分离出鸽毛滴虫,对虫体进行体外纯培养;通过形态学和超微结构观察鉴定虫体;基于ITS1/5.8S/ITS2基因序列分析确定其基因型;以不同剂量虫体经口感染鸽建立鸽毛滴虫感染动物模型。为进一步研究鸽毛滴虫致病机理、免疫机制及药物筛选等提供材料和方法。
1 材料与方法
1.1 试验动物患病落地王鸽和40日龄健康落地王鸽均购自长春市某养鸽场。
1.2 材料瑞氏-吉姆萨染色液和Vero细胞,保存于本实验室;RPMI1640培养基、青链霉素混合液(双抗)、胎牛血清均购自BI公司;DH5α感受态细胞购自天根生化科技(北京)有限公司; pMDTM18-T Vector Cloning Kit、DL2000 DNA Marker、DNA胶回收试剂盒、HaeⅢ限制性内切酶、PrimeSTAR GXL DNA Polymerase等均购自TaKaRa公司;细胞/血液基因组提取试剂盒购自天根生化科技(北京)有限公司;BsiEⅠ限制性内切酶购自赛默飞世尔科技公司;多聚赖氨酸购自Sigma公司。
1.3 鸽毛滴虫的分离鉴定
1.3.1牛肝浸汤培养基的配制 取15 g新鲜牛肝,研磨后放入烧杯。加入100 mL蒸馏水,混匀后放入4℃静置过夜。次日取出蒸煮1 h。用纱布过滤取上清液,后加入0.5 g氯化钠、1 g麦芽糖、0.2 gL-半胱氨酸盐酸盐、2 g蛋白胨直至溶解,再用滤纸过滤。将滤液加蒸馏水定容至100 mL,121℃条件下30 min高温高压灭菌。冷却后置于4℃保存。取4 mL的无菌肝浸汤于无菌试管中,加入60 μL双抗溶液和1 mL灭活的胎牛血清,混匀后置于4℃保存备用。
1.3.2鸽毛滴虫的分离 取患鸽毛滴虫病落地王鸽脑组织于75%乙醇溶液中浸泡5 min,更换75%乙醇溶液后再次浸泡5 min,取中间未被浸泡的部分,在200目细胞筛上研磨至铺好Vero细胞的6孔板中,加入1 mL含2%胎牛血清的RPMI1640培养基,在37℃,5% CO2的条件下培养48 h。取培养上清涂片后镜检鸽毛滴虫。
1.3.3鸽毛滴虫的纯化培养 取上述1 mL培养上清,2 500 ×g离心10 min收集虫体,弃上清,使用PBS清洗2次,取适量PBS重悬沉淀,接种于5 mL牛肝浸汤培养基内进行第1代传代培养,每隔24 h传代1次,直至剩下纯净的鸽毛滴虫。继续培养无菌的鸽毛滴虫至对数生长期,使用DMSO将部分虫体冻存于液氮中。
1.4 鸽毛滴虫形态学观察
1.4.1鸽毛滴虫光学显微镜形态观察 于2 500 ×g离心10 min收集虫体,弃上清,使用PBS清洗2次,取适量PBS重悬沉淀,涂于载玻片上,用酒精灯加热固定,经瑞氏-吉姆萨染色后,按低倍镜→高倍镜的顺序观察涂片。
1.4.2鸽毛滴虫扫描电子显微镜(SEM)形态观察 收集虫体使用多聚赖氨酸进行虫体的固定,染色后在SEM下进行观察。
1.4.3鸽毛滴虫透射电子显微镜(TEM)形态观察 收集虫体缓慢加入1 mL 2.5%的戊二醛固定液,之后进行超薄切片样品制备,染色后于TEM下进行观察。
1.5 鸽毛滴虫基因分型的鉴定
1.5.1引物的设计与合成 引物序列参考ALREFAEI等[7]研究中使用的鸽毛滴虫TFR引物(TFR1:5′-TGCTTCAGTTCAGCGGGTCTTCC-3′,TFR2:5′-CGGTAGGTGAACCTGCCGTTGG-3′),由吉林库美生物公司合成。
1.5.2ITS1/5.8S/ITS2基因的PCR扩增及测序 收集虫体用细胞/血液基因组提取试剂盒提取虫体全基因组DNA。以获得的基因组DNA为模板,扩增ITS1/5.8S/ITS2基因,反应体系(50 μL):5×Buffer 10 μL,dNTP 4 μL,PrimeSTAR GXL Enzymes 1 μL,TFR1 1 μL,TFR2 1 μL,基因组DNA 2 μL,ddH2O 31 μL。PCR扩增程序:98℃ 2 min;98℃ 10 s,60℃ 15 s,68℃ 40 s,共30个循环;68℃延伸5 min,4℃保存。通过1%琼脂糖凝胶电泳检测PCR产物,并用胶回收试剂盒回收目的片段。将扩增后片段连接至pMD-18T载体,转化至E.coliDH5α感受态,均匀涂于含有氨苄抗性的培养皿,37℃培养12 h后,挑取阳性单菌落进行测序。
1.5.3鸽毛滴虫ITS1/5.8S/ITS2基因系统发育进化分析 利用NCBI网站的BLAST工具对测序结果进行比对,获得与其同源性较高的序列,使用MEGA 6.0软件对测序结果及与其同源性较高的序列进行聚类分析,统计方法采用邻接法,系统发生检测采用自举法,置信值为重复抽样1 000次。
1.5.4限制性片段长度多态性分析 分别使用限制性内切酶BsiEⅠ和HaeⅢ对扩增出的ITS1/5.8S/ITS2基因片段进行酶切鉴定,BsiEⅠ可以将基因型为A或B的片段进行切割,HaeⅢ可以将基因型为B的片段进行切割,基因型为T.tenax(包括T.tenax样分离株)的片段不会被BsiEⅠ或HaeⅢ切割[9]。
1.6 鸽毛滴虫感染动物模型的建立将20只40日龄健康落地王鸽分为4组,每组5只,Ⅰ组灌服生理盐水为对照,Ⅱ、Ⅲ、Ⅳ组分别灌服1×105,1×106,1×107个鸽毛滴虫,连续5 d。观察鸽临床症状,1周后采集鸽口咽拭子镜下观察鸽毛滴虫感染情况,同时剖检鸽观察口咽病理变化。
2 结果
2.1 鸽毛滴虫形态学观察
2.1.1鸽毛滴虫培养 经Vero细胞培养24 h后,鸽毛滴虫生长状态良好,部分虫体聚团,呈椭圆形或梨形,运动迅速,活力强,Vero细胞轮廓清晰,胞浆透亮,细胞形态完整(图1A);培养48 h后,鸽毛滴虫生长状态良好,大量虫体聚团,Vero细胞部分裂解,从壁上脱落(图1B)。经牛肝浸汤培养基培养24 h 的鸽毛滴虫生长状态良好(图1C);培养48 h后,鸽毛滴虫大量死亡(图1D)。鸽毛滴虫呈椭圆形或梨形,长8~10 μm,宽4~6 μm。

A.经Vero细胞培养24 h;B.经Vero细胞培养48 h;C.经牛肝浸汤培养基培养24 h;D.经牛肝浸汤培养基培养48 h图1 鸽毛滴虫活体形态学观察(400×)
2.1.2鸽毛滴虫吉姆萨染色后形态学观察 经瑞氏-吉姆萨染色后,虫体被染成蓝紫色,呈椭圆形或不规则形(图2A)。细胞核呈椭圆形,且被染成蓝紫色,位于虫体前端。4根前鞭毛呈紫红色。轴柱颜色浅于原生质,且稍突出于虫体后缘。一侧可清晰观察到波动膜外边缘的轮廓(图2B)。

A.20倍放大虫体形态;B.100倍放大虫体形态(F.鞭毛;B.毛基体;N.细胞核;UM.波动膜;AX.轴柱)图2 鸽毛滴虫吉姆萨染色后形态学观察
2.1.3鸽毛滴虫扫描电镜形态观察 鸽毛滴虫呈圆形、卵圆形或梨形,轮廓清晰,表面有许多孔洞且凹凸不平。虫体前端毛基体处伸出长短不一的4根鞭毛,是虫体的运动器官。在虫体的中央,有一根细长的轴柱以自前向后的方向延伸至虫体游离的后鞭毛之外。虫体一侧有起始于虫体前端终止于虫体侧后方的波动膜(图3A)。
2.1.4鸽毛滴虫透射电镜形态观察 TEM下可见呈椭圆形或卵圆形的细胞核位于虫体的前端中央,细胞核周围的核膜粗糙不齐,细胞质中含有大量的糖原颗粒,在虫体内部还可见到氢化酶体、内质网、高尔基体等细胞器,还有食物泡等结构,虫体周围可以观察到覆盖于外侧的波动膜和游离的鞭毛等结构(图3B)。
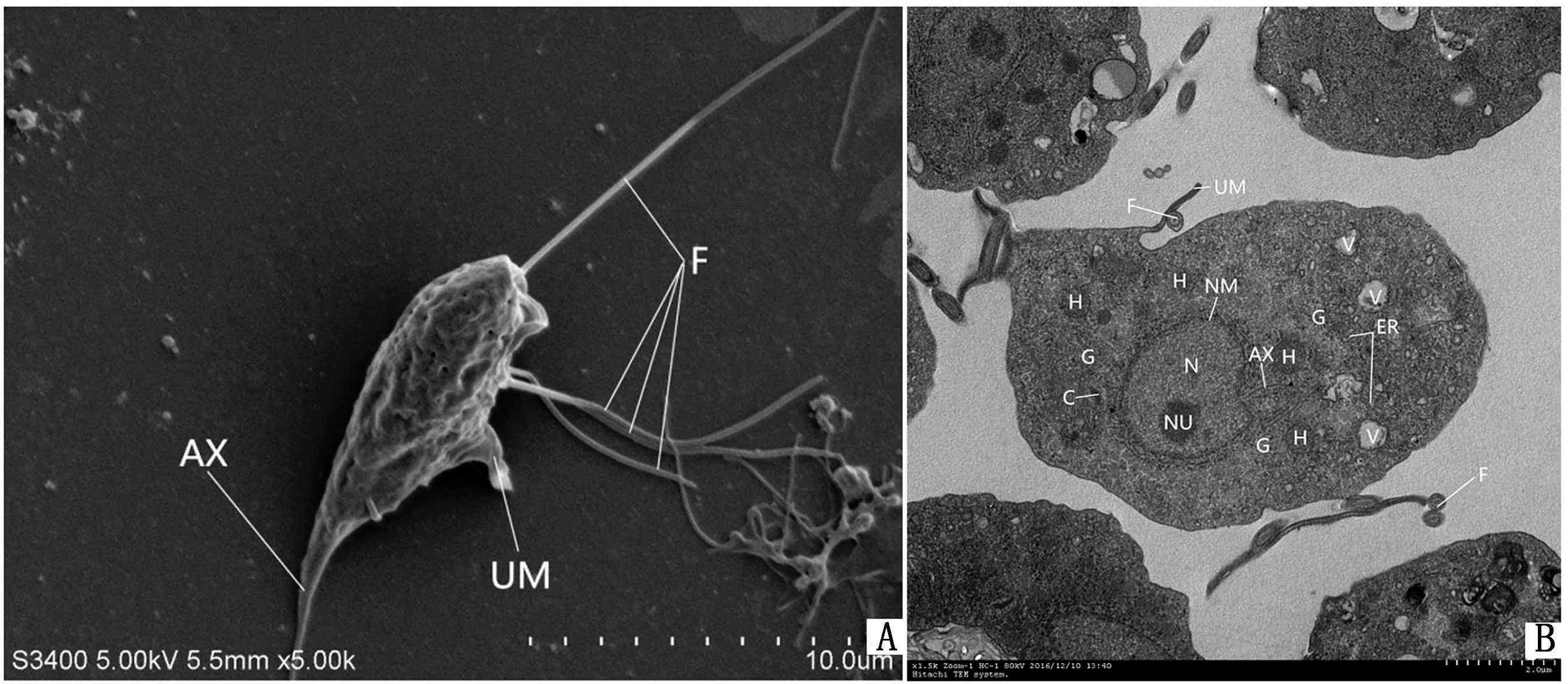
A.鸽毛滴虫扫描电镜形态观察;B.鸽毛滴虫透射电镜形态观察(N.细胞核;NU.核仁;NM.核膜;G.糖原颗粒;ER.内质网;GO.高尔基体;C.中脉;UM.波动膜;AX.轴柱;H.氢化酶体;B.鞭毛基体;F.鞭毛;V.食物泡)图3 鸽毛滴虫电子显微镜下形态观察
2.2 鸽毛滴虫基因分型的鉴定
2.2.1鸽毛滴虫ITS1/5.8S/ITS2基因系统发育进化树的构建 使用引物TFR1和TFR2对鸽毛滴虫ITS1/5.8S/ITS2基因进行PCR扩增,经琼脂糖凝胶电泳分析,可在350 bp左右的位置看见明显条带(图4A)。将扩增得到的ITS1/5.8S/ITS2片段的测序结果与GenBank上登录的基因序列进行BLAST比对,显示其与英国分离株MT632479.1同源性为100%。使用MEGA 6.0软件对ITS1/5.8S/ITS2基因及与其同源性较高的序列进行聚类分析,可以认定所分离得到的毛滴虫即为鸽毛滴虫(图4B)。

A.ITS1/5.8S/ITS2的PCR扩增(M.DL2000 DNA Marker;1.ITS1/5.8S/ITS2基因PCR产物);B.ITS1/5.8S/ITS2基因系统发育进化树图4 鸽毛滴虫ITS1/5.8S/ITS2基因系统发育进化树
2.2.2限制性内切酶片段长度多态性分析 扩增得到的ITS1/5.8S/ITS2序列片段经限制性内切酶BsiEⅠ处理后被切割为大小为234 bp和125 bp的2个片段;经限制性内切酶HaeⅢ处理后未被切割,可以判定该株鸽毛滴虫的基因型为A型(图5)。
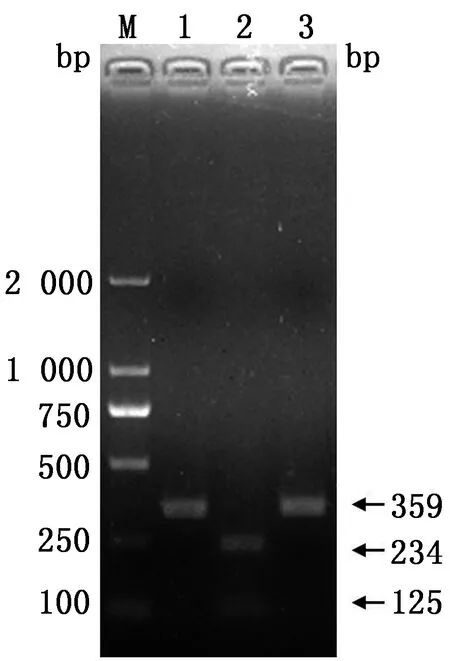
M.DL2000 DNA Marker;1.未酶切;2.BsiEⅠ单酶切;3.HaeⅢ单酶切图5 限制性内切酶片段长度多态性分析
2.3 鸽毛滴虫感染动物模型的建立Ⅰ组落地王鸽灌服生理盐水,为对照组,Ⅱ、Ⅲ、Ⅳ组落地王鸽每天分别灌服1×105,1×106,1×107个毛滴虫,连续5 d。对照组鸽只死亡率为0,无明显临床症状,口咽部剖检均未见病变(图6A),取口咽拭子镜检鸽毛滴虫感染率为0(图6E);攻虫量为1×105个时,鸽只死亡率为0,无明显临床症状,口咽部剖检均未见明显病变(图6B),取口咽拭子镜检显示,鸽毛滴虫感染率为40%(图6F);攻虫量为1×106个时,鸽只死亡率为20%,出现精神萎靡、食欲不振、羽毛松乱、腹泻等症状,口咽部剖检可见黄色粘液或黄白色干酪样物质(图6C),取口咽拭子镜检显示,鸽毛滴虫感染率为80%(图6G);攻虫量为1×107个时,鸽只迅速死亡,死亡率为100%,临床症状加剧,甚至无法站立(图6D),取口咽拭子镜检显示,鸽毛滴虫感染率为80%(图6H)。

A~D.分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ组落地王鸽口咽病理变化;E~H.分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ组落地王鸽口咽拭子镜检图6 鸽毛滴虫感染动物模型的建立
3 讨论
鸽毛滴虫主要寄生于禽类的消化道上部,多见于咽部、食管、肝脏等部位,严重者可引起全身感染,甚至入侵大脑[4]。鸽毛滴虫的体外培养主要通过采集病鸽口咽拭子,接种于含抗生素及血清的培养基中37℃恒温培养。培养基可使用RPMI1640培养基、肝浸汤培养基、TYM培养基或Hollander琼脂培养基,培养24~48 h后收集虫体,经光学及电子显微镜对虫体进行形态学观察,确认是否为鸽毛滴虫。杨秀环等[19]、陈海华等[20]和陆雨楠等[21]经光学显微镜观察可见鸽毛滴虫呈圆形、卵圆形、梨形或纺锤形,有折光性,运动活泼;经扫描显微镜观察可见鸽毛滴虫多呈卵圆形或梨形,少数呈球形,虫体表面分布皱褶;长5~9 μm,宽2~9 μm,具有4根前鞭毛,1根延伸至虫体的后缘以外的轴柱,波动膜起始于虫体的前端,终止在虫体后端的稍前方。MEHLHORN等[22]经透射电子显微镜观察可见鸽毛滴虫细胞质中含有大量的糖原颗粒及氢化酶体;在虫体内部可见内质网、高尔基体等细胞器,还有食物泡等。虫体周围可以观察到覆盖于外侧的波动膜和游离的鞭毛等。本研究成功从落地王鸽脑组织中分离出鸽毛滴虫,并使用Vero细胞及牛肝浸汤培养基对鸽毛滴虫进行体外纯培养。该株鸽毛滴虫形态与前人研究结果一致。
目前鉴定鸽毛滴虫的基因型主要依赖ITS1/5.8S/ITS2 基因的系统发育分析及限制性内切酶片段多态性分析,可将鸽毛滴虫分为3种基因型:基因型A、基因型B及基因型T.tenax(包括T.tenax样分离株)[3,14-15]。已报道虫体基因型与致病性相关[9],A型鸽毛滴虫的致病性相比于B型更强,其感染的家鸽更易出现严重的口腔病变。FENG等[10]对北京地区和JIANG等[9]对山东地区的鸽毛滴虫分别进行ITS1/5.8S/ITS2基因分析,均检出A型和B型鸽毛滴虫。ELKHATAM等[23]对埃及米努菲亚地区的鸽毛滴虫进行分析,确定其基因型为A型。西欧和南欧的野生鸽群中均检出A型及B型鸽毛滴虫[24]。西班牙东部鸽群中流行的A型鸽毛滴虫占76.1%,B型鸽毛滴虫占20.5%,混合感染占3.4%[25]。本研究通过对分离的鸽毛滴虫进行基于ITS1/5.8S/ITS2基因系统发育分析及限制性内切酶片段长度多态性分析,确定其基因型为A型,与英国分离株MT632479.1序列一致[26]。为研究长春地区鸽毛滴虫病的流行情况、虫株致病性和基因型的相关性提供了依据。
鸽毛滴虫病的发生发展是鸽毛滴虫和免疫系统相互作用的病理过程,动物感染模型的建立是研究鸽毛滴虫致病性和防治技术的关键途径。王飞等[16]使用25~30日龄肉鸽灌服1×106个毛滴虫,连续5 d,鸽只剖检可见口腔和咽喉黏膜出现白色干酪样沉着物,死亡率为0,发病率为80%。罗峰等[17]使用120日龄健康鸽口腔接种1×107个鸽毛滴虫,连续观察15 d,鸽只感染率为100%,死亡率为18.75%。YOUSSEFI等[18]使用6周龄健康鸽口腔接种4×104个鸽毛滴虫,连续观察7 d,鸽只感染率为100%,死亡率为0。肉鸽对鸽毛滴虫感染的抵抗力会随着年龄增长而增强[9],故肉鸽日龄的选择十分关键。25日龄肉鸽虽易感鸽毛滴虫,但需母鸽喂食鸽乳及饲料,在实验室条件下不易存活;120日龄的肉鸽对鸽毛滴虫感染的抵抗力较强,在实际生产中多为隐性感染。40日龄肉鸽已脱离母鸽,独立进食,可在实验室条件下稳定饲养,且40日龄肉鸽仍属于实际生产中鸽毛滴虫病发病率较高的群体[10]。故本研究选用40日龄健康肉鸽(落地王鸽),每日口腔接种1×106个强致病性的鸽毛滴虫,连续5 d,在攻虫后采集鸽只口咽拭子镜检、剖检观察感染鸽只口咽病理变化,成功建立了鸽毛滴虫感染动物模型。
综上,本研究成功分离鉴定了1株基因A型鸽毛滴虫,成功进行体外培养并建立感染鸽模型,为研究鸽毛滴虫免疫机制及药物筛选等提供了技术支撑。

