载药微球的理化特性及其在肝癌介入治疗中的应用进展
龚元川, 邵国良
肝癌的载药微球化疗栓塞治疗(drug-eluting beads transhepatic arterial chemoembolization,DEB-TACE)是目前临床研究的一个热点, 与常规TACE 不同之处在于采用了一种新型栓塞材料, 即能够载药的微球(drug-eluting beads),它通过离子交换或吸附等多种机制装载抗肿瘤药物, 既栓塞靶血管又能够局部缓慢释放药物, 对肿瘤病灶发挥双重杀伤 作 用[1]。
目前临床常用的载药微球主要有DC/LC Beads 微球、HepaSpheres 微球、CalliSpheres 微球以及Tandem微球等。 本文就上述载药微球的主要理化特性及其在肝癌治疗中的应用做一综述。
1 载药微球的种类及理化特性
1.1 DC Bead 微球
DC Bead 微球是由PVA 水凝胶相互交联所构成的微球, 交联物上有阴离子磺酸盐基团修饰物,能够通过离子交换机制将多柔比星、阿霉素、伊立替康等带正电荷的药物负载到微球上。DC Bead 微球有粒径100~300 μm、300~500 μm 和500~700 μm 等3 种尺寸。 微球粒径大小对最大载药量没有显著影响, 但与药物释放速度相关。 粒径越小的DC Bead微球负载及释放药物的速度越快,原因可能在于小粒径微球表面积更大,暴露在阿霉素溶液中的面积更多, 单位时间内与药物结合的概率就越大。 理论上DC Bead 微球最大阿霉素载药量可达到45 mg/mL,但载药量超过37.5 mg/mL 时,药物吸附到微球上的时间将显著增加[2],因此临床上推荐阿霉素的载药量为25~37.5 mg/mL。 在载药过程中,DC Bead 微球的粒径会随着载药量的增加而减小。
Guiu 等[3]研究显示,DC Bead(100~300 μm)微球能够在15 min 内加载至少99%的伊达比星,24 min 的药物洗脱率为75%。同样,de Baere 等[4]研究表明,100~300 μm 的DC Bead 在10 min 内可负载95%阿霉素,而洗脱75%阿霉素所用时间为139 min,14 d 后仍可在血浆中检测到阿霉素,微球在负载及释放药物过程中均保持其完整的球形状态。
目前, 市场上已有可视化的LC Bead LUMI 微球[5],由磺酸盐修饰的聚乙烯醇水凝胶微球组成,在微球结构中以共价结合碘实现X 线可视化。 临床报道显示其具有良好的性能和较高的治疗肝癌的有效率[6]。
1.2 HepaSphere 微球
HepaSphere 微球是由聚乙烯醇和丙烯酸盐的共聚物所构成的具有高吸水性聚合物微球。目前临床应用的粒径主要有30~60 μm、50~100 μm、100~200 μm、150~200 μm,平时以冻干粉形式储存,吸收溶液后可以膨胀到预期的大小,在人血清中体积膨胀至原来的4 倍左右,膨胀后具有良好的变形能力,可通过微导管进入肿瘤供血动脉远端[7]。 相比DC Beads 微球粒径随着载药量增加而减小,在栓塞肿瘤微小供血动脉方面HepaSphere 微球可能并不优于DC Beads 微球。 HepaSphere 微球具有带负电荷的丙烯酸酯基团, 能够与带正电荷的化疗药物,如:奥沙利铂、顺铂、多柔比星等形成离子键。 与只有表面结合化疗药物的DC Beads 微球不同,HepaSphere 微球的表面及整个内部都能与阿霉素结合。 Lee 等[8]在一项对兔VX2 肿瘤模型的研究中发现,HepaSphere 微球在2 h 内能够负载82%~94%的阿霉素,6 h 的药物释放量为6%, 第3 天时肿瘤内阿霉素浓度达到峰值,在7 d 的研究期内,阿霉素始终保持在可测量的水平。
HepaSphere 微球除了能够载阿霉素、 表柔比星等小分子化疗药物,也显示了对大分子药物负载及释放的良好特性。 Oselkin 等[9]进行了一项评估HepaSphere 微球对贝伐珠单抗的加载及释放特性的研究, 用200 mg 的贝伐珠单抗配制一小瓶HepaSphere 溶液, 用酶联免疫法测定药物浓度,结果显示在大约90 min 时,微球加载了最大贝伐珠单抗负载量的59%, 体外释放试验显示1 h 释放量为52%,16 h 为68%。 这项研究的结果表明,HepaSphere微球不仅仅限于加载小分子药物,其加载生物制剂的能力可开辟更多的肿瘤治疗新方法。
1.3 CalliSpheres 微球
CalliSpheres 微球(CSM)为我国首个自主研发的载药微球,是以聚乙烯醇为主链的大分子交联聚合物微球,有100~300 μm、300~500 μm、500~700 μm、700~900 μm 和900~1 200 μm 等5 种粒径规格,尚有50~150 μm 及70~150 μm 的微球处于实验研究阶段,可以负载阿霉素、伊立替康、顺铂等带正电荷的药物。CSM 具有良好的生物相容性,顺应性、悬浮性,不可生物降解,能永久地滞留在肿瘤血管局部, 在加载药物后粒径可收缩40%~50%[10],可通过微导管及细小血管以精准栓塞远端肿瘤血管。
Chen 等[10]将不同浓度的阿霉素加载到3 种不同规格(50~150 μm、100~300 μm 及300~500 μm)的CSM 进行研究,结果显示CSM 的大小、阿霉素的剂量和浓度都会影响载药效率: ①微球粒径越小,载药量越大,50~150 μm、100~300 μm 的CSM 在不同药物浓度下30 min 内达到最大载药负荷,不同药物剂量下20 min 内可达最大载药负荷,而300~500 μm 的CSM 所需时间就较长。 分析其原因可能是药物与微球之间离子相互作用,较大微球的相比表面积减小。 ②药物剂量越小,CSM 的载药效率越高,不同规格的微球对20 mg 的阿霉素均达到99%以上的载药量,而对于40、80 及100 mg 的阿霉素,50~150 μm 及100~300 μm 的CSM 载药量>80%,300~500 μm 的CSM 载药量仅70%左右。 ③阿霉素在CSM 中的释放速度较快,在3 种规格的微球中阿霉素均在约8 h 时达到平台期, 最大释放率分别为39.2%、31.3%、31.7%。
Shi 等[11]将新一代小分子血管内皮生长因子受体-2 酪氨酸激酶抑制剂阿帕替尼负载到CSM 上,探讨其用于栓塞兔VX2 肝肿瘤的药动学特征及体内肿瘤反应。 结果显示:①30 min 即可达到最大载药量,20 mg 组的阿帕替尼平均达到70.7%的载药量,24 h 内释放47.2%;②能够提高肿瘤局部的阿帕替尼浓度,并显著降低外周血血药浓度;③TACE 治疗可显著抑制肿瘤血管生成,减缓肿瘤生长,明显延长实验兔的生存期。 该实验研究过程中还发现阿帕替尼载药量与剂量并不呈正相关,与Han 等[12]研究结果相似,这可能与CSM 微球表面带负电荷的磺酸盐基团不足以负载足够多的药物表面正电荷基团有关。
1.4 Tandem 微球
Tandem 微球是有带负电荷的水凝胶核心和生物相容的全氟聚合物涂层组成,可以装载蒽环类药物和其他化疗药物,如阿霉素、伊立替康等。 与其他药物洗脱微球不同的是,其直径可精确校准为(40±10) μm、(75±15) μm 和(100±25) μm,载药后粒径大小保持不变[13]。
Tanaka 等[13]的研究结果表明,用Tandem 微球行TACE 术后180 min, 伊立替康的平均血药浓度达到峰值,药物浓度在72 h 内保持在治疗水平以上。
在水环境治理与修复技术方面,引进了河流“水华”控制、大型渠道清污、深水疏浚、污泥处理、水面垃圾清除、微菌生物污水处理等技术和仪器38项;创新转化技术和产品67项,开发了清污辅助决策系统,改进了深水和水面清污设备,取得专利22项,成果在广东、江苏、天津、上海等地进行成功运用;不仅促进了对污染源的控制能力,提高了水环境机械治理水平,而且提升了水环境生物修复能力,为从根本上治理我国水环境污染,建设环境友好型社会提供了技术支撑。
1.5 季铵盐阳离子改性聚乙烯醇水凝胶微球
Heaysman 等[14]制备了含有阳离子季(3-丙烯酰胺丙基)三甲基氯化铵(APTA)的微球。 实验证明该微球可以通过带正电的季铵基团相互作用,有效负载及释放阴离子模型染料。 在药物负载实验中,当模型药物的电荷密度增加时,微球的最大结合能力降低,微球闭合释放系统中达到的平衡浓度和洗脱总量都会降低。 释放实验中,单价染料的洗脱速度最快,与阳离子聚合物的相互作用相对较弱,当从电荷密度增加的微球中释放时, 洗脱速率并不降低;当使用具有多结合位点的染料时,与聚合物的相互作用增强,从而减缓了释放,并降低了从具有较高电荷密度的微球中洗脱的速率。 模型药物释放研究表明,这些系统也许可以设计成带正电荷的微球负载阴离子药物,用于恶性肿瘤的局部治疗。 但目前仍处于实验研究阶段。
2 载药微球的临床应用
2.1 操作方法
与cTACE 操作技术及治疗方案的个性化特点相比,DEB-TACE 技术更具有统一性。
载药微球的非靶区异位栓塞可能引起严重的并发症,如胆汁瘤、肝脓肿、肝功能不全和肝梗死等,甚至可能因为胃十二指肠动脉、脾动脉等反流引起多器官缺血[15]。 因此需要选择合适的微导管对肿瘤供血动脉进行超选择插管,将载药微球精准递送至肿瘤部位。 如果存在明显的动静脉瘘,可在注射载药微球前用明胶海绵栓塞分流血管;应尽量避开其他脏器的供血动脉,如胆囊动脉、胃十二指肠动脉等,必要时可使用弹簧圈行保护性栓塞。
DEB-TACE 操作过程中须缓慢注射微球以尽量避免反流,2012 年发表的DEB-TACE 欧洲操作指南推荐注射速度为1 mL/min[16],2018 年发表的中国台湾地区DEB-TACE 操作专家共识主张根据靶血管内的流量决定注射速率[17]。 在临床实际操作中,对于直径较大的富血供肿瘤,初始注射速率可根据血流情况加快(2~3 mL/min),血流量减缓后减慢注射速率。
DEB-TACE 治疗有两个栓塞终点。 ①完全栓塞:肿瘤供血动脉血流完全停滞(DSA 下显示肿瘤染色消失);②近似完全栓塞:肿瘤供血动脉血流明显减缓或接近停滞(对比剂在2~5 个心动周期廓清)。 目前临床医师对于完全栓塞和近似完全栓塞终点的选择多根据具体情况确定,如果微导管能超选择性插入到肿瘤滋养动脉则尽量选择完全栓塞, 不能达到完全超选择或者完全栓塞存在较高的异位栓塞风险的患者, 则选择近似完全栓塞作为终点。
2.2 微球粒径的选择
大多数研究显示小粒径的微球显示更好的治疗效果。Grumme 等[18]研究显示,小粒径微球表现出更高的肿瘤反应率,与微球的种类无关。文献报道,CalliSphere 微球100~300 μm 比300~500 μm 的临床近远期疗效更好,100~300 μm DC Beads 比300~500 μm 的肿瘤反应更强[19-21]。 小粒径微球的疗效更好的原因主要在于:①一项兔VX2 肝肿瘤模型的研究证实,小粒径微球能够在远端血管沉积,特别是小于100 μm的微球能达到更远端的血管,远端沉积能够促进更加局部的化疗,导致更大范围的肿瘤坏死,有效降低非靶区的栓塞风险[22];②微球粒径越小,表面积更大,载药量更大,导致化疗药物在肿瘤内释放越多;③较小的微球能较深地穿透肿瘤内的血管床, 可能会减少缺氧缺血性新血管生成,而缺氧缺血新生血管是肿瘤复发的主要原因[23]。
目前关于微球粒径的选择尚无统一标准,临床常选择的是100~300 μm。 但在选择微球尺寸时应当考虑患者个体及肿瘤病灶的差异,临床主要依据肿瘤大小、血供、是否存在动静脉瘘及操作者经验等进行选择。对于乏血供肿瘤病灶,推荐选择70~150 μm的微球;5~7 cm 富血供肿瘤病灶,选择100~300 μm的微球;>7 cm 富血供肿瘤病灶, 选择300~500 μm的微球。 对于富血供巨块型肝癌可选择>500 μm的微球,但大粒径微球不能进入远端血管,近端栓塞可能引起缺血以及影响后续继续行TACE 治疗的效果,在临床中使用较少。
2.3 临床疗效
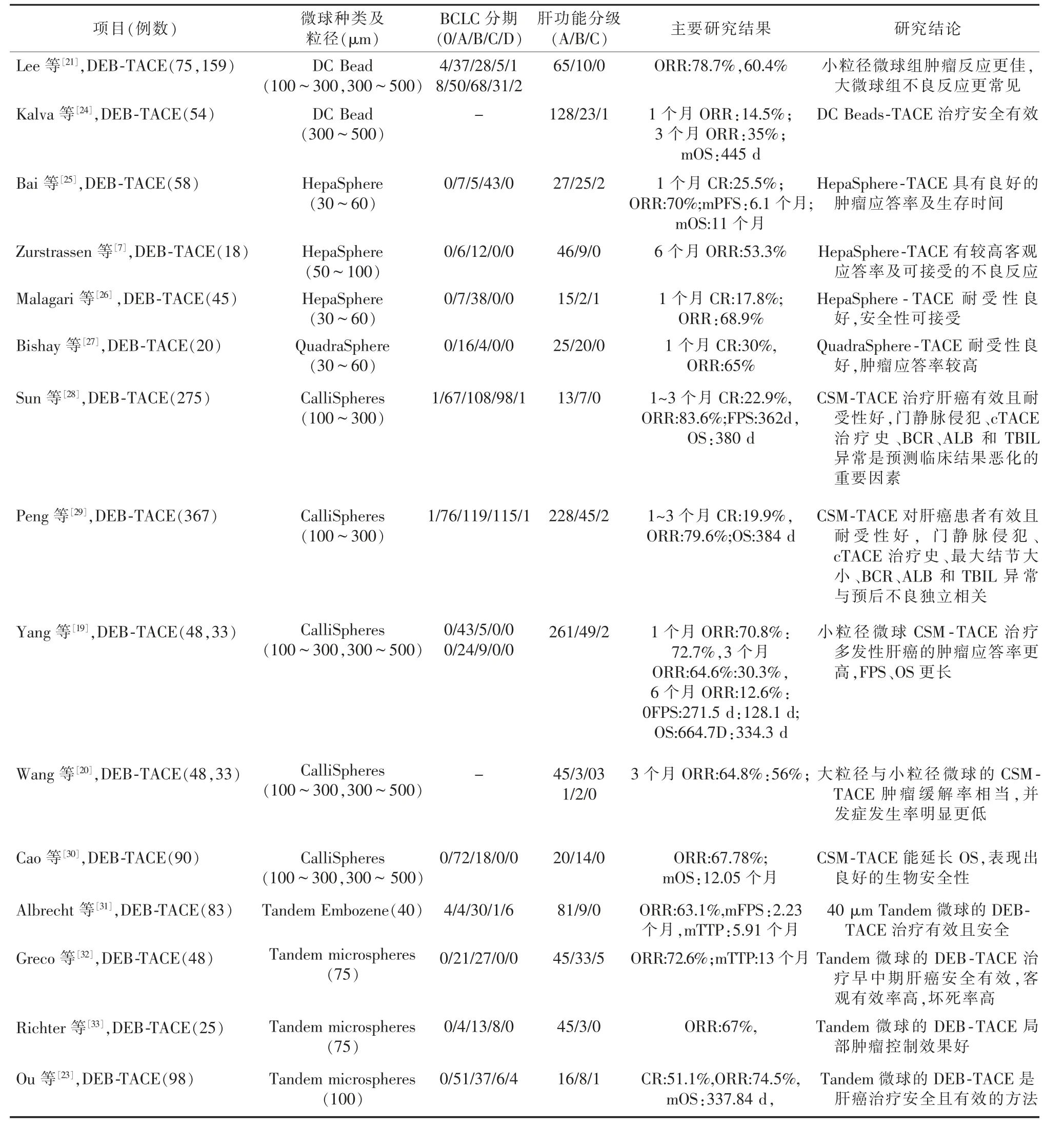
表1 近期关于DEB-TACE 治疗肝癌的临床研究
在Sun 等[28]开展的一项前瞻性多中心单臂临床研究中, 使用CalliSpheres 微球对278 例Child-Pugh A 期HCC 患者行TACE 治疗(以下简称CSMTACE),结果显示,术后1~3 个月的客观缓解率为83.6%,平均PFS 为362 d,平均OS 为380 d,该研究的术后的完全缓解率和客观缓解率与另一项CSM-TACE 治疗肝癌的前瞻性多中心单臂临床研究[29]报道的结果相似,两项大样本的临床研究都证明了CSM-TACE 在肝癌患者中是有效的,耐受性良好, 两个研究团队都认为门静脉侵犯、cTACE 治疗史以及异常的血肌酐、白蛋白、总胆红素水平是预测不良临床预后的重要因素。
综合上述研究,采用DEB-TACE 治疗中晚期肝癌是一种安全、有效的方法,但DEB-TACE 临床疗效, 是否优于cTACE 仍存在争议。 理论上DEBTACE 的疗效要优于cTACE, 并得到多数临床研究结果的支持,但也有些研究得出不同的结果。
Shi 等[34]比 较 了DEB-TACE 和cTACE 的 临 床疗效结果显示,接受DEB-TACE 治疗的患者肿瘤客观缓解率(76.1%比40.4%)、无进展生存期(12 个月比7 个月)、总生存期(21 个月比14 个月)均显著高于cTACE 组,DEB-TACE 是改善PFS 和OS 的唯一独立预后因素。 而另一项研究回顾性分析了接受cTACE(n=33)或DEB-TACE(n=56)治疗的89 例浸润性肝癌患者, 结果显示DEB-TACE 组患者的DCR 更高,耐受性更好,特别是对于存在动-门静脉分流及巨块型肝癌患者, 但并未显示出更高的生 存 率[35]。
在一项国际性、多中心、前瞻性、随机、单盲、Ⅱ期研究中[36],102 例HCC 患者接受DEB(DC Beads)-TACE,110 例接受cTACE, 结果显示,DEB-TACE术后6 个月后客观缓解率(52%)与cTACE 组(44%)差异无统计学意义,接受DEB-TACE 治疗的患者术后肝脏毒性及阿霉素相关不良反应显著降低;分析原因认为是做统计学假设时低估了cTACE 的ORR(预设为35%)而使得入组患者数量不够。 另外,其亚组分析结果显示, 在更具进展性的肿瘤中,DC Beads 组的ORR 和DCR 显著优于cTACE 组。 一项对比DEB-TACE 与cTACE 治疗肝癌临床疗效的真实世界研究[37]显示,与cTACE 相比,DEB-TACE 的耐受性更好,但两种治疗方法的总体存活率没有差异。 对6 项随机对照临床研究(共660 例患者)进行的meta 分析比较了DEB-TACE 与cTACE 的疗效,结果显示两种治疗方法的肿瘤反应率与并发症差异无统计学意义。
但是DEB-TACE 一直被证明具有优越的药代动力学特性和较低的全身化疗相关毒性,与cTACE相比更具有易耐受性。 根据现有的证据提示DEBTACE 可能是治疗大肝癌、 浸润性肝癌及乏血供肝癌患者的更好选择。
2.4 并发症
DEB-TACE 尽管是一种安全有效的介入治疗方法,但也有一定的并发症发生率。 其常见的并发症包括肝功能衰竭、肝脓肿、胆汁瘤、胆管损伤、肺栓塞等,但发生率较低。
在Liang 等[38]开展的一项多中心回顾性研究中,DEB-TACE 组术后患者的疼痛发生率、疼痛分级以及治疗后5~7 d 发热发生率均明显高于cTACE组。分析其原因可能在于CSM-TACE 组的肿瘤体积较大,在治疗过程中予以了更为积极的治疗,肿瘤坏死程度更重,引起了更加严重的栓塞后综合征。在一项多中心单臂临床研究中, 除栓塞后综合征发生率为67.6%外, 有19.7%患者在影像学上表现出明显的胆道损伤,其中4 例(3.3%)有症状,分析其原因可能是由于肿瘤供血动脉完全栓塞时微球的淤积所致[39]。 两项使用100~300 μm 及300~500 μm 的CalliSpheres 微球行DEB-TACE 治疗肝癌的临床研究报道显示,100~300 μm CSM 栓塞组术后栓塞综合征发生率较300~500 μm CSM 组高,严重不良事件发生率也明显高于300~500 μm CSM组,其中包括缺血性肝炎8 例,胆汁瘤2 例,严重肝脓肿2 例[19-20]。
DEB-TACE 引起缺血性肝炎、肝脓肿及胆管损伤主要与局部缺血性损伤相关[40],其原因主要在于: ①肝内胆管供血动脉主要来自肝动脉分支,载药微球的远端栓塞损伤胆道血管丛,导致胆管系统缺血性坏死,并可能引起肠道内菌群进入坏死区域从而引发肝脓肿;②小粒径微球更容易深入穿透正常的残余肝实质,从而在肝脏和胆管系统中引起不可逆转的缺血[20];③肿瘤周围门脉血供内带来的肠道细菌侵入肿瘤坏死区域内,使肝脓肿形成的风险进一步加大[41]。
3 载药微球存在的不足
3.1 载药微球的局限性
由于载药微球大多通过离子交换或吸附作用,只能负载正电荷药物, 限制了化疗药物的选择。Heaysman 等制备了一种带阳离子基团的微球,在阴离子药物模型负载及释放试验中表现出良好特性,但目前还没有进行载药及释药特性研究。
3.2 载药微球的不可降解性
目前临床上常用的载药微球(如HepaSpheres,DC Beads,CalliSpheres 等)均为非降解型微球,异位栓塞时容易造成非靶器官的永久性栓塞和损害。 对此,已有学者研究可生物降解的载药微球,如采用淀粉、 海藻酸钠及壳聚糖作为载体的载药微球,体外试验及动物试验已经证明生物可降解微球具有良好的载药、释药特性及生物相容性,因其是暂时性栓塞, 具有减少栓塞后综合征的潜在优势。Orlacchio 等[42]使 用 可 降 解 淀 粉 微 球 行TACE 治 疗不可切除性肝癌,结果表明可生物降解微球能用于肝癌介入治疗,并取得良好的疗效,但仍需要大量临床研究来证明其临床疗效及安全性。
3.3 载药微球的不可视化
除DC Bead LUMI 微球以外, 载药微球存在自身无法显影的缺点,在体内无法跟踪和定位,无法准确判断微球在血管中的分布情况和栓塞部位,术后无法确认栓塞微球的确切位置。 同时,迄今为止,所有的载药微球均不具备多模态显像的能力,制约了诸多影像设备(如MR、CT、超声等)对其的精准导引、监控和疗效评价。
4 展望
目前已有学者研究多模态显像的载药微球。Shi等[43]构建了一种负载钆剂多功能金纳米颗粒,可实现多模态显影(CT/MRI/SERS),并通过动物实验验证了在动物体内良好的显影特性及生物相容性。 另外通过对金纳米颗粒表面进行介孔有机氧化硅修饰可使其具备负载化疗药物的能力[44]。未来有望构建出一种能够实现多模态成像的载药微球。 此外,加载生物大分子物质的载药微球也是目前研究的热点。Oselkin 等[9]通过试验证明了HepaSpheres 微球负载及释放贝伐珠单抗的良好特性,Shi 等[11]使用负载阿帕替尼的CalliSpheres 微球进行兔肝肿瘤动脉栓塞实验,未来将会涌现出更多加载靶向药物的微球用于HCC 的局部治疗。 同时,临床上仍需要开展更多、更大规模的高质量的对比研究,发挥载药微球在肝癌治疗中的作用。

