COX抑制剂对压力超负荷性心肌肥厚大鼠心室重构的作用
孙浩荣 魏明慧 范晓梅 薛明明
心肌肥厚是指心肌细胞应对增强的心脏后负荷而产生的适应性反应,早期这种代偿性反应有利于维持心脏功能,但长期持续的高负荷状态最终会引起心室重构、心功能失代偿而发生心力衰竭甚至心源性猝死[1,2]。因此,预防和改善心肌肥厚的发生、发展具有重要意义。
环氧化酶(COX)有两种异构体COX-1和COX-2,阿司匹林是COX-1和COX-2抑制剂,塞来昔布是COX-2抑制剂。心肌肥厚过程中伴有炎性反应发生,炎性反应会趋化大量炎性细胞因子[3]。阿司匹林有抗炎疗效并能影响心室重构,塞来昔布通过抑制COX-2阻止炎性前列腺素类物质的产生,达到抗炎、镇痛及退热作用[4,5]。这两种药物目前未被纳入治疗高血压心肌肥厚临床用药指南,且治疗机制不明。本实验将通过腹主动脉缩窄法构建心肌肥厚大鼠模型来探讨COX抑制剂对压力超负荷性心肌肥厚大鼠心室重构的潜在治疗作用及机制,为临床扩大药物治疗方案提供依据。
材料与方法
1.药品与试剂:阿司匹林肠溶片购自辰欣药业股份有限公司;塞来昔布胶囊购自辉瑞公司进口分包装;大鼠TNF-α、IL-10 ELISA 检测试剂盒购自泉州市睿信生物科技有限公司;苏木精-伊红、Masson 三色染色试剂盒购自福州迈新生物技术有限公司;免疫组化试剂盒购自北京博奥森有限公司。
2.实验对象及分组:雄性SPF级SD大鼠,体质量200±20g,购自长沙市天勤生物技术有限公司,在内蒙古医科大学实验动物中心饲养,生产许可证号:SCXK(湘)2014-0011。将大鼠随机分为正常对照组、模型组、模型+阿司匹林组、模型+塞来昔布组。
3.动物模型的制备及灌胃处理:正常对照组不作任何处理,其余3组按照Anderson法[6]制造压力超负荷性心肌肥厚大鼠模型,操作步骤如下:称体质量,用2%戊巴比妥钠溶液1.0ml/400g(50mg/kg)腹腔注射麻醉大鼠,麻醉时长为1.5h左右,固定,备皮,消毒,分层开腹,先剪开皮肤,在剪开肌肉层尽量避免剪到小血管,用手术器械夹住皮肤和肌肉以便获取良好视野,预先准备好用盐水浸泡的棉球,塞入腹腔内部,目的是让腹主动脉更凸显出来便于操作,在右侧肾动脉上方游离腹主动脉,沿腹主动脉长轴置直径为0.7mm的针头,用无菌4号手术线结扎腹主动脉及针头,抽出针头,此时腹主动脉残留0.7mm的残腔。检查腹腔内干净无遗留物后,肌肉层缝合后喷淋硫酸庆大霉素溶液,皮肤缝合后喷淋硫酸庆大霉素溶液,在大鼠后肢根部用碘伏消毒,肌内注射青霉素钠10万单位,围上纱布保温,肌内注射在每天同一时间连续注射5天。术后次日起,正常对照组和模型组以0.9%氯化钠溶液安慰剂2ml/(100g·d)灌胃,阿司匹林组以阿司匹林溶液10mg/(100g·d)灌胃,塞来昔布组以塞来昔布溶液 1.8mg/(100g·d)灌胃,4组大鼠按连续灌胃时间分为第8、10、12、14周。在构建模型及治疗中,大鼠因术中出血、术后感染及肠梗阻等死亡,死亡率在30%左右,最终造模成功并取材的大鼠为每个时间点每组8只。
4.实验方法:(1)左心室质量指数测定:取出大鼠心脏后,用预冷的0.9%氯化钠溶液清洗心腔,滤纸吸干水分,剔除左心室,称重后计算左心室质量指数。(2)心肌组织病理学评价:4%多聚甲醛固定左心室组织,梯度乙醇脱水,石蜡包埋,切片4μm。行HE染色,显微镜下观察,计算心肌细胞直径。Masson染色计算胶原沉积百分比。(3)ELISA 检测血浆炎性细胞因子:腹主动脉采集血液离心,取上清液至 EP 管,-80℃保存,ELISA 检测血浆炎性细胞因子 TNF-α、IL-10 的含量。(4)免疫组织化学检测:取出心脏标本行免疫组化染色,一抗为大鼠Rabbit anti-Notch1 antibody (北京博奥森有限公司,bs-1335R)、Rabbit anti-HEY2 antibody (北京博奥森有限公司,bs-9461R),二抗为北京博奥森有限公司的二抗试剂盒。

结 果
1.左心室质量指数:第8、10、12及14周模型组内左心室质量指数时间依从性增大,正常对照组、塞来昔布组、阿司匹林组组内比较,差异无统计学意义。组间比较:在第8周时,模型组与正常对照组比较增大,差异有统计学意义(P<0.05),模型组与塞来昔布组、阿司匹林组比较,差异无统计学意义;在第10周时,可能由于个体差异,各组间比较差异无统计学意义;在第12、14周时,模型组与正常对照组比较,显著性增加(P分别为<0.05、<0.01),第12周时模型组与塞来昔布组、阿司匹林组比较,差异有统计学意义(P分别为<0.05、<0.01);第14周时的阿司匹林与模型组比较,差异有统计学意义(P<0.05),而塞来昔布组与模型组比较,差异无统计学意义。在4个时间点中,阿司匹林组与塞来昔布组左心室质量指数比较,差异无统计学意义(图1)。
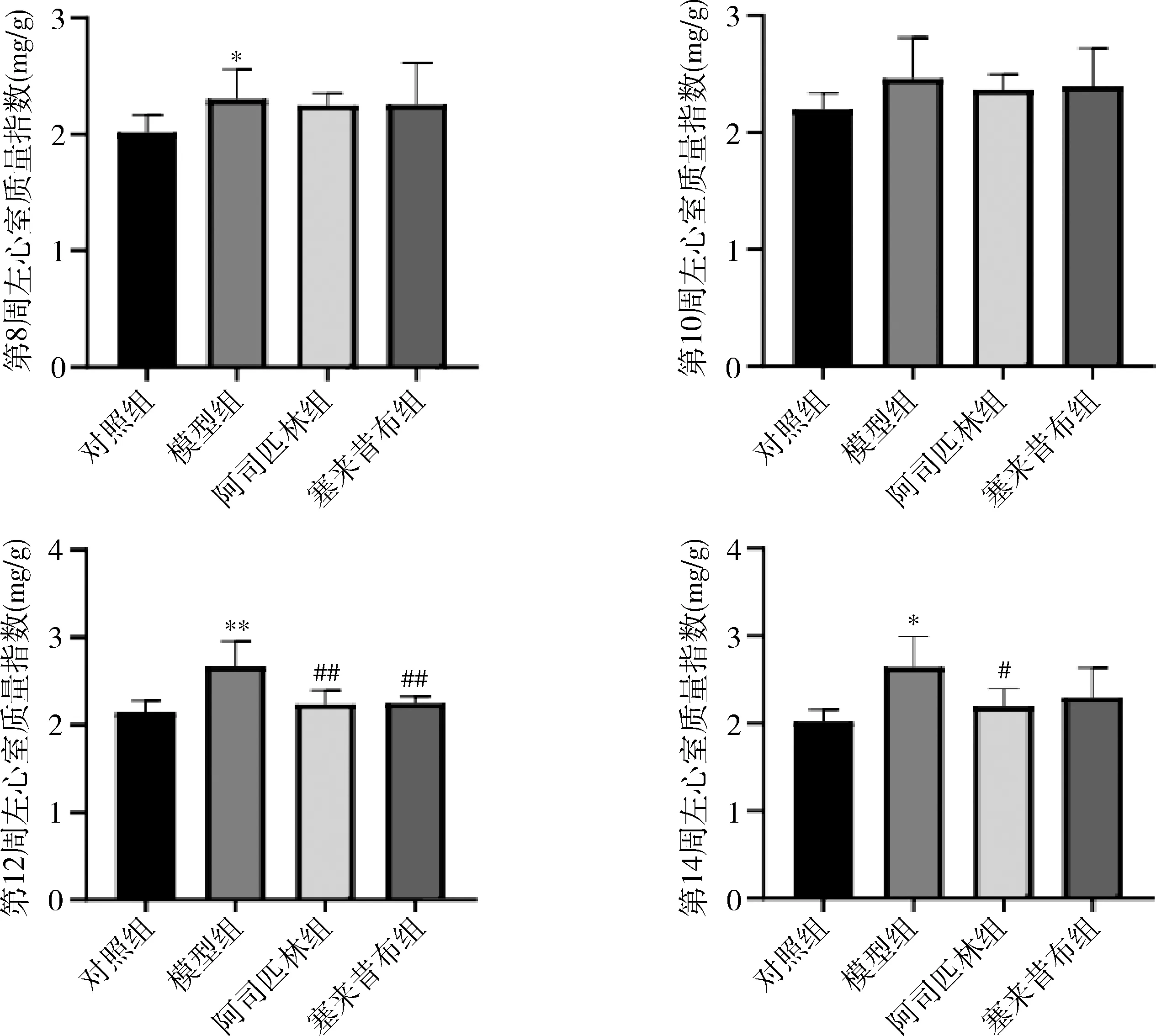
图1 各组大鼠左心室质量指数与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
2.HE染色:光镜下观察,正常对照组大鼠心肌细胞排列致密有序,间隙较小,细胞大小均匀,胞核大小均一。模型组心肌细胞排列紊乱,细胞间隙增大,心肌细胞出现明显肥大,细胞核形态不规则。阿司匹林组、塞来昔布组较模型组心肌细胞肥大有所缓解,间质细胞核明显减少(图2)。心肌细胞短轴直径的测量结果,第8、10、12、14周4个时间点的模型组细胞短直径增加明显与正常对照组比较,差异有统计学意义(P分别为<0.05、<0.01),阿司匹林组、塞来昔布组与模型组比较,细胞短直径降低明显,差异有统计学意义(P分别为<0.05、<0.01),阿司匹林组与塞来昔布组比较细胞短轴直径差异无统计学意义,但随着时间延长,加药处理后的两组细胞短轴直径时间依从性减小,阿司匹林组减小更明显(表1)。
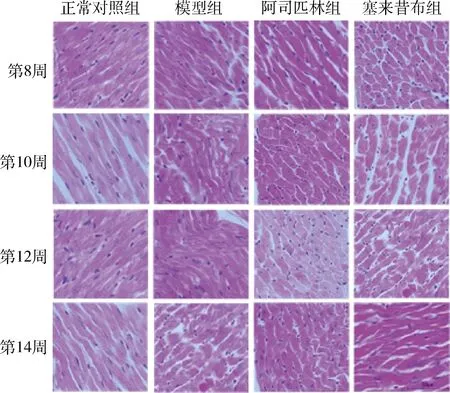
图2 各组大鼠 HE 染色心肌组织光镜下病理形态的改变(×400)
3.Masson染色:各个时间点,正常对照组的视野内淡蓝色区域较小,胶原纤维在间质内呈细丝状。随着时间点的延长,模型组心肌纤维化的状态越来越严重,视野中淡蓝色区域面积越来越大,呈片状。阿司匹林组、塞来昔布组中胶原纤维稍有增生但不及模型组明显,增生位置主要在血管周围(图3)。计算胶原组织所占百分比,含冠状动脉小血管视野胶原容积百分比(CVF-T)和无冠状动脉小血管视野胶原容积百分比(CVF-NV)。测量视野中模型组CVF-T、CVF-NV随着时间逐渐增大,与正常对照组比较,差异有统计学意义(P分别为<0.05、<0.01);阿司匹林组与模型组比较,胶原容积百分比显著减小(P分别为<0.05、<0.01),塞来昔布组CVF-T和CVF-NV测量分别在第10周和第12周开始下降,与模型组比较,胶原容积百分比减小差异有统计学意义(P分别为<0.05、<0.01)。塞来昔布组和阿司匹林组第8周CVF-T比较,差异有统计学意义(P<0.05,表2、表3)。
表1 各组大鼠心肌细胞短轴直径的比较
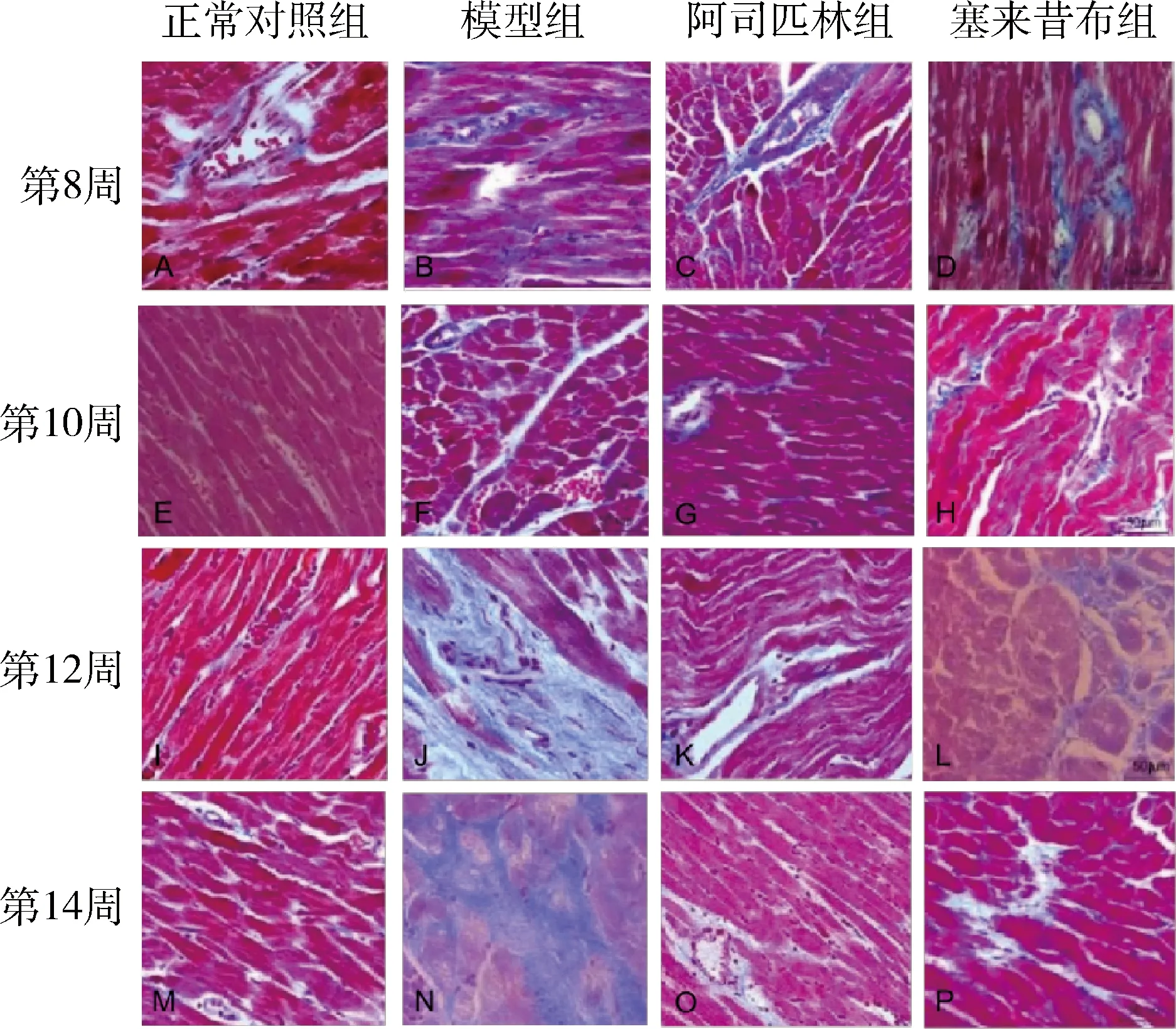
图3 各组大鼠Masson染色心肌组织光镜下病理形态的改变(×400)
4.阿司匹林、塞来昔布对心肌肥厚大鼠血浆炎性细胞因子的影响:各个时间点正常对照组血浆TNF-α、IL-10浓度基本维持不变;模型组中的TNF-α、IL-10与正常对照组比较浓度增高,差异有统计学意义(P分别为<0.05、<0.01)。阿司匹林组、塞来昔布组的TNF-α、IL-10与模型组比较浓度降低,差异有统计学意义(P分别为<0.05、<0.01)。对于TNF-α,在第8周时,塞来昔布组显著高于阿司匹林组(P<0.05);对于IL-10,塞来昔布组在第8周、第10周时显著高于阿司匹林组(P<0.01),随后两组炎性细胞因子TNF-α、IL-10含量降至相近(表4、表5)。
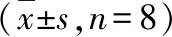
表2 各组大鼠胶原纤维CVF-T测量比较
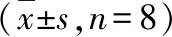
表3 各组大鼠胶原纤维CVF-NV测量比较
5.免疫组化染色结果:(1)Notch1蛋白:Notch1蛋白以棕黄色颗粒的出现为阳性表达。组间Notch1蛋白含量比较,各个时间点模型组与正常对照组比较表达增高,差异有统计学意义(P分别为<0.05、<0.01);阿司匹林组在第8、12、14周与模型组比较表达量降低,差异有统计学意义(P分别为<0.05、<0.01),塞来昔布组在14周时与模型组比较,表达量降低,差异有统计学意义(P<0.01)。对于加药处理的两组,在第8周和第12周时塞来昔布组蛋白表达量高于阿司匹林组,差异有统计学意义(P分别为<0.05、<0.01),随时间延长,阿司匹林组先上升,在第10周达顶峰后下降,塞来昔布则上升至第12周后开始下降,在第14周时差异无统计学意义(图4、表6)。(2)Hey2蛋白:Hey2蛋白以棕黄色颗粒的出现为阳性表达。在第8、10、12、14周,模型组与正常对照组Hey2蛋白量增高,且差异有统计学意义(P<0.01);阿司匹林组与模型组比较,差异有统计学意义(P<0.01)。塞来昔布组在第12、14周时与模型组比较,表达量降低,差异有统计学意义(P<0.01)。随时间延长,阿司匹林在第10周时蛋白含量达峰值后开始下降,塞来昔布则在第12周后开始下降,塞来昔布组与阿司匹林组比较,二者差异有统计学意义(P<0.01,图5、表7)。
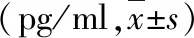
表4 各组大鼠血浆中炎性细胞因子TNF-α的比较
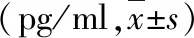
表5 各组大鼠血浆中炎性细胞因子IL-10的比较
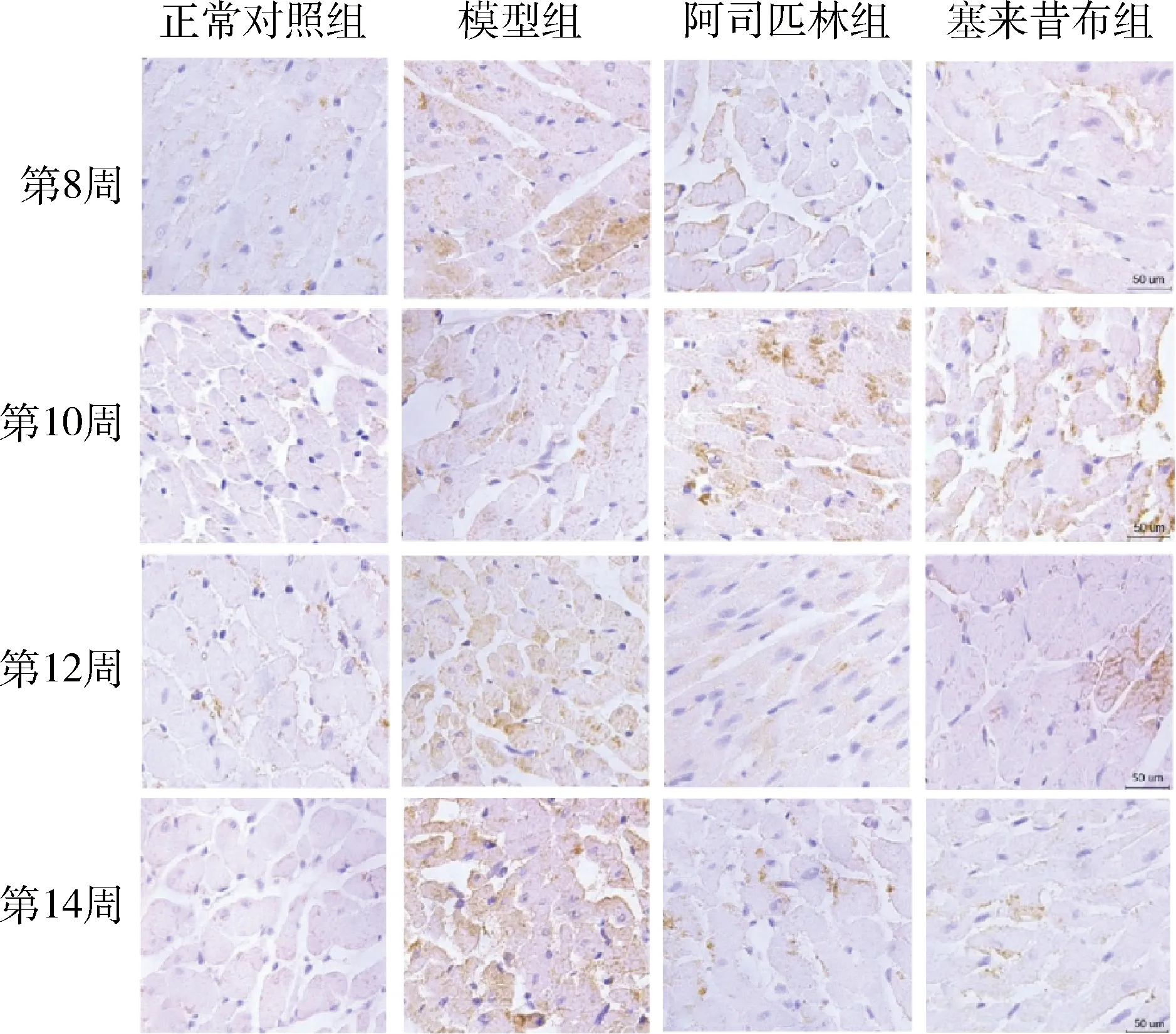
图4 各组大鼠Notch1蛋白免疫组化染色图(×400)
表6 各组大鼠心肌细胞Notch1蛋白平均IOD值表达情况
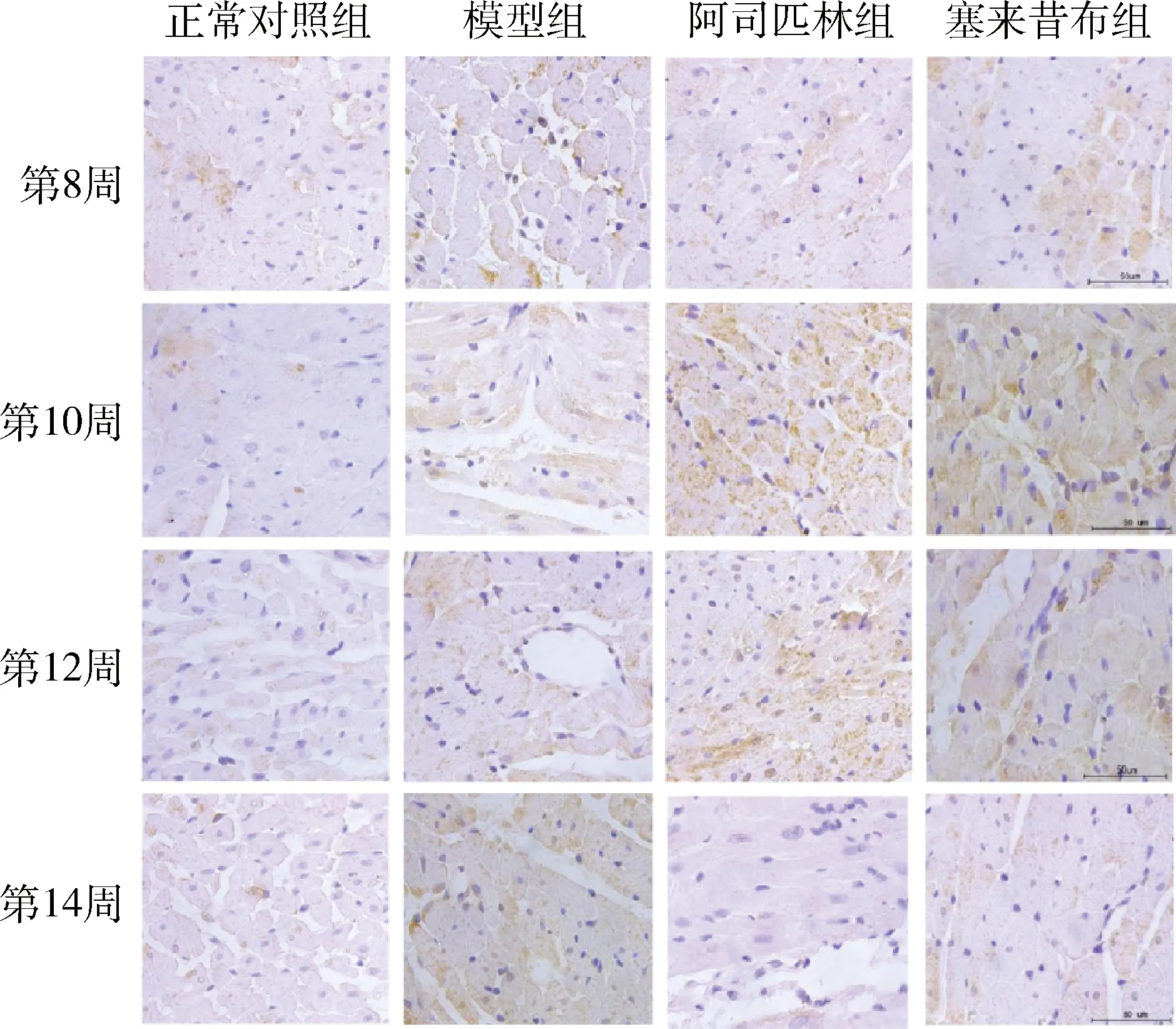
图5 各组大鼠Hey2蛋白免疫组化染色图(×400)
讨 论
心肌肥厚的发生伴有炎性反应,在心室重构过程中,炎症信号分子增加,各种炎性细胞在损伤部位浸润,促进炎性细胞因子释放[7]。炎性细胞因子调控网络极其复杂,促炎性细胞因子和抗炎性细胞因子的相对平衡,有助于控制炎症,从而维持稳态[8]。TNF-α是常见的促炎性细胞因子,其浓度上调与心室重构存在明显的相关性[9]。IL-10是抗炎性细胞因子,在下调炎性反应中发挥关键作用[10]。本研究中模型组血浆炎性细胞因子TNF-α、IL-10浓度随着心肌肥厚的进程逐渐增加,说明模型组中促炎性细胞因子水平的增高将伴随抗炎性细胞因子水平的升高,可能促进心肌肥厚的发生、发展。
Notch信号通路是体内重要的信号转导途径之一,参与多种心血管疾病的发生、发展,主要由Notch受体、Notch配体,通路相关蛋白及其下游靶蛋白Hes1、Hey2等组成[11]。Notch家族的4个受体中,Notch1主要在心脏中表达,对损伤的心肌发挥保护作用[12]。Notch1信号通路的缺失,会加剧心肌肥厚[13]。由于Notch1失调会导致室间隔异常、瓣膜畸变以及心肌细胞肥大和细胞凋亡加剧[14]。在心脏中Notch信号通路下游基因Hey2在心室表达,有研究表明如果将Hey2敲除则导致明显的心脏畸形[15]。本研究中模型组Notch1及Hey2的蛋白表达水平随着心肌肥厚的进程逐渐增加,Notch信号通路可能通过负调节心脏基因表达来限制心肌细胞肥大的程度,这说明Notch在心脏发育中具有重要功能,心肌损伤后其激活表明该通路在心脏修复中发挥作用,以此达到保护心肌受损的目的,这与Croquelois等[13]的研究结论相同。
表7 各组大鼠心肌细胞Hey2蛋白平均IOD值表达情况
阿司匹林、塞来昔布均是COX-2的抑制剂,研究表明,COX-2参与了心室重构、心力衰竭的发生和发展,与TNF-α共同促进炎性反应的发生[16,17]。炎性反应的发生与Notch1信号通路也相关,据文献报道TNF-α通过NF-κB炎症信号通路与Notch信号通路发生串扰。此外在心室重构过程中炎性细胞浸润,例如巨噬细胞,在巨噬细胞分化过程中,Notch1导致大量M1型巨噬细胞分化,促使炎性细胞因子释放,引发炎性反应[18]。阿司匹林、塞来昔布是非甾体类抗炎药,长期服用阿司匹林对心脏有保护和抗氧化的作用,长期使用塞来昔布可减轻心肌肥厚和纤维化的形成[19,20]。本研究中,经两药物处理可降低心肌细胞肥大、减轻心肌纤维化程度,血浆TNF-α、IL-10浓度下降显著,表明此两种药物可降低心肌肥厚大鼠体内炎性细胞因子的产生,达到保护心肌的疗效。加药处理后,两组Notch1和Hey2蛋白表达量随时间推移整体先升高后下降,与模型组比较差异有统计学意义,表明阿司匹林、塞来昔布可降低Notch1信号通路的活性,这提示环氧化酶抑制剂可能通过减少Notch1信号通路激活,进而降低体内炎性反应,从而达到保护心肌的作用。
通过塞来昔布组与阿司匹林组比较,早期塞来昔布组TNF-α、IL-10含量显著高于阿司匹林组,后期塞来昔布和阿司匹林对降低体内炎性细胞因子的作用比较,差异无统计学意义。在检测Notch1和Hey2蛋白时,阿司匹林组在第10周达顶峰然后开始下降,而塞来昔布组第12周含量达顶峰之后开始下降,到第14周时,两组间Notch1蛋白表达量差异无统计学意义。由此可见,阿司匹林及塞来昔布对压力超负荷性心肌肥厚治疗有一定显著效果,但阿司匹林对于超负荷心肌肥厚的治疗作用更加显著,而塞来昔布作用的时间较长,发挥作用较阿司匹林迟缓,在长时间的药物治疗下,可以达到相同的治疗效果。
综上所述,环氧化酶抑制剂对压力超负荷性心肌肥厚大鼠有一定的治疗作用,且阿司匹林发挥作用较快,其机制可能与降低Notch1信号通路的活性,缓解炎性反应有关。Notch1信号转导在心脏疾病及炎性反应中的潜在影响是广泛的,这也提示Notch1信号通路可作为预防和治疗心肌肥厚潜在的新靶点,为临床的治疗提供新的研究方向。

