饲粮中棕榈酸与油酸的比例对泌乳早期奶牛瘤胃发酵参数与菌群组成的影响
户林其 沈宜钊 李 妍 王美美 张海博, 郭 刚 申跃宇 李建国,4* 高艳霞,4* 李素霞 王 颖
(1.河北农业大学动物科技学院,保定 071001;2.河北农业大学动物医学院,保定 071001;3.北京首农畜牧发展有限公司,北京 100076;4.河北省牛羊胚胎技术创新中心,保定 071001;5.承德市畜牧工作站,承德 067000)
泌乳早期奶牛由于采食高峰期滞后于产奶高峰期,采食的能量不能满足奶牛(尤其是高产奶牛)的能量需要,易出现能量负平衡[1],造成奶牛产奶量下降、体重减轻和代谢疾病多发。在奶牛饲粮中添加脂肪酸来提高饲粮的能量水平是缓解奶牛泌乳早期能量负平衡的有效方法[2]。棕榈酸(palmitic acid,PA)和油酸(oleic acid,OA)是构成奶牛乳脂[3]和脂肪组织[4]的重要脂肪酸。前人研究表明,饲粮中PA与OA的比例对机体能量分配具有一定的影响,PA能提高产奶的能量分配,而OA能提高体脂的能量分配[5-6]。De Souza等[7]对围产后期奶牛的研究发现,饲粮中适宜的PA与OA比例可增加产奶量和乳脂率,并在后期追踪期间对奶牛产奶量和乳脂产量具有正向效应。因此,围产后期饲粮中适宜的PA和OA比例可能既能保证奶牛高产,又能降低体脂动员,缓解奶牛能量负平衡。瘤胃发酵和微生物菌群结构是影响奶牛生产性能的重要因素[8-9]。目前关于饲粮中添加不同比例的PA和OA的研究主要集中在对奶牛生产性能、乳成分、能量分配和营养物质消化率等的影响方面,对泌乳早期奶牛瘤胃发酵和菌群组成变化的研究相对较少。Zhang等[10]研究表明,与对照组相比,添加PA后,瘤胃液中乙酸摩尔比例降低,丙酸摩尔比例增加,氨态氮(ammonia nitrogen,NH3-N)浓度降低,但差异不显著,瘤胃液中溶纤维丁酸弧菌和嗜淀粉瘤胃杆菌数量均增加,但总原生动物数量减少。De Carvalho等[11]观察到,添加棕榈油可提高瘤胃液中乙酸和丙酸浓度,降低乙丙比,但并不影响瘤胃液中黄藻酸杆菌和琥珀酸杆菌的相对丰度。Maczulak等[12]研究表明,OA和PA可降低瘤胃液中栖瘤胃普雷沃氏菌和溶纤维丁酸弧菌的数量,OA的抑制效果高于PA。Adeyemi等[13]研究表明,随饲粮中PA比例下降,OA比例增加,瘤胃总VFA浓度、乙酸和丁酸摩尔比例以及乙丙比线性降低,丙酸摩尔比例有线性增加的趋势。通过上述前人研究发现,奶牛饲粮中添加PA和OA能够改变瘤胃发酵模式,并影响瘤胃菌群结构,但不同的研究所得结果并不一致。鉴于此,本试验重点研究饲粮中PA与OA的比例对泌乳早期奶牛瘤胃发酵参数和菌群组成的影响,以期为优化奶牛饲粮中脂肪酸组成提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为3种不同脂肪粉添加剂,购自天津市某公司,其中脂肪粉1含90.61%的PA、8.20%的硬脂酸以及1.19%的其他物质,脂肪粉2含70.79%的PA、5.33%的硬脂酸、18.22%的OA以及5.66%的其他物质,脂肪粉3含51.0%的PA、4.0%的硬脂酸、35.0%的OA以及10.0%的其他物质。将3种脂肪粉以不同比例混合以实现不同的棕榈酸和油酸比例。
1.2 试验设计
采用单因素试验设计,选取胎次[(2.39±0.20)胎]、体重[(668.3±20.1)kg]、体况评分(3.29±0.06)、产奶量[(47.9±1.6)kg]和泌乳天数[(63.5±2.6)d]接近的健康泌乳早期的经产荷斯坦奶牛72头,随机分为3组,每组24头。根据NRC(2001)配制3种等能等氮的试验饲粮,其组成及营养水平见表1。通过调整3种脂肪粉比例使3种试验饲粮所含脂肪粉中PA与OA的比例分别为90.9∶9.1(A组)、79.5∶20.5(B组)、72.7∶27.3(C组)。本试验于2021年5月14日至2021年6月17日在河南省新乡市首农畜牧河南分公司牛场进行。试验期35 d,其中预试期7 d,正试期28 d。

表1 试验饲粮组成及营养水平(干物质基础)
1.3 饲养管理
试验奶牛圈舍配置有运动场、卧床、风扇、喷淋和水槽,每日饲喂2次(07:00和15:00)和挤奶3次(06:30、14:30和22:30),自由饮水。每日对圈舍和运动场消毒,保持卧床干燥和卫生。
1.4 样品采集与测定
1.4.1 瘤胃液的采集
在正试期的第28天,从A组和B组中每组随机选择11头奶牛,C组中随机选择12头奶牛,于晨饲2 h后口腔采集瘤胃液。采集的瘤胃液分为5份,1份用于测定瘤胃液pH,1份转移到10 mL离心管,立刻冻存于液氮中,然后于-80 ℃冻存,用于瘤胃菌群组成分析,3份经4层无菌纱布过滤后,分装于10 mL离心管,用于测定瘤胃液NH3-N、微生物蛋白(microbial protein,MCP)和挥发性脂肪酸(volatile fatty acid,VFA)浓度。
1.4.2 样品测定
根据AOAC(2005)[14]测定饲粮中的干物质(930.15)、粗蛋白质(996.11)、粗脂肪(920.39)、酸性洗涤纤维(973.18)、钙(968.08)和磷(946.06)含量,根据Van Soest等[15]的方法测定饲粮中中性洗涤纤维含量。瘤胃液pH使用Denver UB-7型pH计测定。瘤胃液NH3-N浓度参照Weatherburn[16]的比色法测定。瘤胃液MCP浓度参照Makkar等[17]的方法测定。瘤胃液VFA浓度参考Erwin等[18]的方法测定,计算总挥发性脂肪酸(TVFA)浓度和各VFA的摩尔比例。
1.4.3 瘤胃菌群测定
1.4.3.1 瘤胃液微生物总DNA的提取和PCR扩增
采用CTAB方法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,根据细菌16S rDNA以稀释后的基因组DNA为模板,使用细菌V4区域引物进行PCR扩增。
1.4.3.2 PCR产物的混样和纯化
PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测,对检测合格的PCR产物进行磁珠纯化,采用酶标定量,根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物。
1.4.3.3 文库构建和上机测序
使用Illumina公司的建库试剂盒TruSeq®DNA PCR-Free Sample Preparation Kit进行文库构建,构建好的文库经过Qubit和PCR定量,文库合格后,使用NovaSeq 6000进行上机测序。
1.4.3.4 数据分析
对下机样本数据进行质量控制,舍弃低质量序列后获得有效数据,默认以97%的一致性将序列聚类成为操作分类单元(OTUs)。对OTUs序列进行物种注释,对各样本的数据进行均一化处理,后续的α多样性分析和β多样性分析都是基于均一化处理后的数据。使用Qiime软件(Version 1.9.1)计算Chao1、Shannon、Simpson、ACE指数和Unifrac距离,使用R软件(Version 2.15.3)绘制稀释曲线、Venn图和主坐标分析(PCoA)图。
1.5 统计分析
试验数据用SAS 9.4统计软件的MIXED程序进行分析,试验处理为固定效应,奶牛为随机效应,用Tukey法进行多重比较检验。试验结果以最小二乘均数和最小二乘均数的标准误表示。采用contrast语句对OA比例的线性和二次效应进行分析。基于Unweighted Unifrac距离,使用mothur(2009)软件中的AMOVA函数进行组间差异分析。以P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 饲粮中PA与OA的比例对奶牛瘤胃发酵参数的影响
由表2可知,不同处理对瘤胃液pH、NH3-N和MCP浓度、乙酸和丙酸摩尔比例以及乙丙比未产生显著影响(P>0.05)。随饲粮中OA比例的增加,瘤胃液TVFA浓度有线性升高的趋势(P=0.09),丁酸摩尔比例则线性降低(P<0.01),且C组丁酸摩尔比例显著低于A组(P<0.05)。

表2 饲粮中PA与OA的比例对奶牛瘤胃发酵参数的影响
2.2 凝胶电泳分析
由PCR扩增样品的琼脂糖凝胶电泳定量结果(图1)可知,对34个瘤胃液细菌的16S rDNA的V4区进行PCR扩增,产物目的条带清晰、浓度合适,质量满足建库要求,可进行后续建库。

M1:100 bp DNA ladder;CK:以纯水作为空白;1~34:34个样品,1~11为A组的11个样本,12~22为B组的11个样本,23~34为C组的12个样本。
2.3 饲粮中PA与OA的比例对奶牛瘤胃菌群α多样性的影响
由图2可知,随测序深度的增加,各组样本的物种数均趋向平稳,且各组样本平均覆盖率分别为99.0%、99.1%和99.3%,表明测序量达到饱和,瘤胃液中大部分物种已被检测到,这表明该样本量能够反映瘤胃菌群结构。
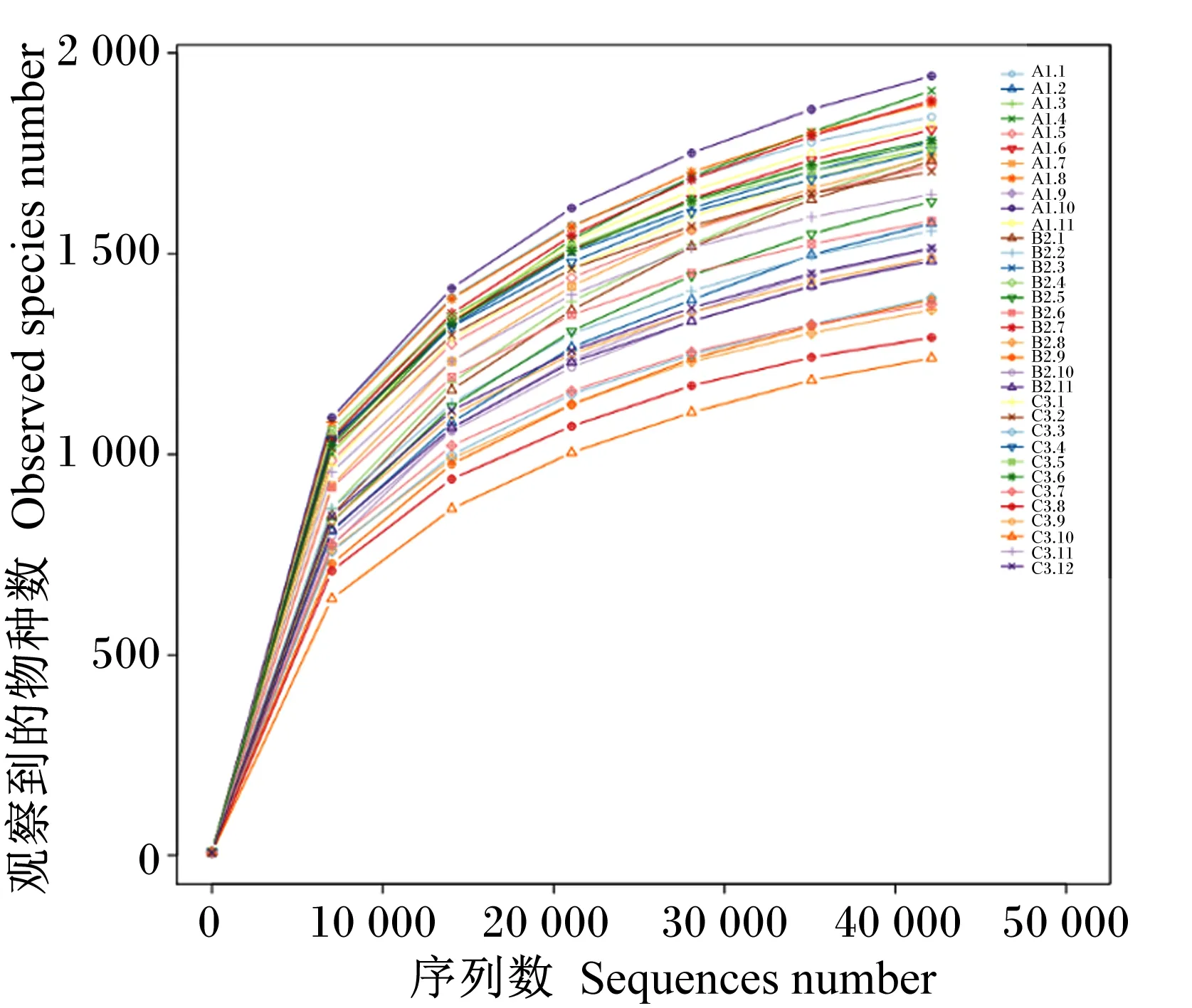
A1.1~A1.11为A组的11个样本,B1.1~B1.11为B组的11个样本,C1.1~C1.12为C组的12个样本。图5同。
由图3可知,A组、B组和C组OTUs数分别为3 333、3 472和3 360个。3个组共有的OTUs数为2 449个,A组、B组和C组独有的OTUs数分别为420、404、388个,分别占各自OTUs总数的12.60%、11.64%和11.55%。A组与B组、A组与C组共有的OTUs数分别为280和184个,B组与C组共有的OTUs数为339个。

A:A组 group A;B:B组 group B;C:C组 group C。下图同 the same as below。
如表3所示,试验各组的Shannon和Simpson指数差异不显著(P>0.05),而随OA比例的增加,Chao1和ACE指数均线性降低(P<0.01),且B组和C组Chao1指数和ACE指数均显著低于A组(P<0.05)。
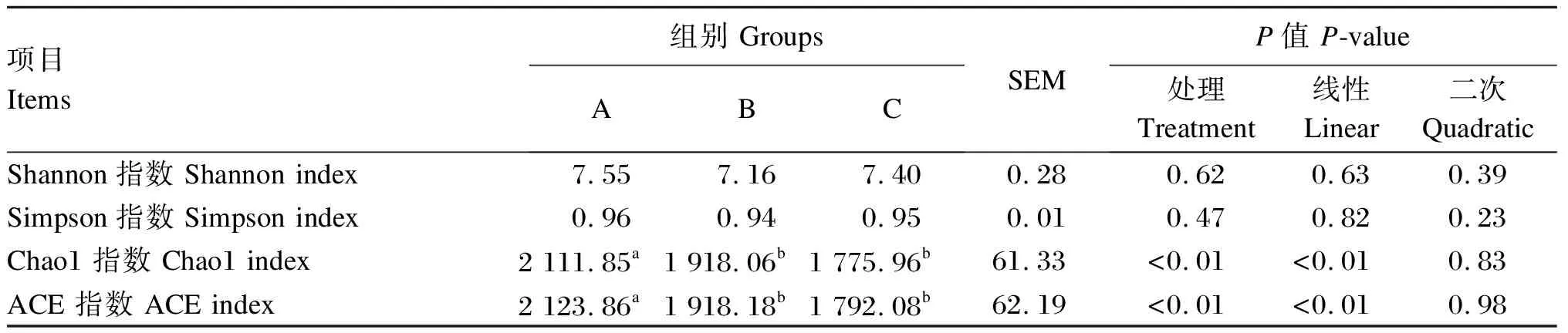
表3 饲粮中PA与OA的比例对奶牛瘤胃菌群α多样性的影响
2.4 饲粮中PA与OA的比例对奶牛瘤胃菌群β多样性的影响
PCoA结果(图4)显示,主成分1的贡献率为12.05%,主成分2贡献率为11.04%,能把B组和C组与A组样品分开,说明B组和C组与A组瘤胃菌群结构存在差异。由图5可知,A组聚在一起,B组和C组聚在一起,通过分子方差分析(AMOVA)(表4)进一步证明,B组与C组奶牛瘤胃菌群结构相似,无显著差异(P>0.05),A组与B组、A组与C组奶牛瘤胃菌群结构存在显著差异(P<0.05)。

表4 基于AMOVA的组间差异性分析
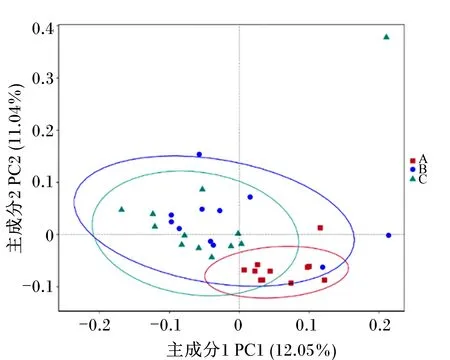
图4 基于Unweighted Unifrac距离的PCoA
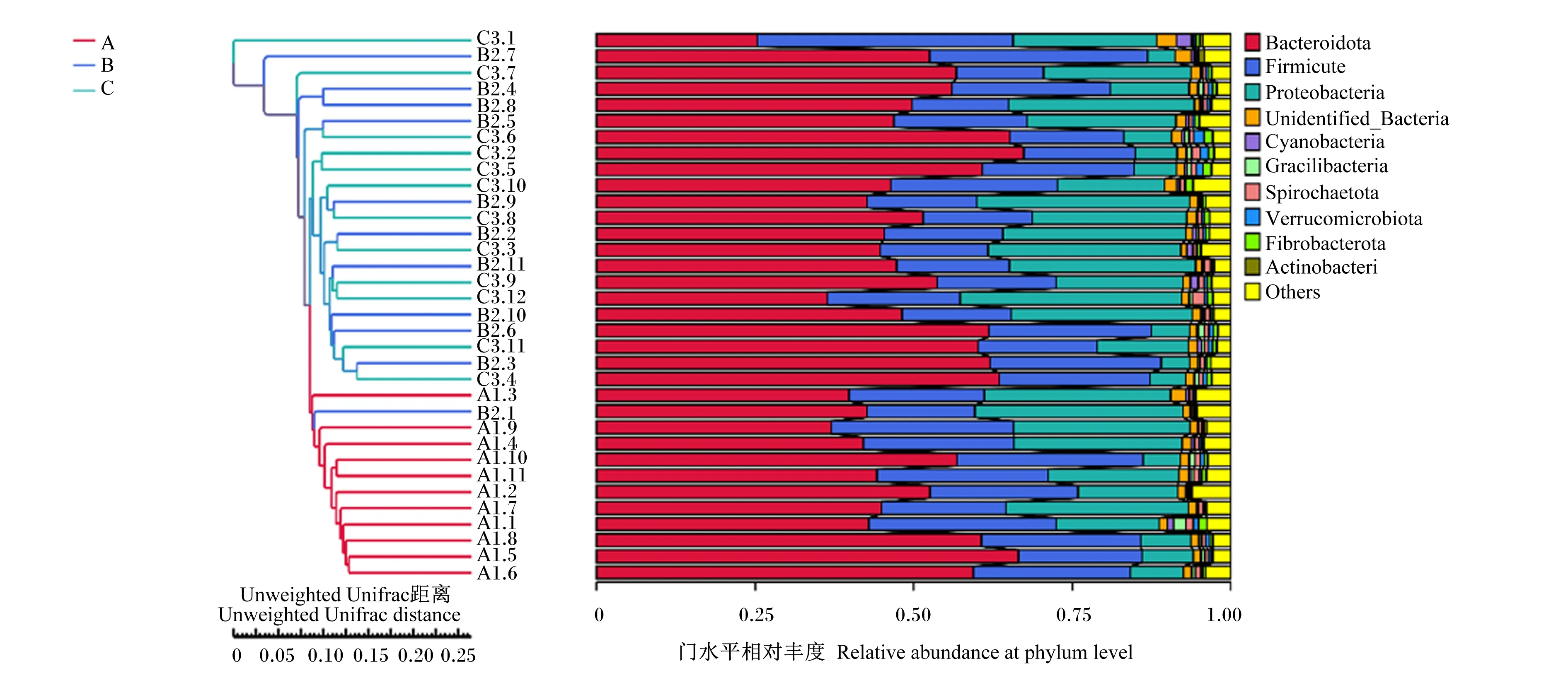
Bacteroidota:拟杆菌门;Firmicute:厚壁菌门;Proteobacteria:变形菌门;Unidentified_Bacteria:未识别的细菌;Cyanobacteria:蓝藻菌门;Gracilibacteria:纤细菌门;Spirochaetota:螺旋体门;Verrucomicrobiota:疣微菌门;Fibrobacterota:纤维杆菌门;Actinobacteri:放线菌门;Others:其他。
2.5 饲粮中PA与OA的比例对奶牛瘤胃菌群丰富度的影响
如表5所示,在门水平上,不同处理对变形菌门、蓝藻菌门、螺旋体门、庞微菌门和放线菌门的相对丰度无显著影响(P>0.05)。随OA比例的增加,拟杆菌门的相对丰度有线性增加的趋势(P=0.09);厚壁菌门的相对丰度线性降低(P<0.01),且B组和C组厚壁菌门的相对丰度均显著低于A组(P<0.05);纤维杆菌门的相对丰度线性升高(P<0.01),且C组纤维杆菌门的相对丰度显著高于A组和B组(P<0.05),B组纤维杆菌的相对丰度显著高于A组(P<0.05);厚壁菌门/拟杆菌门线性降低(P<0.01),且B组和C组的厚壁菌门/拟杆菌门均显著低于A组(P<0.05)。

表5 饲粮中PA与OA的比例对奶牛门水平瘤胃菌群组成的影响
如表6所示,普雷沃氏菌属、琥珀酸弧菌科_UCG-001、普雷沃氏菌属_7、理研菌科_RC9_肠道群、解琥珀酸菌属、瘤胃球菌属、普雷沃氏菌科_YAB2003群、月形单胞菌属和克里斯滕森菌科_R_7群的相对丰度各组之间差异不显著(P>0.05)。随OA比例的增加,琥珀酸弧菌科_UCG-002的相对丰度线性降低(P<0.01),且B组和C组琥珀酸弧菌科_UCG-002的相对丰度均显著低于A组(P<0.05)。
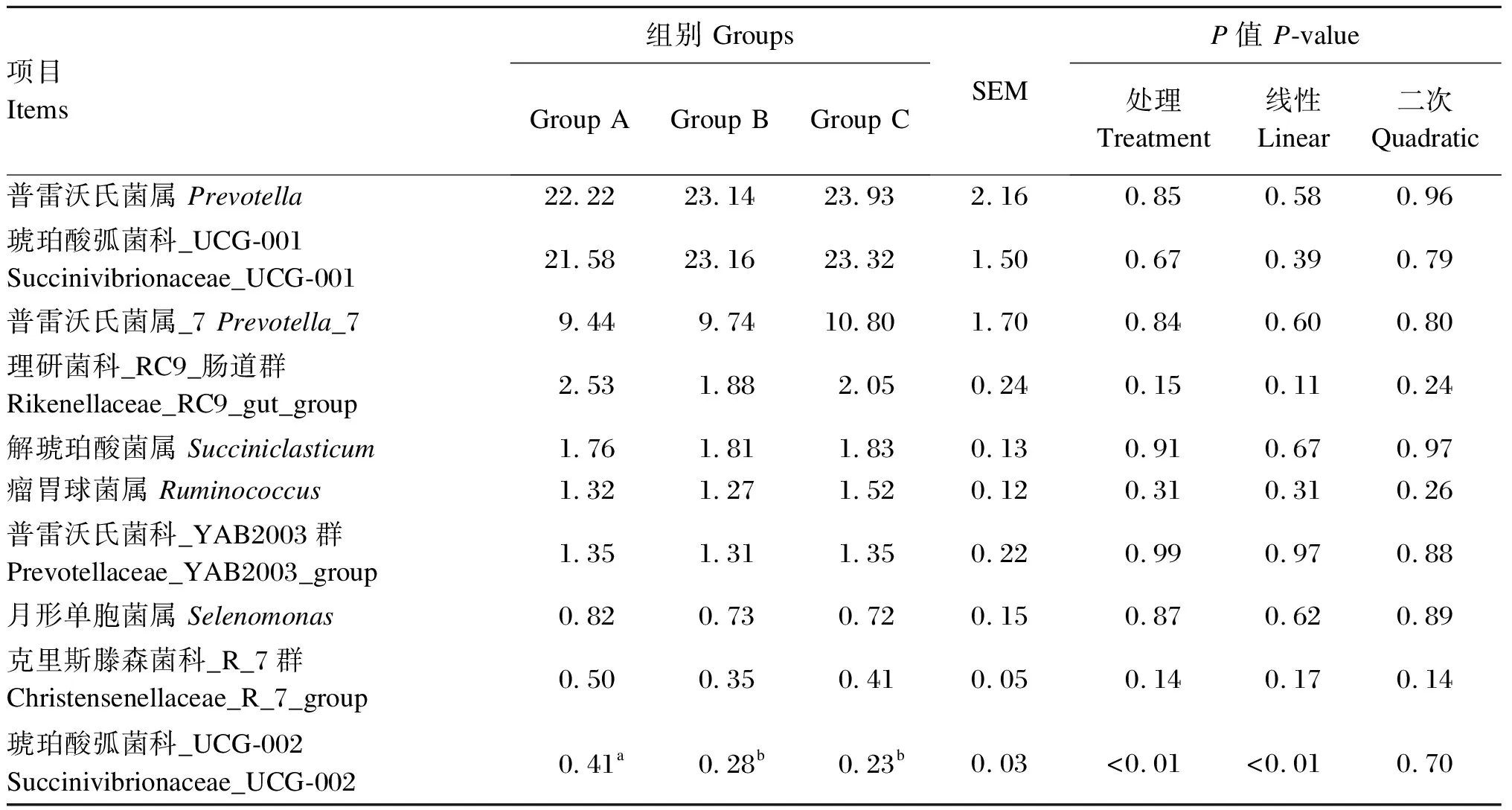
表6 饲粮中PA与OA的比例对奶牛属水平瘤胃菌群组成的影响
3 讨 论
3.1 饲粮中PA与OA的比例对奶牛瘤胃发酵参数的影响
瘤胃液pH、VFA和NH3-N是反映瘤胃内环境的关键指标。瘤胃液pH受饲粮类型、唾液和有机酸浓度的影响,其正常范围在5.5~7.5[19]。本试验中,各组奶牛瘤胃液pH差异不显著,同时pH在正常范围内,可保证瘤胃微生物对纤维和蛋白质的消化[20]。张双双[21]研究发现,不同油脂添加物对奶水牛瘤胃液pH无显著影响,与本研究结果一致,说明饲粮中添加脂肪可能对瘤胃内环境酸碱度无影响。饲粮内碳水化合物发酵后产生VFA,为奶牛机体活动提供能量和前体物质。本试验发现,随饲粮中OA比例的增加,瘤胃液TVFA有线性增加的趋势,而Adeyemi等[13]研究表明,随饲粮中PA比例的下降,OA比例增加,山羊瘤胃液TVFA浓度线性降低,与本研究结果相反,这可能是因为Adeyemi等[13]使用的是液态植物油,液态油脂能全部附着在饲料颗粒表面,在饲料颗粒表面形成脂层[22],降低营养物质降解率,而本研究用的是固体颗粒的脂肪粉添加剂,可能不易形成脂层或形成部分脂层,对营养物质降解率影响较小。Freitas等[23]发现,液态油脂对TVFA浓度的降低效果高于固体颗粒脂肪添加剂。乙酸和丁酸是合成乳脂的前体,本研究中,随着OA比例的增加,虽然没有改变奶牛瘤胃液中乙酸摩尔比例,但是显著降低丁酸摩尔比例。Machmüller等[24]发现,在绵羊饲粮中添加植物油,其瘤胃液中丁酸摩尔比例随着纤毛虫数量的减少而降低,据此推测,本研究中奶牛瘤胃液丁酸摩尔比例的降低也可能与纤毛虫数量降低有关,因为原生动物是丁酸的生产者[25]。由于本研究并没有测定瘤胃液纤毛虫数量,因此丁酸摩尔比例的降低原因还有待进一步研究。丙酸是合成葡萄糖的前体,因此可通过乙丙比来反映瘤胃发酵类型,其中丙酸型发酵可产生较多的能量供机体利用,因此,趋于丙酸型发酵的饲粮可缓解泌乳早期奶牛能量负平衡状态。本试验中,饲粮中OA比例的增加,奶牛瘤胃液丙酸摩尔比例无显著变化,这与Grummer[26]的研究结果一致,说明饲粮中添加不同类型的脂肪酸不影响丙酸摩尔比例。
NH3-N是饲粮蛋白质、非蛋白氮降解和MCP合成的中间产物,主要受饲粮蛋白质降解、瘤胃壁吸收、微生物利用和瘤胃食糜流出率的影响[27],其在瘤胃中的适宜浓度为6.3~27.5 mg/dL[28],适宜的NH3-N浓度有利于微生物的生长繁殖,进一步促进MCP的合成。Dewhurst等[29]报道,脂质可通过促进蛋白质降解,间接影响MCP的合成。本试验中,随饲粮PA比例的下降,OA比例的增加,瘤胃液NH3-N浓度无显著变化,且均在适宜浓度范围内,这与Wu等[30]的体外试验结果一致。虽然本试验没有测定蛋白质的瘤胃降解率,但是MCP浓度没有发生变化,说明饲粮中PA与OA的比例可能不影响蛋白质的瘤胃降解,这与刘融[31]的研究结果一致。
3.2 饲粮中PA与OA的比例对奶牛瘤胃菌群多样性的影响
瘤胃微生物种类繁多,包括细菌、古菌、原生动物和真菌,它们的种类和数量与奶牛品种、饲粮组成和环境等有关[32-33]。当样本覆盖率达到97%以上时,说明测序样本取样充分[34],本试验中各组样本平均覆盖率均在99%以上,表明本次测序结果能够真实地反映奶牛瘤胃微生物种类和结构多样性。Shannon指数越大或Simpson指数越小,菌群多样性越高;ACE和Chao1指数越大,菌群越丰富[35]。本试验发现,各组的Shannon和Simpson指数无显著差异,B组和C组的ACE和Chao1指数均显著低于A组,说明饲粮中PA与OA的比例不影响瘤胃菌群的多样性,但菌群的丰富度降低,这与Shabat等[36]的研究结果一致。Xue等[9,37]和Li等[38]发现,高产奶牛和饲料效率高的奶牛的瘤胃菌群丰富度较低。因此,随饲粮中OA比例的增加,瘤胃菌群丰富度的线性降低可能意味着OA比例的增加有提高奶牛生产性能和饲料效率的潜力。De Souza等[39]的研究也发现随着OA比例的增加,高产奶牛的生产性能和饲料效率有所增加。
3.3 饲粮中PA与OA的比例对奶牛瘤胃菌群丰富度的影响
饲粮组成对瘤胃菌群结构具有一定的影响[40]。拟杆菌门和厚壁菌门是反刍动物瘤胃菌群中的优势菌门[41-42],本试验中奶牛瘤胃中优势菌门与前人研究结果一致。拟杆菌门和厚壁菌门、纤维杆菌门是分解饲粮中碳水化合物的菌群,间接为机体提供能量。拟杆菌门属于革兰氏阴性菌,主要降解非纤维物质(淀粉、蛋白质和多糖)[43],主要产丙酸;厚壁菌门属于革兰氏阳性菌,纤维杆菌门是革兰氏阴性菌,厚壁菌门和纤维杆菌门是促进胃肠道对纤维素分解的主要菌群[44],主要产乙酸。刘融[31]研究发现,在湖羊饲粮中添加3%豆油(不饱和脂肪酸含量74.9%)与添加3%脂肪粉(饱和脂肪酸含量78.6%)相比,可降低厚壁菌门的相对丰度,提高纤维杆菌门的相对丰度,与本试验研究结果类似。本试验中,随着饲粮OA比例的增加,厚壁菌门的相对丰度线性下降,纤维杆菌门的相对丰度线性升高,可能是饲粮中OA比例的增加抑制了厚壁菌门的生长与增殖。Maia等[45]发现,不饱和脂肪酸对革兰氏阳性菌有杀灭作用。本研究中,2种重要的乙酸产生菌厚壁菌门与纤维杆菌门的相对丰度的一个降低一个升高,这可能是乙酸摩尔比例差异不显著的原因。厚壁菌门和拟杆菌门已被证明参与脂质和胆酸代谢,而厚壁菌门/拟杆菌门的降低与体脂沉积和提高饲料利用效率密切相关[46-47]。本试验中,随着饲粮OA比例的增加厚壁菌门/拟杆菌门线性降低,说明饲粮中适宜的PA与OA比例能够促进瘤胃对碳水化合物的降解,提高饲料利用率,为机体提供较多的能量,降低体脂分解,缓解泌乳早期奶牛能量负平衡,这与De Souza等[7]在围产后期奶牛饲粮中提高OA的比例可降低奶牛体重损失的研究结果相吻合。
在属水平上,普雷沃氏菌属是瘤胃菌群中的优势菌属,普雷沃氏菌属可分解半纤维素、蛋白质和非纤维多糖[48]。本试验中,普雷沃氏菌属的相对丰度最高,这与前人研究结果[49]一致。解琥珀酸菌属在瘤胃中将碳水化合物降解后产生琥珀酸,进一步代谢生成丙酸[50]。本研究中,饲粮中OA比例的增加,解琥珀酸菌属的相对丰度无显著变化,这与Cancino-Padilla等[51]的研究结果一致。琥珀酸弧菌科_UCG-002属于变形菌门,变形菌门相对丰度的升高是胃肠道微生态平衡失调和疾病风险的标志[52],虽然本试验中变形菌门的相对丰度各组间差异不显著,但琥珀酸弧菌科_UCG-002的相对丰度随饲粮中OA比例的增加线性降低,据此推测,饲粮中OA比例的增加可能有利于维持奶牛瘤胃微生态平衡和提高机体免疫能力,具体机制还有待进一步研究。
4 结 论
在本试验条件下,饲粮中PA与OA的比例为72.7∶27.3时,虽然对瘤胃液中乙酸和丙酸摩尔比例无显著影响,但可提高TVFA浓度并降低丁酸摩尔比例,降低菌群丰富度和厚壁菌门/拟杆菌门,提高纤维杆菌门相对丰度,改善瘤胃发酵功能,有提高生产性能和降低体脂分解的潜力,缓解泌乳早期奶牛能量负平衡状态。

