不同年龄段放牧牦牛生长发育及肌内脂肪沉积规律研究
柏 琴 张翔飞 罗晓林 官久强 安添午 赵洪文 李华德 周建旭 朱友军 谢荣清 黄艳玲*
(1.西南民族大学畜牧兽医学院,成都 610041;2.四川省草原科学研究院,成都 611731;3.小金县科学技术和农业畜牧水务局,小金 624200)
肉类食品是人类饮食结构中最重要的一类,也是摄取营养物质的重要来源。随着现代生活水平的提高,人们越来越关注肉产品的品质,不仅注重食用品质,同时强调肉的保健功能。牛肉因其高蛋白质、低脂肪、富含烟酸、铁等营养成分而倍受消费者青睐[1]。目前我国已成为世界第四大牛肉生产国,第二大牛肉消费国和第一大肉牛进口国,但从人均牛肉占有量来看,我国仍远低于发达国家水平乃至世界平均水平,牛肉需求缺口巨大。
牦牛(Bosgrunniens)是青藏高原及其毗邻地区的主要畜种之一,其肉、奶产品是当地畜牧业经济发展和牧民增收的重要来源。牦牛肉产品具有营养丰富,富含必需氨基酸、不饱和脂肪酸、矿物质,天然无污染等特点[2],是藏区牧民饮食中动物性蛋白质的主要来源,也是我国牛肉市场的重要供给保障。然而,现阶段牦牛养殖仍多采用“靠天养畜”的传统放牧模式,生产周期长、效率低,并且牦牛肉在食用品质方面如肌肉嫩度、系水力等相对肉牛品种较差[3],一定程度上制约了牦牛产业的发展。因此,牦牛肌肉品质的研究是推动当前高原畜牧业发展的重要方向。
脂肪广泛分布于机体的各种组织,在动物生命活动中起到关键作用,包括应对饥饿、哺乳和肉产品改善等[4]。动物机体脂肪的沉积是脂肪合成与分解代谢动态平衡的结果,也是供能物质的摄入量与机体能量消耗之间的平衡状态,此过程受一系列激素和脂肪代谢酶的共同作用。脂肪在肌肉内沉积形成肌内脂肪(intramuscular fat,IMF),俗称大理石花纹,主要成分是磷脂(存在于细胞膜中)和甘油三酯(脂滴),分布于肌外膜、肌束膜与肌内膜。有研究表明,IMF含量、脂肪酸组成与肉品质的剪切力、嫩度、风味、感官评分密切相关[5]。IMF因夹在肌周结缔组织中削弱了胶原纤维之间的关联,减少了破坏结缔组织所需的力量,从而可提高肉的嫩度[6]。同时,IMF中所含的脂溶性成分及其降解物(如醛和醇)可提高肉品的风味。由此可见,IMF沉积在肉品质改善方面发挥了重要作用。石斌刚[7]研究发现,犊牛、青年牛和成年牛的肉品质存在显著差异,表明年龄对牦牛肉品质有显著影响。牦牛生长发育过程中IMF沉积的时序及其营养代谢规律如何,目前鲜有报道。鉴于此,本研究选择不同年龄段的放牧牦牛,研究其生长发育和IMF沉积规律,以期为提高牦牛肉品质的研究提供参考。
1 材料与方法
1.1 试验设计
本试验从四川省草原科学研究院红原牦牛科技园区随机选取不同年龄段(0.5、1.5、2.5、3.5、4.5岁)的健康麦洼公牦牛作为研究对象,每个年龄段6头,共30头牦牛。试验牛均在同一天然牧场内放牧,饲养管理条件一致,冬季补饲少量青干草以避免牛只过度掉膘死亡。
1.2 样品采集和检测指标
1.2.1 体重测定
利用牛用电子称测定不同年龄段牦牛晨牧前体重。
1.2.2 血清生化指标测定
晨牧前采集各年龄段牦牛颈静脉血,静置后离心分离血清,-80 ℃冻存,待测血清生化指标。
血清代谢物含量:利用全自动生化分析仪(Chemray 800,深圳雷杜生命科学股份有限公司)测定血清葡萄糖(GLU)、尿素氮(UN)、白蛋白(ALB)、总蛋白(TP)、球蛋白(GLB)、甘油三酯(TG)、胆固醇(CHO)含量;血清非酯化脂肪酸(NEFA)、β-羟基丁酸(BHBA)含量采用酶联免疫吸附测定(ELISA)法通过酶标仪(Epoch,BioTek,美国)测定,试剂盒购自上海酶联生物科技有限公司,操作步骤试剂盒说明书执行。
血清能量代谢相关激素水平:采用ELISA法通过酶标仪(Epoch,BioTek,美国)测定血清脂联素(APN)、胰高血糖素(GLN)、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)、胰岛素(INS)、瘦素(LEP)、抵抗素(RETN)水平,试剂盒购自上海酶联生物科技有限公司。
1.2.3 肌肉品质测定
对各年龄段牦牛进行统一屠宰,屠宰前禁食24 h,屠宰后采集背最长肌(第12~13肋骨处)样品,用于肉质性状(pH、熟肉率、剪切力)和营养成分(IMF、脂肪酸)含量测定。使用在pH 4.0和7.0缓冲液中校准过的pH计(pHS-3D型,雷磁,上海)分别测定宰后1 h和4 ℃冰箱保存24 h肌肉的pH;将肉样在80 ℃的恒温水浴锅加热至肉样中心温度为70 ℃,冷却后,沿肌纤维平行方向截取肉柱(宽1.0 cm、厚1.0 cm)后用CLM-3B数显式型肌肉嫩度仪测定其剪切力;参照Li等[8]的称重法测定肌肉的熟肉率。样品将经过预处理后,采用索氏脂肪抽提法测定IMF含量。采用气相色谱(gas chromatography,GC)法测定肌肉中脂肪酸组成,测定方法参考文献[9]。
1.2.4 肌肉中脂肪代谢关键酶活性测定
另采集牛背最长肌肉(第12~13肋骨处)样品,立即放于液氮保存,用于脂肪代谢关键酶活性测定。取适量肌肉样品,用4倍匀浆介质研磨,然后将研磨液3 000~4 000 r/min离心10 min,取上清制备成20%的组织匀浆,分析其中脂肪合成关键酶——乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)、二酰甘油酰基转移酶-1(DGAT-1)、硬脂酰辅酶A去饱和酶(SCD)、脂蛋白脂酶(LPL)与脂肪分解关键酶——激素敏感脂肪酶(HSL)、脂酰辅酶A氧化酶(ACOX)、肉碱脂酰转移酶-Ⅰ(CPT-Ⅰ)活性,采用ELISA法测定,试剂盒购自上海酶联生物科技有限公司,具体操作步骤按照使用说明书。
1.3 数据统计与分析
试验数据经Excel 2010初步整理后,利用SAS 9.4统计软件的one-way ANOVA程序进行方差分析,采用Student-Newman-Keuls(SNK)模型进行组间多重比较,结果变异程度以均值标准误(SEM)表示,以P<0.05为差异显著。
2 结 果
2.1 不同年龄段牦牛体重比较
由图1可知,随着年龄的增长,牦牛体重显著增加(P<0.05)。
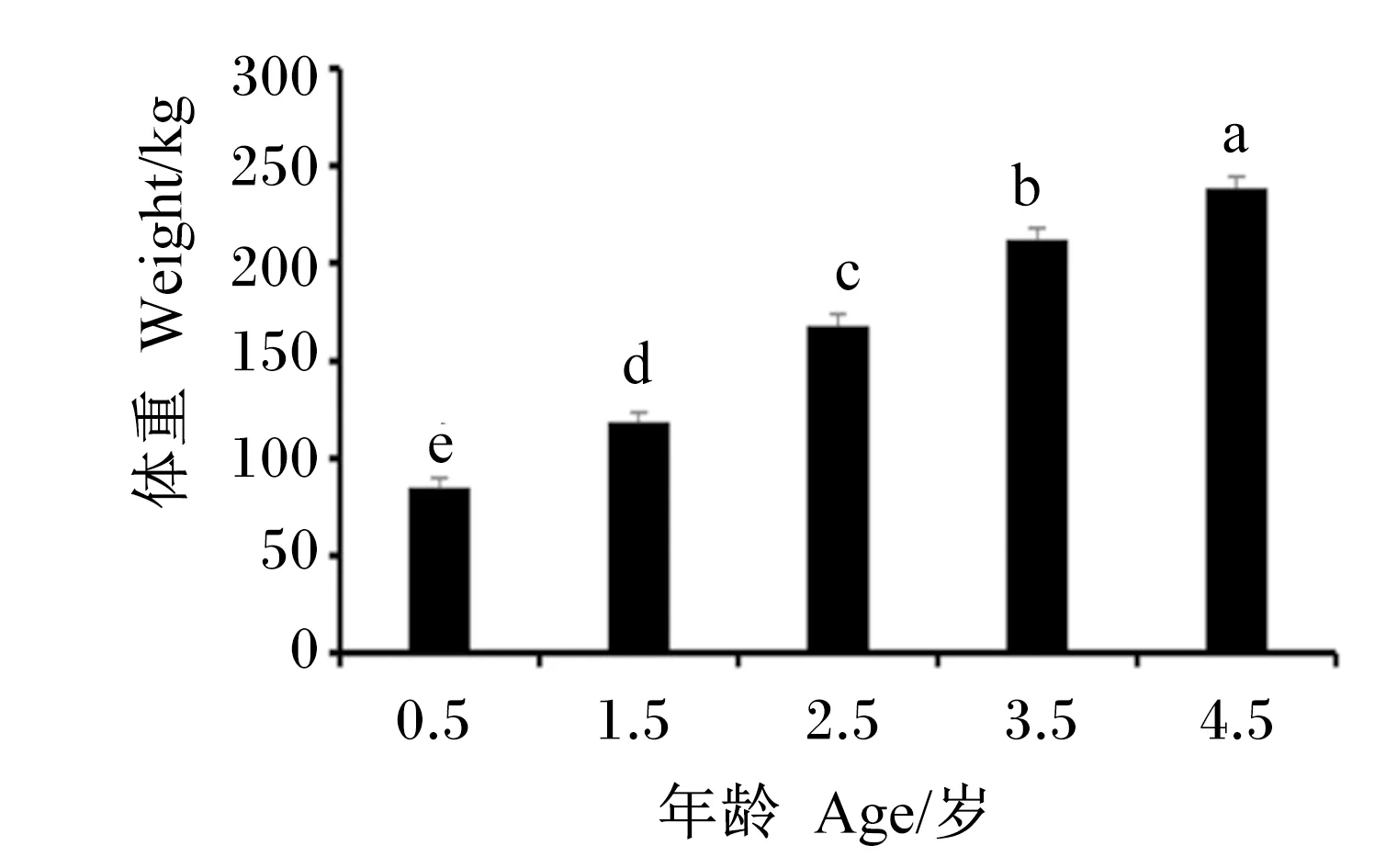
数据柱形标注不同字母表示差异显著(P<0.05)。图2同。
2.2 不同年龄段牦牛血清代谢物含量比较
由表1可知,血清UN含量随着牦牛年龄的增长先升高后趋于平稳,2.5、3.5和4.5岁牦牛血清UN显著高于0.5岁牦牛(P<0.05);2.5和4.5岁牦牛血清CHO含量显著高于0.5岁牦牛(P<0.05),且2.5岁牦牛还显著高于1.5岁牦牛(P<0.05);所测其他血清代谢物含量在不同年龄段牦牛之间无显著差异(P>0.05)。
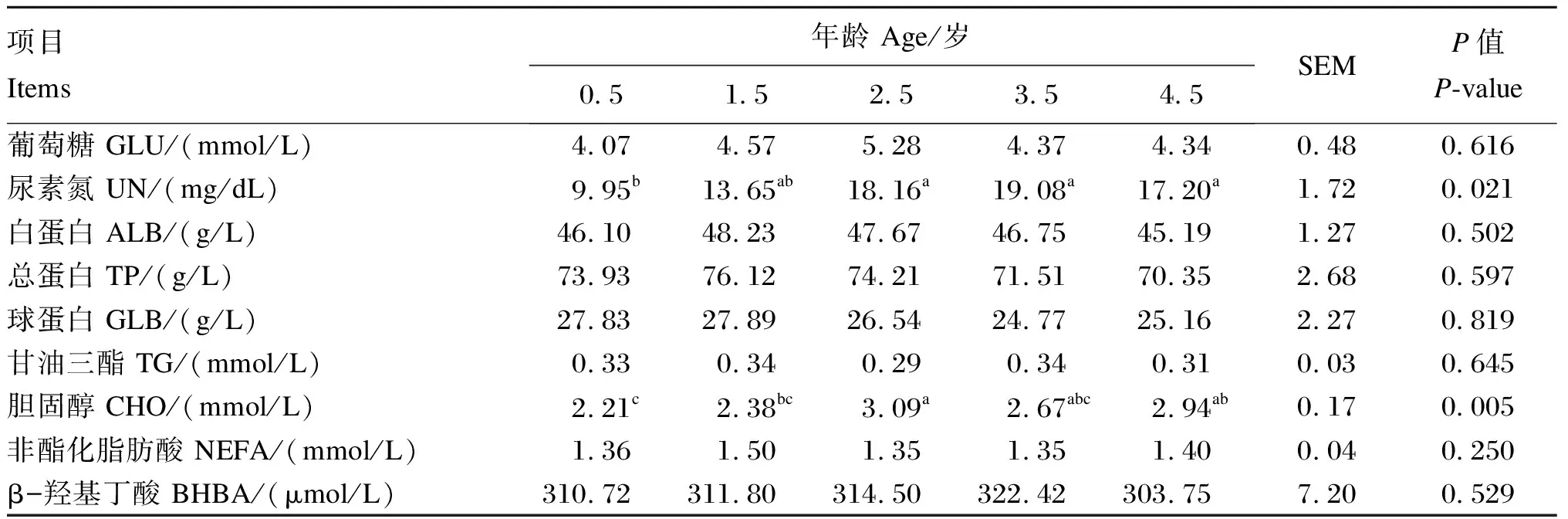
表1 不同年龄段牦牛血清代谢物含量比较
2.3 不同年龄段牦牛血清能量代谢相关激素水平比较
由表2可知,4.5岁牦牛血清INS水平显著高于0.5、1.5和2.5岁牦牛(P<0.05),3.5与4.5岁牦牛之间无显著差异(P>0.05);血清LEP水平随着牦牛年龄的增长而升高,其中2.5、3.5和4.5岁牦牛显著高于0.5岁牦牛(P<0.05),4.5岁牦牛显著高于1.5岁牦牛(P<0.05);血清GLN、IGF-Ⅰ和RETN水平随着牦牛年龄的增长虽有波动但整体上呈逐渐降低趋势,其中3.5和4.5岁牦牛血清GLN、RETN水平显著低于1.5岁牦牛(P<0.05),2.5、3.5和4.5岁牦牛血清IGF-Ⅰ水平显著低于0.5和1.5岁牦牛(P<0.05);血清APN水平在不同年龄段牦牛之间无显著差异(P>0.05)。

表2 不同年龄段牦牛血清能量代谢相关激素水平比较
2.4 不同年龄段牦牛肌肉品质比较
由表3可知,牦牛肌肉的剪切力随着年龄的增长逐渐增大,其中0.5和1.5岁牦牛显著低于4.5岁牦牛(P<0.05),而2.5、3.5和4.5岁牦牛之间差异不显著(P>0.05);牦牛肌肉的熟肉率随着年龄的增长有所降低,但各年龄段牦牛之间差异不显著(P>0.05);各年龄段牦牛肌肉pH1 h无显著差异(P>0.05),平均值为6.68;牦牛肌肉pH24 h表现为3.5和4.5岁牦牛显著高于0.5岁牦牛(P<0.05),平均值为5.70,从宰后1 h到4 ℃冰箱保存24 h,肌肉pH平均下降0.98。

表3 不同年龄段牦牛肌肉品质比较
2.5 不同年龄段牦牛肌肉IMF含量和脂肪酸组成比较
如图2可知,随着牦牛年龄的增长,IMF含量逐渐增加,其中4.5岁牦牛显著高于0.5、1.5和2.5岁牦牛(P<0.05),4.5和3.5岁牦牛之间差异不显著(P>0.05)。

图2 不同年龄段牦牛肌肉IMF含量比较
由表4可知,牦牛肌肉饱和脂肪酸、不饱和脂肪酸等组成和含量在不同年龄段牦牛之间均无显著差异(P>0.05)。
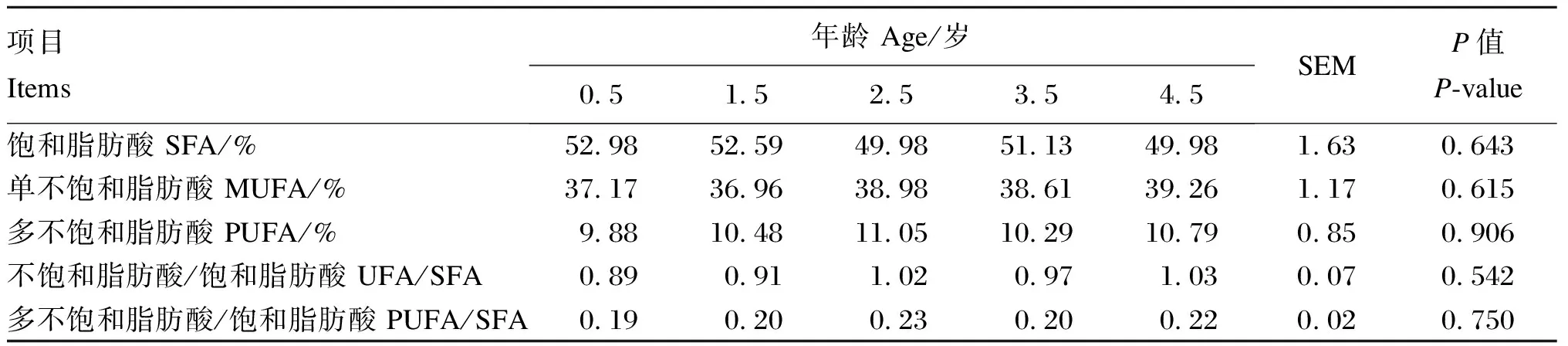
表4 不同年龄段牦牛肌肉脂肪酸组成比较
2.6 不同年龄段牦牛肌肉中脂肪代谢关键酶活性比较
由表5可知,在肌肉中脂肪合成代谢关键酶方面:1.5、2.5、3.5和4.5岁牦牛ACC活性显著高于0.5岁牦牛(P<0.05);3.5和4.5岁牦牛DGAT-1活性显著高于0.5和1.5岁牦牛(P<0.05);FAS与SCD活性在各年龄段牦牛之间无显著差异(P>0.05);LPL活性随着牦牛年龄的增长而升高,其中4.5岁牦牛显著高于0.5、1.5岁牦牛(P<0.05),2.5、3.5和4.5岁牦牛之间无显著差异(P>0.05)。在肌肉中脂肪分解代谢关键酶方面:HSL活性随着牦牛年龄的增长总体呈现降低的趋势,其中1.5岁牦牛显著高于3.5岁牦牛(P<0.05),2.5、3.5和4.5岁牦牛之间无显著差异(P>0.05);ACOX、CPT-Ⅰ活性在不同年龄段牦牛之间无显著差异(P>0.05)。
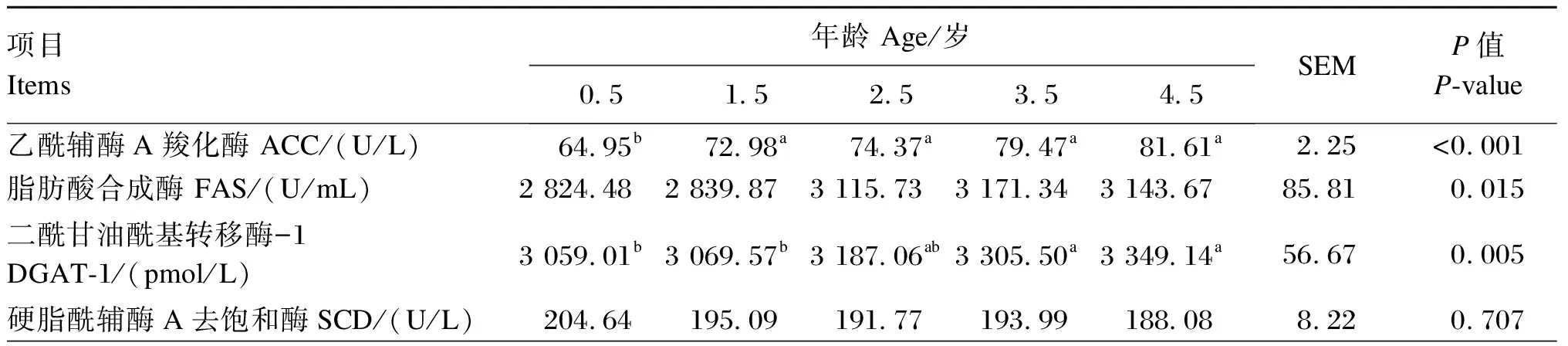
表5 不同年龄段牦牛肌肉中脂肪代谢关键酶活性比较
3 讨 论
3.1 不同年龄段牦牛生长发育与血清激素水平变化
体重作为家畜生产性能的重要数量指标和经济指标,直接反映了动物的生长发育情况。本研究中,随着年龄的增长,牦牛的体重显著增加,说明年龄对牦牛生长发育有显著影响。石斌刚[7]对放牧条件下6、30和54月龄牦牛进行了比较,发现牦牛在6~30月龄段生长速度比30~54月龄段快,即6~30月龄段是牦牛主要的生长发育段。本研究也发现,随着牦牛生长期的延长,生长速度呈现前期快后期慢的特点,其中以1.5~2.5岁段生长速度最快。
血液中TG、CHO、NEFA和BHBA含量能够反映机体脂肪代谢和能量平衡状态[10]。TG是动物贮存脂肪的主要形式,动物机体可分解TG为NEFA,再通过血液循环为机体供能[11]。CHO由高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、极低密度脂蛋白胆固醇等组成,在机体脂肪代谢与能量代谢过程发挥重要作用。有研究表明血液CHO含量与肌肉IMF含量呈显著正相关关系[12]。在本研究中,0.5、1.5及2.5岁牦牛血清CHO含量逐渐增加,并在2.5岁时达到峰值,显著高于0.5和1.5岁牦牛,而与3.5和4.5岁牦牛无显著差异,表明在2.5岁前血清CHO含量随年龄的增加逐渐升高,而在2.5岁以后血清CHO含量相对稳定,该结果也与本试验中IMF沉积结果相符。血清UN含量的高低可以反映动物体内蛋白质代谢和氨基酸的平衡状况。本研究结果显示,牦牛血清UN含量随着年龄的增长先升高后趋于平稳,推测与幼龄牦牛早期肌肉组织发育的大量蛋白质、氨基酸需求,以及随着年龄增长机体生长发育成熟,牧草采食量提高和瘤胃发酵功能逐渐完善,提供了更多可吸收利用的氨氮有关。
脂肪沉积是脂肪合成与分解代谢的一种平衡状态,受到各类激素、因子的调控作用[13]。在脂肪合成代谢中,INS有显著的促进作用,将能量以脂肪形式储存起来,使血液中游离脂肪酸(FFA)含量减少,同时抑制脂肪的分解,主要通过诱导脂肪酸合成过程中的关键酶ACC和FAS表达,从而促进脂肪沉积[14]。LEP水平与动物机体脂肪含量密切相关,研究发现,当哺乳动物能量摄入平衡时,体脂增加,会促使脂肪细胞LEP分泌增多[15]。本试验中,牦牛血清INS和LEP水平随年龄的增长而逐渐升高,并且INS水平表现为4.5岁牦牛显著高于0.5、1.5和2.5岁牦牛,而LEP水平表现为4.5岁牦牛显著高于0.5和1.5岁牦牛,说明牦牛机体对脂肪沉积的促进调控主要在生长发育后期。GLN与IGF-Ⅰ同样是机体能量代谢调控的重要激素,研究表明GLN能够显著促进脂肪分解代谢关键酶HSL表达[16],从而促进脂肪分解,而IGF-Ⅰ具有促进蛋白质合成、刺激肌肉生长、抑制脂肪积累的生物学功能。本研究发现牦牛血清GLN、IGF-Ⅰ水平在2.5~4.5岁间显著降低,亦表明机体脂肪沉积的负向调控减弱。近年来,RETN与脂肪代谢的关系成为研究热点,刘小平等[17]认为RETN与动物肌内脂肪沉积密切相关。在本研究中,血清RETN水平在牦牛3.5~4.5岁时显著低于1.5岁时,提示RETN对牦牛IMF沉积可能存在负调控。
3.2 不同年龄段牦牛肌肉品质与IMF沉积规律分析
在肌肉品质研究中,牛肉的嫩度、多汁性是决定其品质的关键因素,而肉产品嫩度的评定通常用剪切力反映,它的大小与嫩度呈负相关。本研究中,随着牦牛年龄的增长,背最长肌的剪切力逐渐增大,2.5、3.5和4.5岁牦牛肌肉剪切力显著高于0.5岁牦牛,牛肉嫩度逐渐下降,表明年龄影响了牦牛肉品质,年龄增长会引起牛肉嫩度和品质下降,这与付洋洋[18]研究发现的舍饲牦牛肉剪切力随着年龄增长逐渐增大的结果一致。由此可见,牦牛的饲养并非年龄越大越好,饲养周期过长、出栏年龄过大会影响牦牛肉产品品质。熟肉率是衡量肌肉在蒸煮过程中损失状况的指标,其值越大,肉质保水性越好,咀嚼时越多汁[19]。本研究中,随着牦牛年龄的增长,肌肉熟肉率逐渐降低,但各年龄段牦牛之间差异不显著,表明肌肉熟肉率受到年龄影响,但作用效果较小。
肌肉中的脂肪含量、脂肪酸组成与肉品质密切相关[20]。动物在整个生长过程中,青年时期侧重于骨骼与肌肉的发育,生长速度较快,前期主要是蛋白质沉积,性成熟过后生长速度变缓,逐渐由蛋白质沉积为主转变为脂肪沉积为主[21]。Setiyono等[22]报道,年龄对肌肉蛋白质沉积的影响较小,而对肌肉脂肪沉积的影响较大。本研究发现,随着年龄的增长,牦牛肌肉IMF含量逐渐增加,并且3.5和4.5岁牦牛显著高于0.5和1.5岁牦牛。徐瑛[23]比较了放牧条件下不同年龄(3~7岁)牦牛的IMF含量,结果表明,随着年龄的增长,牦牛肉中脂肪含量更加丰富,与本研究结果相似。这提示,随着年龄的增长,牦牛机体在能量代谢相关激素的调控下,脂肪合成代谢得到促进,肌肉中IMF含量增加。
在评价肉品质时,脂肪酸组成是一个重要的指标[24],IMF中脂肪酸的种类和比例不仅对风味物质的影响很大[25],而且也是人体必需的营养素,具有较高的营养价值[26]。Cho等[27]对不同年龄段韩国肉牛背最长肌脂肪酸组成进行分析后发现,各年龄段之间脂肪酸组成差异不显著。付洋洋[18]比较了舍饲条件下1.5、2.5和4.5岁牦牛肉的脂肪酸组成,发现各组间无显著变化。同时,Zorzi等[28]研究表明,内洛尔牛的同一部位间脂肪酸组成差异极小。本研究中,放牧条件下不同年龄段牦牛之间背最长肌中脂肪酸组成同样没有显著差异,表明牦牛IMF沉积过程中各类型脂肪酸是同步沉积的,在比例上无显著变化。
3.3 不同年龄段牦牛肌肉中脂肪代谢关键酶活性分析
脂肪合成和分解是在一系列关键酶的参与和催化下完成的,这些关键酶活性的高低影响组织中脂肪的合成、分解和转运[29]。动物机体可改变脂肪合成酶和分解酶的数量与活性、脂肪运输体的数量及运输方向,进而实现对脂肪沉积的调控[30]。Herrera-Marcos等[31]、Gamarra等[32]研究发现,FAS、ACC、SCD、DGAT-1都是脂肪合成代谢的正向促进因子,其中ACC催化脂肪酸合成的第1步反应,是脂肪酸合成过程的限速酶;DGAT-1作为酰基转移酶,以甘油和脂肪酸为底物,催化甘油三酯的合成,在快速生长期其表达水平增高;LPL是脂肪转运的关键酶,其活性是判断FFA流向的有效标志,活性高说明体内FFA向脂肪组织汇集而进行脂质集聚和能量储备[33]。在本研究中,随着年龄的增长,牦牛肌肉中ACC、DGAT-1和LPL活性逐渐增加,并在3.5~4.5岁段达到高峰,说明随着年龄的增长,脂肪合成速度得到增强,促进了牦牛肌肉中的脂肪合成,这与肌肉IMF含量结果相一致。同时,Rumberger等[34]研究表明ACC的活性随INS含量的升高而升高,二者呈线性正相关,本试验也表现出类似结果。FAS是一种多功能的复合酶,其活性的高低对控制动物体脂肪沉积发挥重要作用,FAS具有催化丙二酸单酰辅酶A合成脂肪酸的功能,因此提高FAS的活性可促进脂肪沉积[35];SCD是哺乳动物饱和脂肪酸脱氢形成单不饱和脂肪酸的限速酶。本研究中,FAS和SCD活性在各年龄段之间无显著差异。此外,脂肪分解关键酶也可调控IMF沉积,HSL、CPT-1都是脂肪分解或脂肪酸氧化的正向促进因子[36],HSL启动分解脂肪组织中的TG释放出FFA,是调控能量平衡的关键酶和限速酶[37],对细胞内调节TG含量起重要作用;CPT-1是脂肪酸氧化的限速酶之一,主要功能使脂肪酸发生β氧化[38]。本研究中,3.5岁牦牛肌肉HSL活性显著低于1.5岁牦牛,表明3.5岁牦牛的脂肪分解能力受到抑制。姚飞[39]研究了苏尼特羊发育阶段对IMF沉积的影响,发现IMF含量增加的同时HSL活性逐渐降低、FAS活性升高,与本研究结果相一致。由此可见,随着年龄的增长,牦牛肌肉中脂肪合成关键酶活性升高,而脂肪分解关键酶活性降低,从而促进肌肉IMF的沉积。
4 结 论
① 随着年龄的增长和体重的增加,牦牛自2.5岁起肌肉IMF开始快速沉积,至3.5~4.5岁时达到IMF沉积旺盛期。
② 牦牛机体通过能量代谢相关激素、因子作用于肌肉脂肪代谢途径,提升脂肪合成代谢关键酶ACC、DGAT-1、LPL的活性,抑制脂肪分解代谢关键酶HSL的活性,从而促进肌肉IMF的沉积。

