饲料中添加槲皮素-5′-磺酸钠对杂交石斑鱼(褐点石斑鱼♀×清水石斑鱼)生长性能、抗氧化能力和肠道健康的影响
罗 君 杨二军 付伟杰 黄建盛,2 谢瑞涛 陈 刚,2*
(1.广东海洋大学水产学院,湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),湛江 524025;3.广东恒兴饲料实业股份有限公司,湛江 524022)
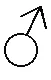
槲皮素(3,3′,4′,5,7-五羟基黄酮,C15H10O7)是一种在植物中广泛存在的黄酮类化合物,具有抗炎、抗癌、抗细胞凋亡和免疫保护等生物学功能[7-9]。研究表明,饲料中添加黄酮类化合物可提高水产动物的生长性能、抗氧化和免疫能力,调节肠道微生物群落的组成[10-11]。槲皮素作为饲料添加剂对鱼类生长和免疫的作用已在虹鳟鱼(Oncorhynchusmykiss)[12]、斑马鱼(Daniorerio)[13]、克琳雷氏鲶(Rhamdiaquelen)[14]、金头鲷(SparusaurataL.)[15]、牙鲆(Paralichthysolivaceus)[16]和草鱼(Ctenopharyngodonidella)[17]上进行了研究。但由于槲皮素的水溶性差、体内代谢快、生物利用度低,限制了其在食品和医药领域的应用[9]。为改善槲皮素的肠道吸收和生物活性,研究人员对其进行了各种化学修饰[7-9,18]。磺化反应可提高黄酮类化合物的水溶性和生物活性[19],1914年Watson等[20]通过在槲皮素中引入磺酸基,合成了槲皮素-5′-磺酸及槲皮素-5′-磺酸钠(QS)。基于特定的分子结构,QS可能是一种具有临床应用潜力的有机金属化合物。体外研究表明,QS可通过抑制人结肠癌细胞系HT-29增殖、诱导细胞凋亡和细胞周期停滞,发挥抗癌作用[21]。
QS具有抗氧化、抗菌和抗肿瘤活性[22-24]。动物模型研究表明,QS对重金属中毒小鼠的器官具有一定的保护作用[25-26]。但饲料中添加QS对石斑鱼生长和免疫的影响尚未见研究。为促进QS在水产动物饲料中的应用,本研究通过在饲料中添加QS,探究QS对杂交石斑鱼生长性能、抗氧化能力和肠道健康的影响。
1 材料与方法
1.1 QS的化学合成及表征
试验用所有化学品均为分析纯,无需进一步纯化即可使用。槲皮素(质量分数为97%,结构如图1-A所示)购买自上海麦克林生化有限公司。
参考Czerwonka等[21]的方法制备QS,具体如下:将浓硫酸(40.0 mL)和槲皮素(10.0 g)于80 ℃水浴中加热搅拌反应2 h。冷却后,在连续搅拌状态下加入适量蒸馏水,过滤得到橙红色槲皮素-5′-磺酸沉淀,在饱和水溶液中重结晶。使用NaOH中和所得的槲皮素-5′-磺酸,过滤得到黄色沉淀并在饱和水溶液重结晶。经风干和研磨,得到黄色微晶QS产物。QS的结构如图1-B所示。
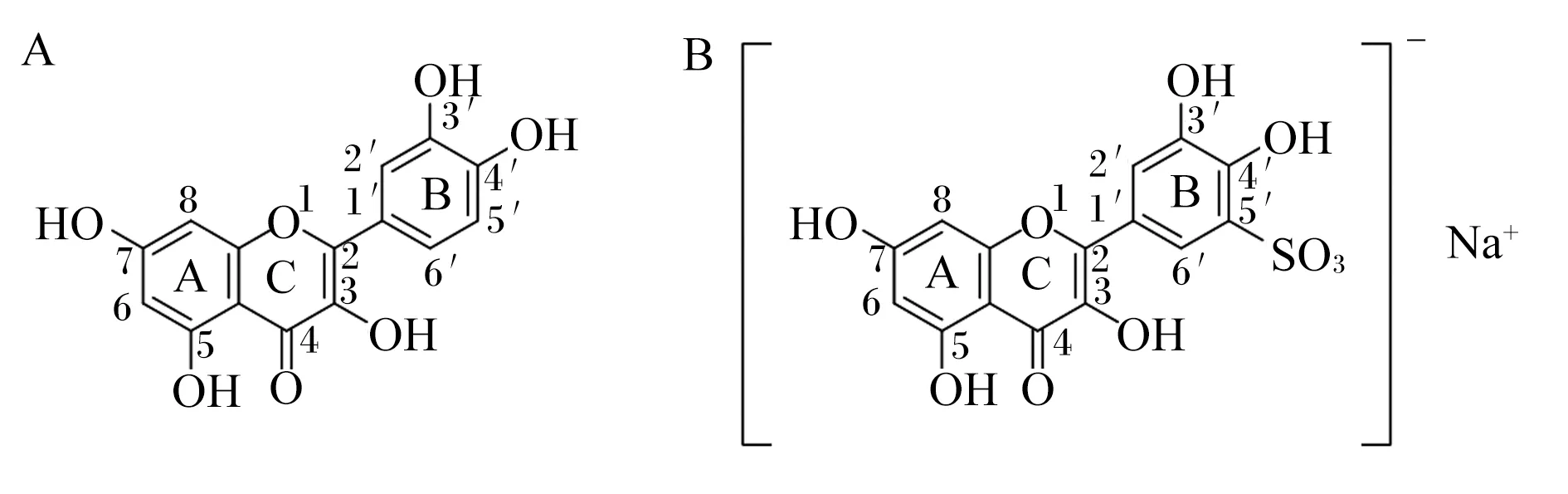
图1 槲皮素(3,3′,4′,5,7-五羟基黄酮)(A)和槲皮素-5′-磺酸钠(3,3′,4′,5,7-五羟基黄酮-5′-磺酸钠)结构(B)
1H NMR和13C NMR光谱在BRUKE AVANCE Ⅲ 400 MHz上测量。四甲基硅烷(TMS)作为内标。
1H NMR(400 MHz,DMSO-d6)δ: 12.47(1H, s, 5-OH), 10.98(1H, s, 4′-OH), 10.78(1H, s, 7-OH), 9.46(1H, s, 3-OH), 9.26(1H, s, 3′-OH), 7.87(1H, d, H-2′), 7.62(1H, d, H-6′), 6.40(1H, d, H-8), 6.19(1H, d, H-6)。
13C NMR(101 MHz,DMSO-d6)δ: 175.84(C-4), 163.99(C-7), 160.76(C-5), 156.12(C-9), 145.96(C-2), 145.46(C-3′), 144.20(C-4′), 136.10(C-3), 131.19(C-5′), 120.81(C-1′), 117.76(C-2′), 115.37(C-6′), 103.04(C-10), 98.22(C-6), 93.26(C-8)。
1.2 试验设计
参考石斑鱼的研究成果[27-28]配制基础饲料,其组成及营养水平见表1。参考槲皮素的研究结果[29-30],分别在基础饲料中添加0、0.80、1.60、3.20 mmol/kg QS,换算为质量分数分别为0、0.381、0.762、1.524 g/kg,以槲皮素等量替代基础饲料中的微晶纤维素。饲料制备前将所有原料粉碎过60目筛,并按照配方精确称重。按照含量从小到大的原则逐级将QS与各饲料成分混匀,然后再将油和水分别混入,揉搓;混合物用螺杆机湿法挤出4.0 mm粒径的颗粒饲料并于阴凉处风干。干燥后,饲料颗粒分装于密封袋中,在-20 ℃保存直至使用。
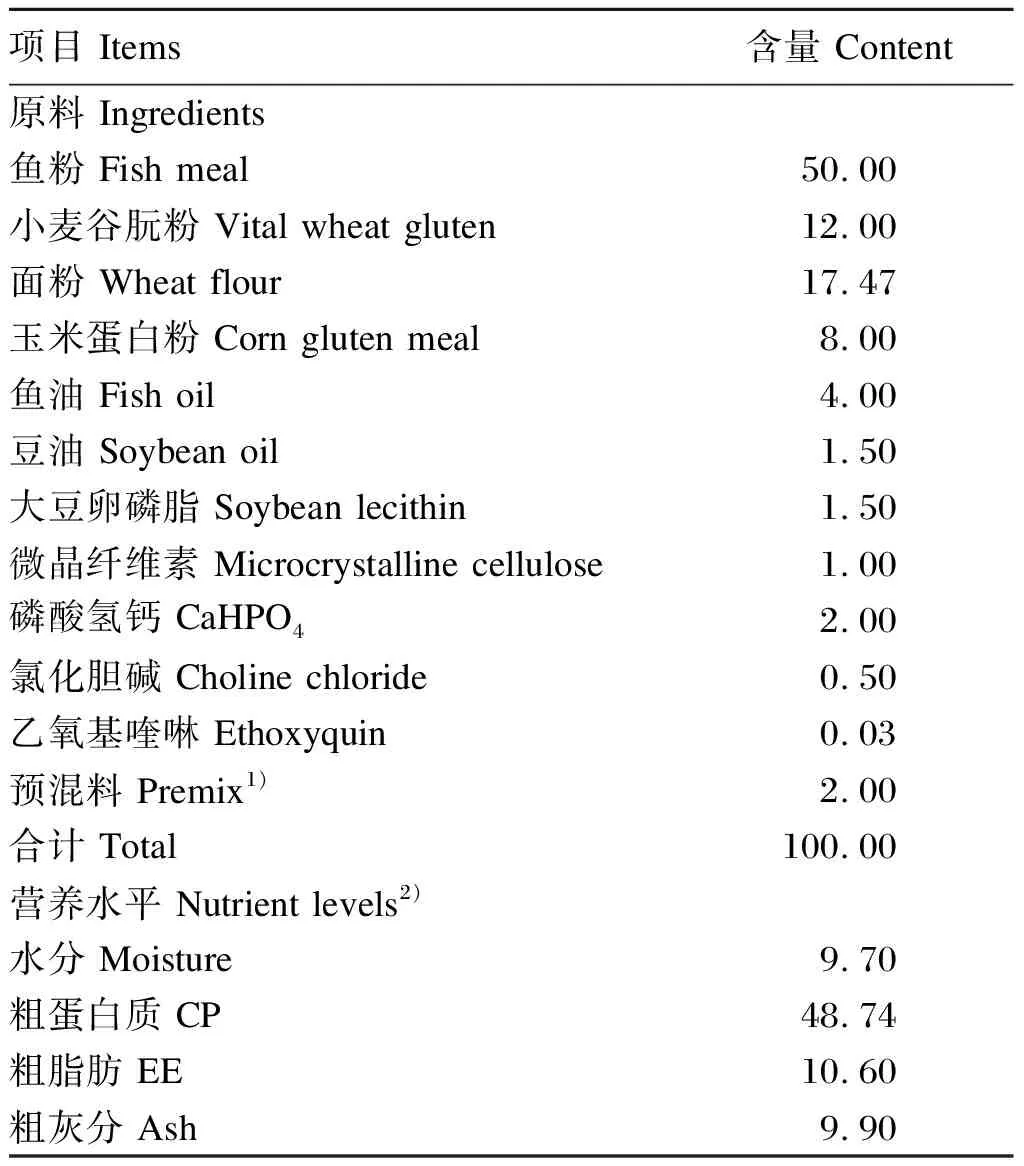
表1 基础饲料组成及营养水平(干物质基础)
1.3 试验用鱼与饲养管理
试验鱼取自广东海洋大学湛江海洋高新科技园养殖所培育的杂交子一代幼鱼。选取健康的杂交石斑鱼运至广东恒兴饲料实业股份有限公司863养殖基地,饲喂基础饲料暂养2周,禁食24 h后,取体重为(10.10±0.02)g的幼鱼300尾,随机放入12个玻璃钢养殖桶(500 L,25尾/桶)。将12个玻璃钢养殖桶随机分为4组,每组3个养殖桶(重复)。4组试验鱼分别投喂在基础饲料中添加0(FM组)、0.80(QSL组)、1.60(QSM组)、3.20 mmol/kg QS(QSH组)的试验饲料,每日投喂2次(08:00和17:00),按照体重的5%~8%饱食投喂。各组试验鱼饲养管理条件相同。在8周的饲养试验期间,每日记录死亡鱼的数量、重量及饲料投喂量。试验期间试验鱼在一个连续24 h通风的流水养殖系统中饲养,水温25~29 ℃、pH 7.5~8.0、盐度28.0~32.0 g/L、溶氧浓度6~8 mg/L、氨氮浓度(0.03±0.01)mg/L。
1.4 样品采集
饲养试验结束后停食24 h,记录每个养殖桶中试验鱼的数量和重量。每个养殖桶中随机取9尾试验鱼,MS-222麻醉,其中3尾鱼采集长度1 cm的后肠用于肠道核因子-κB(NF-κB)信号通路相关基因表达测定,取肝脏用于抗氧化指标测定;剩余的6尾鱼在无菌状态下剖取整肠,剥离肠道外脂肪组织后,3尾鱼的整肠用于肠道菌群分析,3尾鱼的整肠用于抗氧化指标测定。所取组织采用液氮速冻后在-80 ℃保存直至使用。
1.5 生长指标测定
饲养8周后,根据记录的采食量、体重以及死亡鱼的数量计算增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、存活率(survival rate,SR)和饲料系数(feed coefficient rate,FCR),计算公式如下:
WGR(%)=100×(终末总重-初始总重)/初始总重;SGR(%/d)=100×(ln终末总重-ln初始总重)/饲养天数;SR(%)=100×终末尾数/初始尾数;FCR=摄食饲料干重/(终末总重+死亡个体总重-初始总重)。
1.6 肝脏及肠道抗氧化指标测定
肝脏或肠道样品用预冷的生理盐水漂洗和滤纸拭干后,称取0.4 g,加入9倍体积预冷的0.9%生理盐水匀浆;匀浆液在4 ℃条件下以2 500 r/min离心10 min;取上清液保存在-80 ℃下直至进一步分析。使用商业试剂盒(南京建成生物工程研究所)测定组织中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutamate peroxidase,GPx)、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量。
1.7 实时荧光定量PCR检测
将杂交石斑鱼后肠样品置于装有液氮的研钵中研磨至粉末状,采用TransZol UP Plus RNA Kit试剂盒(北京全式金生物技术股份有限公司)从中提取总RNA。提取的RNA溶解在120 μL不含RNase的水中,用1.5%琼脂糖凝胶电泳检验提取的RNA条带,超微量核酸蛋白检测仪检验RNA的纯度及浓度。使用TranScript cDNA Synthesis SuperMix试剂盒(北京全式金生物技术股份有限公司)合成第1链cDNA。使用Primer 5.0软件设计各个基因的上、下游引物序列并由上海生工生物股份有限公司合成,所有引物经过验证后用于后续正式试验。NF-κB信号通路相关基因主要包括肿瘤坏死因子-α(TNF-α)、TNF受体相关因子-2(TRAF-2)、TNF受体超家族成员1A(TNFRSF1A)、干扰素-γ(IFN-γ)、丝裂原活化蛋白激酶激酶激酶7(MAP3K7)、MAP3K7结合蛋白3(TAB3)、NF-κBp65亚单位(NF-κBp65)、NF-κB抑制剂-α(IκB-α),以β-肌动蛋白(β-actin)为内参基因。本试验使用的所有引物序列如表2所示。

表2 实时荧光定量PCR引物序列
使用PerfectStart Green qPCR Su-perMix(北京全式金生物技术股份有限公司)荧光定量试剂盒在实时荧光定量PCR扩增仪(Roche LightCycler®96 SW1.1)上进行扩增。10 μL反应体系包括5 μL SYBR Green Supermix,上、下游引物各0.5 μL,3.5 μL ddH2O和0.5 μL cDNA。熔解曲线验证引物特异性。PCR扩增程序如下:94 ℃预变性30 s,94 ℃变性5 s,58 ℃退火15 s,72 ℃延伸10 s,循环40次。每个样本重复3次验证。按照2-ΔΔCt的方法[31]计算目的基因相对表达量。
1.8 肠道菌群
使用DNA提取试剂盒(MN NucleoSpin 96 Soi)提取微生物DNA;利用通用引物对(正向引物338F:5′-ACTCCTACGGGAGGCGCAGCA-3′;反向引物806R:5′-GGACTACHVGGGTWTCTAAT-3′)PCR扩增各样品16S rRNA基因的V3~V4区序列。使用北京百迈客生物科技有限公司的Illumina HiSeq 2500平台对纯化的样品进行高通量测序分析。
原始图像数据文件经碱基识别分析转化为原始测序序列,结果以FASTQ文件格式存储。使用FLASH软件(version 1.2.11)对原始数据进行拼接,Trimmomatic软件(version 0.33)将拼接得到的序列进行质量过滤,UCHIME软件(version 8.1)鉴定并去除嵌合体,生成tags。使用USEARCH软件(version 10.0)在相似性97%的水平上对tags进行聚类,获得操作分类单元(OTU)。基于百迈客云平台进行微生物多样性分析,得到α多样性指数(Ace、Chao1、Shannon、Simpson指数)、β多样性、物种注释及分类学分析。
1.9 统计分析
使用SPSS 22.0软件对试验数据进行单因素方差分析(one-way ANOVA),方差分析显著时采用Duncan氏法进行组间多重比较。试验结果以“平均值±标准误”(mean±SE)表示,P<0.05时具有显著差异。
2 结 果
2.1 QS对杂交石斑鱼生长性能的影响
由表3可知,与FM组相比,添加不同水平QS对杂交石斑鱼的终末体重、WGR、SGR、SR和FCR均无显著影响(P>0.05),其中,QSL组的WGR和SGR相比FM组有所上升;4组的SR均大于96%。
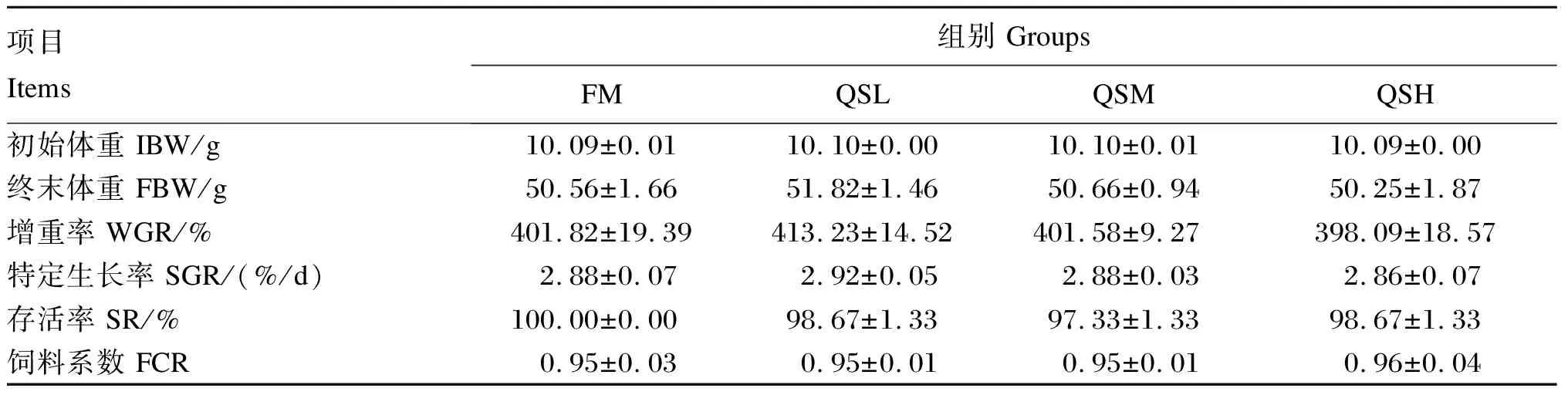
表3 QS对杂交石斑鱼生长性能的影响
2.2 QS对杂交石斑鱼肝脏和肠道抗氧化指标的影响
通过测定肝脏和肠道中SOD、GPx、CAT活性和MDA含量来评估杂交石斑鱼的抗氧化状态,肝脏和肠道检测结果分别见表4和表5。与FM组相比,QSL和QSM组的肝脏SOD、GPx和CAT活性显著增加(P<0.05);QSH组的肝脏CAT活性显著高于FM组(P<0.05),SOD和GPx活性与FM组无显著差异(P>0.05);各组肝脏MDA含量无显著差异(P>0.05)。各组肠道SOD活性无显著差异(P>0.05);与FM组相比,3个添加QS组肠道GPx活性显著降低(P<0.05),MDA含量显著增加(P<0.05);QSH组肠道CAT活性显著低于FM组(P<0.05)。
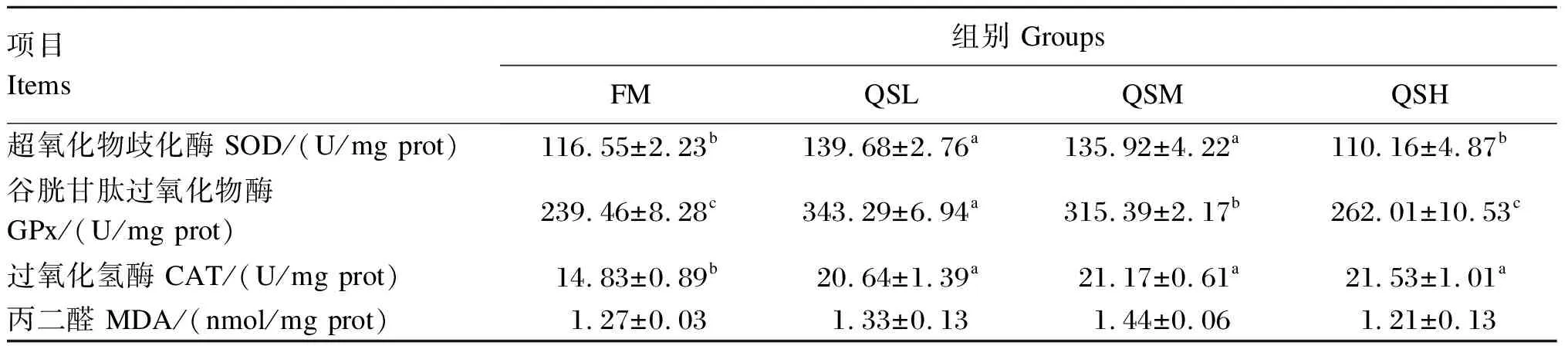
表4 QS对杂交石斑鱼肝脏抗氧化指标的影响

表5 QS对杂交石斑鱼肠道抗氧化指标的影响
2.3 QS对杂交石斑鱼肠道NF-κB信号通路相关基因表达的影响
图2显示了各组杂交石斑鱼肠道NF-κB信号通路相关基因的相对表达量。与FM组相比,QSL组TNF-α、TRAF-2、TNFRSF1A、IFN-γ、TAB3和MAP3K7的相对表达量显著上调(P<0.05),NF-κBp65和IκB-α的相对表达量无显著变化(P>0.05);QSM和QSH组NF-κBp65、IκB-α、TAB3和MAP3K7的相对表达量显著下调(P<0.05),TNF-α和IFN-γ的相对表达量显著上调(P<0.05),TRAF-2和TNFRSF1A的相对表达量无显著变化(P>0.05)。
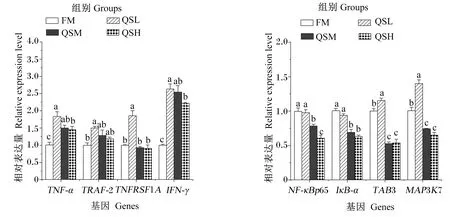
TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;TRAF-2:TNF受体相关因子-2 TNF receptor-associated factor-2;TNFRSF1A:TNF受体超家族成员1A TNF receptor superfamily member 1A;IFN-γ:干扰素-γ interferon-γ;NF-κBp65:NF-κBp65亚单位 nuclear factor-κB p65 subunit;IκB-α:NF-κB抑制剂-α NF-κB inhibitor-α;MAP3K7:丝裂原活化蛋白激酶激酶激酶7 mitogen-activated protein kinase kinase kinase 7;TAB3:MAP3K7结合蛋白3 MAP3K7-binding protein 3。
2.4 饲料中添加QS对杂交石斑鱼肠道菌群的影响
2.4.1 肠道菌群多样性分析
通过对杂交石斑鱼肠道菌群进行16S rRNA高通量测序,样品的平均干净读数为79 409,平均有效读数为74 985。基于OTU数据的韦恩图(图3)显示,4组共享的OTU数目为619个;FM组中特有OTU数目最多,为134个;QSH组中特有OTU数目最少,为75个。OTU分析表明,QS使杂交石斑鱼肠道微生物群落数量降低。
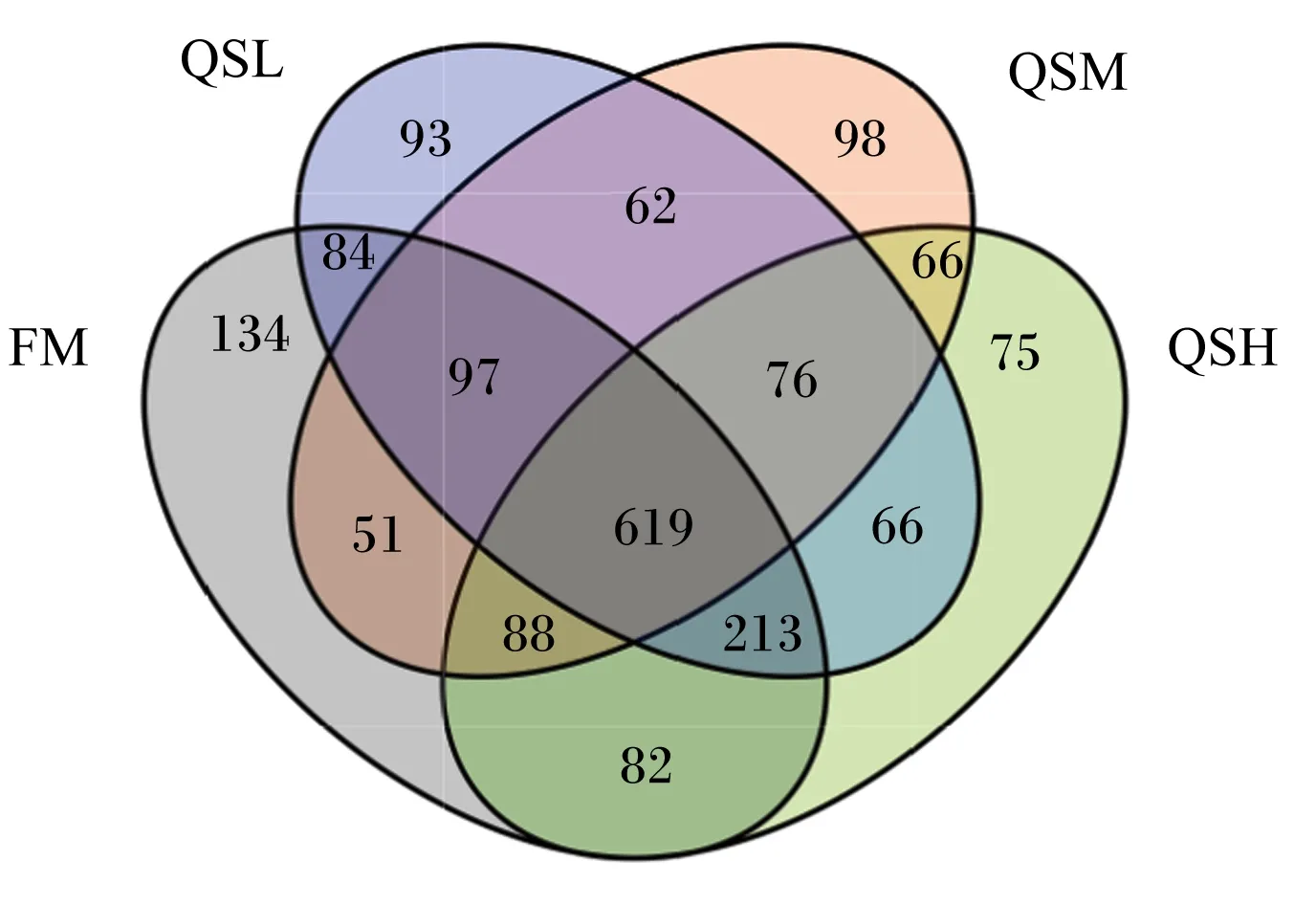
FM:FM组 FM group;QSL:QSL组 QSL group;QSM:QSM组 QSM group;QSH:QSH组 QSH group。
使用QIIME2软件,进行α多样性指数分析。所有样本的Good’s覆盖率均高于99.6%,表明数据涵盖了大多数细菌物种。α多样性指数结果如表6所示,与FM组相比,各添加QS组OTU数目,ACE和Chao1指数无显著差异(P>0.05),QSL组的Simpson和Shannon指数显著增加(P<0.05),QSM和QSH组无显著差异(P>0.05)。
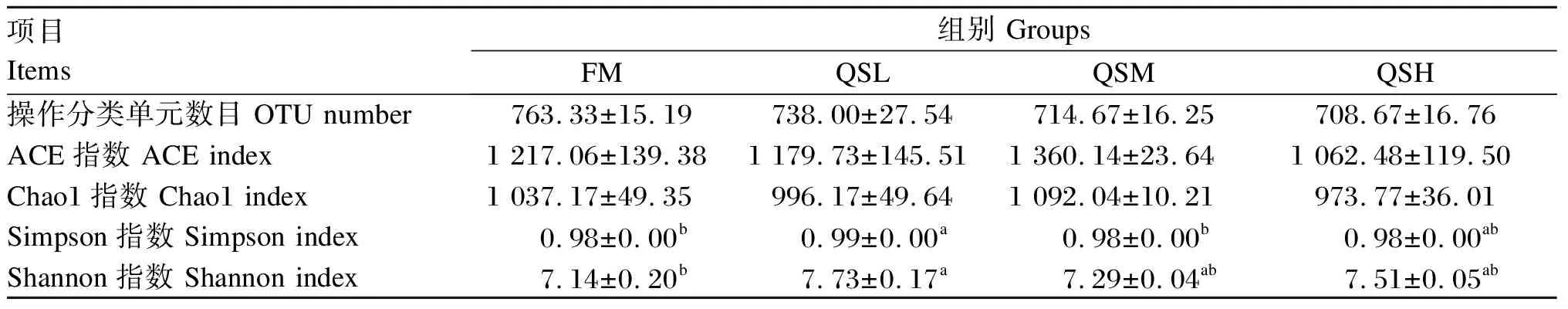
表6 QS对杂交石斑鱼肠道菌群α多样性指数的影响
通过偏最小二乘判别分析(PLS-DA)法对杂交石斑鱼肠道菌群的β多样性进行分析,结果显示,成分(component)1和2的主要贡献率分别为11.75%、9.26%,4组样本有明显聚类趋势,QSL和QSM组远离FM组(图4),这说明QS可引起杂交石斑鱼肠道菌群结构改变。

图4 偏最小二乘判别分析
2.4.2 肠道菌群组成分析
根据物种注释结果,4组杂交石斑鱼肠道菌群在门水平上的组成见图5-A,在属水平上的组成见图5-B。
由图5-A可知,4组样本中相对丰度大于5%的菌门共有5个,分别为厚壁菌门(Firmicutes,31.24%)、变形菌门(Proteobacteria,26.50%)、拟杆菌门(Bacteroidetes,13.37%)、放线菌门(Actinobacteria,9.68%)和疣微菌门(Verrucomicrobia,5.09%)。方差分析结果(表7)显示,与FM组相比,QSM组Firmicutes相对丰度显著降低(P<0.05);QSL组Bacteroidetes相对丰度显著降低(P<0.05),Actinobacteria相对丰度显著增加(P<0.05)。
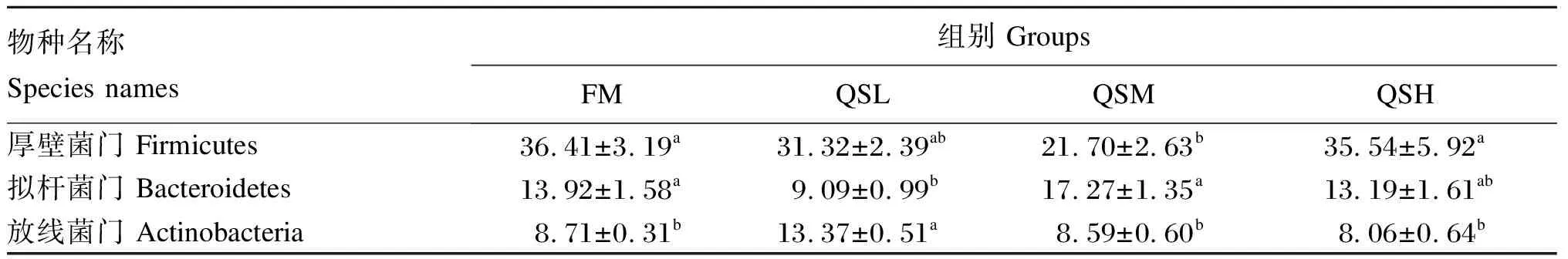
表7 杂交石斑鱼肠道菌群门水平上的相对丰度
由图5-B可知,除属水平上未命名的菌群外,4组样本中相对丰度大于2%的菌属共有10个,分别为艾克曼菌属(Akkermansia,4.86%)、拟杆菌属(Bacteroides,4.77%)、不可培养细菌_o_Chloroplast(uncultured_bacterium_o_Chloroplast,3.33%)、暂定种_Vidania(Candidatus_Vidania,3.22%)、乳杆菌属(Lactobacillus,2.88%)、不可培养细菌_f_毛螺菌科(uncultured_bacterium_f_Lachnospiraceae,2.86%)、双歧杆菌属(Bifidobacterium,2.80%)、瘤胃球菌科_UCG-005(Ruminococcaceae_UCG-005,2.62%)、脱硫弧菌属(Desulfovibrio,2.43%)、不可培养细菌_f_Muribaculaceae(uncultured_bacterium_f_Muribaculaceae,2.26%)。方差分析结果(表8)显示,与FM组相比,QSL组Bifidobacterium相对丰度显著增加(P<0.05)、Akkermansia相对丰度显著降低(P<0.05);QSM组Ruminococcaceae_UCG-005相对丰度显著降低(P<0.05)。
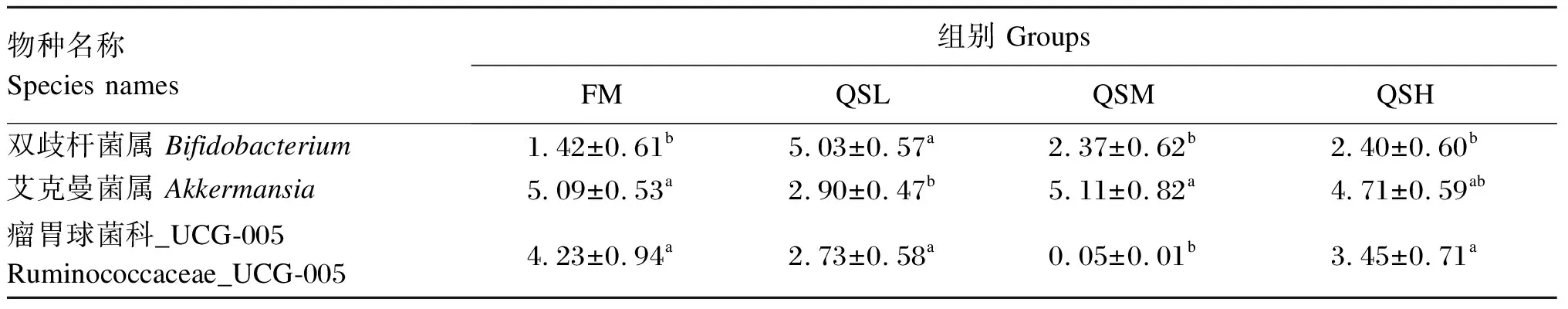
表8 杂交石斑鱼肠道菌群属水平上的相对丰度
3 讨 论
3.1 QS对杂交石斑鱼生长性能的影响
黄酮类化合物是药用植物最有效的成分之一,可提高鱼类的生长速度,增强机体免疫能力[32-33]。研究发现,饲料中添加0.4 g/kg槲皮素可显著提高草鱼的WGR并降低FCR[29]。Zhai等[30]报道,饲料中添加不同水平(200、400、800和1 600 mg/kg)槲皮素后罗非鱼(Oreochromisniloticus)的SGR有所提高,且高剂量更有效。在肉鸡的研究中发现,饲粮中添加0、0.02%、0.04%、0.06%的槲皮素对生长指标无显著影响[34]。槲皮素被机体吸收后主要以苷元形式存在,这种存在形式在促进生长中可能发挥重要作用[35]。但由于研究对象、饲养条件和使用剂量不同,目前关于槲皮素的促生长机制尚不清楚。本试验中,QS对杂交石斑鱼的生长性能无显著影响;相比于FM组,QSL组的终末体重和WGR有上升趋势,但随着添加量的增加而降低。磺化反应显著提高了槲皮素的水溶性,但也可能导致QS在鱼体内的吸收与代谢发生改变。此外,植物提取物对生长的促进作用呈剂量依赖性,超出最佳剂量时,可能会降低促生长作用。在草鱼的研究中发现,随着槲皮素添加量的增加,WGR有降低的趋势[29]。Santos-Buelga等[36]发现,饲喂3.3 g/kg槲皮素可使小鼠的WGR降低29%。高剂量添加黄酮类化合物可能会抑制营养物质的吸收,导致促生长作用降低[29]。由于缺乏QS相关文献,其饲用最佳添加量仍需进一步研究。
3.2 QS对杂交石斑鱼抗氧化能力的影响
机体通过产生少量活性氧(ROS)增强对病原体的抵抗能力,而过量的ROS可对组织和细胞造成氧化损伤[37]。槲皮素可能通过上调抗氧化酶(如SOD、CAT和GPx)的活性抑制过量ROS的形成,从而减少细胞氧化应激[38-39]。据Cui等[40]报道,槲皮素和槲皮素-5′,8-二磺酸盐增强了小鼠肝脏GPx和SOD活性并抑制氧化应激。本试验中,3个添加QS组杂交石斑鱼肝脏中SOD、GPx和CAT活性均显著提高,其中QSL和QSM组增强效果更显著,表明QS增强了杂交石斑鱼肝脏的抗氧化能力,且较低剂量更有效。根据Czerwonka等[21]的研究结果,槲皮素和QS均具有高自由基清除能力,且二者清除1,1-二苯基-2-三硝基苯肼(DPPH)的能力相当。综上所述,本试验进一步证明了QS的抗氧化能力。
当机体ROS产生和清除之间的平衡遭到破坏时,会发生脂质过氧化,导致MDA和其他过氧化脂的积累,因此MDA含量通常用于评估细胞氧化损伤程度[41]。GPx是一种重要的抗氧化酶,可通过谷胱甘肽(GSH)还原过氧化氢(H2O2)清除氧自由基;机体中H2O2含量增加,可引起组织氧化应激[42-43]。本试验结果显示,QS的添加使杂交石斑鱼肠道中GPx活性显著降低,MDA含量显著增加。Kaindl等[44]发现,槲皮素可有效抵抗结肠上皮中脂肪酸氢过氧化物(LOOH)等营养因素诱导的氧化应激损伤,但在无外源压力的情况下,槲皮素可引起组织损伤。槲皮素的毒性作用可能与槲皮素清除ROS的过程中氧化形成的有毒产物有关。槲皮素能够与人体自由基反应生成有毒的氧化产物,即槲皮素-奎宁(quercetin-quinine),这种物质几乎立即与GSH反应,或者在没有GSH的情况下与蛋白质巯基反应[45-48]。此类反应一旦发生,可能会导致毒性作用,例如,通过破坏细胞膜和蛋白质的完整性而导致细胞损伤,或破坏含有巯基结构的酶的功能[49-51]。此外,在离体小鼠肝核模型系统中,槲皮素以剂量依赖性方式降低核GSH含量,并可能导致DNA损伤[52]。本研究中,随着QS添加量的增加,杂交石斑鱼肝脏SOD和GPx活性出现下降趋势,肠道MDA含量显著增加。杂交石斑鱼摄入高剂量QS后,可能产生了有毒的代谢产物,这些代谢产物降低了肝脏和肠道的抗氧化能力。
3.3 QS对杂交石斑鱼肠道NF-κB信号通路相关基因表达的影响
适量的炎症因子参与损伤组织再生,可修复和愈合伤口;严重的炎症会破坏正常组织和细胞,引起各种炎症性疾病[53]。NF-κB信号通路被认为在促炎基因的表达中起主要作用[54]。TNF-α是早期炎症发生过程中的重要成分[55]。根据Yang等[34]对肉鸡的研究结果,槲皮素通过上调脾脏中TNF-α、TRAF-2、TNFRSF1B、NF-κBp65和IFN-γ和下调IκB-α的表达激活NF-κB信号通路。与Yang等[34]的研究结果一致,本试验中,添加QS组杂交石斑鱼肠道NF-κB信号通路被激活,TNF-α的相对表达量在各添加QS组中显著上调。研究显示,植物成分饲料添加剂对鱼类炎症基因的表达有促进作用,能够上调TNF-α在鱼肠道中的表达[56-57]。随着QS添加量的增加,NF-κBp65的相对表达量下调,NF-κB信号通路被抑制,结合抗氧化指标测定结果,表明肠道抗氧化能力降低,这可能导致了ROS的蓄积。研究发现,ROS少量存在时,有利于NF-κB信号通路的激活,发挥抗细胞凋亡作用;当ROS大量存在时,可通过抑制NF-κB信号通路促进细胞凋亡[58-59]。
体外试验证明QS显著降低了HT-29结肠癌细胞系的活力,表明QS可能是潜在的抗结肠癌药物[21]。研究发现,抗结肠癌药物在高度增殖的正常组织(如胃肠道黏膜)中表现出了细胞毒性:通过增强细胞氧化应激、增加ROS生成并促发一系列炎症通路,破坏肠道黏膜,引发黏膜炎[60-61]。NF-κB在此过程中起关键作用,可诱导炎症基因表达和促炎细胞因子的产生,导致组织损伤和细胞凋亡[61]。这可能进一步解释了肠道MDA含量的增加。此外,NF-κB还会导致黏附分子和环氧合酶-2(COX-2)基因表达上调[62]。COX-2是一种参与炎症的诱导型酶,在血管内皮细胞、炎性细胞、癌性上皮和成纤维细胞中受到刺激后表达[62]。研究发现,槲皮素及其代谢物在体外和体内都表现出对COX-2的激活作用[63-64]。根据上述研究结果推测QS具有促炎活性,长期补充可能会导致肠道发生炎症反应。然而,仍需要更多的研究来明确QS与鱼类肠道炎症反应间的联系。
3.4 QS对杂交石斑鱼肠道菌群的影响
肠道是鱼类的消化和免疫器官,肠道菌群在维持宿主肠道结构功能,促进营养物质吸收、代谢以及调节机体免疫功能等方面具有重要作用[65]。研究表明,膳食多酚可调节肠道微生物群落的组成和活性[66]。在人类肠道中发现,肠道微生物参与黄酮类化合物在体内的转化,发挥更强的生理功能[67]。本试验中,菌群结构分析结果表明杂交石斑鱼肠道菌群在门水平主要富集在Firmicutes、Proteobacteria、Bacteroidetes、Actinobacteria和Verrucomicrobia。这一结果与He等[68]对杂交石斑鱼肠道优势菌群的研究结果一致。这些菌门通常构成了杂交石斑鱼的肠道核心菌群,而与饮食类型无关。研究发现,Firmicutes、Proteobacteria、Bacteroidetes占各种海洋和淡水鱼类肠道微生物群的90%[69-71]。这些细菌在宿主肠道的营养吸收和免疫反应中发挥重要作用。
通常,肠道菌群的多样性越高,微生态系统越稳定,肠道菌群多样性降低可能导致细菌群落功能稳定性降低,增加机体患病风险[72]。分析菌群α多样性变化有助于从宏观上评估QS对杂交石斑鱼肠道菌群的影响。本试验中,QS添加不影响杂交石斑鱼肠道菌群的种类和丰富度。与FM组相比,QSL组的物种多样性和均匀度变化最显著。Xiong等[73]研究发现,幼虾发生疾病后肠道菌群组成会发生显著变化。
肠道中的微生物具有塑造炎症微环境的潜力,相反,炎症也可能会影响微生物的组成[74]。Jiang等[75]发现益生菌补充剂可通过抑制NF-κB信号通路的激活改善肠道微生物紊乱。这意味着肠道微生物失衡可能激活NF-κB信号通路导致肠炎。在本试验中,与FM组相比,QSL组Bacteroidetes相对丰度显著降低。谭蓉等[76]研究结果中肠道炎症伴随着Bacteroidetes相对丰度的下降。Lactobacillus、Bifidobacterium和Akkermansia是水产养殖领域最常用的益生菌种类,它们的减少会导致体内炎症和代谢紊乱[77]。进一步从属水平上发现,QSL组Akkermansia相对丰度显著降低。Wang等[78]发现固肠止泻丸可以降低与结肠炎呈正相关的Turicibacter的相对丰度,显著增加有益菌Ruminococcaceae_UCG-005的相对丰度。在本试验中,与FM组相比,QSM组Ruminococcaceae_UCG-005相对丰度显著降低。因此,QS可能通过直接或间接影响肠道炎症相关微生物的丰度调控NF-κB信号通路的激活。
4 结 论
① 饲料中添加QS不影响杂交石斑鱼的生长。
② 饲料中添加QS可以提高杂交石斑鱼的肝脏抗氧化能力。
③ QS通过增强肠道氧化应激、降低肠道Bacteroidetes和Akkermansia的相对丰度、激活肠道NF-κB信号通路,诱导杂交石斑鱼的肠道炎症反应。

