饲料添加L-精氨酸或N-氨甲酰谷氨酸对杂交鳢生长性能、血浆生化指标、肠道功能及抗氧化能力的影响
李培佳 侯冬强* 赵红霞 陈 冰 彭 凯 黄 文,3 郑春田 曹俊明
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广东海洋大学水产学院,湛江 524088;3.广州飞禧特生物科技有限公司,广州 510640)
精氨酸(Arg)作为鱼类必需氨基酸,参与机体蛋白质、肌酸等合成,对促进水生动物生长、提高机体抗氧化能力等方面极为重要[1]。研究结果表明,Arg可提高养殖动物饲料效率和蛋白质沉积率[2];降低血清谷草转氨酶、谷丙转氨酶活性,维持正常氨基酸代谢能力[3];提高肠道谷胱甘肽过氧化物酶活性,增强机体抗氧能力[4];降低肠道丙二醛含量,减少肠道氧化损伤[5]。N-氨甲酰谷氨酸(NCG)作为N-乙甲酰谷氨酸(NAG)类似物,可激活氨甲酰磷酸合酶-1(CPS-1),促进内源性Arg合成[6-7]。同时作为一种安全、代谢稳定的营养物质,可在治疗疾病有关的方面发挥有益作用[8]。然而,饲料中直接添加Arg在体内易被精氨酸酶降解,并且会影响机体对其他氨基酸的吸收效率。因此,利用NCG内源性合成Arg是目前解决Arg使用问题的可行方法,饲料中直接添加NCG,不仅代谢稳定性高,而且吸收效率强,相对于饲料补充Arg大幅降低了饲料成本。
杂交鳢子一代较斑鳢(Channamaculata)、乌鳢(ChannaArgus)在生长性能、抗病能力方面有显著优势。目前在水产养殖中,易驯食人工配合饲料,养殖周期短,珠三角养殖产量占比较高[9]。近年来,随着养殖产量不断攀升,营养性、微生物性疾病不断增多。本实验室开展了杂交鳢对Arg需要量的养殖试验,试验结果表明,杂交鳢Arg适宜水平为2.91%~2.98%[10]。目前,由于不同鱼种饲料添加Arg存在其他氨基酸吸收拮抗、投入成本太高等因素,因此内源性合成Arg途径成为高效经济的方法,但是关于NCG在水产动物饲料中的应用研究较少。NCG研究主要集中为内源性激活Arg,也有研究证明,饲料添加NCG可提高大菱鲆(Scophthalmusmaximus)的生长性能[11],改善镜鲤(Cyprinuscarpio)的机体免疫活性[12]。NCG在鱼类机体内可内源性合成Arg,生成的Arg与NCG比值为(10~20)∶1[13]。本实验室开展了Arg或NCG在黄颡鱼(Pelteobagrusfulvidraco)中的应用试验,发现黄颡鱼饲料中NCG的适宜添加水平是Arg适宜添加水平的1/20[14]。在黄颡鱼[14]、大菱鲆[11]、花鲈(Lateolabraxmaculatus)[15]、罗非鱼(Oreochromismossambicus)[16]、镜鲤[12]等水产动物中的研究表明,NCG在饲料中的适宜添加水平为0.03%左右。前期开展试验获得的杂交鳢饲料Arg适宜添加水平为0.6%[10],本试验NCG添加水平设计主要依据以上研究文献,按照杂交鳢饲料Arg适宜添加水平的1/20即0.03%添加。本试验通过在饲料中添加Arg或NCG,研究其对杂交鳢幼鱼生长性能、体成分、肠道功能、血浆生化指标及抗氧化能力的影响,为NCG在杂交鳢配合饲料中的应用提供理论依据。
1 材料与方法
1.1 试验饲料
基础饲料的主要原料为鱼粉、面粉、豆粕、玉米蛋白粉,在基础饲料中分别添加0(对照)、0.60% Arg(L-Arg,纯度≥98%)、0.03% NCG(纯度≥98%)配制成3种试验饲料。饲料Arg含量采用GB/T 18246—2019的常规酸水解法测定。饲料营养水平及维生素预混料、矿物质预混料添加水平按照乌鳢营养需求量添加[17]。试验饲料组成及营养水平见表1。

表1 试验饲料组成及营养水平(干物质基础)
根据饲料配方将原料粉碎,要求过60目筛,而后进行称量,称量后将其逐级混匀,加入磷脂油、豆油、鱼油、水进行再次混匀,混匀后,将原料置于膨化机内膨化制成膨化颗粒饲料(华强膨化机械T52型膨化机),而后将膨化饲料置于55 ℃温度烘干。
1.2 试验设计及养殖管理
将杂交鳢鱼苗(锦龙渔业有限公司)运输至广东省农业科学院动物科学研究所白云实验基地。鱼苗运回后在暂养网箱暂养1周,暂养网箱规格为2.5 m×2.5 m×1.5 m,暂养期每天饱食投喂2次基础饲料,暂养结束后饥饿24 h开始正式试验。随机挑选初始体重为(22.02±0.02)g、体格健壮的杂交鳢鱼苗450尾,随机分为3组,分别为对照组、0.60% Arg组、0.03% NCG组,每组3个重复(网箱),每个网箱50尾鱼,分别投喂3种试验饲料。
试验网箱规格为1.5 m×1.5 m×1.5 m,水体有效体积为293 L,饲喂8周。每天08:00、16:00定时表观饱食投喂2次,并根据水温、摄食和生长等因素调整投喂量,并记录摄食及死亡情况。每日对养殖环境进行检测,要求溶氧含量大约为8 mg/L,酸碱度大约为8.0,水温为25~32 ℃,氨氮含量小于0.1 mg/L。
1.3 样品采集及测定指标
1.3.1 生长性能和形态学指标
生长性能和形态学指标计算公式如下:
存活率(survival rate,SR,%)=100×F末/F初;增重率(weight gain rate,WGR,%)=100×(W末-W初)/W初;饲料系数(feed coefficient rate,FCR)=D总/(W末-W初);蛋白质沉积率(protein deposition rate,PDR,%)=100×(W末×CP末-W初×CP初)/(D×CP饲料);特定生长率(specific growth rate,SGR,%/d)=100×(LnW末-LnW初)/T;肥满度(condition factor,CF,g/cm3)=100×W/L3;肝体比(hepatopancreas somatic indices,HIS,%)=100×W肝脏/W;脏体比(viscera somatic indices,VSI,%)=100×W内脏/W。
式中:F初为初始尾数;F末为终末尾数;W为体重;L为体长;W初为初始鱼体重;W末为终末鱼体重;CP初为初始鱼体蛋白质含量;CP末为终末鱼体蛋白质含量;CP饲料为饲料蛋白质含量;D总为摄入饲料总重;D为饲料摄入量;T为养殖时间;W肝脏为肝脏重;W内脏为内脏重。
1.3.2 饲料营养水平及鱼体营养成分测定
养殖试验结束后进行样品采集,将试验鱼禁食24 h,记录每个试验网箱称重计数结果。随后从每个网箱中随机选取3尾鱼检测鱼体营养成分。饲料及鱼体粗蛋白质、粗脂肪、粗灰分、水分含量分别采用GB/T 6432—2018、GB/T 6433—2006、GB/T 6438—2007、GB/T 6435—2014的方法进行测定。
1.3.3 血浆制备及生化指标测定
从每个网箱中随机选取8尾鱼抽取血液制备血浆,首先采用浓度为120 mg/L MS-222溶液麻醉,尾静脉采血法采集血液,肝素钠抗凝管收集血液,将采集好的血液采用离心机4 000 r/min进行离心,离心时间10 min,制备血浆。
血浆总蛋白(total protein,TP)含量采用双缩脲法测定,谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)活性采用速率法测定,尿素氮(urea nitrogen,UN)含量采用酶偶联速率法测定,总胆固醇(total cholesterol,TCHO)、甘油三酯(triglyceride,TG)、葡萄糖(glucose,GLU)含量采用酶活性法测定。血浆生化指标采用的测定仪器均为全自动化分析仪(贝克曼ProCX4,德国)。
1.3.4 肠道消化酶、功能性指标及血浆抗氧化指标测定
从每个网箱中随机选取3尾鱼解剖后取肠道组织,进行肠道消化酶、功能性指标检测。采用南京建成生物工程研究所试剂盒测定肠道蛋白酶、脂肪酶(lipase,LPS)、淀粉酶(amylase,AMS)、Na+/K+ATP酶(sodium-potassium ATPase,Na+/K+ATPase)、γ-谷氨酰基转移酶(γ-glutamyltransferase,γ-GT),血浆超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)活性,总抗氧化能力(total antioxidant capacity,T-AOC)及丙二醛(malondialdehyde,MDA)含量,测定方法、步骤、计算公式等见试剂盒说明书。
1.4 数据统计与分析
试验数据分析结果均以平均值±标准差(mean±SD)表示,数据采用SPSS 25.0统计软件进行单因素方差分析,而后采用Duncan氏法进行多重比较,差异显著水平为P<0.05。
2 结果与分析
2.1 饲料添加Arg和NCG对杂交鳢生长性能及形态学指标的影响
由表3可知,与对照组和0.03% NCG组相比,饲料中添加0.60% Arg显著提高了杂交鳢WGR及SGR(P<0.05)。对照组和0.03% NCG组间杂交鳢WGR及SGR没有显著差异(P>0.05)。与对照组相比,饲料中添加0.60% Arg和0.03% NCG显著降低了杂交鳢FCR(P<0.05)。与对照组相比,饲料中添加0.60% Arg和0.03% NCG显著提高了杂交鳢的PDR及SR(P<0.05),0.60% Arg和0.03% NCG组间PDR和SR显著差异(P<0.05)。与对照组相比,各试验组CF、HSI、VSI无显著差异(P>0.05)。

表3 饲料添加Arg和NCG对杂交鳢鱼体成分的影响
2.2 饲料添加Arg和NCG对杂交鳢鱼体成分的影响
由表4可知,与对照组相比,饲料中添加0.60% Arg和0.03% NCG显著增加了杂交鳢全鱼CP含量(P<0.05)。饲料中添加0.60% Arg或0.03% NCG对杂交鳢全鱼水分、EE、Ash含量无显著影响(P>0.05)。

表4 饲料添加Arg和NCG对杂交鳢血浆生化指标的影响
2.3 饲料添加Arg和NCG对杂交鳢血浆生化指标的影响
由表5可知,饲料中添加0.60% Arg或0.03% NCG对杂交鳢血浆TP、TG、GLU、UN、TC含量及AST、ALT活性均无显著影响(P>0.05)。
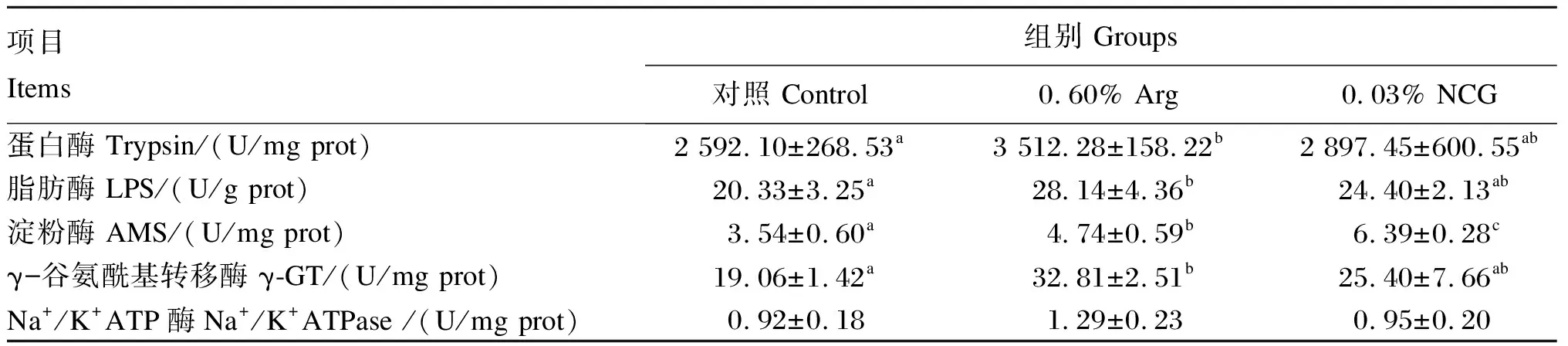
表5 饲料添加Arg和NCG对杂交鳢肠道消化酶活性及功能性指标的影响
2.4 饲料添加Arg和NCG对杂交鳢肠道消化酶活性及功能性指标的影响
由表6可知,与对照组相比,饲料中添加0.60% Arg显著增加了杂交鳢肠道蛋白酶、LPS、AMS和γ-GT活性(P<0.05)。与对照组和0.60% Arg组相比,饲料中添加0.03% NCG显著提高了杂交鳢肠道AMS活性(P<0.05)。饲料中添加0.60% Arg或0.03% NCG对杂交鳢肠道Na+/K+ATPase酶活性无显著影响(P>0.05)。

表6 饲料添加Arg和NCG对杂交鳢血浆抗氧化指标的影响
2.5 饲料添加Arg和NCG对杂交鳢血浆抗氧化指标的影响
由表7可知,与对照组相比,饲料中添加0.60% Arg显著提高了杂交鳢血浆T-AOC(P<0.05)。与对照组和0.60% Arg组相比,饲料中添加0.03% NCG显著提高了杂交鳢血浆POD活性(P<0.05)。0.60% Arg组杂交鳢血浆POD活性与对照组之间没有显著差异(P>0.05)。与0.60% Arg组相比,饲料中添加0.03% NCG显著提高了杂交鳢血浆CAT活性(P<0.05)。饲料中添加0.60% Arg或0.03% NCG对杂交鳢SOD、GSH-Px活性及MDA含量无显著影响(P>0.05)。

表2 饲料添加Arg和NCG对杂交鳢生长性能及形态学指标的影响
3 讨 论
由于水生动物鸟氨酸转羧化酶(OTC)、氨甲酰磷酸合成酶(CPS)Ⅲ的活性偏低,因此,必需外源补充Arg以满足鱼类生长和代谢所必需[1]。Arg可激活雷帕霉素靶蛋白(TOR)信号通路调节蛋白质合成,参与鸟氨酸循环,促进蛋白质在体内沉积,提高机体生长性能[18]。水生动物缺乏Arg会导致生长迟缓、免疫神经受损、营养障碍性疾病等[19]。在本试验条件下,饲料添加0.03% NCG对杂交鳢WGR及SGR没有显著影响,但添加0.60% Arg使饲料Arg含量达到2.92%,可显著提高杂交鳢WGR及SGR,可能由于杂交鳢对NCG合成的内源Arg利用效率低于饲料添加的Arg。但饲料中添加Arg和NCG可降低FCR,提高PDR。这表明外源添加Arg或NCG都可提高机体蛋白质沉积,提高生长效率。在本试验条件下,与对照组相比,饲料中添加Arg和NCG可提高PDR,并且提高杂交鳢鱼体CP含量,但对全鱼水分、EE、CF含量没有显著影响,说明适量添加Arg可有效促进鱼体蛋白质沉积,促进氨基酸吸收利用,提高肌肉品质。NCG作为NAG类似物,由于NAG易降解,NCG不易降解,并且与直接添加Arg相比,可降低饲料成本,提高代谢相对稳定性[13]。目前,在水产动物中关于Arg和NCG的应用研究效果较缺乏,并且在研究中还要考虑到添加量、试验动物种类以及实际生产成本等因素。
血浆生化指标直观反映鱼体健康水平、代谢能力及机体内环境稳态,也可反映机体病理变化[20]。在本研究中,杂交鳢血浆TP、TG、GLU、UN、TC含量及AST、ALT活性各组间均无显著差异,表明外源添加Arg或内源合成途径并未对杂交鳢机体产生不良影响。
肠道作为运输、消化食物的主要场所,是一个复杂的多功能器官,同时也是抵御病原微生物入侵的防线,对鱼类生长及健康非常重要[21]。本试验中,与对照组及0.60% Arg组相比较,饲料添加0.03% NCG显著增加了杂交鳢肠道AMS活性,饲料添加Arg可显著提高仿刺参蛋白酶活性[22],显著提高建鲤蛋白酶及LPS活性[23],与本试验研究结果相同,但NCG在水产动物消化方面研究相对较少。本试验结果表明,在饲料中添加Arg可显著促进营养物质交换,提高杂交鳢肠道酶活性及能量转化效率,但Arg代谢物多胺可作用于细胞增殖分化,同时保护肠道的完整性[24],Arg在促进营养物质消化吸收方面的作用不仅取决于消化酶的活性,还可能与其代谢产物如一氧化氮或多胺有关。研究显示,饲料补充NCG可促进罗非鱼脂肪沉积[16],显著提高黄颡鱼肠道LPS活性[25],显著提高大菱鲆PDR[11],显著提高花鲈PDR,减少肝腹脂沉积[15]。本试验结果表明,添加Arg提高肠道蛋白酶活性,作用于机体蛋白质合成,促进机体生长,但NCG只显著提高了肠道AMS活性,与上述研究结果不一致,原因可能由于内源性合成Arg利用效率低,或与添加量及动物种类相关联。
在水生动物中,机体抗氧化防御系统通过清除体内外氧自由基,减少内外环境因素造成的氧化应激,保护机体免受氧自由基损伤,其中抗氧化酶的保护机制主要与清除ROS相关,抗氧化防御系统由SOD、GSH-Px、T-AOC等组成,调节机体氧化平衡[26-27]。在本试验条件下,与对照组相比,饲料添加0.60% Arg显著增强了杂交鳢血浆T-AOC,T-AOC是机体抗氧化能力的综合指标,直接参与并反映机体受外部刺激及氧自由基代谢的能力。与0.60% Arg组相比,0.03% NCG组显著提高杂交鳢血浆CAT及POD活性,NCG的抗氧化活性效果要优于Arg。
4 结 论
综上所述,饲料中添加0.60% Arg或0.03% NCG均能显著增强杂交鳢PDR、鱼体CP含量、肠道LPS及γ-GT活性、血浆T-AOC。而饲料中添加0.03% NCG显著提高了杂交鳢血浆CAT、POD活性。在本试验条件下,饲料中添加Arg在生长性能上优于NCG,但对抗氧化能力而言,饲料中添加NCG效果优于Arg。

