不同LED光谱环境对许氏平鲉幼鱼肌肉营养成分与品质的影响
孙 飞 吴燕玲 蔡皓玮 刘松涛 李 鑫 房莹莹 刘 鹰 韩 蕊 马 贺*
(1.大连海洋大学设施渔业教育部重点实验室,大连 116023;2.大连海洋大学海洋科技与环境学院,大连 116023;3.大连海洋大学水产与生命学院,大连 116023;4.浙江大学生物系统工程与食品科学学院,杭州 310058)
光作为重要且复杂的生态环境因子之一,可以直接或间接地影响水生动物的生长、存活等[1]。近年来,光谱环境对养殖鱼类生长发育的相关研究正广泛受到人们的关注。很多研究表明,光谱环境对养殖鱼类生长的影响具有种属差异性。例如,虹鳟(Oncorhynchusmykiss)和金头鲷(Sparusaurata)的生长均受到红光和蓝光的抑制[2],而蓝光对大西洋鳕(Gadusmorhua)和大菱鲆(Scophthalmusmaximus)则具有促生长作用[3];对红鳍东方鲀(Takifugurubripes)而言,随着生物体由仔稚鱼发育至幼鱼阶段,能够促进其生长发育的光谱环境也从蓝光转变为绿光[4-5]。此外,还有证据表明,不同光谱环境还能对硬骨鱼类的激素分泌产生影响,如暴露在高光照度的蓝光下,大西洋鲑(Salmosalar)在3 h内血浆皮质醇和葡萄糖水平均呈上升趋势[6]。同时,关于光对鱼类肌肉营养品质的影响目前已有一些研究报道,如李鑫等[7]研究发现,8L∶16D和12L∶12D光周期下欧洲舌齿鲈(Dicentrarchuslabrax)肌肉胶原蛋白含量丰富,肌肉品质较高。狄正凯等[8]证实,墨瑞鳕(Maccullochellapeelii)幼鱼在1 500 lx光照度和18L∶16D光周期条件下肌肉中粗灰分和粗脂肪含量最高。还有研究发现,红光会增强尼罗罗非鱼(Oreochromisniloticus)的食欲,使体内脂肪含量增多[9-10],而绿光会促进条斑星鲽(Veraspermoseri)的摄食行为,有利于营养物质在其体内的积累[11];另外,绿光还可以提升欧洲舌齿鲈肌肉蛋白质的含量,改善其肌肉品质,增加营养价值与经济效益[12]。目前水产养殖产业对人工光源的应用及关注依然较少,有关光照对海水鱼影响的科学研究比较缺乏,导致目前设施养殖过程中光照的调控没有理论依据可循,而关于不同光源对鱼类肌肉品质的影响研究则更少,其作用的机制更未涉及。因此,探寻光照对鱼类生长品质及机理研究具有重要的理论意义及应用价值。
许氏平鲉(Sebastesschlegelii)又名黑鲪,隶属于鲉形目(Scorpaeniformes)鲉科(Scorpaenidae)平鲉属(Sebastes),属卵胎生繁殖,一次性产仔类型鱼类。它广泛分布于北半球温带水域,是我国黄渤海常见的经济鱼类之一。由于其肉质鲜嫩、生长快且抗病力强,因此在北方沿海地区得到广泛养殖[13]。目前关于许氏平鲉的摄食与生长[14]、人工繁育[15]、生理[16]、肌肉发育[17]等方面已有较多研究,不少学者也阐述了光对许氏平鲉的生理生态的影响[18-19],而关于光谱环境对许氏平鲉肌肉营养品质的研究还未见报道。因此,本试验选取5种常见的LED光谱环境(蓝光、绿光、黄光、红光、白光),对这些光谱环境对许氏平鲉肌肉营养品质的影响进行研究,以期为我国许氏平鲉水产养殖中LED光谱环境的针对性调控提供参考依据。
1 材料与方法
1.1 试验动物与饲料
试验所用许氏平鲉幼鱼源自大连天正实业有限公司。将许氏平鲉幼鱼运至实验室后,养殖在圆柱形水箱(直径:80 cm,内高:60 cm,容积:250 L)进行为期1周的驯化,使其适应养殖环境。采用商业浮性饲料进行投喂,饲料主要营养源包括进口南极磷虾粉、白鱼粉、鱿鱼粉、深海鱿鱼油及各种维生素和矿物质等,其营养水平见表1。每天08:30和16:30各饱食投喂1次。1周后选取750尾均质健康的许氏平鲉幼鱼进行试验。

表1 饲料营养水平(风干基础)
1.2 试验设计
本试验设置5个LED光谱组,分别为白光组、蓝光组、绿光组、黄光组、红光组,每组设3个重复,即放置3个养殖桶(灰白色PE材质圆柱型桶,直径80 cm,内高60 cm)。试验在设施渔业教育部重点实验室养殖间进行,各处理之间采用遮光布进行遮盖形成封闭隔间,以免造成光源的交叉类试验误差;每个隔间内试验光源为LED灯(型号为GK5A,由中国科学院半导体研究所提供设计,深圳超频三科技股份有限公司生产),灯具共5种光色,分别为白光(λ400~780 nm)、蓝光(λ450~455 nm)、绿光(λ525~530 nm)、黄光(λ590~595 nm)、红光(λ625~630 nm),按照试验设计将5种光色的LED灯安装在养殖水面正上方1 m处。
试验开始时,每桶随机放入50尾驯化后的许氏平鲉幼鱼,体质量为(38.80±0.43)g、体长为(10.20±0.17)cm,共750尾,试验周期为60 d。试验期间,每天08:30和16:30各投喂1次,每日投喂饲料的重量按每养殖桶内鱼体总质量的2%进行计算;各组光周期设定为12L∶12D(由电子定时器进行控制),光照度均设定为(250±20)mW/m2[5]。每日08:30采用光谱照度计(SRI-2000UV,尚泽光电股份有限公司,中国台湾)进行测量并调整。试验期间采用24 h流水养殖,水温为19~23 ℃,pH 7.0~8.0,盐度保持在27~30区间内,连续曝气,保持溶氧浓度>6 mg/L。每天吸底2次清理残饵粪便,分别在投喂30 min后进行。
1.3 样品采集
试验结束后,每个养殖桶随机选取2尾鱼,每个组共取6尾,麻醉后于冰盘上尽快解剖,取鱼脊背两侧背鳍中点以下水平膈肌上方的白色肌肉,去鳞、去皮,用去离子水冲洗干净。然后取2尾鱼的肌肉组织于多聚甲醛固定液中保存,其余放入标记好的冻存管中并立即冷冻于液氮中,随后放入-80 ℃超低温冰箱保存,用于后续样品的制备与测定。
1.4 测定方法
1.4.1 肌肉组织切片的制备
将肌肉组织从固定液取出,进行无水乙醇脱水。用石蜡对组织进行包埋,用徕卡RM-2016切片机(上海徕卡仪器有限公司)连续切片,厚度为4.0~4.5 μm。经40 ℃水浴展片,60 ℃烘干。切片经二甲苯脱蜡,乙醇梯度脱水,苏木素-伊红(HE)染色,最后用中性树胶封片,于室温晾干后保存。使用正置光学显微镜(Nikon eclipse-e100,尼康,日本)观察肌纤维形态,Case Viewe 2.4软件对白肌组织切片进行肌纤维直径测量。测量时尽量选取同一位置鱼脊背两侧背鳍中点以下水平膈肌上方的肌肉切片,在约1 cm2大小的范围进行肌纤维直径的测量。
1.4.2 饲料和肌肉中常规营养成分含量的测定
根据国家标准检测方法测定常规营养成分含量,其中水分含量采用105 ℃干燥法(GB 5009.3—2016)测定;粗蛋白质含量采用凯氏定氮法(GB 5009.5—2016),使用K9840凯氏定氮仪测定;粗脂肪含量采用索氏抽提法(GB 5009.168—2016),使用SZF-06A型粗脂肪测定仪测定;粗灰分含量采用马弗炉550 ℃灼烧法(GB 5009.3—2016)测定。
1.4.3 肌肉中氨基酸组成的测定
取-80 ℃低温保存的适量肌肉样品,按照 GB/T 5009.124—2003的方法前处理。先在水解管中加入10~15 mL 6 mol/L盐酸溶液,将水解管放入冷冻剂中,冷冻3~5 min,充氮保护,拧紧瓶盖,将水解管放在(110±1)℃的电热鼓风恒温箱中水解22 h后,取出,冷却至室温。打开水解管,将水解液过滤至50 mL容量瓶中,用少量水多次冲洗水解管,水洗液移入同一50 mL容量瓶内,最后用水定容至刻度,摇匀。准确吸取1.0 mL滤液移入至15 mL试管内,40 ℃减压至干,用1.0 mL pH 2.2的柠檬酸钠缓冲溶液附溶,振荡混匀后,过0.22 μm滤膜后,使用日立LA-8080氨基酸自动分析仪测定肌肉中氨基酸含量。色谱柱:磺酸型阳离子树脂;波长:570和440 nm;进样量:500 μL;反应温度:(135±5)℃。
1.4.4 肌肉中脂肪酸组成的测定
参照GB 5009.168—2016的方法进行样品预处理。称取适量肌肉样品于50 mL烧瓶,加入约100 mg焦性没食子酸,加入几粒沸石,再加入2 mL 95%乙醇,混匀后加入盐酸溶液10 mL,将烧瓶放入70~80 ℃水浴中水解40 min。每隔10 min振荡一下烧瓶,使黏附在烧瓶壁上的颗粒物混入溶液中。水解完成后,取出烧瓶冷却至室温。
脂肪的提取:在水解后的试样中加入10 mL 95%乙醇,混匀。将烧瓶中的水解液转移到分液漏斗中,用50 mL乙醚-石油醚混合液冲洗烧瓶和塞子,冲洗液并入分液漏斗中,加盖,振摇5 min,静置10 min。将醚层提取液收集到250 mL烧瓶中。按照以上步骤重复提取水解液3次,最后用乙醚-石油醚混合液冲洗分液漏斗,并收集到已恒重的烧瓶中,将烧瓶置水浴上蒸干,置(100±5)℃烘箱中干燥2 h。
脂肪的皂化和脂肪酸的甲酯化:在脂肪提取物中继续加入2 mL 2%氢氧化钠甲醇溶液,85 ℃水浴锅中水浴30 min,加入3 mL 14%三氟化硼甲醇溶液,于85 ℃水浴锅中水浴30 min。水浴完成后,等温度降到室温,在离心管中加入1 mL正己烷,振荡萃取2 min之后,静置1 h,等待分层。取上层清液100 μL,用正己烷定容到1 mL,0.45 μm滤膜过膜。使用型号为Agilent-7890A气相色谱仪进行检测,按外标法定量计算脂肪酸的含量。
1.4.5 肌肉中羟脯氨酸和胶原蛋白含量测定
取-80 ℃超低温冰箱中保存的肌肉组织,按南京建成生物工程研究所的试剂盒按照说明书进行羟脯氨酸含量测定。先准确称量样品30~100 mg,放入试管中,准确加水解液1 mL,混匀;加盖后95 ℃或者沸水浴水解20 min(水解10 min时混匀1次,目的是使水解更充分);调pH至6.0~6.8。最后混匀,60 ℃水浴15 min,冷却后,3 500 r/min离心10 min,取上清于波长550 nm(1 cm光径,双蒸水调零)测定各管吸光度值。羟脯氨酸含量计算公式如下:
羟脯氨酸含量(μg/mg湿重)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×标准品含量(5 μg/mL)×{[水解液总体积(10 mL)]/[组织湿重(mg)]};
将羟脯氨酸含量转换为用百分比(%)表示后计算胶原蛋白含量,计算公式如下:
胶原蛋白含量(%)=羟脯氨酸含量(%)×11.1。
1.5 肌肉营养品质评价
根据目前养殖鱼类的营养品质评价方法,肌肉营养品质评价所涉及的氨基酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI)均根据1973年联合国粮农组织/世界卫生组织(FAO/WHO)提出的每克氨基酸评分标准模式和1991年中国预防医学科学院营养与食品卫生研究所提出的全鸡蛋蛋白质的氨基酸模式进行比较,计算方法同李鑫等[7]的报道,具体计算如下:

式中:aa为检测样品中某种氨基酸含量(mg/g);AA(FAO/WHO)为FAO/WHO评价标准中同种氨基酸含量(mg/g);AA(egg)为全鸡蛋蛋白质中同种氨基酸含量(mg/g);n为比较的必需氨基酸个数;A,B,C…H为试验鱼肌肉中蛋白质的必需氨基酸含量(mg/g);AE,BE,CE…HE为全鸡蛋蛋白质的必需氨基酸含量(mg/g)。
1.6 数据处理
采用SPSS 26.0软件的单因素方差分析(one-way ANOVA)程序进行统计处理,并采用Duncan氏法进行多重比较检验,P<0.05为差异显著。分析所得数据用Origin 2017软件进行绘图。
2 结果与分析
2.1 不同LED光谱环境下许氏平鲉幼鱼肌纤维的形态学观察
不同LED光谱环境下的肌纤维纵切图如图1所示,可以发现,不同LED光谱环境下许氏平鲉幼鱼的肌纤维形态不同,其中绿光组肌纤维间隙较大,其次是白光组和红光组,黄光组肌纤维间隙较为紧密。如表2所示,蓝光组中肌纤维直径最大,为(105.04±11.78)μm,其次是绿光组,为(87.10±6.60)μm,黄光组最小,为(62.04±4.59)μm,且蓝光组、绿光组和红光组的肌纤维直径显著大于黄光组和白光组(P<0.05)。

A:蓝光组肌纤维纵切面;B:绿光组肌纤维纵切面;C:红光组肌纤维纵切面;D:黄光组肌纤维纵切面;E:白光组肌纤维纵切面。标尺均为500 μm。

表2 不同LED光谱环境下许氏平鲉的肌纤维直径统计
2.2 不同LED光谱环境下许氏平鲉幼鱼肌肉中常规营养成分含量
由表3可知,各组肌肉粗灰分、水分、粗蛋白质含量差异不显著(P>0.05)。白光组肌肉粗脂肪含量最高,显著高于红光组和黄光组(P<0.05),与绿光组和蓝光组则不存在显著差异(P>0.05)。
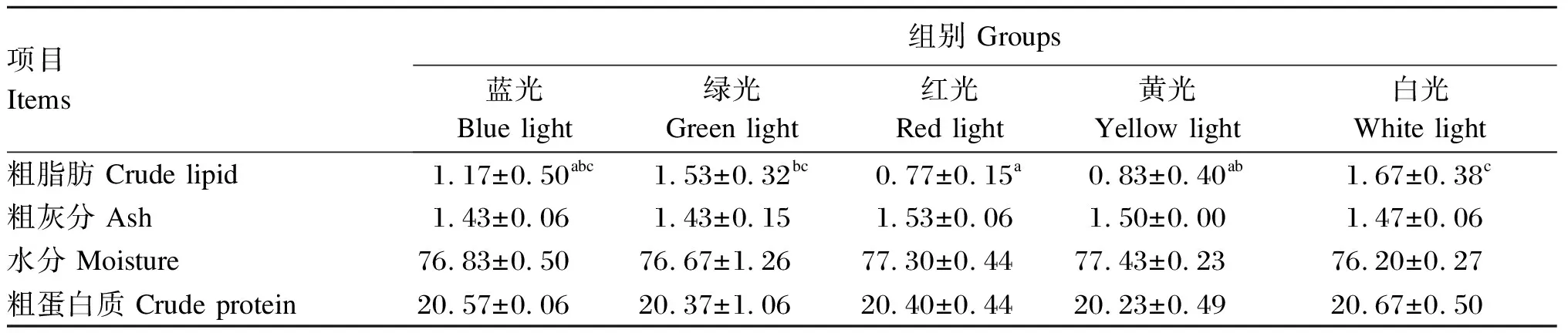
表3 不同LED光谱环境下许氏平鲉幼鱼肌肉中常规营养成分含量(鲜样基础)
2.3 不同LED光谱环境下许氏平鲉幼鱼肌肉中羟脯氨酸和胶原蛋白含量
如图2-A所示,在不同LED光谱环境下肌肉中羟脯氨酸含量分别为0.02%(红光组)、0.02%(黄光组)、0.06%(蓝光组)、0.03%(绿光组)、0.08%(白光组),其中白光组和蓝光组羟脯氨酸含量显著高于其他3个组(P<0.05),白光组和蓝光组之间以及绿光组、红光组和黄光组之间没有显著差异(P>0.05);肌肉中对应的胶原蛋白含量分别为0.22%(红光组)、0.22%(黄光组)、0.67%(蓝光组)、0.33%(绿光组)、0.89%(白光组),且各组间肌肉胶原蛋白含量的差异显著性同羟脯氨酸含量一致(图2-B)。

数据柱标注不同小写字母表示差异显著(P<0.05)。
2.4 不同LED光谱环境下许氏平鲉幼鱼的肌肉氨基酸组成与营养品质评价
2.4.1 不同LED光谱环境下许氏平鲉幼鱼的肌肉氨基酸组成
由表4可知,不同LED光谱环境下养殖的许氏平鲉肌肉中均检测出17种氨基酸(色氨酸未测),其中非必需氨基酸(NEAA)8种、半必需氨基酸(HEAA)2种、必需氨基酸(EAA)7种。方差分析结果显示,蓝光组的甘氨酸含量最高,其次是红光组,且2组的甘氨酸含量均显著高于绿光组和白光组(P<0.05),以白光组的甘氨酸含量最低;此外,谷氨酸含量在不同LED光谱环境中是最高的,其在白光组、蓝光组、绿光组、黄光组、红光组中的含量分别为13.37%、13.86%、13.99%、14.55%、13.70%,然后含量从高到低依次为天冬氨酸、赖氨酸、亮氨酸、精氨酸,含量最低的是丙氨酸,其在白光组、蓝光组、绿光组、黄光组、红光组中的含量分别为0.57%、0.69%、0.57%、0.63%、0.52%;许氏平鲉肌肉的必需氨基酸/非必需氨基酸在76.49%~78.46%,必需氨基酸/总氨基酸在38.10%~38.69%,各组间差异不显著(P>0.05)。

表4 不同LED光谱环境下许氏平鲉幼鱼的肌肉氨基酸组成(干物质基础)
2.4.2 不同光谱环境下许氏平鲉幼鱼的肌肉营养品质评价
由表5可知,不同LED光谱环境下许氏平鲉肌肉中必需氨基酸的含量不同,其中黄光组含量最高,为2 796.43 mg/g N,其次是绿光组(2 739.12 mg/g N)、蓝光组(2 653.68 mg/g N)和白光组(2 645.41 mg/g N),红光组最低,为2 635.81 mg/g N,均高于FAO/WHO模式(2 250 mg/g N)。不同LED光谱环境下许氏平鲉肌肉中赖氨酸和苏氨酸含量均超出FAO/WHO模式和全鸡蛋蛋白质的氨基酸模式,除红光组外,各组亮氨酸含量均超出FAO/WHO模式(440 mg/g N)和全鸡蛋蛋白质的氨基酸模式(534 mg/g N)。另外,白光组检测到的蛋氨酸+半胱氨酸含量低于其他各组。

表5 不同LED光谱环境下许氏平鲉幼鱼肌肉中必需氨基酸含量与FAO/WHO模式和全鸡蛋蛋白质的氨基酸模式比较
由表6可知,不同LED光谱环境下许氏平鲉幼鱼肌肉必需氨基酸的AAS均接近或大于1.00,CS均大于0.50,并且各必需氨基酸的AAS和CS基本上都符合黄光组最高,绿光组次之,红光组最低的规律。此外,由AAS和CS可知,5种LED光谱环境下许氏平鲉幼鱼肌肉中的第一限制性氨基酸均为缬氨酸。对于EAAI,以黄光组最高,其次是绿光组,而后是蓝光组、白光组,红光组最低。

表6 不同LED光谱环境下许氏平鲉幼鱼肌肉必需氨基酸的AAS、CS和EAAI比较
2.5 不同LED光谱环境下许氏平鲉幼鱼的肌肉脂肪酸组成
不同LED光谱环境下许氏平鲉幼鱼的肌肉脂肪酸组成如表7所示。各组许氏平鲉幼鱼肌肉脂肪酸组成相似,均检测出16种脂肪酸,其中饱和脂肪酸(SFA)6种,单不饱和脂肪酸(MUFA)4种,多不饱和脂肪酸(PUFA)6种。肌肉中各脂肪酸含量普遍表现为绿光组最高,其次是蓝光组,再次是白光组,红光组最低。在饱和脂肪酸中,绿光组的C16∶0含量最高,其次为蓝光组,黄光组和红光组中C15∶0含量最低;在单不饱和脂肪酸中,各组均以C16∶1含量最高,其中绿光组最高,红光组最低;多不饱和脂肪酸中,以C18∶1n-9c含量最高,其次是C20∶5n-3(EPA)、C22∶6n-3(DHA)。各组之间各脂肪酸含量差异均不显著(P>0.05)。

表7 不同LED光谱环境下许氏平鲉幼鱼的肌肉脂肪酸组成(干物质基础)
3 讨 论
3.1 不同LED光谱环境对许氏平鲉幼鱼肌纤维的影响
大多数鱼类的肌肉呈非限定性生长模式,即通过肌纤维增生和肥大2种方式生长,但具体生长速率因鱼种类不同而略有差异。鱼类在早期生长发育中肌肉细胞会先经历分层生长阶段,以增加肌纤维数量,随后转变为嵌合生长,这一阶段会伴随肌细胞的增大[20-21]。王梦娅等[17]研究发现,许氏平鲉幼鱼阶段肌肉生长主要方式为肌纤维肥大,同时存在肌纤维数量的增加。本试验中,蓝光组和绿光组许氏平鲉幼鱼肌纤维直径大于其他组,表明蓝光和绿光可能有利于许氏平鲉幼鱼肌纤维的生长。但目前关于光谱环境影响鱼类肌肉生长方面的研究仍知之甚少,不同光谱环境对许氏平鲉幼鱼肌纤维生长方式的调控机制还尚不清晰。
3.2 不同LED光谱环境对许氏平鲉幼鱼肌肉中常规营养成分含量的影响
经济鱼类最重要的可食用部分是肌肉组织,其营养成分主要是粗灰分、粗蛋白质、粗脂肪等[22-23]。本试验得出的结果表明,白光组的肌肉粗脂肪含量最高,绿光组和蓝光组次之,黄光组再次之,红光组最低。费凡等[12]在研究不同光谱处理对欧洲舌齿鲈肌肉营养品质的影响时发现,绿光处理下肌肉的粗脂肪含量显著高于其他光谱处理,而红光处理下肌肉粗脂肪含量最低。本研究也得出了类似的结果,红光组许氏平鲉幼鱼肌肉中粗脂肪含量较低,而蓝光组、绿光组和白光组表现出较好效果,而肌肉中粗蛋白质、水分、粗灰分含量在所有不同LED光谱环境下差异并不显著。有研究发现,应激可能会影响鱼类的营养组分,如饥饿状态的下许氏平鲉会分解自身贮存的营养物质,使机体的有机物质含量减少,而水分和粗灰分含量则会相对增加[24];再比如低温胁迫下的许氏平鲉,在长时间低温胁迫过程中,鱼体主要靠消耗脂肪作为能量来源,而水分的相对含量则会逐渐增加[25]。因此,不利的光谱环境可能也会对鱼类产生胁迫,红光组和黄光组许氏平鲉幼鱼肌肉中粗脂肪含量降低的原因也可能为应激胁迫所致,但具体原因还需要开展进一步的研究来证实。
3.3 不同LED光谱环境对许氏平鲉幼鱼肌肉中胶原蛋白含量的影响
目前研究证明,许氏平鲉肌肉表层的胶原蛋白多为Ⅰ型胶原蛋白(COLⅠ),该蛋白具有三重螺旋结构且纯度较高。作为鱼类体内结缔组织重要的组成部分,胶原蛋白含量的高低也是评价肌肉营养价值和品质的关键指标[26-27]。许多研究表明,鱼类肌肉中胶原蛋白含量与肌肉嫩度之间存在负相关关系,但与肌肉柔韧性之间却是明显的正相关关系[28]。通常来说,胶原蛋白通过分子间交联影响胶原纤维的稳定性,在鱼类发育过程中非还原性交联会增加,从而增强肌肉韧性[29];未成熟交联比例越高,鱼体内肌肉胶原蛋白合成量越多[30]。本研究中,白光组和蓝光组许氏平鲉幼鱼肌肉中胶原蛋白含量较高,且与其他组差异显著,说明白光、蓝光均可以提高许氏平鲉幼鱼肌肉中胶原蛋白含量,增加肌肉的柔韧性,进而提升肌肉营养品质。然而,不同光谱环境是否影响了许氏平鲉肌肉中胶原蛋白分子间交联过程,最终导致胶原蛋白含量不同还需进一步验证。
3.4 不同LED光谱环境下许氏平鲉幼鱼的肌肉氨基酸组成与营养品质评价
蛋白质是食物中主要的营养成分,主要由多种氨基酸组成,鱼类肌肉的鲜美程度与其鲜味氨基酸含量密切相关。有研究证明,绿光下养殖的豹纹鳃棘鲈幼鱼的肌肉具有较高的鲜味,尤其是天冬氨酸、谷氨酸等呈味氨基酸含量较高[22]。甘氨酸不仅可以提高鱼类肌肉的鲜味,还可以提高鱼类的抗氧化应激能力,例如,研究发现,饲料中加入一定量的甘氨酸会有效提升大黄鱼的抗氧化和抗应激水平[31]。本试验结果发现,白光组许氏平鲉幼鱼肌肉中甘氨酸含量最低,其原因可能是白光抑制了许氏平鲉幼鱼肌肉中甘氨酸的合成;除甘氨酸外,其余氨基酸的含量在不同LED光谱环境下均未发现有显著差异。
按照FAO/WHO的理想模式,组成蛋白质的氨基酸中EAA/NEAA和EAA/TAA应该分别在60%以上和40%左右才能称之为优质蛋白质[32]。在本试验中,不同LED光谱环境下许氏平鲉幼鱼肌肉EAA/TAA都约为38%,EAA/NEAA为77%左右,这些数据表明许氏平鲉幼鱼肌肉中的蛋白质较为优质。EAAI是评价蛋白质营养价值的常用指标之一,EAAI越高,氨基酸组成越均衡,蛋白质的营养品质越高。本试验中,黄光组和绿光组EAAI较高,红光组最低,EAAI从高至低依次为黄光组、绿光组、蓝光组、白光组、红光组。因此,在黄光和绿光下许氏平鲉的肌肉氨基酸组成更符合优质蛋白质标准。
3.5 不同LED光谱环境下许氏平鲉幼鱼的肌肉脂肪酸组成评价
脂肪酸可分为饱和脂肪酸与不饱和脂肪酸,它是磷脂、中性脂肪和糖脂的主要成分[33]。鱼类肌肉中含有丰富的脂肪酸,其中饱和脂肪酸是鱼体首要的能量来源。有研究表明,光谱实际上会影响欧洲舌齿鲈肌肉中脂肪酸的含量[12],当鱼类受到应激刺激时,体内的C16∶0会被优先作为能量利用[34]。此外,鱼类肌肉中含有较高的不饱和脂肪酸,可以提高肌肉的鲜味度和多汁性[32]。本试验中,饱和脂肪酸中C16∶0、C14∶0和C18∶0的含量占比较高,而黄光组和红光组中C16∶0含量较低,可能是由于许氏平鲉幼鱼在这2种LED光谱环境下处于胁迫状态,从而消耗了更多能量。不同LED光谱环境下许氏平鲉幼鱼肌肉中不饱和脂肪酸含量占比均较高,表明许氏平鲉幼鱼肌肉具有较好的风味。有研究表明,EPA、DHA不仅具有降血脂、降血压的作用[35],还能够促进大脑发育并减缓衰老[36-37]。本试验结果显示,绿光组许氏平鲉幼鱼肌肉中EPA+DHA含量最高,蓝光组次之,黄光组最低,但总体差异不显著。
综上所述,LED光谱环境对许氏平鲉幼鱼肌肉生长以及营养成分和品质均产生了一定影响,但总体来看,与红光和黄光相比,蓝光、绿光及白光对许氏平鲉幼鱼的肌肉营养品质稍有改善。有研究发现,红光、绿光和白光均促进了欧洲舌齿鲈幼鱼的生长,而与红光和白光相比,绿光还显著提升了欧洲舌齿鲈幼鱼的肌肉品质[12,38]。因此,在实际应用中,还需结合光谱环境对生长指标等的影响,综合选择较为适宜的光谱环境。
4 结 论
5种LED光谱环境对许氏平鲉幼鱼肌肉生长以及营养成分和品质均产生了一定影响。与红光和黄光相比,蓝光、绿光及白光对许氏平鲉幼鱼的肌肉营养品质稍有改善。

