基于代谢组学技术研究枸杞多糖对雏鸡免疫抑制的拮抗机制
王建东 唐玉林 王 敏 张宝锁 杨富强 高海慧 于 洋 郭延生* 梁小军**
(1.宁夏农林科学院动物科学研究所,银川 750002;2.宁夏大学农学院,银川 750021;3.宁夏银川市妇幼保健院,银川 750001;4.宁夏顺宝现代农业股份有限公司,青铜峡 751600)
免疫抑制是指动物机体存在免疫功能障碍,导致免疫力下降,进而更容易受到病原的侵害,这在很大程度上制约了畜禽业的健康发展[1]。因此,为消除或改善畜禽免疫抑制情况,寻找一种副作用小且无残留的免疫增强剂来代替抗生素等化学药物成为目前亟待解决的问题。枸杞(Lyciumbarbarum)是一种药食同源中药,具有滋肝补肾、益精明目之功效[2]。现代大量药理研究表明,枸杞具有增强免疫、促生长的作用,而枸杞多糖(Lyciumbarbarumpolysaccharide,LBP)是其发挥功效的主要活性成分之一[3-4]。经研究证实,LBP具有抗氧化[5-6]、抗炎[7-8]、保护神经[9]、降血糖血脂[10]、调节免疫[11-12]等功能。Long等[13]研究表明,在肉鸡饲粮中添加2 000 mg/kg LBP能显著改善其生长性能,提高机体抗氧化能力,并增加血清中免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和γ-干扰素(IFN-γ)的含量,从而达到增强免疫的作用。本课题组前期研究也证实,在肉雏鸡饲粮中添加LBP有助于提高血清中IgG含量及促进免疫器官脾脏和法氏囊的发育[14];此外,通过饮水方式给予LBP能够提高环磷酰胺诱导免疫抑制雏鸡外周血淋巴细胞转化率和脾脏生发中心数量[15],但相关作用机制尚不明确。因此,本试验采用超高效液相色谱串联三重四级杆飞行时间质谱(UHPLC-Triple-TOF-MS)代谢组学技术研究枸杞多糖对免疫抑制雏鸡脾脏代谢物的影响,旨在揭示枸杞多糖干预免疫抑制雏鸡的生物标志物并探讨其保护机制。
1 材料与方法
1.1 试验动物分组与处理
将120羽1日龄海兰褐蛋鸡(购自北京市华都峪口禽业有限公司)适应性饲养至7日龄后随机分成3个组,即空白组(NC组)、环磷酰胺组(CY组)及枸杞多糖组(CYLbGp组),每组40羽,除NC组外,其余2组连续3 d按照80 mg/(kg·d)的剂量胸肌注射环磷酰胺溶液(以生理盐水为溶剂)进行造模[16],NC组胸肌注射等体积的生理盐水,造模后CYLbGp组通过饮水的方式给予5 mg/(kg·d)枸杞多糖(购自于宁夏天某生物科技股份有限公司,纯度>90%),持续30 d,并观察各组鸡的外观、状态及饮食情况。
1.2 脾脏采集与预处理
在CYLbGp组给药结束后第1天,每组随机选取6只鸡称重,随后取下脾脏称重,记录数据计算脾脏指数[脾脏指数(%)=100×脾重(g)/体重(g)]。随后将脾脏置于冻存管中,-80 ℃超低温冰箱保存。
取出脾脏样品,在低温环境下精确称取50 mg样品至2 mL离心管中,加入1颗直径6 mm的研磨珠、400 μL提取液(甲醇和水体积比4∶1)和0.02 mg/mL的L-2-氯苯丙氨酸,放到冷冻组织研磨仪研磨6 min(-10 ℃,50 Hz),低温超声提取30 min(5 ℃,40 kHz),随后将样品置于-20 ℃静置30 min,再离心15 min(13 000×g,4 ℃),移取上清液至带内插管的进样小瓶中上机分析。
1.3 UHPLC-Triple-TOF-MS分析
色谱条件:采用AB SCIEX ExionLC AD System超高效液相色谱进行色谱分析,色谱柱选择美国Waters公司的ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm),柱温设置为40 ℃;流动相A为95%水+5%乙腈(含0.1%甲酸),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸),梯度洗脱程序设置为:0~2.5 min,0~25%B;2.5~9 min,25%~100%B;9~13 min,100%B;13~13.1 min,100%~0 B;13.1~16 min,0 B;流速为0.40 mL/min,进样量为10 μL。
质谱条件:采用AB SCIEX-Triple TOF 5600+质谱仪进行质谱分析,电喷雾离子源温度为550 ℃,正、负极电压分别为5 000和-4 000 V,离子源气体G1、G2和气帘气分别为50、50和30 psi,根据优化的去簇电压(80 V)和碰撞能(40±20)对在三重四级杆(Qtrap)中的离子对进行扫描检测(范围50~1 000,循环时间510 ms)。
1.4 数据处理与分析
将液相色谱质谱(LC-MS)原始数据导入ProgenesisQI(Waters公司,美国)软件,按每组内缺失值>20%去除特征值,缺失值采用极小值填补,并按总和进行归一化处理,再剔除质控(QC)样本中相对标准偏差>30%的变量,并进行log10对数化处理,得到预处理完成后的数据,用于后续的分析。再进行特征峰搜库鉴定,将质谱信息与代谢数据库进行匹配,质谱质量误差设置为小于10 ppm,同时根据二级质谱匹配得分鉴定代谢物[17]。将预处理得到的数据输入ropls(R packages)软件,进行主成分分析(principal components analysis,PCA)、偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),根据t检验和OPLS-DA结果,进行差异代谢物的筛选[变量投影重要度(VIP)>1,P<0.05],再使用MetaboAnalyst 5.0单变量ROC曲线分析计算差异代谢物AUC值,筛选出AUC值>0.8的差异代谢物。
数据使用SPSS 25.0软件的one-way ANOVA程序进行方差分析,采用LSD法分析组间的差异显著性,结果用平均值±标准误表示。
2 结 果
2.1 免疫抑制雏鸡模型判断
CY组雏鸡在注射环磷酰胺后,外观可见精神萎靡、喜卧、羽毛凌乱、少食,体重和脾脏指数较NC组显著下降(表1)。CYLbGp组雏鸡体重、脾脏重和脾脏指数均显著高于CY组(P<0.05),而与NC组差异不显著(P>0.05)。上述结果表明,免疫抑制雏鸡模型建立成功,脾脏组织可用于代谢组学分析。

表1 3组雏鸡体重、脾脏重和脾脏指数
2.2 样本质控分析
样品经色谱分离流出的组分不断进入质谱,质谱连续扫描进行数据采集,每一次扫描得到一张质谱图,将每一张质谱图中所有离子强度相加,得到一个总的离子流强度。图1分别展示了正、负离子模式下,质控样品的总离子色谱图,可见该检测条件下,峰形良好,分布相对均匀,表明代谢组数据稳定性好,可用于后续分析。
A:正离子模式 positive ion mode;B:负离子模式 negative ion mode。
2.3 脾脏代谢轮廓分析
采用PCA对NC组、CY组、CYLbGp组海兰褐蛋鸡脾脏组织样本进行代谢轮廓分析,从PCA的2D散点图(图2)可以看出,各组样本均位于其95%可置信区间内,表明每组样本组内差异小。CY组和NC组在用药后30 d脾脏代谢轮廓发生了大幅度变动,说明环磷酰胺对鸡脾脏代谢轮廓有较大影响。CY组和CYLbGp组脾脏代谢轮廓存在一定夹角,表明CYLbGp组与CY组脾脏代谢物轮廓也存在明显差异。

图2 3组脾脏样本PCA模型得分图
2.4 脾脏代谢物的PLS-DA和OPLS-DA
为了评价枸杞多糖改善免疫抑制雏鸡脾脏代谢,对NC组、CY组和CYLbGp组脾脏代谢谱进一步进行PLS-DA及模型验证,结果(图3-A)显示,CYLbGp组代谢轮廓介于NC组CY组之间,说明枸杞多糖对免疫抑制雏鸡的脾脏代谢紊乱有一定的拮抗作用。模型结果(图3-B)表明,随着置换保留度的下降,R2和Q2下降,回归线呈向上的趋势,说明置换检验过关,模型不存在过拟合现象,所建PLS-DA模型对3组雏鸡均具有较好的预测能力。OPLS-DA可以剔除不相关的差异变量,筛选出与药物作用相关的差异变量。OPLS-DA得分图(图4)显示,NC组和CY组能够显著分离,表明免疫抑制雏鸡脾脏代谢轮廓发生了显著改变,CY组和CYLbGp组显著分离,表明枸杞多糖干预使免疫抑制雏鸡脾脏代谢轮廓发生显著改变。

图3 3组脾脏样本PLS-DA模型得分图(A)及模型置换检验图(B)

图4 脾脏样本OPLS-DA得分图(左:NC组和CY组;右:CY组和CYLbGp组)
2.5 差异代谢物筛选
根据t检验P值(P<0.05)和OPLS-DA模型VIP(VIP>1),进行差异代谢物的筛选,筛选结果为,CY组和NC组共有114个差异代谢物,CY组和CYLbGp组共有116个差异代谢物,再筛选经枸杞多糖干预后共有的发生显著回调的差异代谢物,最终筛选出满足条件的差异代谢物14种,采用MetaboAnalyst 5.0中经典单变量ROC曲线分析对这14种差异代谢物进行生物标志物分析,筛选出AUC值>0.8的差异代谢物,结果显示14种差异代谢物AUC值均大于0.8(表2),因此可视为枸杞干预环磷酰胺的生物标志物,这14种生物标志物在3组中的丰度见图5。
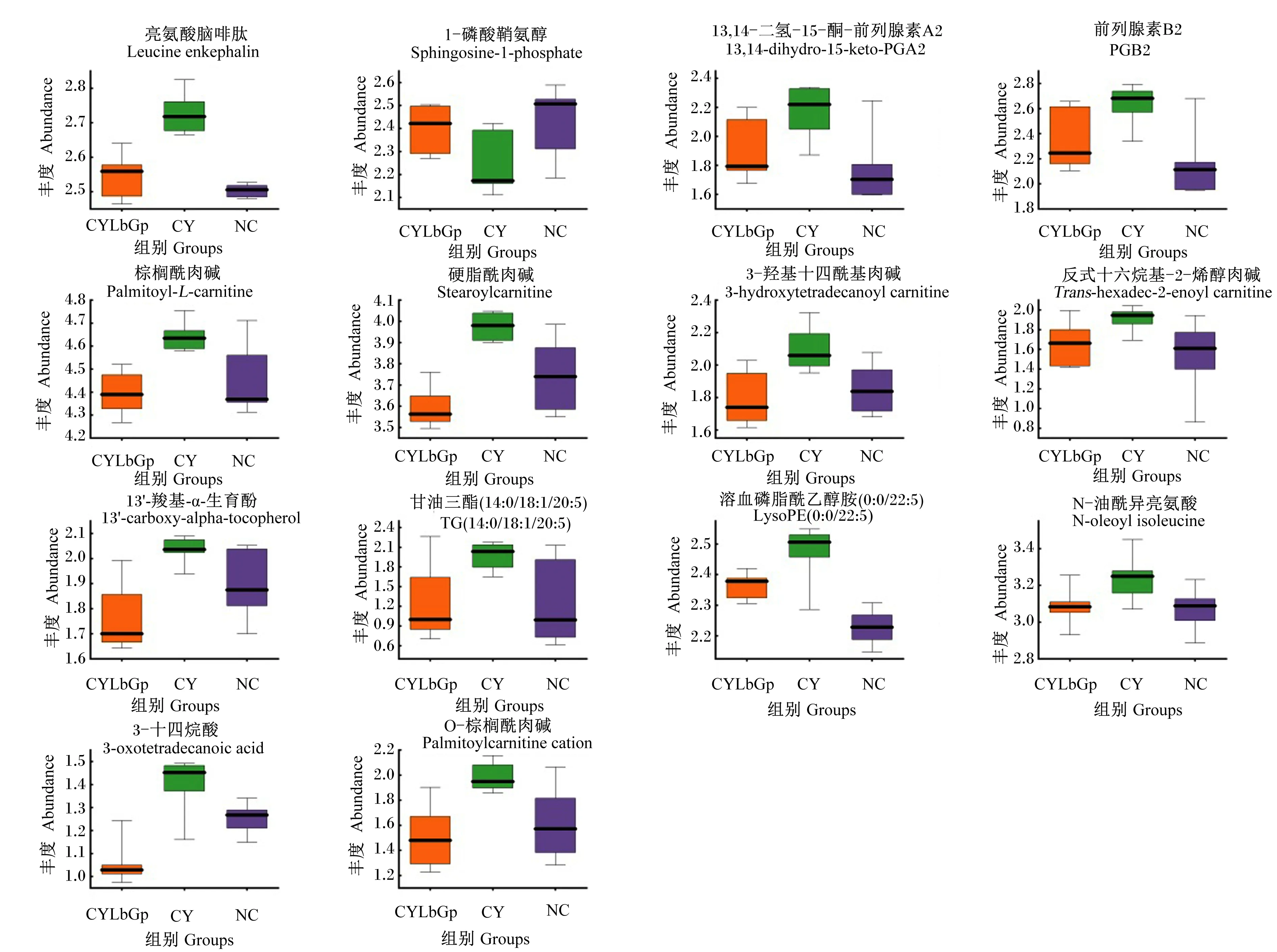
图5 CYLbGp组脾脏样本中显著回调差异代谢物箱线图

表2 CYLbGp组脾脏样本中发生显著回调差异代谢物
3 讨 论
环磷酰胺是一种烷化剂类抗肿瘤药物,对处于有丝分裂循环周期的细胞有破坏和杀灭的作用,对活化增殖的细胞具有细胞毒性作用[18],尤其是对免疫相关细胞呈现出较强的免疫抑制作用[19],所以环磷酰胺常被用于动物免疫抑制模型的建立。师萱等[20]通过对环磷酰胺免疫抑制小鼠血清进行代谢组学分析,发现环磷酰胺对脂质代谢相关代谢通路有明显影响。
3.1 枸杞多糖对环磷酰胺所致脂质代谢紊乱的调节作用
脂肪酸氧化过程主要分为肉碱循环和脂肪酸β氧化2个阶段,长链脂肪酸需在相关酶的作用下形成酰基肉碱才可进入线粒体内进行β氧化[21]。斯皮热古丽·阿布都卡地等[22]对免疫抑制小鼠模型血清代谢组学结果表明,模型组小鼠血清中肉碱含量显著增多,说明环磷酰胺可使机体脂肪酸氧化紊乱。本试验中CY组多种肉碱(棕榈酰肉碱、硬脂酰肉碱、3-羟基十四酰基肉碱、反式十六烷基-2-烯醇肉碱、O-棕榈酰肉碱)和脂质代谢中间产物3-氧十四烷酸、甘油三酯(14∶0/18∶1/20∶5)含量均显著高于NC组和CYLbGp组,提示枸杞多糖有助于恢复环磷酰胺所致的脂质代谢紊乱。
前列腺素(PG)是由花生四烯酸经包括环氧合酶-1(COX-1)和环氧合酶-2(COX-2)在内的多种酶作用形成,可调节多种生理反应,包括炎症、免疫反应和细胞分化[23-25]。13,14-二氢-15-酮-前列腺素A2(13,14-dihydro-15-keto PGA2)是通过13,14-二氢-15-酮-前列腺素E2(13,14-dihydro-15-keto PGE2)的非酶促脱水产生的,是前列腺素E2(PGE2)代谢的中间产物。有研究表明,PGE2不仅是炎症介质,也被称为免疫抑制分子[26]。PGE2能抑制T细胞和自然杀伤细胞等免疫细胞的活性,还可通过减少Th1细胞因子的产生和诱导免疫抑制分子程序性死亡配体1(PD-L1)的表达来抑制Th1免疫反应[27]。在本研究中,CYLbGp组13,14-dihydro-15-keto-PGA2、前列腺素B2(PGB2)含量均较CY组显著降低,这表明枸杞多糖可通过抑制PG产生发挥抗炎、调节免疫作用。
有研究表明环磷酰胺可作用于细胞导致细胞核DNA损伤、线粒体去极化等应激信号作用于线粒体,导致线粒体受体蛋白,如Bcl-2同源拮抗剂(BAK)、Bcl-2相关X蛋白(BAX)表达增加,促使线粒体通透性改变,释放细胞色素C、线粒体膜间隙蛋白酶(Omi)和线粒体促凋亡蛋白(Smac)[28-29]等物质到细胞质中,启动下游凋亡蛋白,如半胱氨酸蛋白酶-3(Caspase-3)、半胱氨酸蛋白酶-9(Caspase-9)等的表达[30-31],从而引起细胞凋亡,尤其是T淋巴细胞[32]。1-磷酸鞘氨醇(S1P)是一种多效的细胞膜鞘脂的代谢产物,参与机体多种细胞功能调节[33]。Wang等[34]研究表明,S1P能显著降低Caspase-3水平,进而起到抑制细胞凋亡的作用。本试验中CYLbGp组和NC组S1P的含量均显著高于CY组,表明枸杞多糖能够通过提高S1P含量起到抑制细胞凋亡的作用。本课题组前期研究也证实,枸杞多糖可以显著提高雏鸡外周血淋巴细胞的增殖率,缓解环磷酰胺对淋巴细胞凋亡的影响[15]。综上可知,枸杞多糖可通过改善环磷酰胺所致的脂质代谢紊乱而发挥抗炎、调节免疫和抑制细胞凋亡作用。
有研究表明,升高的溶血磷脂酰乙醇胺(0∶0/22∶5)[LysoPE(0∶0/22∶5)]含量可能会导致机体炎症加剧[35]。因此,脂质代谢紊乱可能会在体内诱导炎症的发生及加重其程度[36]。3-氧十四烷酸、甘油三酯(14∶0/18∶1/20∶5)是脂质代谢过程中的重要代谢物,在本试验中上述代谢物含量CY组均高于NC组,提示环磷酰胺可引起动物机体内脂质代谢紊乱,给予枸杞多糖后,CYLbGp组上述代谢物含量均发生显著回调,表明枸杞多糖有助于改善环磷酰胺引起的脂质代谢紊乱现象。
3.2 枸杞多糖对环磷酰胺所致氧化应激反应的调节作用
13′-羧基-α-生育酚是维生素E代谢的中间代谢产物,而维生素E是机体中一种有效的脂溶性抗氧化剂,且在免疫细胞中的含量更高[37]。此外,维生素E还可通过直接影响T细胞膜的完整性来调节T细胞功能、增殖及信号转导,并且能间接影响其他免疫细胞产生的炎症介质[38],从而起到调节机体免疫功能的作用。有研究表明,环磷酰胺可使机体氧化应激反应增强[39]。本试验发现,CY组13′-羧基-α-生育酚含量较NC组增多且AUC值>0.8,提示13′-羧基-α-生育酚是表征氧化应激反应的生物标志物,CYLbGp组13′-羧基-α-生育酚含量发生显著回调,说明枸杞多糖能够降低免疫抑制雏鸡氧化应激反应。
3.3 枸杞多糖对环磷酰胺所致脾脏功能障碍的改善作用
亮氨酸脑啡肽(L-EK)是内源性阿片类化合物的一种,主要由中枢神经系统产生,具有镇痛、应激反应调节及免疫调节的作用[40]。目前,现代医学研究表明,机体脾脏功能和神经-内分泌-免疫调节网络存在密切相关的关系[41]。李刚等[42]对脾虚证大鼠和正常大鼠各脑区L-EK含量变化进行了研究,证实脾脏与各脑区L-EK的生成密切相关,脾脏功能出现障碍时,L-EK含量上升。而众多研究证实,环磷酰胺可引起动物脾虚证[43]。本试验结果显示,CY组L-EK含量较NC组显著上升,推测环磷酰胺可能引起脾脏功能障碍,进而导致L-EK含量升高,而CYLbGp组上述代谢物较CY组均发生显著回调,前期脾脏病理切片研究也表明枸杞多糖有助于缓解环磷酰胺带来的脾脏损伤[15],提示枸杞多糖可改善脾脏功能。
4 结 论
本试验采用UHPLC-Triple-TOF-MS代谢组学技术研究了枸杞多糖对免疫抑制雏鸡脾脏代谢的影响,分析了脾脏差异代谢物,最终确定了14种潜在生物标志物,给用枸杞多糖后,其中13种差异代谢物含量降低,1种差异代谢物含量升高。上述研究结果提示枸杞多糖拮抗雏鸡免疫抑制的作用机制可能与纠正脂质代谢功能紊乱、抗氧化应激和改善脾脏功能有关。

