蛋氨酸对HepG2细胞和鸭原代肝细胞生长和脂质代谢的影响
吴永保 唐 静 闻治国 曹俊婷 张 博 邢光楠 谢 明 胡海峰 崔德福 侯水生*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.中国农业科学院饲料研究所,农业农村部饲料生物技术重点实验室,北京 100081;3.河北乐寿鸭业有限责任公司,沧州 062250)
蛋氨酸(Met)是家禽饲粮中第一限制性氨基酸,对生长发育起着重要的作用。在饲粮中添加适宜水平的Met可提高家禽生长性能、繁殖性能、免疫能力和抗氧化能力,调节脂质代谢等生理过程[1-4]。肝脏是家禽机体脂质代谢的主要器官,约90%脂质代谢发生在肝脏中,肝细胞生长状况直接影响家禽机体脂质代谢的能力。研究表明,体外培养的肝细胞系或分离的原代肝细胞能够表现机体肝脏绝大部分的生理功能,保留和维持机体肝细胞的特性,反映体内机体的生理代谢状态[5],另外,利用体外肝细胞模型可以克服在体内难以排除无关因素对脂质代谢调控作用的不足。Qi等[6]研究表明,Met通过钠离子依赖的中性氨基酸转运蛋白2(sodium-coupled neutral amino acid transporter 2,SNAT2)-磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路调控奶牛乳腺上皮细胞乳脂肪合成和细胞增殖;申晓婷[7]研究表明,Met限制可能是通过减弱肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)对肌球蛋白轻链激酶(myosin light chain kinase,MLCK)磷酸化肌球蛋白轻链(phosphorylation of myosin light chain,p-MLC)信号通路的激活作用来保护肠上皮屏障功能;左方瑞[8]研究了不同形式的Met源在猪不同细胞系中的代谢特征以及对细胞功能的影响。众多研究均主要集中在利用肠道细胞和乳腺上皮细胞模型研究Met调控猪和反刍动物肠道健康和乳腺中乳脂肪分泌的分子机制研究,然而关于Met调控体外肝细胞系和鸭原代肝细胞脂质代谢方面的研究尚未见报道。因此,本研究选用了HepG2细胞和鸭原代肝细胞2种肝细胞模型,研究Met对肝细胞的生长和脂质代谢的影响,以期为Met调控肝细胞生长和脂质代谢方面提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验细胞
HepG2细胞购自中国科学院细胞库。鸭原代肝细胞由鸭胚分离并提纯制备,具体步骤如下:选用14胚龄的鸭胚,消毒后取胚体肝脏组织置于磷酸盐缓冲液(PBS)的培养皿中,清洗2~3次,手术刀切碎,加入37 ℃预热的0.25%胰蛋白酶(约1 mL/鸭胚),用枪头用力吹打1~2 min,加入等量含有胎牛血清(FBS)的培养基终止消化,100 μm细胞过滤筛过滤,700 r/min离心10 min,弃上清,培养基重悬细胞,重复离心2~3次,去除死细胞及杂细胞。加入2 mL无Met添加的培养基,细胞计数,制备成细胞接种储备液。取一定量的储备液加入5 mL正常培养基中,把细胞接种到细胞瓶中,培养24 h,用于后续糖原染色试验。
1.1.2 试验试剂
DMEM培养基(不含Met)定制于大连美伦生物科技有限公司;CCK-8试剂盒(cell counting kit-8)、L-谷氨酰胺、丙酮酸钠购自于大连美伦生物科技有限公司;FBS、青霉素-链霉素(双抗,10 000 U/mL)购自于美国Gibco公司;L-蛋氨酸(L-Met)、油酸(oleic acid)、十二烷基硫酸钠(SDS)购自于美国Sigma公司;PBS购自美国HyClone公司;RNAiso Plus、反转录试剂盒、实时定量PCR(RT-PCR)反应相应试剂盒均购自于日本TaKaRa公司;甘氨酸、Tris、0.25%胰蛋白酶、20×Tris-HCl缓冲盐溶液(TBS缓冲液)、吐温-20、油红O染色试剂盒(细胞专用)、RIPA蛋白裂解液(强)、糖原过碘酸-雪夫(PAS)染色液试剂盒购自于北京索莱宝生物公司;聚偏氟乙烯(PVDF)膜(0.45 μm)购自于美国Pall公司;96(384)孔荧光定量PCR板购自于美国Axygen公司;超敏电化学发光(ECL)化学发光试剂盒购自于北京兰易科技有限公司;BCA蛋白浓度测定试剂盒、Western blot Stripping Buffer购自于美国Thermo公司;甲醇、乙二胺四乙酸(EDTA)购自国药集团化学试剂有限公司;Western blot预制胶购自于金斯瑞生物科技股份有限公司。
1.2 试验设计
1.2.1 HepG2细胞试验
1.2.1.1 培养基中添加Met对HepG2细胞存活率的影响
采用单因素试验设计,在细胞培养基中添加不同剂量Met储备液(100 mmol/L),使培养基中Met终浓度分别为0、12.5、25、50、100、200 μmol/L,共设置6个处理,每个处理5个重复。按照5 000个细胞/孔置于96孔板中,培养24 h,利用CCK-8细胞计数说明书测定细胞存活率。
1.2.1.2 培养基中添加Met对HepG2细胞脂质沉积的影响
采用单因素试验设计,在细胞培养基中添加不同剂量Met储备液(100 mmol/L),使培养基中Met终浓度分别为0、25、200 μmol/L,且添加0.25 mmol/L油酸诱导细胞高脂模型。共设置3个处理,每个处理3个重复。将饥饿12 h的HepG2细胞按照8×105个细胞/孔置于6孔板中,不同Met浓度培养基培养24 h,按照CCK-8法测定细胞数目以及油红O染色,评价细胞脂质沉积状况。
1.2.1.3 培养基中添加Met对HepG2细胞脂质代谢相关基因和蛋白表达的影响
采用单因素试验设计,在细胞培养基中添加不同剂量Met储备液(100 mmol/L),使培养基中Met终浓度分别为0、25、200 μmol/L,共设置3个处理,每个处理3个重复。将饥饿12 h的HepG2细胞按照8×105个细胞/孔置于6孔板中,不同Met浓度培养基培养24 h,2个孔合并为1个重复,提取其总RNA或蛋白,用于后续RT-PCR和Western blot试验,检测HepG2细胞生长代谢相关基因和蛋白表达量。
1.2.2 鸭原代肝细胞试验
1.2.2.1 培养基中添加Met对鸭原代肝细胞存活率的影响
采用单因素试验设计,在细胞培养基中添加不同剂量Met储备液(100 mmol/L),使培养基中Met终浓度分别为0、6.25、12.5、25、50、100、200 μmol/L,共7设置个处理,每个处理8个重复。按照8 000细胞/孔置于96孔板中,培养24 h,利用CCK-8细胞计数说明书测定细胞存活率。
1.2.2.2 培养基中添加Met对鸭原代肝细胞脂质代谢相关基因和蛋白表达的影响
采用单因素试验设计,在细胞培养基中添加不同剂量Met储备液(100 mmol/L),使培养基中Met终浓度分别为0、25、100和200 μmol/L,共设置4个处理,每个处理5个重复。将分离出的鸭原代肝细胞按照2×106个细胞/孔置于6孔板中,在不同Met浓度培养基中培养24 h,提取其总RNA和蛋白并测定其浓度,用于后续RT-PCR和Western blot试验,检测鸭原代肝细胞脂质代谢相关基因和蛋白表达量。
1.3 测定方法
1.3.1 细胞增殖活性试验
利用CCK-8试剂盒检测培养基中不同浓度Met对HepG2细胞或鸭原代肝细胞存活率的影响。流程如下:培养HepG2细胞或鸭原代肝细胞至70%~80%融合,利用无FBS添加的培养基饥饿细胞12 h,消化计数,以5 000个/孔的密度接种至96孔板中,利用不同Met浓度的DMEM完全培养基培养24 h,然后每孔加入10 μL CCK-8增强液,孵育0.5~2.0 h,在450 nm处测定吸光度(OD)值,通过OD值计算细胞的存活率,具体参照细胞增殖及毒性检测试剂盒(CCK-8)说明书。
1.3.2 细胞油红O染色和OD值测定
利用油红O染色试剂盒评价培养基Met浓度对HepG2细胞脂质沉积的影响。详细步骤及注意事项参照油红O染色试剂盒说明书。在显微镜下观察拍照后,弃去蒸馏水,加入1 mL 100%异丙醇,孵育10 min,将油红洗脱到异丙醇中,充分吹打,混合均匀,吸取200 μL加入至96孔板中,每个样品3个重复孔,用酶标仪在520 nm波长测定其OD值,以100%异丙醇作为空白对照。根据测定的细胞存活率,计算单位细胞数目油红O的吸光度(OD520 nm/细胞存活率)来表示细胞脂质沉积状况。
1.3.3 细胞mRNA提取及RT-PCR
利用不同Met浓度的DMEM完全培养基培养HepG2或鸭原代肝细胞24 h,然后弃去上层培养基,PBS冲洗1~2次,加入RNAiso Plus提取总RNA,RNAase-free水复溶,测定每个样品总RNA浓度和质量,保证各样品OD260/280在1.8~2.0之间,OD260/230大于2.0,并用焦碳酸二乙酯(DEPC)水稀释总RNA浓度。按照TaKaRa Super RT Kit说明,把总RNA反转录成cDNA。引物采用Primer 6.0软件设计(表1),由北京擎科生物技术有限公司合成。以β-肌动蛋白(β-actin)作为内参,采用SYBR Green荧光定量PCR对相关基因进行定量分析。RT-PCR反应体系为10 μL:2×TB Green Premix Ex Taq Ⅱ 5 μL,ROX Reference Dye Ⅱ 0.2 μL,引物各0.4 μL,cDNA模板1 μL,RNase-free ddH2O 3 μL。反应条件:95 ℃ 30 s预变性;随后95 ℃ 5 s变性,60 ℃ 34 s退火,95 ℃ 15 s延伸,进行40个循环;然后95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。根据熔解曲线得出的待测样品Ct值,采用2-ΔΔCt法计算基因表达量。
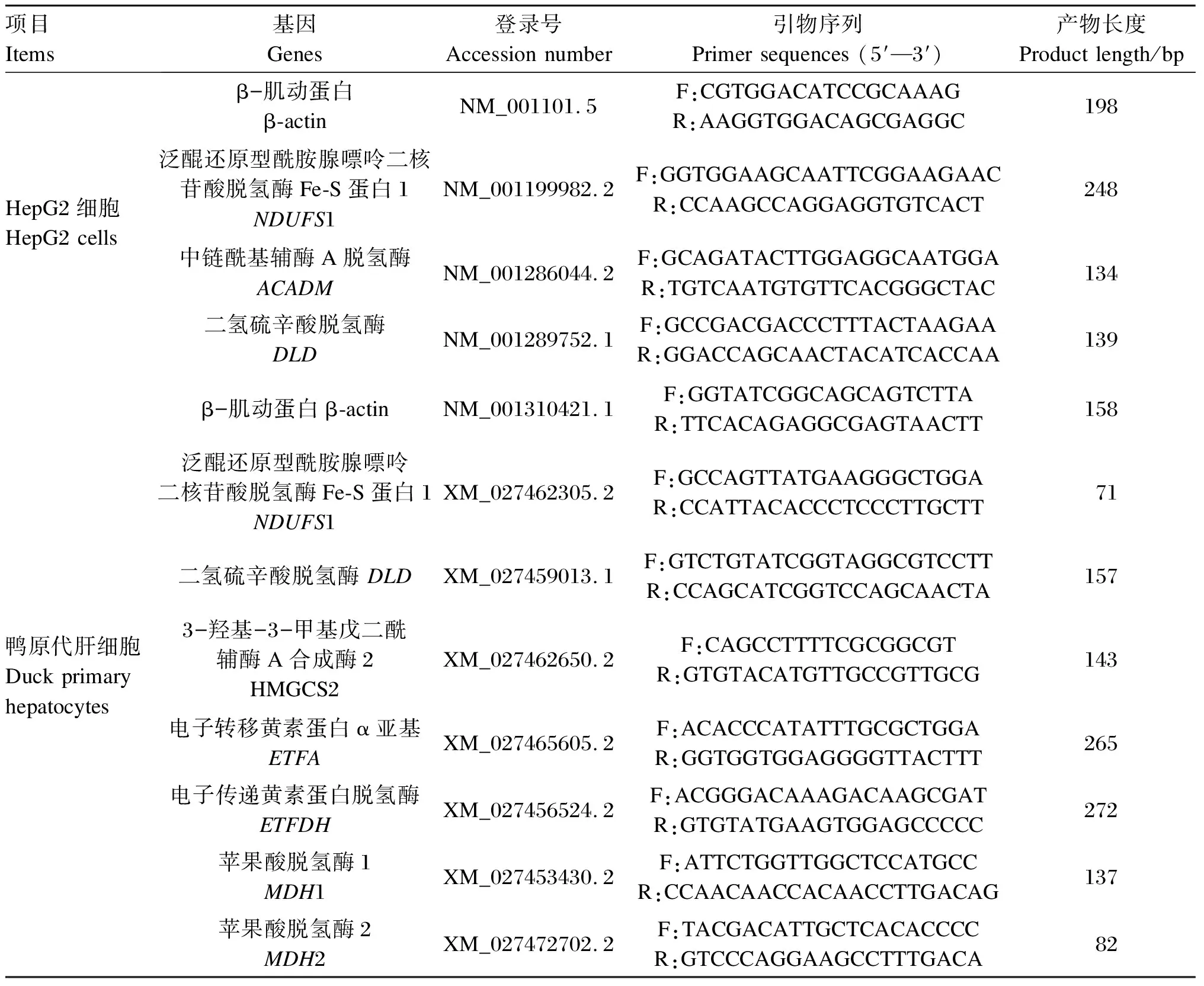
表1 HepG2细胞和鸭原代肝细胞RT-PCR引物序列
1.3.4 细胞Western blot试验
利用不同Met浓度的DMEM完全培养基培养HepG2细胞或鸭原代肝细胞24 h,弃去上层培养基,PBS冲洗1~2次,加入裂解液提取蛋白,利用BCA法测定各样品的蛋白浓度,各样品加入相同剂量(20~30 mg)蛋白进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(80 V恒压10 min,然后140 V恒压35~45 min),电泳分离蛋白转印至PVDF膜上(130 mA恒流60 min),5%脱脂奶粉4 ℃封闭2 h,然后4 ℃孵育一抗过夜,用洗膜缓冲液(TBST)洗膜3~5次,每次5~7 min,室温孵育二抗2 h(1∶5 000稀释),利用TBST洗膜。然后孵育发光液1~3 min后,利用全自动化学发光/荧光图像分析系统仪器(Tanon 5200 Multi多功能成像系统)收集条带曝光信号,最终使用图象处理系统(Tanon Gis系列数码凝胶图像处理系统)分析蛋白条带的灰度值。以β-微管蛋白(β-tubulin)作为内参,计算目的蛋白表达量。目的蛋白及内参蛋白一抗信息如下:泛醌还原型酰胺腺嘌呤二核苷酸脱氢酶Fe-S蛋白1(NDUFS1,b169540,1∶5 000)购自美国Abcam公司,β-微管蛋白(HX1829,1∶5 000)购自北京华兴博创公司。
1.4 数据统计与统计分析
试验数据经过整理后,利用SAS 9.4统计软件进行单因素方差分析,当方差分析显著时,采用Duncan氏法进行多重比较。P<0.05为差异显著,数据用“平均值±标准差”表示。
2 结果与分析
2.1 鸭原代肝细胞PAS染色
PAS染色可以把糖原或多糖等阳性物质染成红色或紫红色,肝细胞中含有大量的肝糖原,因此PAS染色可以把肝细胞染成红色,苏木素可以把细胞核染成蓝色,而成纤维细胞、血细胞以及其他杂细胞不会被染色。鸭原代肝细胞PAS染色如图1所示,阳性染色细胞占绝大部分,肝细胞比例较大,表明分离的原代肝细胞纯度较高,按照此方法分离纯化可用于后续试验。
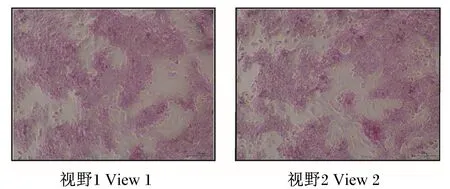
图1 鸭原代肝细胞PAS染色
2.2 HepG2细胞和鸭原代肝细胞存活率
由图2-A可知,细胞培养基中Met浓度为0 μmol/L时HepG2细胞存活率显著低于其他Met浓度(P<0.05),随着细胞培养基中Met浓度升高,HepG2细胞存活率先增加后降低,在Met浓度为25 μmol/L时达到平台,但培养基中Met浓度为25、50、100和200 μmol/L时HepG2细胞存活率无显著差异(P>0.05)。因此,选择0、25和200 μmol/L Met浓度进行后续试验。
由图2-B可知,细胞培养基中Met浓度为0、6.25、12.5和25 μmol/L时鸭原代肝细胞存活率显著低于浓度为100和200 μmol/L时(P<0.05),随着细胞培养基中Met浓度升高,鸭原代肝细胞存活率逐渐增加,在Met浓度为100 μmol/L时达到平台。因此,选择0、25、100和200 μmol/L Met浓度进行后续试验。
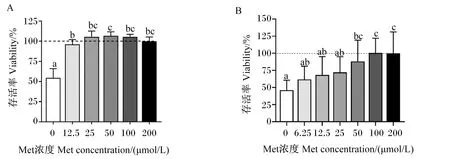
A:HepG2细胞 HepG2 cells;B:鸭原代肝细胞 duck primary hepatocytes。
2.3 HepG2细胞油红O染色和OD520 nm
由图3-A可知,与200 μmol/L Met组相比,0、25 μmol/L Met组脂滴数量明显增加。由图3-B和图3-C可知,0、25 μmol/L Met组HepG2细胞增殖速率下降,与25、200 μmol/L Met组相比,0 μmol/L Met组细胞存活率显著降低(P<0.05),但25、200 μmol/L组细胞存活率无显著差异(P>0.05),这与上述的试验结果一致。由图3-D可知,25 μmol Met组OD520 nm显著高于0、200 μmol/L Met组(P<0.05)。由图3-E可知,200 μmol/L Met组OD520 nm/细胞存活率显著低于0、25 μmol/L Met组(P<0.05),且0、25 μmol/L Met组之间无显著差异(P>0.05)。
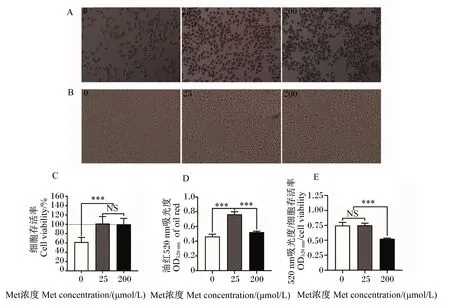
A:细胞油红O染色图 image of cells oil red O staining;B:细胞存活状态图 image of cells growth condition;C:细胞存活率 cell viability;D:油红520 nm吸光度 OD520 nm of oil red;E:520 nm吸光度/细胞存活率OD520 nm/cell viability。
2.4 HepG2细胞和鸭原代肝细胞脂质代谢mRNA和蛋白表达量
由图4可知,与200 μmol/L Met组相比,0、25 μmol/L Met组HepG2细胞脂肪酸β-氧化[(中链酰基辅酶A脱氢酶(ACADM)]、三羧酸循环[(二氢硫辛酸脱氢酶(DLD)]、呼吸链电子传递(NDUFS1)过程相关的基因表达量显著下调(P<0.05),且0 μmol/L Met组HepG2细胞中NDUFS1蛋白表达量显著下调(P<0.05)。
由图5可知,与200 μmol/L Met组相比,0、25、100 μmol/L Met组鸭原代肝细胞三羧酸循环[苹果酸脱氢酶(MDH)1、MDH2、DLD]和酮体生成[3-羟基-3-甲基戊二酰辅酶A合成酶2(HMGCS2)]过程相关的基因表达量显著下调(P<0.05)。
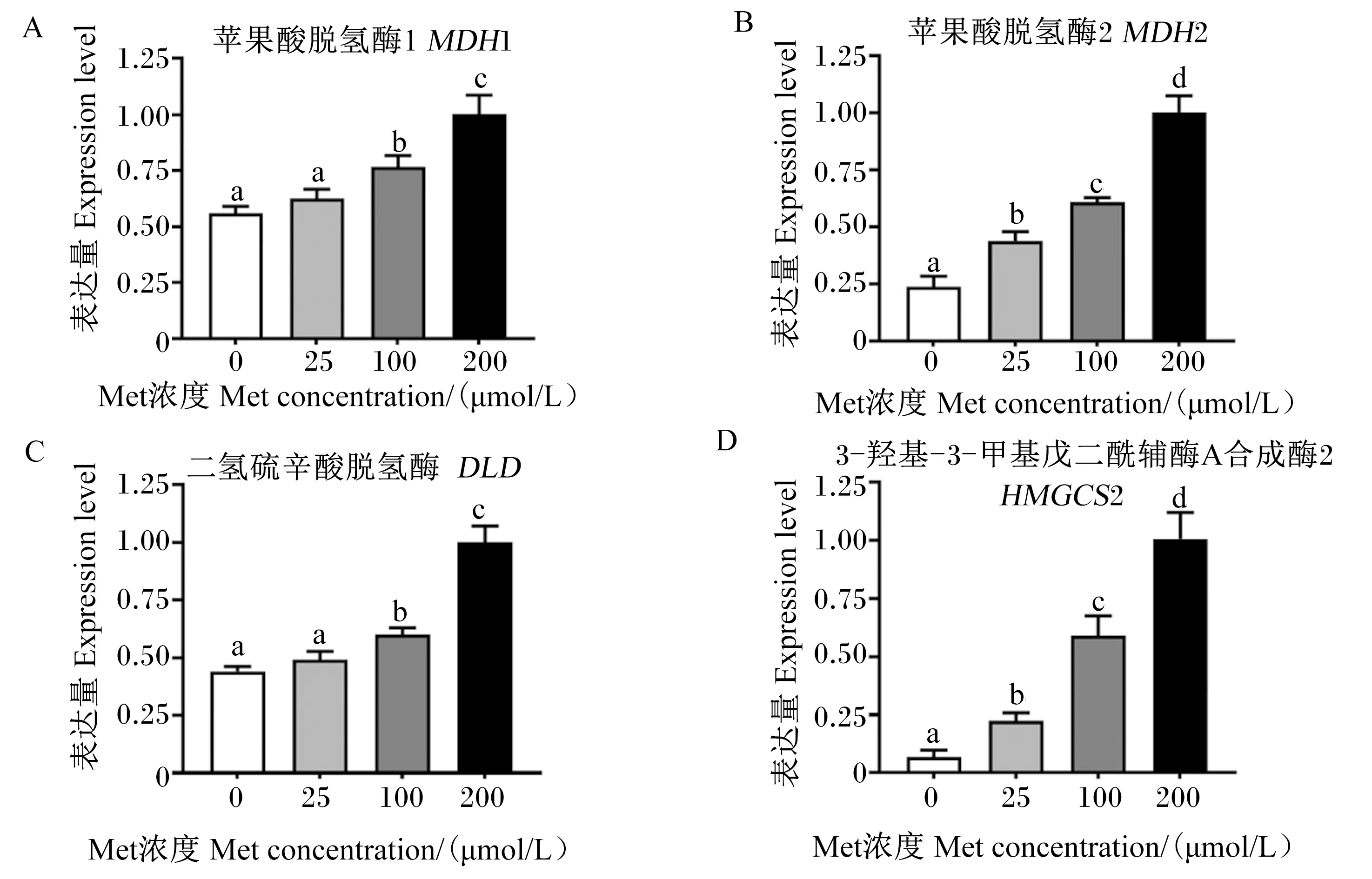
图5 培养基Met缺乏对鸭原代肝细胞三羧酸循环和酮体生成相关基因的影响
由图6可知,与200 μmol/L Met组相比,0、25、100 μmol/L Met组鸭原代肝细胞呼吸链电子传递过程的相关基因[电子转移黄素蛋白α亚基(ETFA)、电子传递黄素蛋白脱氢酶(ETFED)和NDUFS1]表达量显著下调(P<0.05),且0、25 μmol/L Met组鸭原代肝细胞NDUFS1蛋白表达量显著下调(P<0.05)。

图6 培养基Met缺乏对鸭原代肝细胞呼吸链电子传递相关基因和蛋白的影响
3 讨 论
本试验在不含Met的培养基中添加不同浓度Met培养HepG2细胞和鸭原代肝细胞24 h后,与正常Met浓度(200 μmol/L)培养基相比,不添加Met或添加低浓度Met组的细胞存活率下降,机体生长代谢相关基因和蛋白表达量下调,表明成功构建HepG2细胞和鸭原代肝细胞Met缺乏模型。随着在培养基中添加Met,HepG2细胞存活率在添加25 μmol/L Met时达到平台,而鸭原代肝细胞存活率在添加100 μmol/L Met时达到平台,其原因有可能是由于鸭原代肝细胞比HepG2细胞对培养基中Met更加敏感,鸭原代肝细胞需要更高浓度的Met来维持细胞的正常生长。
利用体外细胞模型来研究Met对不同细胞生长和增殖的影响均有所报道。体外奶牛乳腺上皮细胞培养试验表明,与Met缺乏组相比,添加0.6 mmol/L Met显著提高乳腺上皮细胞的增殖[9-10]。培养基中添加Met(0.2、0.5、1.0 mmol/L)可显著提高猪血管内皮细胞的活力、形成管腔数目、总的节点数目以及总分支长度,表明Met可促进血管的生成[11]。Met缺乏在家禽组织细胞中也有些报道,体外试验表明Met缺乏导致肉鸡肝细胞G2M期阻滞,细胞增殖受到阻碍[12]。本试验中,HepG2细胞和鸭原代肝细胞在不添加Met或添加低浓度Met培养基中培养24 h后,其细胞增殖均显著受到抑制,HepG2细胞脂质沉积量显著增加,表明培养基中Met浓度显著影响肝细胞生长及脂质沉积状况。
Met是动物机体重要的必需氨基酸,是肉鸭饲粮中第一限制氨基酸,对机体生长及各代谢过程起着至关重要的调控作用。我们之前的研究表明,饲粮中Met缺乏可导致北京鸭体重显著下降,脂肪沉积显著增加[13-14],且肝脏蛋白组学研究表明Met缺乏导致北京鸭肝脏脂肪酸β氧化(ACADM、HADH、ACOX1)、三羧酸循环(DLD、MDH1、MDH2)、呼吸链电子传递(NDUFS1、ETFA、ETFDH)、糖酵解/糖异生(GAPDH、PGK1、TPI1)、酮体生成(HMGCS2)等过程受阻[15]。DLD是丙酮酸脱氢酶复合物的组成成分,可以将二氢硫辛酸和烟酰胺腺嘌呤二核苷酸(NAD+)转化为硫辛酸和还原型酰胺腺嘌呤二核苷酸(NADH)[16],丙酮酸脱氢酶催化丙酮酸氧化脱羧生成乙酰CoA,将糖酵解与三羧酸循环和脂肪酸合成联系起来[17]。MDH1和MDH2是苹果酸脱氢酶的2种同工酶,分别位于细胞质和线粒体中,催化苹果酸和草酰乙酸的可逆互相转化[18]。ACADM是脂肪酸酰基CoA脱氢酶家族成员之一,β-氧化过程起初阶段重要的限速酶[19]。ETFA、ETFDH和NDUFS1是在呼吸链电子传递链过程中3种重要的催化酶,ETFA编码电子传递黄素蛋白(ETF)的α亚基,ETF可以把电子对转移给线粒体电子传递链,ETFDH接收脂酰基CoA脱氢酶的电子传递至呼吸链[20-21]。NDUFS1是线粒体呼吸链复合体Ⅰ的亚基,在呼吸链复合体Ⅰ的装配中起着至关重要的作用[22]。HMGCS2是肝脏线粒体酮体生成过程的关键酶,生成的酮体可经血液进入肝外组织(脑、心脏等),为肝外组织提供能量[21]。研究表明,Met对脂质沉积的影响可能主要是通过调控机体脂质代谢相关基因和蛋白表达来实现的[4]。利用体外细胞模型可以更准确地验证Met与相关基因和蛋白表达之间的关系。在本研究中,HepG2细胞和鸭原代肝细胞试验中均发现Met缺乏导致上述关键蛋白表达量和基因表达量严重下调,表明Met缺乏导致细胞体内多种代谢过程受阻,导致细胞产生ATP不足,表现出生长受阻,体外细胞模型的研究结果与北京鸭肝脏体内试验结果[15]一致。
4 结 论
① Met缺乏导致HepG2细胞和鸭原代肝细胞存活率降低。
② Met缺乏导致HepG2细胞脂质沉积增加。
③ Met缺乏导致HepG2细胞和鸭原代肝细胞脂肪酸β-氧化、三羧酸循环、呼吸链电子传递和酮体生成等过程受阻。

