岩藻多糖对大鼠肾脏氧化应激、炎症和细胞凋亡的缓解作用
蒯云逸 蒋和浩 红 雷 徐元庆
(内蒙古农业大学动物科学学院,呼和浩特 010018)
正常生理状态下机体会产生少量的活性氧(reactive oxygen species,ROS)参与机体正常代谢,同时体内也存在抑制和清除ROS反应的机制,当这一机制遭到破坏,细胞内ROS的生成过度或生物体抗氧化系统清除过多ROS的能力受损,会导致细胞内氧化还原状态失衡,进而导致代谢失常[1]。过多的ROS可直接作用于细胞诱导脂质、蛋白质和DNA/RNA等各种生物分子损伤,造成细胞损伤,甚至引起细胞死亡,导致疾病的产生[2]。许多类型的肾脏疾病如糖尿病肾病[3]、高同型半胱氨酸血症肾损伤[4]、脓毒症急性肾损伤[5]、尿酸性肾病[6]及肾细胞癌[7]等都与ROS的代谢失常所致的氧化应激有关,且常伴随炎症反应和过度细胞凋亡。因此,通过减少肾脏组织中ROS的产生进而缓解氧化应激,减轻炎症反应是防治肾脏损伤的有效途径。已有研究表明,天然来源的抗氧化剂有助于减轻氧化应激诱导的损伤,改善细胞内酶促和非酶促抗氧化系统[2,8]。大多数抗氧化剂是从陆生植物中分离出来的,近些年来从几种海洋生物(如褐藻)中分离出来的岩藻多糖也具有潜在抗氧化活性[9-10]。
岩藻多糖又称褐藻糖胶、岩藻多糖硫酸酯、褐藻多糖硫酸酯等,主要存在于褐藻和一些海洋无脊椎动物如海胆、海参中[9,11]。岩藻多糖主要为含有L-岩藻糖单元和硫酸盐基团,以及少量的中性单糖、糖醛酸、蛋白质和酚类化合物组成的水溶性多糖[12]。大量研究表明,岩藻多糖在体外和体内都具有多种生物学功能,例如抗炎[13]、抗病毒感染[14]、增强免疫功能[15]和抗肿瘤[16]活性。此外,岩藻多糖已显示出对几种天然和异生物质毒性的细胞保护作用,例如酒精[17]、四氯化碳[18]、对乙酰氨基酚[19]、微囊藻毒素-LR[20]诱导的肝脏损伤和异丙肾上腺素诱导的心脏毒性[21]。岩藻多糖还在改善急性肾损伤[22]、慢性肾病[23]和糖尿病肾病[24]方面具有预防功效。岩藻多糖的这些作用可能是通过抗氧化作用、抗炎和抗细胞凋亡以及抗纤维化机制来实现的[17,19,25-26]。
综上所述,作为机体内外环境物质交换的主要场所,肾脏易受到ROS的攻击而出现损伤,导致其结构和功能受损。有研究表明,岩藻多糖在体内和体外都具有抗氧化活性[27-28],是一种天然的抗氧化剂,具有预防ROS介导的疾病的巨大潜力。但岩藻多糖缓解肾脏氧化损伤的研究鲜见报道,且其是否通过调控抗氧化酶的基因表达而增强机体抗氧化酶活性,下调促炎基因表达缓解机体炎症反应,以及调控细胞凋亡调控因子的基因表达缓解细胞凋亡而发挥其作用的机制也未明确。因此,本试验以氧化应激所引起的氧化损伤、炎症反应和细胞凋亡为切入点,通过大鼠腹腔注射Diquat诱导肾脏氧化损伤模型,并饲喂岩藻多糖探索其能否缓解肾脏的氧化损伤、炎症反应和细胞凋亡,以期为将岩藻多糖开发为保健食品或膳食补充剂以预防或延迟慢性疾病,或在畜牧生产中用作促进畜禽生长和健康的饲料添加剂提供理论依据。
1 材料与方法
1.1 试验材料和仪器

1.2 试验设计
适应性饲养1周后开始试验,将28只大鼠随机分为3个组单笼饲养,分别为对照组(CT,10只)、氧化应激组(OS,9只)以及氧化应激与岩藻多糖联合处理组(OS+Fuc,9只),试验期为20 d。整个试验期,对照组和氧化应激组饲喂基础饲粮,氧化应激与岩藻多糖联合处理组饲喂试验饲粮(在基础饲粮中添加250 mg/kg岩藻多糖)。试验第12天,氧化应激组和氧化应激与岩藻多糖联合处理组分别通过腹腔注射10 mg/kg BW的Diquat,建立氧化应激模型,对照组注射等量的生理盐水。之后继续饲喂8 d,试验期间,饲养环境温度为(22±2)℃,相对湿度为(55±5)%,光暗循环为12 h。试验结束后记录大鼠体重,并采集血液和肾脏组织样品,用于后续指标测定。
1.3 样品采集与指标测定
1.3.1 样品采集
试验结束时,末次禁食不禁水12 h。将大鼠用麻醉后迅速剖开胸腔,进行心脏采血,取血清于-20 ℃冰箱中保存。之后剖开腹腔,分离完整的肾脏组织,并用生理盐水洗净2~3次,用滤纸吸干水后称重,用于计算肾脏相对重量(肾脏重量/活体重量),之后于-80 ℃中冷冻保存。
1.3.2 指标测定及方法
1.3.2.1 大鼠血清尿素氮和肌酐含量的测定
采用全自动生化分析仪(Hitachi 7020)检测大鼠血清尿素氮和肌酐含量,测定试剂盒由乐普(北京)诊断技术股份有限公司提供。
1.3.2.2 大鼠肾脏抗氧化能力的测定
取大鼠肾脏组织,按照试剂盒说明制备组织匀浆液,肾脏总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)活性以及谷胱甘肽(GSH)和丙二醛(MDA)含量的测定均按照商用试剂盒(南京建成生物工程研究所),根据试剂盒说明用分光光度计进行测定。
1.3.2.3 大鼠肾脏抗氧化酶、炎性细胞因子以及细胞凋亡相关基因表达的测定
根据试剂盒制造商的说明,使用商业TRIzol试剂盒从肾脏组织样品中提取细胞总RNA,并使用琼脂糖凝胶电泳和Nano Drop ND-1000紫外分光光度计对其完整性、纯度和浓度进行测定。之后使用商业PrimeScriptTMRT试剂盒(TaKaRa),将RNA反转录合成cDNA。以cDNA为模板,进行实时荧光定量PCR。PCR反应混合物由2.0 μL cDNA模板、0.4 μL上游引物、0.4 μL下游引物、10.0 μL SYBR Premix Ex TaqTM(TaKaRa)、0.4 μL ROX参比染料(TaKaRa)和6.8 μL双蒸水组成。PCR反应条件为:95 ℃预热变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环。以β-肌动蛋白(β-actin)为内参基因,根据2-ΔΔCt方法计算目的基因的相对表达量,引物序列见表1。

表1 引物序列
1.4 数据统计分析
试验数据运用GraphPad Prism 8分析软件进行统计分析,使用单因素进行方差分析(one-way ANOVA),之后采用LSD多重比较用于进行确定方差分析后的组间差异显著性比较,并使用GraphPad Prism 8进行绘图。试验结果数据表示为“平均值±标准差(SD)”,P<0.01表示差异极显著,P<0.05表示差异显著,0.05≤P<0.10表示差异趋于显著。
2 结 果
2.1 岩藻多糖对大鼠体重和肾脏重量的影响
如图1所示,各组大鼠中,对照组大鼠终末体重和肾脏重量最高,且均极显著高于氧化应激组和氧化应激与岩藻多糖联合处理组(P<0.01),但氧化应激与岩藻多糖联合处理组和氧化应激组大鼠终末体重和肾脏重量无显著差异(P>0.05);3组之间肾脏相对重量无显著差异(P>0.05)。

CT:对照组;OS:氧化应激组;OS+Fuc:氧化应激与岩藻多糖联合处理组。数据柱标注*表示P<0.05,**表示P<0.01,***表示P<0.001。下图同。
2.2 岩藻多糖对大鼠血清尿素氮和肌酐含量的影响
如图2所示,氧化应激组大鼠血清尿素氮和肌酐含量均显著高于对照组(P<0.05);氧化应激与岩藻多糖联合处理组大鼠血清尿素氮含量低于氧化应激组(P=0.061),血清肌酐含量显著低于氧化应激组(P<0.05)。
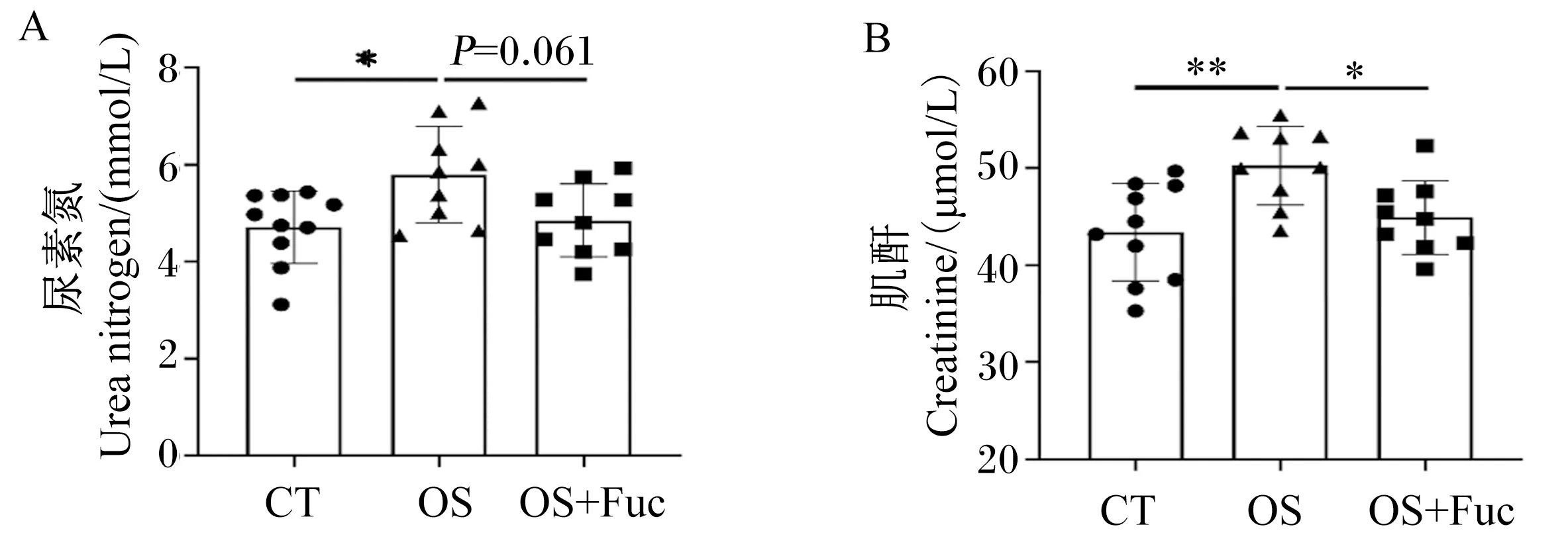
图2 岩藻多糖对大鼠血清尿素氮和肌酐含量的影响
2.3 岩藻多糖对大鼠肾脏抗氧化能力的影响
如图3所示,与对照组相比,氧化应激组大鼠肾脏MDA含量显著升高(P<0.05),而肾脏T-AOC以及CAT和SOD活性均极显著降低(P<0.01)。与氧化应激组相比,饲喂岩藻多糖降低了大鼠肾脏MDA含量(P=0.052),并提高了肾脏CAT(P<0.05)、SOD(P=0.068)和GPx(P=0.085)活性,但对肾脏T-AOC没有显著影响(P>0.05)。对照组、氧化应激组和氧化应激与岩藻多糖联合处理组大鼠肾脏GSH含量无显著差异(P>0.05)。

图3 岩藻多糖对大鼠肾脏抗氧化能力的影响
2.4 岩藻多糖对大鼠肾脏抗氧化酶基因表达的影响
如图4所示,与对照组相比,氧化应激下调了大鼠肾脏CAT(P<0.05)、超氧化物歧化酶2(SOD2)(P=0.061)及核因子E2相关因子2(Nrf2)(P<0.05)的基因表达,而饲喂岩藻多糖上调了肾脏CAT(P=0.064)、SOD2(P<0.05)及Nrf2(P<0.01)的基因表达。对照组、氧化应激组和氧化应激与岩藻多糖联合处理组大鼠肾脏超氧化物歧化酶1(SOD1)、GPx及血红素加氧酶-1(HO-1)基因表达无显著差异(P>0.05)。
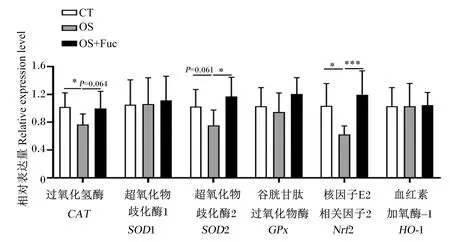
图4 岩藻多糖对大鼠肾脏抗氧化酶基因表达的影响
2.5 岩藻多糖对大鼠肾脏炎性细胞因子基因表达的影响
如图5所示,与对照组相比,氧化应激显著上调了大鼠肾脏白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及核转录因子-κB(NF-κB)的基因表达(P<0.05),而饲喂岩藻多糖下调了大鼠肾脏IL-1(P<0.01)、TNF-α(P=0.079)及NF-κB(P<0.05)的基因表达,但对肾脏IL-6的基因表达没有显著影响(P>0.05)。

图5 岩藻多糖对大鼠肾脏组织炎性细胞因子基因表达的影响
2.6 岩藻多糖对大鼠肾脏细胞凋亡相关基因表达的影响
如图6所示,与对照组相比,氧化应激显著下调了大鼠肾脏B淋巴细胞瘤/白血病-2(Bcl-2)的基因表达(P<0.05),显著上调了肾脏B淋巴细胞瘤/白血病-2相关X蛋白(Bax)、半胱氨酸天冬氨酸蛋白酶-9(Caspase-9)、半胱氨酸天冬氨酸蛋白酶-8(Caspase-8)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)以及凋亡相关因子配体(FasL)的基因表达(P<0.05)。与氧化应激组相比,饲喂岩藻多糖极显著上调了大鼠肾脏Bcl-2的基因表达(P<0.01),下调了肾脏Bax(P<0.01)、Caspase-8(P<0.01)、凋亡相关因子(Fas)(P<0.01)以及FasL(P=0.064)的基因表达,并极显著提高了Bcl-2与Bax的基因表达比值(P<0.01)。此外,与对照组相比,氧化应激与岩藻多糖联合处理极显著上调了大鼠肾脏Bcl-2的基因表达(P<0.01),显著下调了肾脏Bax(P<0.01)、Caspase-9(P<0.05)和Fas(P<0.05)的基因表达,并极显著提高了Bcl-2与Bax的基因表达比值(P<0.01)。
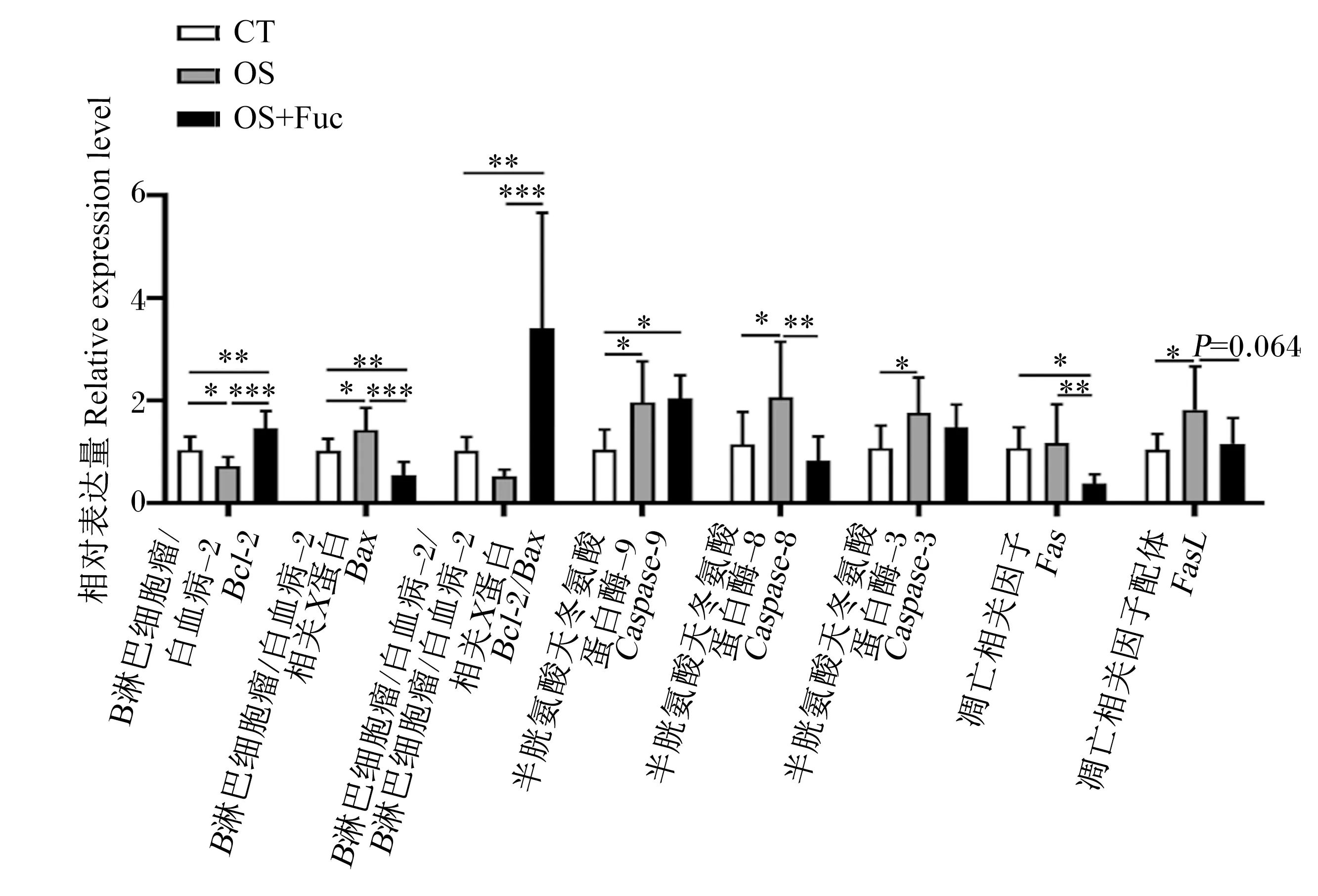
图6 岩藻多糖对大鼠肾脏细胞凋亡相关基因表达的影响
3 讨 论
氧化应激是Diquat诱导细胞毒性的主要方式。当Diquat进入机体后,在还原型辅酶Ⅱ和细胞色素还原酶作用下,其氧化还原循环导致高度不稳定的Diquat自由基将电子转移到分子氧上,形成超氧阴离子,引起机体产生过量的ROS,ROS会与细胞大分子相互作用,导致脂质过氧化、酶功能障碍和基因毒性,从而导致线粒体功能障碍,进一步造成广泛的细胞损伤和死亡[29-30]。此外,Diquat通过抑制GPx、SOD和CAT等关键抗氧化酶来降低细胞的T-AOC。所以Diquat作为常用的试验用氧化应激原,在多种模式动物中均可成功建立氧化应激模型。肾脏是Diquat的主要排泄器官,81%急性Diquat中毒患者会出现急性肾脏损伤[31],肾脏存在着明显的肾小管坏死[32]。研究表明,岩藻多糖在体外试验中具有显著的抗氧化活性,对羟基自由基和超氧阴离子的形成具有抑制作用,对ROS的清除率达到14%~26%[33],是一种极好的天然抗氧化剂,具有预防ROS导致的疾病的巨大潜力。本试验通过给大鼠腹腔注射10 mg/kg BW的Diquat,导致其肾脏组织中超氧阴离子的产生,能攻击生物膜上的多不饱和脂肪酸,引发脂质过氧化作用,从而导致大鼠肾脏组织中MDA含量的升高以及T-AOC、SOD和CAT活性的降低。本试验中,氧化应激组大鼠血清尿素氮和肌酐含量相比于对照组显著提高,而且大鼠的终末体重和肾脏重量均极显著下降,显示大鼠的肾脏受到了氧化应激损伤,表明本试验成功建立了大鼠肾脏氧化损伤的模型。饲喂岩藻多糖能降低受到氧化损伤的大鼠肾脏组织的MDA含量,而且主要通过提高肾脏SOD2和CAT基因的表达使得肾脏SOD和CAT的活性有所提高,并能够提高肾脏GPx的活性。SOD将超氧阴离子转化为过氧化氢,之后主要通过CAT和GPx将其转化为分子氧和水,从而缓解大鼠肾脏组织的氧化应激反应。此外,饲喂岩藻多糖降低了氧化应激大鼠血清尿素氮和肌酐含量,这也证明岩藻多糖缓解了肾脏氧化损伤。这些结果与之前岩藻多糖对二嗪酮诱导大鼠肾脏组织损伤[34]、微囊藻毒素-LR诱导的肾脏损伤[20]和低蛋白质饮食诱导老年小鼠肾脏损伤[35]的缓解作用的研究一致。
岩藻多糖的抗氧化活性可能由直接的自由基清除活性和细胞抗氧化防御系统的调节机制2个主要因素共同决定。体外试验发现,岩藻多糖对表现出不同程度的1,1-二苯基-2-三硝基苯肼(DPPH)自由基和羟基自由基清除活性[36-37]。这可能与岩藻多糖的分子质量和硫酸盐含量有关,如岩藻多糖中的低分子质量和高硫酸盐含量呈现更强的自由基清除活性[12]。动物体内试验也发现,岩藻多糖可明显提高辐射小鼠体内[38]和低蛋白质饮食老年小鼠肾脏[35]中GSH含量,降低MDA含量,说明岩藻多糖可提高清除机体内的自由基能力。本研究并未发现岩藻多糖对大鼠肾脏组织中GSH含量的影响。因此,岩藻多糖可能主要通过调节细胞抗氧化防御系统发挥积极作用。Hong等[39]也证实岩藻多糖可以在转录的基因水平上直接相互作用,并诱导参与抗氧化防御系统的酶如GPx、SOD和CAT的增加。同时,饲喂岩藻多糖大鼠肾脏组织中Nrf2基因表达相比于受到氧化损伤的大鼠显著上调,提示岩藻多糖可能激活了Nrf2信号通路,抑制了大鼠肾脏的氧化应激反应。Nrf2是调控细胞氧化应激的重要转录因子,同时也是维持细胞内氧化还原稳态的中枢调节因子。当细胞发生氧化应激时,可以引起Nrf2进入细胞核,上调Nrf2下游抗氧化酶如SOD、CAT和GPx的表达,发挥抗氧化作用,以维持细胞内氧化还原的稳定性。本研究中,饲喂岩藻多糖可显著上调大鼠肾脏组织中SOD、CAT和Nrf2的基因表达也证实了这一观点。体外研究也发现,岩藻多糖可以显著提高Nrf2的表达水平,并促进Nrf2进入细胞核,从而降低高脂引起的神经前体细胞C17.2细胞中ROS水平的提高[40],这与本研究结论一致。总之,岩藻多糖可以通过Nrf2途径上调抗氧化酶的基因表达增强机体抗氧化能力,从而缓解肾脏的氧化损伤。
另外,ROS可以作为细胞内转导信号激活细胞内核转录因子如NF-κB,引起核内相关基因的转录,上调炎症介质的表达来诱导炎症,是诸多急、慢性及免疫失调疾病发生的分子基础。ROS诱导的炎症反应是由促炎细胞因子如IL-1、IL-6和TNF-α的作用介导的,这些细胞因子具有重要的免疫调节作用,其中IL-1失调会导致自身炎症、自身免疫和感染的产生和发展;IL-6具有调节多种细胞生长与分化的功能,同时也是自身免疫性和慢性炎症疾病的主要致病介质;而TNF-α除了可以杀伤或抑制肿瘤细胞之外,还可以刺激机体局部炎症反应。文献记录了氧化应激与促炎因子表达之间的相互关系,即氧化应激增加促炎因子表达,而促炎因子又促进氧化应激[41-42]。所以,氧化应激促进炎症因子参与大鼠肾脏的炎症,可能进一步加重肾脏氧化损伤。因此,我们研究了岩藻多糖是否对Diquat引起的肾脏损伤具有抗炎作用。本试验结果显示,大鼠肾脏受到氧化损伤时NF-κB表达显著上调,这说明Diquat诱导的氧化应激诱导了炎症通路NF-κB的激活,并显著上调了大鼠肾脏组织中促炎因子IL-1、IL-6和TNF-α的表达;饲喂岩藻多糖则降低了氧化应激引起的促炎因子IL-1、TNF-α及NF-κB表达的上调,其主要途径可能是通过调控NF-κB通路,并下调下游促炎因子IL-1和TNF-α基因表达,进而减轻肾脏炎症。这些结果与之前岩藻多糖降低链脲佐菌素诱导的糖尿病肾病大鼠血清IL-1β、IL-6和TNF-α含量以及肾脏中IL-6的表达[24,43-44],岩藻多糖缓解二嗪酮诱导的肾脏组织损伤大鼠血清IL-6和TNF-α含量上升[34],以及岩藻多糖降低微囊藻毒素-LR诱导的肾脏损伤小鼠血清白细胞介素-1β(IL-1β)、IL-6和TNF-α含量[20]的研究结果一致。这表明岩藻多糖能够通过NF-κB途径下调促炎因子的表达,从而缓解肾脏的氧化损伤。
岩藻多糖对肾脏氧化损伤的保护作用可能也与其抗细胞凋亡机制有关[17,19,26]。细胞凋亡是由基因所决定的细胞自动结束生命的程序性死亡过程,凋亡通路包括死亡受体和线粒体凋亡通路。其中半胱氨酸天冬氨酸蛋白酶(Caspase)依赖途径可以通过内在发生线粒体途径和外源性死亡受体途径,分别以Caspase-9和Caspase-8的激活为标志[45]。Bcl-2基因家族,是与细胞凋亡关系密切的原基因之一,其中Bcl-2是凋亡抑制因子,Bax为促凋亡因子,Bax通过插入线粒体外膜并通过寡聚化形成孔来促进细胞凋亡,从而诱导促凋亡因子的释放[46]。本试验结果表明,氧化应激上调了大鼠肾脏组织中Bax基因表达,并下调了Bcl-2基因表达,饲喂岩藻多糖能够有效扭转Bax表达的上调和Bcl-2表达的下调。Bcl-2和Bax作为Caspase-3的上游调控机制,可调节线粒体的通透性,Bcl-2过表达后可阻断细胞色素C(Cyt-C)的释放,抑制Caspase的活性[47],从而抑制大鼠肾脏细胞的凋亡。细胞收到凋亡信号后,Bid被激活为t-Bid。t-Bid与Bax结合并导致其构象变化被激活,促进Cyt-C释放到细胞质中并激活Caspase-9,然后裂解Caspase-3导致线粒体凋亡[48]。此外,本研究中,饲喂岩藻多糖还下调了氧化应激大鼠肾脏组织中Fas和FasL的基因表达,这可能是由于减少了死亡受体途径Fas受体与FasL三聚体结合,抑制了Caspase-8的激活,最终抑制了大鼠肾脏细胞的凋亡。与本研究结果相似,一项关于岩藻多糖对对乙酰氨基酚引起的大鼠急性肝损伤的保护作用的研究表明,岩藻多糖降低了大鼠肝脏细胞Bax和活化Caspase-3的增强表达,以及增加了被对乙酰氨基酚下调的Bcl-2的蛋白表达,发挥了对对乙酰氨基酚诱导的肝脏细胞凋亡的有效保护[19]。Zhu等[49]对雄性小鼠灌服岩藻多糖,结果显示岩藻多糖可以有效缓解高脂高糖饲粮诱导的胰岛β细胞Bax、Caspase-9和Caspase-3等线粒体凋亡通路关键基因表达的上调,但对Fas/FasL通路中的Fas和FasL等关键基因的表达没有影响。这与本研究结果略有不同,这可能与试验所使用的岩藻多糖的剂量和分子量不同有关,但具体的机制还需进一步研究。总体而言,岩藻多糖能够通过调控死亡受体和线粒体凋亡通路细胞凋亡调控因子的基因表达来缓解细胞凋亡,从而缓解肾脏损伤。
4 结 论
岩藻多糖可以通过Nrf2途径上调氧化应激大鼠肾脏抗氧化酶基因表达,增强机体抗氧化能力;也可通过NF-κB途径下调促炎因子的基因表达,缓解肾脏炎症反应,并通过调控细胞凋亡调控因子的基因表达来缓解肾脏细胞凋亡。总之,岩藻多糖对于大鼠肾脏氧化损伤有一定的缓解作用,其保护机制可能与岩藻多糖的抗氧化活性、抑制炎症反应和抗细胞凋亡作用有关。

