一株安庆六白猪源乳酸菌的分离鉴定及生物特性研究
吴雨晗 吴 婷 涂 健 李 哲 盛婷婷 李 峰 姚皓洲
(安徽农业大学动物科技学院,合肥 230000)
我国作为畜禽生产和消费大国,抗生素滥用导致的耐药性问题已严重影响到养殖业的发展,直接或间接影响到公众健康[1]。耐药病菌引起畜禽疫病时将会更难治疗,且会影响畜禽养殖的可持续发展[2];畜禽食品中抗生素残留也极易使人体产生过敏、耳聋及人体菌群失调导致的二次感染等不良反应[3]。因此,寻找一种无毒副作用、无残留的抗生素替代品已迫在眉睫。其中,益生菌可以克服抗生素所带来的负面影响,具有广阔的发展前景。
益生菌作为一种在适当剂量下给宿主带来健康益处的活微生物,主要种类有乳酸菌、芽孢杆菌和酵母等[4]。芽孢杆菌可使胃肠道处于一种厌氧环境,导致需氧和兼氧性致病菌的数量减少[5];酵母可分泌具有生物活性的酶,促进肠道有益菌群的生长[6];乳酸菌既可通过自身代谢的产物抑制病原菌的活性,又可通过黏附性影响其免疫调节活性,保护宿主肠道健康[7]。虽然益生菌具有抗菌活性、免疫调节等益生功能,但不同的菌株,即使为同一种属,其功能也可能会有很大差别,再加之目前我国自主开发的菌种很少,市售的益生菌相关产品中的菌株几乎被国外菌株所垄断[7],所以筛选优良的生产菌株是研制益生菌制品的关键步骤[8]。
因此,本试验旨在筛选出一株抗逆性强、抗菌效果好的乳酸菌,系统研究其环境耐受能力、抑菌能力、黏附能力、产酸能力以及生长曲线,为抗生素替代提供助力,为开发安全有效的益生菌微生态制剂或菌体产物相关免疫调节制剂提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试剂
MRS肉汤培养基、乳酸菌专用生化管(蔗糖、乳糖、麦芽糖、山梨醇、水杨苷、甘露醇、纤维二糖、棉子糖、七叶苷)购于青岛海博生物技术有限公司,溴甲酚绿购于天津市广复精细化工研究所,二甲苯购于西陇化工股份有限公司,抗荧光淬灭封片剂购于山东思科捷生物技术有限公司,异硫氰酸荧光素(FITC)购于上海源叶生物科技有限公司,革兰氏染色液试剂盒购于北京索莱宝科技有限公司。
1.1.2 样品和菌株
猪粪来源于安庆六白猪,大肠杆菌CMCC 44102来源于中国医学细菌保藏管理中心,沙门氏菌ATCC 9150、金黄色葡萄球菌ATCC 25923来源于美国菌种保藏中心。
1.2 试验方法
1.2.1 乳酸菌的分离鉴定
1.2.1.1 菌株的分离筛选
配制1%碳酸钙(CaCO3)的MRS固体培养基,取猪粪1 g与1 mL无菌磷酸盐缓冲液(PBS)混合,倍比稀释后涂布于含有1% CaCO3的MRS固体培养基上,于37 ℃恒温培养箱培养48 h,挑取其中有明显溶钙圈的单菌落进行纯化培养。
将纯化后的乳酸菌培养至对数期后,按1%接种量接种于无菌MRS液体培养基中,于50 ℃水浴20 min,培养4 h后吸取200 μL至96孔板中,使用酶标仪测定620 nm处的吸光度值(OD600),计算其存活率。
乳酸菌培养至对数期后,按1%接种量接种于pH=3的MRS液体培养基中,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率。
乳酸菌培养至对数期后,按1%接种量接种于含0.1%猪胆盐的MRS液体培养基中,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率。
存活率计算公式[9]:
存活率(%)=(A-B)/(a-b)。
式中:A为处理后菌液培养4 h后的OD600;B为处理后菌液培养0 h的OD600;a为37 ℃静置培养4 h的菌液的OD600;b为37 ℃静置培养0 h的菌液的OD600。
根据以上3种耐受性试验结果进行初筛,耐受优秀的乳酸菌采用凝胶打孔方法进行抑菌活性测定,根据抑菌活性结果进行复筛。
1.2.1.2 菌株的鉴定
对筛选出来的菌株进行生化管试验鉴定[10]。纯化3次后挑取单菌落于1.5 mL EP管中,培养至对数期,使用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-AAGTCGTAACAAGGTAACC-3’)进行PCR扩增,按照2 μL菌液,8 μL Mix,1 μL引物27F,1 μL引物1492R,8 μL双蒸水配制20 μL反应体系,进行PCR扩增。16S rRNA反应程序为[11]:预变性94 ℃ 5 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 90 s,以上重复30个循环,终端延伸72 ℃ 10 min。
配制1.5%琼脂糖凝胶,于1×TAE缓冲液中,以80 V、80 mA电泳30 min,使用凝胶成像系统分析结果,产物送至上海生工有限公司进行测序,所得结果使用BLAST分析,使用MAGE 7.0绘制进化树。
1.2.1.3 生长曲线测定
于培养基上挑取单菌落,培养至对数期后,按1%接种量转接至无菌的MRS液体培养基内,每2 h测定菌液的OD600。
1.2.2 乳酸菌的环境耐受性评价
1.2.2.1 耐热评价
菌株培养至对数期后,按1%接种量接种于无菌的MRS液体培养基中,于40、50、60、70、80、90 ℃水浴15 min,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率,计算公式见1.2.1.1。
1.2.2.2 耐酸评价
菌株培养至对数期后,按1%接种量接种于pH=2.0、2.5、3.0、3.5、4.0、4.5、5.0的MRS液体培养基中,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率,计算公式见1.2.1.1。
1.2.3 乳酸菌的生物学功能评价
1.2.3.1 产酸能力测定
按1%接种量接种菌液至无菌的液体MRS中,培养24 h,每隔2 h测1次pH。
配制溴甲酚绿蛋白胨培养基,每升水加入蛋白胨10 g,葡萄糖5 g,溴甲酚绿0.012 g,琼脂15 g。凝固后使用打孔器打孔,每孔注入200 μL培养至对数期菌液(pH=6.0),当pH变为3.6时固体培养基从蓝绿色变成黄色。冰箱放置3 h后放入培养箱,过夜后观察。
1.2.3.2 抑菌能力测定
于LB固体培养基按1%接种量加入OD600=1.0的大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150,轻摇混匀,凝固后使用打孔器打孔,每板一孔加入200 μL OD600=1.0的乳酸菌菌液,一孔加入离心过滤后的上清,最后一孔加入无菌的MRS液体培养基,于冰箱放置4 h后恢复室温30 min,放入培养箱过夜即可观察结果[12]。
1.2.3.3 疏水能力测定
将乳酸菌菌液5 000×g离心弃去上清,加入PBS清洗3次菌体,使用0.1 mol/L的KNO3重悬,调整OD600=0.5,取3 mL菌悬液+1 mL二甲苯静置10 min,振荡1 min,静置30 min,取水相测定OD600,计算公式如下:
疏水性(%)=(1-OD600/0.5)×100。
1.2.3.4 自聚合能力测定
将乳酸菌菌液5 000×g离心弃去上清,加入PBS清洗3次菌体,使用PBS重悬,调整OD600=0.5,振荡10 s,37 ℃静置2 h,取上层清液测定OD600,计算公式如下:
自聚合性(%)=(1-OD600/0.5)×100。
1.2.3.5 共凝集能力测定
将各菌菌液调整OD600=0.5,取等量乳酸菌的菌悬液与大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150分别混合,室温静置,于0和18 h取上清液测OD600,计算公式如下:
共凝集性(%)=[0.5-OD600]/0.5×100。
1.2.4 乳酸菌的动物饲喂试验
1.2.4.1 乳酸菌的肠道内定植观察
使用无菌PBS将FITC粉末稀释为200 μg/mL的储备液,于4 ℃冰箱避光保存备用,将乳酸菌培养至对数期,4 ℃、5 000×g离心10 min,去上清,使用无菌PBS洗涤菌体3次,使用FITC储备液重悬成109CFU/mL的菌悬液,避光37 ℃孵育2 h取出,使用无菌PBS洗涤其至无色,并使用PBS将其配制为109CFU/mL的菌悬液。
选择20只小鼠,随机分为2组,分别为饲喂菌液组和对照组,每组10只,公母各占1/2。饲喂菌液组小鼠灌胃被FICT标记过的109CFU/mL菌悬液0.5 mL,对照组小鼠灌胃PBS稀释后的FITC溶液0.5 mL,12 h后安乐处死小鼠并快速收集肠组织(0.5 mm×0.5 mm),PBS避光清洗,放置于玻片上滴加1滴抗荧光猝灭剂,于上方轻轻盖上盖玻片,于荧光显微镜下观察[13]。
1.2.4.2 乳酸菌诱导脏器指数变化观察
选择20只小鼠,随机分为2组,分别为饲喂菌液组和对照组,每组10只,公母各占1/2。饲喂菌液组小鼠灌胃0.5 mL 109CFU/mL乳酸菌,对照组小鼠灌胃0.5 mL PBS,7 d后安乐处死小鼠并采集胸腺和脾脏,进行称重,计算脏器指数。计算公式如下:
脏器指数(mg/g)=脏器质量(mg)/
小鼠质量(g)。
1.2.4.3 乳酸菌生物安全性评价
选择20只小鼠,随机分为2组,分别为饲喂菌液组和对照组,每组10只,公母各占1/2。饲喂菌液组小鼠灌胃0.5 mL 109CFU/mL乳酸菌,对照组小鼠灌胃0.5 mL PBS,饲喂14 d后,观察小鼠精神状态、生病或死亡情况以及解剖腔(包括胸腔、腹腔与其中脏器)是否有病理变化。
1.3 数据的处理及分析
所有试验均进行了6次重复试验,去最高与最低数据后,剩余数据进行处理分析。试验数据均使用SPSS 19.0软件进行单因素方差分析。数据以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 乳酸菌的分离筛选与鉴定结果
2.1.1 初筛结果
从健康六白猪粪便中获得了6株疑似乳酸菌,分别命名为T’-1、T’-2、J’-1、J’-3、Tβ、J’-4,对其进行酸处理(pH=3)、热处理(50 ℃)和胆盐处理(0.1%),根据结果进行初筛。由表1可见,J’-1、J’-3、Tβ、J’-4酸处理下的存活率显著高于T’-2(P<0.05),T’-1、Tβ、J’-4热处理下的存活率显著高于T’-2、J’-1、J’-3(P<0.05),J’-1,Tβ,J’-4胆盐处理下的存活率显著高于T’-1(P<0.05)。综合上述结果,挑选J’-1、Tβ、J’-4进行复筛。

表1 酸处理、热处理和胆盐处理下菌株存活率
2.1.2 复筛结果
从初筛结果挑选J’-1、Tβ、J’-4进行抑菌试验复筛。由表2可见,3株菌株对大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150均有不同程度的抑制作用,J’-1、Tβ对大肠杆菌CMCC 44102的抑菌能力显著高于J’-4(P<0.05),Tβ对金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150的抑菌能力显著高于J’-1、J’-4(P<0.05)。

表2 J’-1、Tβ、J’-4对不同致病菌的抑菌能力
2.1.3 形态特征及染色结果
综合以上试验结果,挑取具有优秀抗逆性和抑菌能力的Tβ进行后续试验。由图1可见,Tβ进行3次纯化培养之后于MRS固体培养基上可以观察到白色湿润、边缘光滑的菌落,菌落直径在1~2 mm;革兰氏染色镜检可以观察到单个或成对存在的革兰氏阳性菌,无芽孢和鞭毛,符合乳酸菌特征。

A:菌落形态 colony morphology;B:革兰氏染色镜检 Gram stain microscopy(1 000×)。
2.1.4 分子生物学鉴定结果
由图2可见,通过通用引物(27F、1492R)对Tβ进行扩增,在1 500 bp处出现条带。由图3可见,通过核苷酸同源性比对,Tβ与约翰氏乳杆菌同源性高达99.50%。
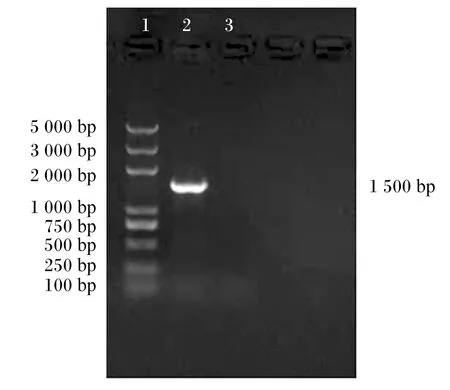
1:Trans2K Plus DNA Ladder;2:Tβ;3:阴性对照 negative control。
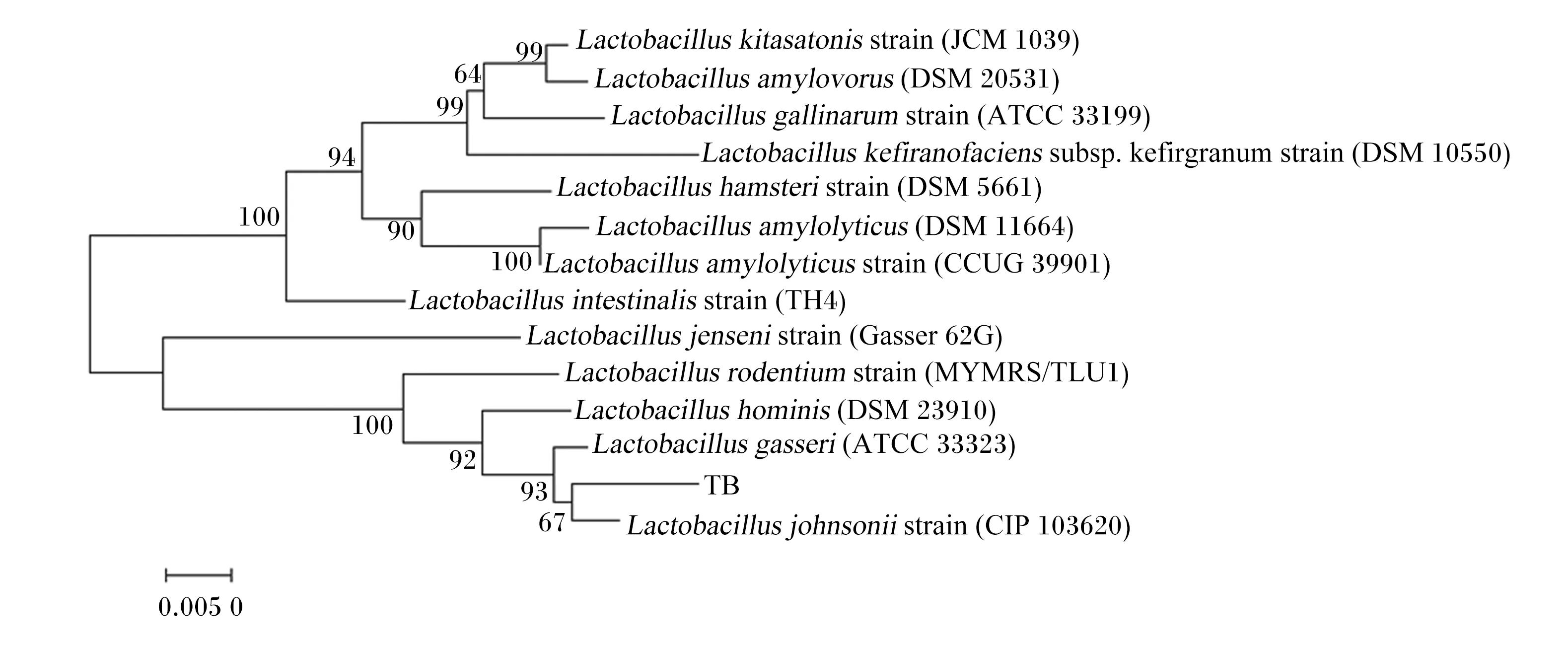
Lactobacillus kitasatonis strain:北卡罗来纳乳杆菌菌株;Lactobacillus amylovorus:淀粉乳杆菌;Lactobacillus gallinarum strain:鸡乳杆菌菌株;Lactobacillus kefiranofaciens:鸡乳杆菌;Lactobacillus hamsteri strain:哈姆斯特乳杆菌菌株;Lactobacillus amylolyticus:淀粉乳杆菌;Lactobacillus amylolyticus strain:淀粉乳杆菌菌株;Lactobacillus intestinalis strain:肠道乳酸杆菌菌株;Lactobacillus jenseni strain:詹森乳杆菌菌株;Lactobacillus rodentium strain:乳酸杆菌菌株;Lactobacillus hominis:人乳杆菌;Lactobacillus gasseri:格氏乳杆菌;Lactobacillus johnsonii strain:约氏乳杆菌菌株。
2.1.5 生理生化特性结果
由表3可见,通过形态观察、染色结果、分子生物学鉴定结果、生理生化试验结果综合分析可知,该菌株为约翰氏乳杆菌。
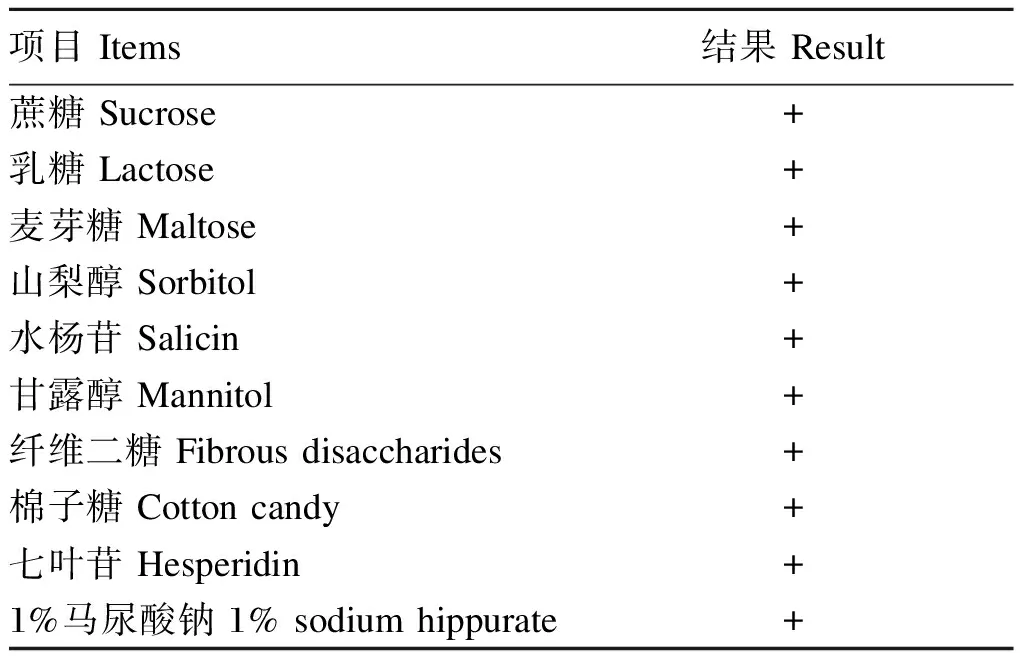
表3 Tβ的生理生化鉴定结果
2.1.6 生长曲线结果
由图4可见,Tβ在4~8 h为生长对数期,生长较快,10 h开始生长速度下降,16 h之后进入平稳期。
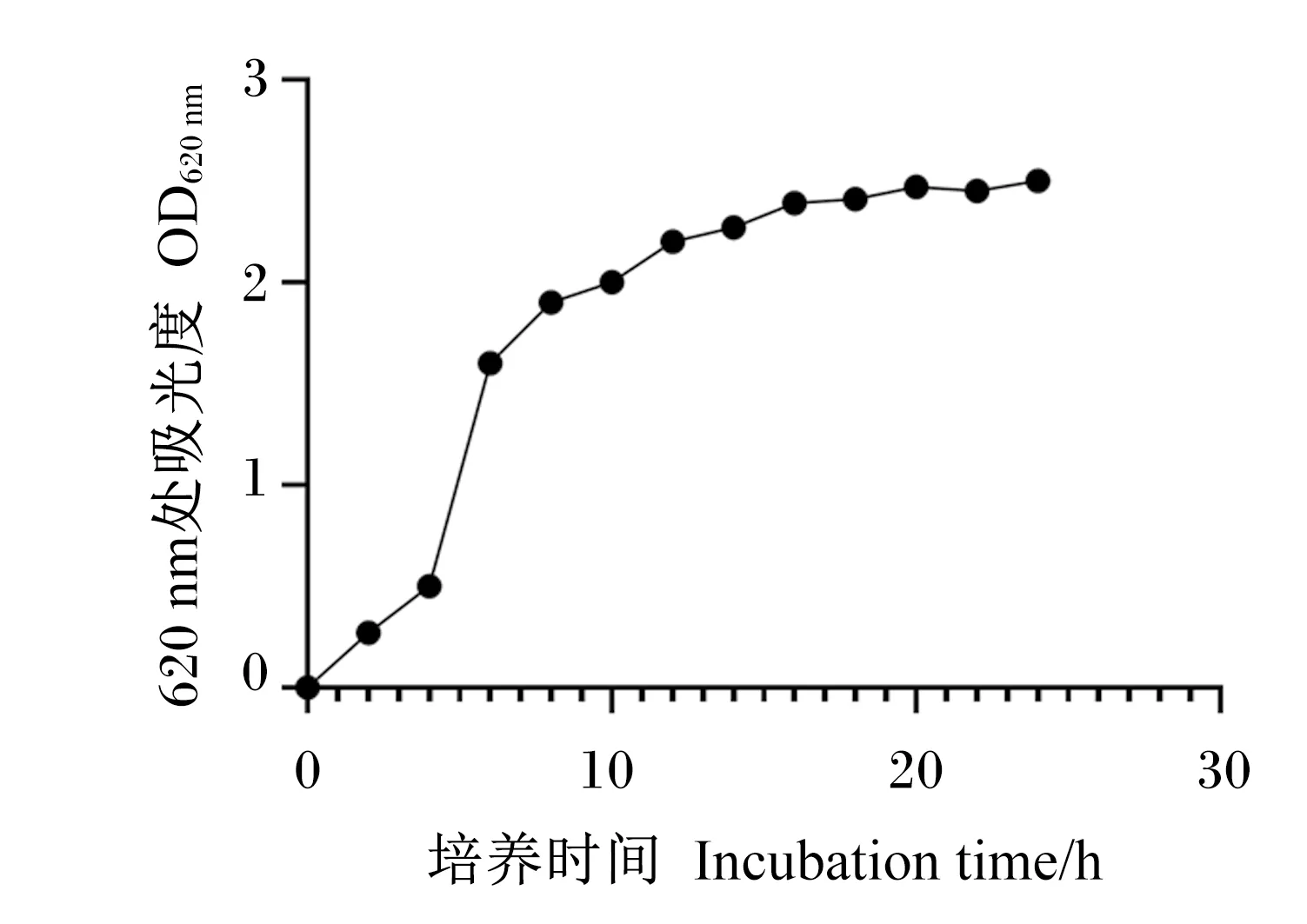
图4 Tβ生长曲线
2.2 Tβ的环境耐受性评价结果
2.2.1 耐热评价结果
由图5-A可见,40 ℃热处理之后的Tβ存活率为93.54%,50 ℃热处理之后的Tβ存活率为73.09%,60 ℃热处理之后的Tβ存活率为60.33%,说明在60 ℃之前,温度对于Tβ的存活与生长没有太大的影响。70 ℃热处理之后的Tβ存活率为16.82%,80 ℃热处理之后的Tβ存活率为15.05%,90 ℃热处理之后的Tβ存活率为14.02%。70、80、90 ℃热处理之后的Tβ存活率显著低于40、50、60 ℃(P<0.05)。以上结果表明,70 ℃及以上较为不利于Tβ生长,但是在90 ℃时Tβ依旧可以存活并且缓慢生长,说明此菌耐热性较强。
2.2.2 耐酸评价结果
由图5-B可见,pH为2.0培养时Tβ存活率为12.1%,pH为2.5培养时Tβ存活率为13.45%,pH为3.0培养时Tβ存活率为32.01%,pH为3.5培养时Tβ存活率为45.41%,pH为4.0培养时Tβ存活率为53.2%,而当pH为4.5培养时Tβ存活率为60.13%,pH为5.0培养时Tβ存活率为68.47%。pH为4.0、4.5、5.0培养时Tβ存活率显著高于pH为2.0、2.5、3.0培养时(P<0.05)。以上结果表明,pH为4.0~5.0时Tβ可正常生长,而在pH为2.0时也有Tβ存活生长,说明Tβ的耐酸能力较为优秀。
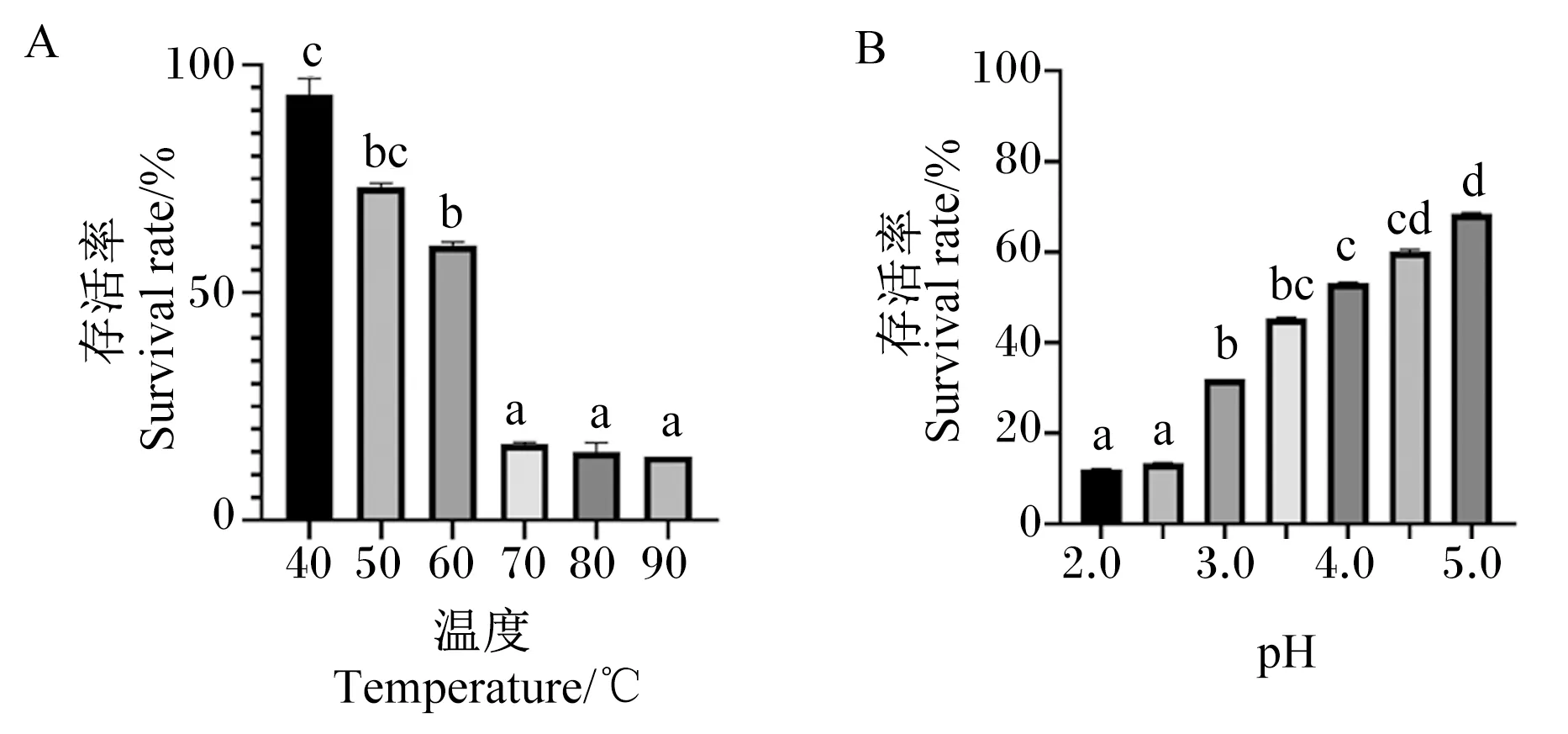
A:不同温度处理后的Tβ存活率 survival rate of Tβ treated at different temperatures;B:不同pH培养时Tβ存活率 survival rate of Tβ when cultured at different pH。
2.3 乳酸菌的生物学功能评价
2.3.1 产酸能力测定
由图6-A可见,溴甲酚绿在pH为3.6时会由蓝色变为黄色,加入Tβ菌液的培养基有明显变化,且产酸圈直径达到了35 mm,与对照组相比变化明显。由此可见,Tβ产酸效果优异。
由图6-B可见,在0、2 h Tβ菌液的pH分别为7.2、6.8,但在4 h急剧下降至6.0,并且在6 h达到5.1,一直到8 h降至4.5后才回归平稳,后续在10 h到达了4.1,12 h到达了3.6。于培养箱放置24 h后菌液的pH为3.4。由此可见,Tβ产酸能力较好,2~12 h为产酸高峰期。
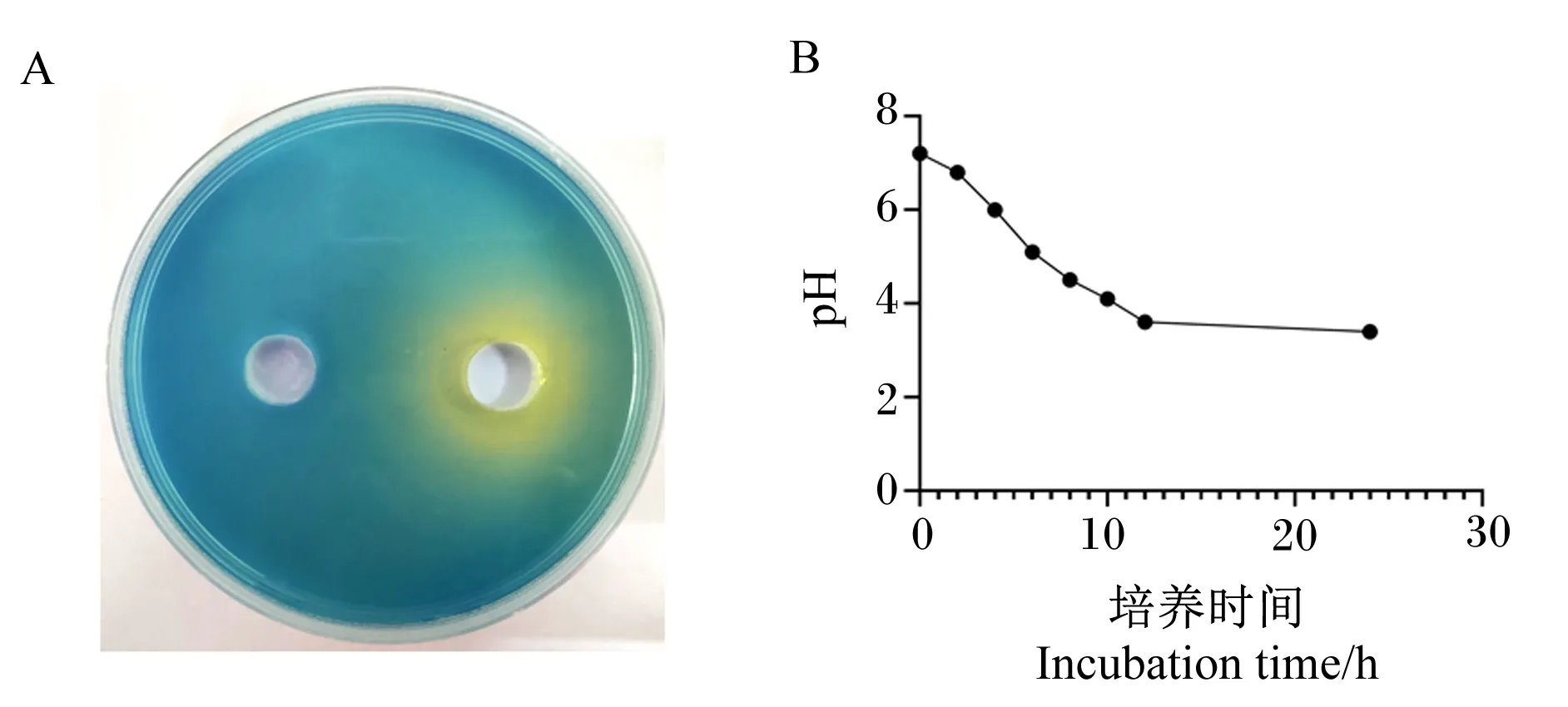
A:产酸圈图 acid-producing circle diagram;B:产酸曲线 acid-producing curve。
2.3.2 抑菌能力测定
由表4、图7可见,Tβ菌悬液和上清液对大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150都有良好的抑菌能力,其中Tβ菌悬液对金黄色葡萄球菌的抑菌能力显著高于上清液(P<0.05)。

1:空白对照 blank control;2:Tβ上清液 Tβ supernatant;3:Tβ菌悬液 Tβ bacterial suspension。

表4 Tβ菌悬液和上清液对不同致病菌的抑菌能力
2.3.3 自聚合能力测定
细菌对于自聚合能力的划分标准为,自聚合性在16%~35%为低自聚合能力,在36%~50%为中等自聚合能力,在50%以上为高自聚合能力。Tβ的自聚合性为16.77%,说明Tβ具有较低的自聚合能力。
2.3.4 疏水能力测定
细菌对于疏水能力的划分标准为,疏水性在20%以下为非疏水,在20%~50%为中度疏水,在50%以上为高度疏水。Tβ的疏水性为51.80%,说明Tβ具有较高的疏水能力。
2.3.5 共凝集能力测定
由图8可见,Tβ与金黄色葡萄球菌ATCC 25923共凝集性为52.11%,与沙门氏菌ATCC 9150共凝集性为75.64%,与大肠杆菌CMCC 44102共凝集性为73.95%;Tβ与金黄色葡萄球菌ATCC 25923的共凝集性显著低于沙门氏菌ATCC 9150和大肠杆菌CMCC 44102(P<0.05)。由此可知,Tβ与沙门氏菌ATCC 9150的共凝集能力最好,对金黄色葡萄球菌ATCC 25923的共凝集能力较弱。
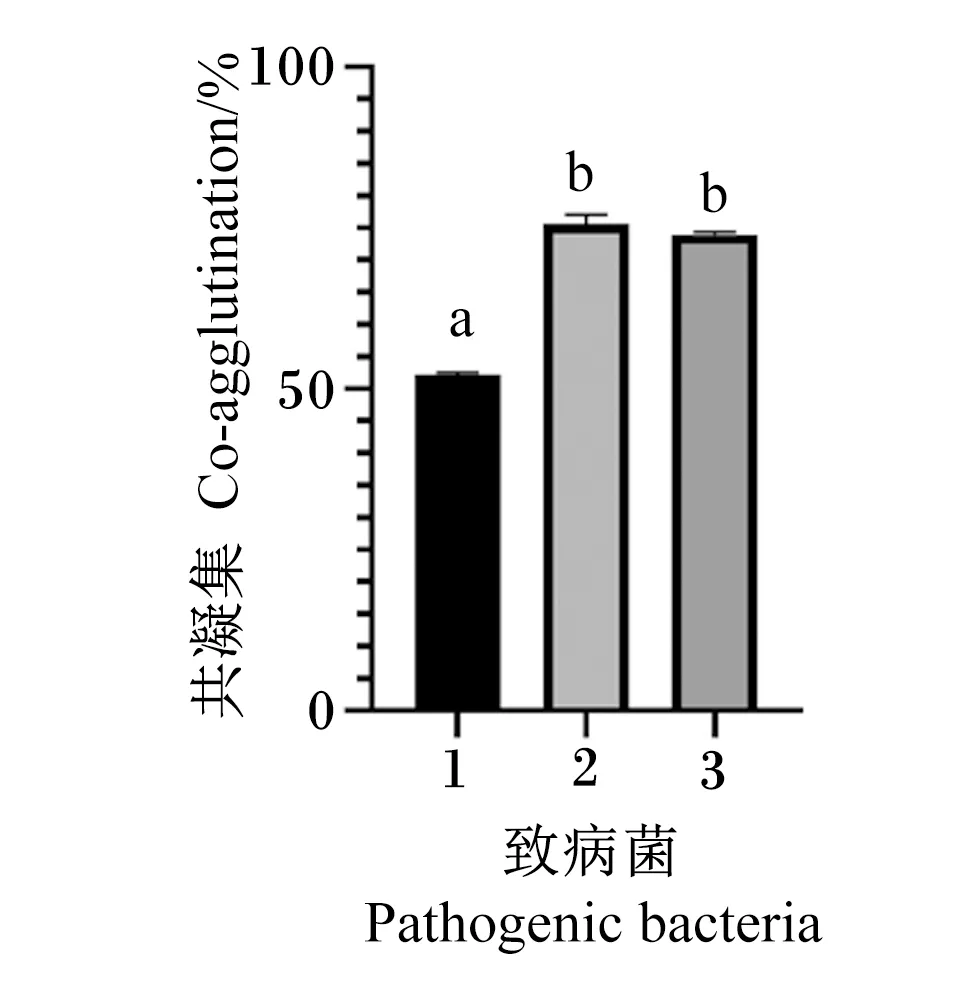
1:金黄色葡萄球菌ATCC 25923 Staphylococcus aureus ATCC 25923;2:沙门氏菌ATCC 9150 Salmonella ATCC 9150;3:大肠杆菌CMCC 44102 Escherichia coli CMCC 44102。
2.4 乳酸菌的动物饲喂试验结果
2.4.1 乳酸菌的肠道内定植观察
由图9可见,取肠道组织于荧光显微镜下观察,饲喂菌液组肠道组织可观察到大量荧光,荧光来源于被FITC标记的菌体,说明Tβ肠道黏附能力优秀。
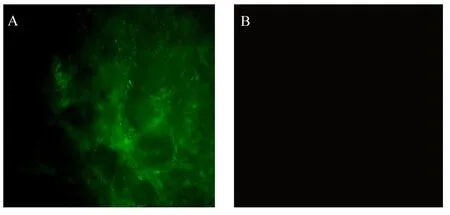
A:饲喂菌液组的肠道组织显微镜观察图 microscopic view of intestinal tissue of the fed bacteria solution group;B:对照组的肠道组织显微镜观察图 microscopic view of intestinal tissue of the control group。
2.4.2 脏器指数
由表6可见,饲喂菌液组的小鼠脾脏指数和肝脏指数较对照组均增加,饲喂菌液组的肝脏指数显著高于对照组(P<0.05),且解剖观察到饲喂菌液组和对照组小鼠免疫器官均无病理变化,说明Tβ有促进免疫器官生长的效果。
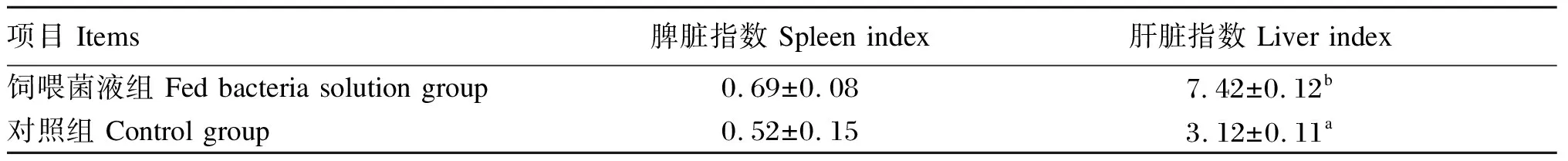
表6 脏器指数结果
2.4.3 动物安全性评价
经过14 d的饲喂,试验小鼠精神状态良好,无生病或者死亡,解剖观察解剖腔无病理变化,证明Tβ无致病性,是一种安全无毒的优秀的微生态制剂备用菌。
3 讨 论
乳酸菌是哺乳动物肠道内的益生菌之一,对动物机体有着不可小觑的益生作用。张在等[15]通过溶钙圈法从猪粪中提取出了10株疑似乳酸菌。本试验借鉴了此方法,通过在MRS培养基中加入CaCO3,挑取具有溶钙圈的菌落,在耐受性试验初筛与抑菌活性测定复筛后,选择最优菌进行乳酸菌专用生化管鉴定,再通过16S rRNA反应程序进行PCR扩增,出现正确条带后送检,得到核苷酸序列进行比对建立进化树,确定此菌株是约翰氏乳杆菌。
在动物的胃肠道内存活是乳酸菌在动物体内产生作用的基础[16],因此我们检测了Tβ的耐酸能力、耐热能力和耐胆盐能力,证明了其具有优良的在动物消化道内存活的能力。考虑饲料的发酵以及环境保存不当可能会导致强酸、高温等恶劣环境,我们检测了其在pH为2时的存活率,平均存活率为12.1%,付浩等[17]研究了乳酸菌于不同pH(3.5、4.5、5.5、6.5、7.5)处理后的存活率,在pH为3.5时菌株存活明显下降,与本试验结果相符。同时本试验也检测了Tβ在90 ℃时的存活率,其在90 ℃时也可存活并且生长,平均存活率为14.02%。曹海鹏等[18]测定了乳酸菌在30~60 ℃时的存活率,在30~45 ℃时乳酸菌存活率基本无变化,45 ℃以上随着温度升高存活率逐渐降低,与本试验结果一致。以上结果证明了Tβ具有优异的抗逆能力。
乳酸菌具有优秀的抑菌能力,是因为其可以产生乳酸以及一些抑菌物质[19]。孔祥丽等[20]证实了乳酸对致病菌有抑制作用;顾彬涛[13]也证实了乳酸菌对肠毒素性大肠杆菌ETEC 10和金黄色葡萄球菌A65具有体外抗菌能力,以上研究成果与本研究结果相符。Tβ具有十分优异的产酸能力,由此我们可以将两者联系起来,测定Tβ的抑菌能力,得到结果证明Tβ对大肠杆菌和沙门氏菌具有优秀的抑菌能力,Tβ上清液与菌悬液结果差异不显著;对金黄色葡萄球菌的抑菌能力,Tβ上清液与菌悬液结果相差较大,Tβ菌悬液的抑菌效果更优秀。针对以上结果我们可以得出结论,Tβ具有良好的抑菌效果,其菌悬液对大肠杆菌、金黄色葡萄球菌、沙门氏菌均有一定抑菌效果。
益生菌的益生效果与其黏附能力息息相关,在消化道内黏附时间越长,发挥作用越大[21]。孙笑非等[22]通过禽类动物试验证实了乳酸菌可以通过提高肠绒毛高度、改善黏膜结构来提高营养成分的消化吸收、增强上皮细胞的调节功能、防御病原菌和维持细胞稳态等。想要消灭病原菌,与病原菌共凝集也是十分重要的一环[23]。通过本试验结果可知,Tβ具有一定的自凝集能力和较高的疏水能力,在病原菌共凝集试验中结果较为优异。龚虹等[24]测定了不同乳酸菌的黏附能力,结果显示德氏乳杆菌与罗伊乳杆菌具有良好的疏水能力和自凝集能力,而戊糖片球菌则疏水能力与自凝集能力较弱。本试验选用菌株为约翰氏乳杆菌,试验结果显示具有较优秀的黏附能力,推测乳酸杆菌的黏附能力会较优于乳酸球菌。
石水琴[25]通过FITC标记乳酸菌,成功观测到了被FITC标记的乳酸菌。本试验结果表明,饲喂菌液组小鼠肠道组织于荧光显微镜下可观察到大量荧光,证明Tβ肠道黏附能力十分优秀。饲喂菌液组的小鼠脏器指数高于对照组,且饲喂菌液组的小鼠无任何异常,解剖腔也无肉眼可观察到的病变,说明Tβ在一定程度上可以提高机体免疫能力。
4 结 论
从安庆六白猪粪便中纯化而来的Tβ经过16S rDNA核酸同源性分析、生化管鉴定、细菌形态及菌落特征综合分析,确定其为约翰氏乳杆菌。Tβ是一株优异的微生态制剂备用菌,具有耐热和耐酸能力强、产酸丰富、抑菌谱广、生长迅速、黏附能力优秀等特点。动物试验显示,Tβ具有优良的肠道益生功能。

