基于液相色谱的菊苣及其相关产品中6种功能成分的分析方法
李晶,钱晓国,许洪高,陈小强,鲁绯*
(1.北京市营养源研究所有限公司,北京 100069;2.北京市系统营养工程技术研究中心,北京 100069;3.河北省菊苣膳食纤维技术创新中心,河北 承德 130826)
菊苣(Cichorium intybus L.)是一种多年生菊科菊苣属草本植物[1],在世界各地均有栽培[2],在我国主要分布于新疆、辽宁、山西、黑龙江、北京和江西等地[3]。菊苣是一种药食两用植物,1977年被纳入我国国家药典,具有清热解毒、利尿消肿和健胃等功效。菊苣的叶子和根可作开胃菜、制作泻药和利尿茶,而菊苣根提取物菊粉作为一种膳食纤维在食品生产中的应用也越来越广泛[4-7]。
近年来,人们对菊苣植物化学成分越来越感兴趣。研究证明菊苣中除了具有丰富的营养成分[8],如碳水化合物、脂肪、蛋白质、氨基酸、维生素E、β-胡萝卜素、玉米黄质和矿物质等,还含有多种具有潜在生物活性的功能成分,如倍半萜内酯、咖啡酸衍生物、香豆素类、黄酮类、生物碱和类固醇等[2,9-11]。这些生物活性物质显示出广泛的生物学和药理特性,如抗高尿酸血症、抗炎、抗糖尿病、抗肿瘤、抗氧化和抗增殖、保肝护肝、抗菌等作用[1-2,8,10-16]。此外,菊苣中的一些化合物,如多酚[11-12]、菊粉[4-7]和倍半萜内酯[15]等被认为是食品功能的潜在载体,它们的含量是菊苣及其相关产品品质的一个重要指标。因此,菊苣中功能成分的准确定量,对菊苣及其相关衍生产品(包括食品和保健品)的品质评价和质量控制具有十分重要的意义。
菊苣酸、绿原酸、秦皮甲素、秦皮乙素、山莴苣素和山莴苣苦素是菊苣中6种重要的生物活性化合物,它们的分子结构如图1所示。
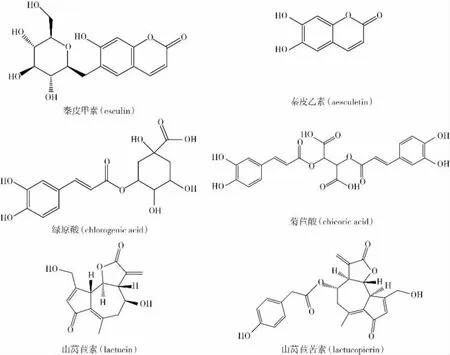
图1 6种功能成分的分子结构图Fig.1 Molecular structure diagrams of the six functional components
咖啡酸衍生物菊苣酸和绿原酸属于多酚类化合物,分子中含有多个羟基和羧基。目前,绿原酸和菊苣酸等多酚类化合物的定量分析方法有高效液相色谱法(high-performance liquid chromatography,HPLC)紫外可见(ultra violet-visible,UV-Vis)或二极管阵列(Diode array detector,DAD)检测法[11,17-20]、液相色谱串联质谱法(high performance liquid chromatography-tandem mass spectrometry,LC-MS/MS)[11,21]和毛细管电泳法(capillary electrophoresis)DAD 检测[22]等。秦皮甲素和秦皮乙素是简单香豆素类化合物[23],它们是只在苯环一侧有取代,且7位羟基未与6位或8位取代基形成呋喃环或吡喃环的香豆素类,其主要分析方法为液相色谱紫外可见或二极管阵列检测法[24-26]。山莴苣素和山莴苣苦素是菊苣中的主要倍半萜内酯类化学成分,倍半萜内酯是菊苣属植物呈苦味和具有抗疟、保肝、镇痛等生物活性的主要原因[15]。由于山莴苣素和山莴苣苦素具有较强烈的苦味,它们在菊苣和相关衍生产品中的存在应有效地控制,以使产品品质呈现最佳状态[27]。山莴苣素和山莴苣苦素的定量分析方法主要有HPLC[25-28]和HPLC-MS/MS法[29]。然而,目前还未见同时测定上述6种功能成分含量的分析方法的相关报道。
本研究建立了同时测定菊苣及其相关产品中菊苣酸、绿原酸、秦皮甲素、秦皮乙素、山莴苣素和山莴苣苦素6种功能成分含量的HPLC和超高效液相色谱法(ultra high-performance liquid chromatography,UPLC)分析方法。两种分析方法准确性好,灵敏度高,可作为监控菊苣药材、提取物及其他相关衍生产品中6种功能成分含量的技术手段,有助于质量控制和评价菊苣及其相关产品的应用开发。
1 材料与方法
1.1 材料与试剂
菊苣根、菊苣蓉(菊苣加工副产物):丰宁平安高科实业有限公司。
山莴苣素(纯度≥95%)、山莴苣苦素(纯度≥95%)、菊苣酸(纯度≥98%)、绿原酸(纯度≥98%)、秦皮甲素(纯度≥98%)、秦皮乙素(纯度≥98%):上海源叶生物科技有限公司;甲醇、乙腈(色谱级):Fisher Chemical公司;磷酸(分析纯):北京化工厂。本试验所用水为超纯水。
1.2 仪器与设备
Thermo Scientific Vanquish系列UHPLC液相色谱仪(含VH-P10高压二元体系泵、VH-A10自动进样器、LC-VQ柱温箱、HL型二极管阵列检测器和Chromeleon 7.2 SR4色谱数据系统):美国赛默飞世尔科技(中国)有限公司;KQ5200DE型数控超声波清洗仪:昆山市超声仪器有限公司;HITACHI CF16RX高速冷冻离心机:日本日立工机(Hitachi Koki)有限公司;RE-2000A旋转蒸发仪:郑州科泰实验设备有限公司;FiveEasy Plus FE28 pH计:瑞士梅特勒-托利多(Mettler Toledo)集团;MX-F涡旋混合器:北京联合科仪科技有限公司。
1.3 方法
1.3.1 样品预处理
将菊苣根和菊苣蓉烘干,粉碎均匀后过80目筛。准确称取(1.000 0±0.000 1)g样品于50 mL离心管中,加入70%的甲醇水溶液20 mL,混匀后在35℃~40℃水浴中超声提取30 min(输入总功率为700 W,超声频率为 40 kHz),在 80 000 r/min离心 15 min,将上清液转移至100 mL鸡心瓶中;残渣中再加入70%的甲醇水溶液20 mL,按照上述条件再重复超声提取、离心,合并上清液于100 mL鸡心瓶,在45℃旋蒸至近干,用70%的甲醇水溶液溶解后转移至10 mL容量瓶并定容至刻度,混匀后经0.22 μm微孔滤膜过滤,待用。
1.3.2 标准溶液的配制
精密称取山莴苣素、山莴苣苦素、菊苣酸、绿原酸、秦皮甲素和秦皮乙素标准品各(10.00±0.01mg)于10mL容量瓶中,用甲醇溶解并定容至刻度,混匀后作为储备液,于-20℃避光保存,测定前进行系列标准溶液的稀释。
1.3.3 色谱条件
1.3.3.1 HPLC条件
色谱柱:Agilent ZORBAX SB-C18(4.6mm×250mm,5 μm);柱温:30℃;山莴苣素和山莴苣苦素检测波长为258 nm,菊苣酸、绿原酸、秦皮甲素和秦皮乙素检测波长为330 nm;流动相A为0.1%H3PO4水溶液,流动相B为甲醇,梯度洗脱程序为:0~5 min,5.0%~15.0%B;5 min~15min,15.0%~25.0%B;15 min~25 min,25.0%~50.0%B;28 min~30 min,80%B;30 min~33min,80.0%~5.0%B;33 min~40 min,5.0%B。流速:1.0 mL/min;进样体积:10 μL。根据保留时间(配合紫外光谱)定性目标化合物,使用外标法根据峰面积定量。
1.3.3.2 UPLC条件
色谱柱:Thermo Scientific Accucore Vanquish C18+(2.1mm×100 mm,1.5μm);柱温:30℃;检测波长和流动相同1.3.3.1;梯度洗脱程序:0~8min,5.0%~7.0%B,8min~9 min,7.0%~32.0%B,9 min~11 min,32.0%B,11.5 min,5%B,11.5 min~15.0 min,5.0%B;流速:0.4 mL/min;进样体积:5 μL。根据保留时间(配合化合物紫外光谱)定性化合物,使用外标法根据峰面积定量。
1.3.4 标准曲线的绘制
移取一定量的标准储备溶液,用甲醇稀释配制为质 量 浓 度 为 0.10、0.20、0.50、1.00、2.00、5.00、10.00、20.00、50.00 μg/mL 和 100.00 μg/mL 的系列标准溶液。按照1.3.3的色谱条件进行色谱分析,分别以山莴苣素、山莴苣苦素、菊苣酸、绿原酸、秦皮甲素和秦皮乙素的质量浓度为横坐标(X),峰面积为纵坐标(Y)作图,进行线性回归分析。相关系数R2>0.999时进行样品定量分析。
1.3.5 加标样品回收率的测定
准确称取1 g菊苣蓉样品6份,分别加入200 μg的山莴苣素、山莴苣苦素、菊苣酸、绿原酸、秦皮甲素和秦皮乙素,按照1.3.1的方法进行样品的预处理,再按照1.3.3的色谱条件进行测定,计算回收率。
2 结果与分析
2.1 检测波长的确定
根据山莴苣素、山莴苣苦素、菊苣酸、绿原酸、秦皮甲素和秦皮乙素的最大吸收波长选择检测波长。6种功能成分的紫外可见光谱见图2。
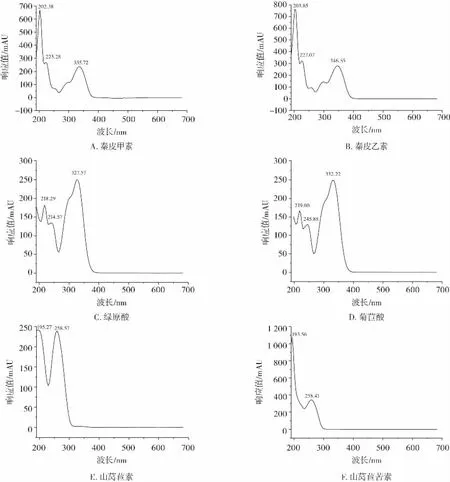
图2 紫外可见光谱Fig.2 UV-Vis absorption spectrum
由图2可知,在紫外可见光谱区,山莴苣素在195.27 nm和258.57 nm有两个最大吸收峰,山莴苣苦素在193.56 nm和258.41 nm有两个最大吸收峰,菊苣酸在219.00、245.88 nm和332.22 nm有3个最大吸收峰,绿原酸在218.29、241.57 nm和327.57 nm有3个最大吸收峰,秦皮甲素在202.38、223.28 nm和335.72 nm有3个最大吸收峰,秦皮乙素在203.85、227.07 nm和346.55 nm有3个最大吸收峰。由于在紫外光谱区的分子吸收干扰多,因此通常选定接近可见光谱区长波方向的最大吸收波长为检测波长。在258 nm波长下,山莴苣素和山莴苣苦素有最大吸收峰,两种成分得到了较好的分离,确定258 nm为山莴苣素和山莴苣苦素的检测波长。在330 nm波长下,菊苣酸、绿原酸、秦皮甲素和秦皮乙素都接近最大吸收峰,6种成分的分离效果好,因此确定330 nm为菊苣酸、绿原酸、秦皮甲素和秦皮乙素的检测波长。
2.2 流动相的选择
考察了不同流动相和流动相配比对山莴苣素、山莴苣苦素、菊苣酸、绿原酸、秦皮甲素和秦皮乙素色谱行为的影响,也对在HPLC法中使用的色谱柱[Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm) 色谱柱和Thermo Scientific Hypersil GOLD C18(4.6 mm×250 mm,5 μm)]和在UPLC法中使用的色谱柱[Thermo Scientific Accucore Vanquish C18+(2.1 mm×100 mm,1.5 μm)色谱柱和Waters ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)色谱柱]进行了选择。采用不同的梯度洗脱方式进行色谱分析,比较了甲醇和水流动相、乙腈和水流动相、甲醇和乙酸水流动相、乙腈和乙酸水流动相、甲醇和磷酸水溶液流动相以及乙腈和磷酸水溶液流动相对实际样品的分离效果,结果见图3。
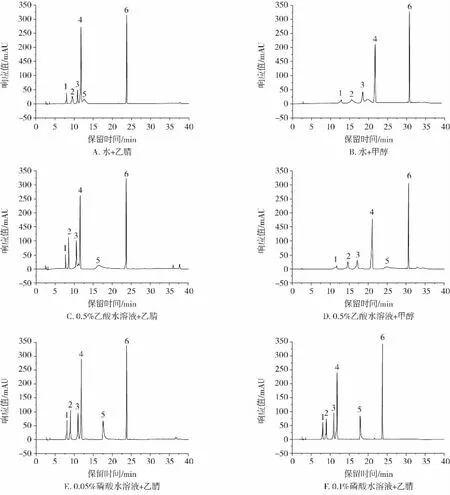
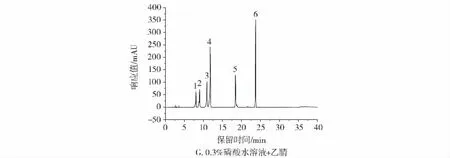
图3 不同流动相条件试验色谱图Fig.3 Chromatogram with different mobile phase conditions
如图3A~3D所示,流动相中有机相为乙腈时,色谱峰峰形更好,响应值更高,在相同的洗脱梯度条件下色谱峰出峰时间也更快,并且采用酸性流动相时的分离效果更佳。图3E~3G是乙腈和不同浓度(0.05%、0.1%、0.3%)磷酸水溶液作为流动相时的色谱图。显然,当流动相中磷酸的浓度由0.05%增加至0.1%时,色谱峰峰形更好,而流动相中磷酸的浓度为0.1%和0.3%时,色谱分离度和峰形无明显差别。磷酸水溶液浓度越高,pH值越低。通常,C18色谱柱适用的酸度范围是pH值为2~8,而Agilent ZORBAX SB-C18色谱柱的适用酸度范围为pH值1~8,更适合酸性流动相。因此,确定以0.1%的磷酸水溶液和乙腈作为流动相,通过优化两相配比,采用梯度洗脱方式对6种功能成分进行分离。6种功能成分在Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)分析柱上的出峰顺序为秦皮甲素、绿原酸、秦皮乙素、山莴苣素、菊苣酸和山莴苣苦素,色谱分离度和峰形良好,选择Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)作为 HPLC 法测定6种功能成分的分离柱。考察了流速在0.8 mL/min~1.2 mL/min范围内对分离效果的影响,在合理时间内,1.0 mL/min的流速是分离效果最佳的流速。
流动相为0.1%磷酸和乙腈时的UPLC色谱图见图4。
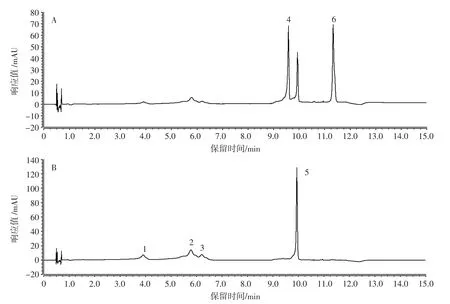
图4 流动相为0.1%磷酸和乙腈时的UPLC色谱图Fig.4 UPLC chromatogram with mobile phase of 0.1%phosphoric acid and acetonitrile
如图4所示,UPLC法中6种功能成分在Accucore Vanquish C18+分析柱上的出峰顺序为秦皮甲素、秦皮乙素、绿原酸、山莴苣素、菊苣酸和山莴苣苦素,色谱分离度和峰形良好。在Accucore Vanquish C18+色谱柱上,秦皮乙素比绿原酸先洗脱出来,山莴苣素和菊苣酸的色谱行为更相似,保留时间更接近,选择Accucore Vanquish C18+(2.1 mm×100 mm,1.5 μm)作为 UPLC法测定山莴苣素、山莴苣苦素、菊苣酸、绿原酸、秦皮甲素和秦皮乙素的分离柱。选择同一检测波长进行检测,即在258 nm对6种功能成分进行定量测定,秦皮甲素、绿原酸、秦皮乙素和菊苣酸的检测灵敏度会低于检测波长为330 nm的灵敏度。相比HPLC法,UPLC法在维持分离度的同时增加了通量,减少分析时间的同时提高了分离度,提高了色谱分离效率。
2.3 试样提取方法的选择
植物中功能成分的提取方法包括煎煮、浸渍、渗漉、回流和连续提取的传统溶剂提取法、超临界流体萃取法、超声波辅助萃取法、微波辅助萃取法、加速溶剂萃取法以及其它萃取法如分散液液微萃取法等。超声波提取法具有设备和操作简单、低温提取、提取物活性高且提取率高的优点[30]。超声波辅助提取法中,超声波产生的强烈振动、高速和强烈的空化效应、搅拌作用,破坏了植物组织的细胞,细胞膜的破裂和细胞壁的机械破坏使得提取溶剂可迅速渗透到细胞质和细胞液中,加速植物化学成分的浸出,并且这种可以控制的溶剂渗透到植物组织基质中的过程能够防止提取产物变性[31],而原料粒径的减小和溶剂用量的增加都有助于提高有效成分的提取产量[30-33]。Mazvimba 等[31]、Stuart等[32]和Saleh等[33]的研究指出,采用甲醇(或乙醇)和水的混合提取溶剂而不是100%的甲醇(乙醇)或100%的水有助于提高超声萃取中功能成分的有效提取产量,并相应地降低蛋白质和多糖等杂质的溶出或提取物掺假。试验中比较了不同提取溶剂、超声提取温度和时间对6种功能成分超声波萃取的提取效果,结果见表1。
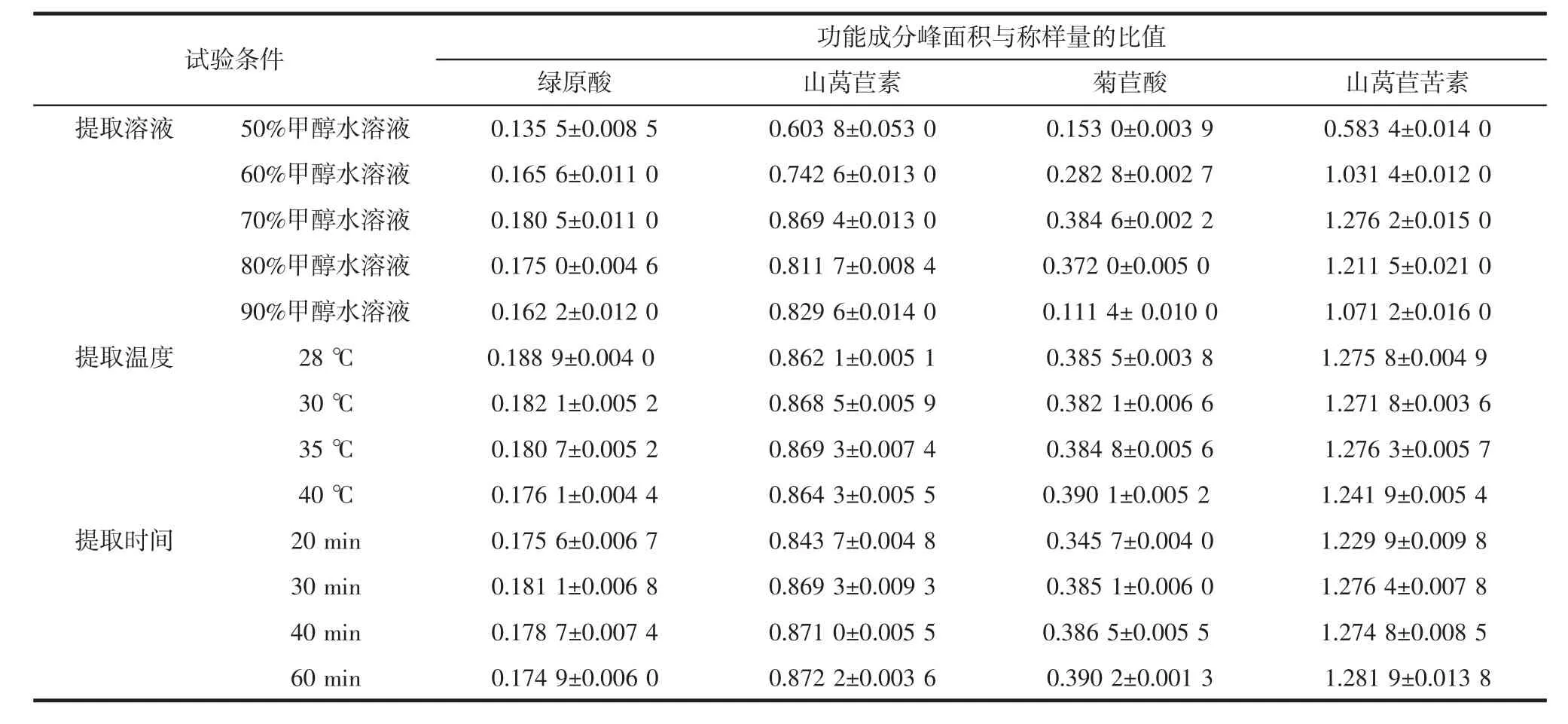
表1 不同提取条件对提取效果的影响Table 1 Influence of different extraction conditions on the extraction effect
如表1所示,确定以70%甲醇水溶液作为提取溶剂。超声提取温度为28、30、35、40℃时,对6种功能成分的提取效率影响很小,超声提取温度为40℃时绿原酸的提取效率略有降低,因此,确定超声提取温度为35℃~40℃。提取时间为30 min时,提取效果最好。
确定提取方法:超声提取时间为30 min,离心后收集上清液于鸡心瓶中,残渣中再加入20 mL提取溶剂后重复处理1次,合并两次的上清液,在45℃旋蒸至近干,用70%甲醇水溶液复溶后,转移至10 mL容量瓶并定容至刻度。
2.4 标准曲线的线性范围和精密度
分别将不同浓度的6种功能成分混合标准溶液按HPLC和UPLC色谱条件进行测定,得到标准溶液色谱图,见图5。
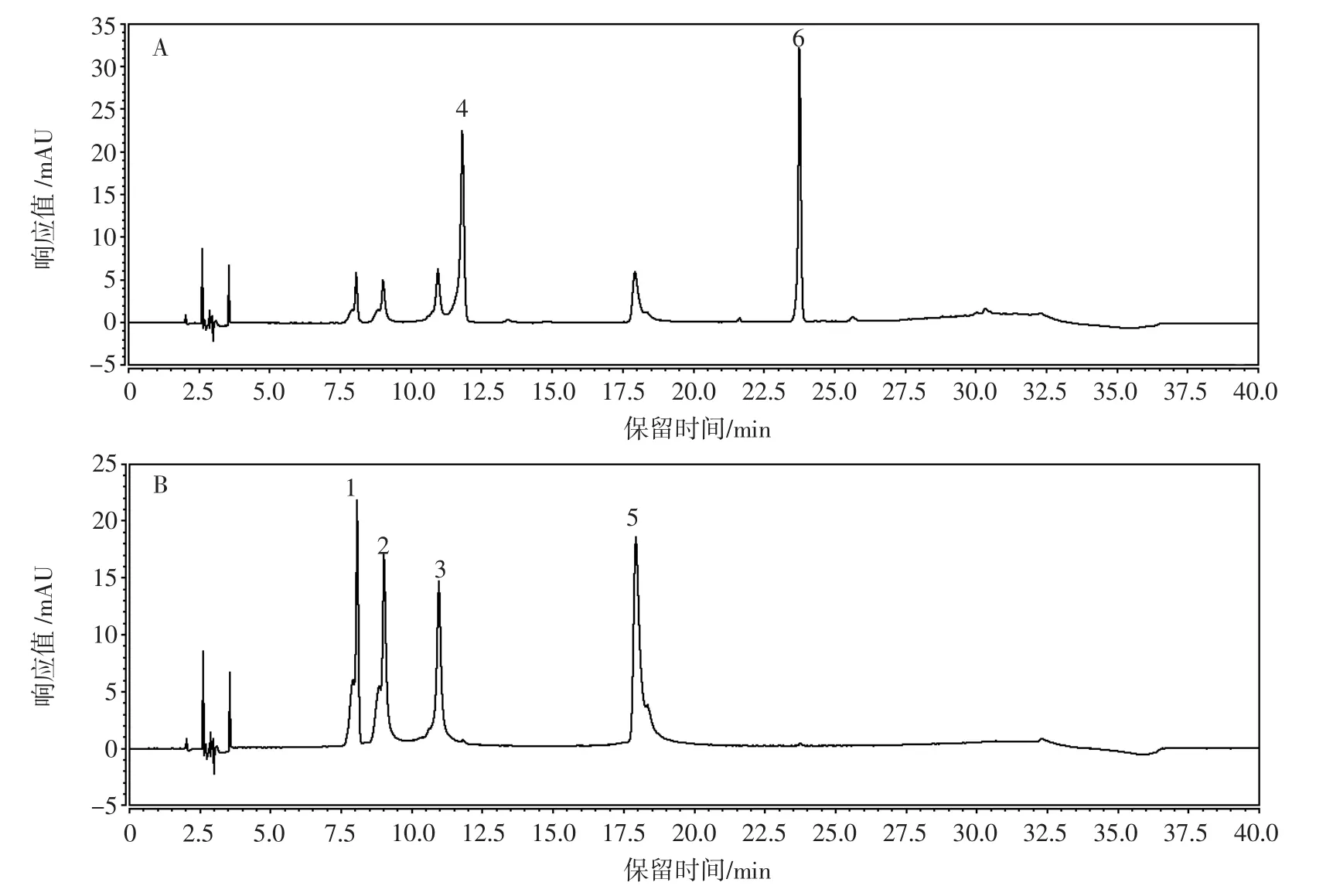
图5 HPLC标准溶液色谱图Fig.5 HPLC chromatogram of standard solution
HPLC法分离秦皮甲素、绿原酸、秦皮乙素、山莴苣素、菊苣酸和山莴苣苦素的保留时间分别为8.050、8.986、10.935、17.914、11.811 min 和 23.747 min,UPLC法分离秦皮甲素、秦皮乙素、绿原酸、山莴苣素、菊苣酸和山莴苣苦素的保留时间分别为3.836、5.736、6.186、9.576、9.966 min和 11.292 min,绿原酸在 Vanquish C18+色谱柱上的保留时间比秦皮乙素更长。
以6种功能成分的质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标作图,得到线性回归方程见表2。
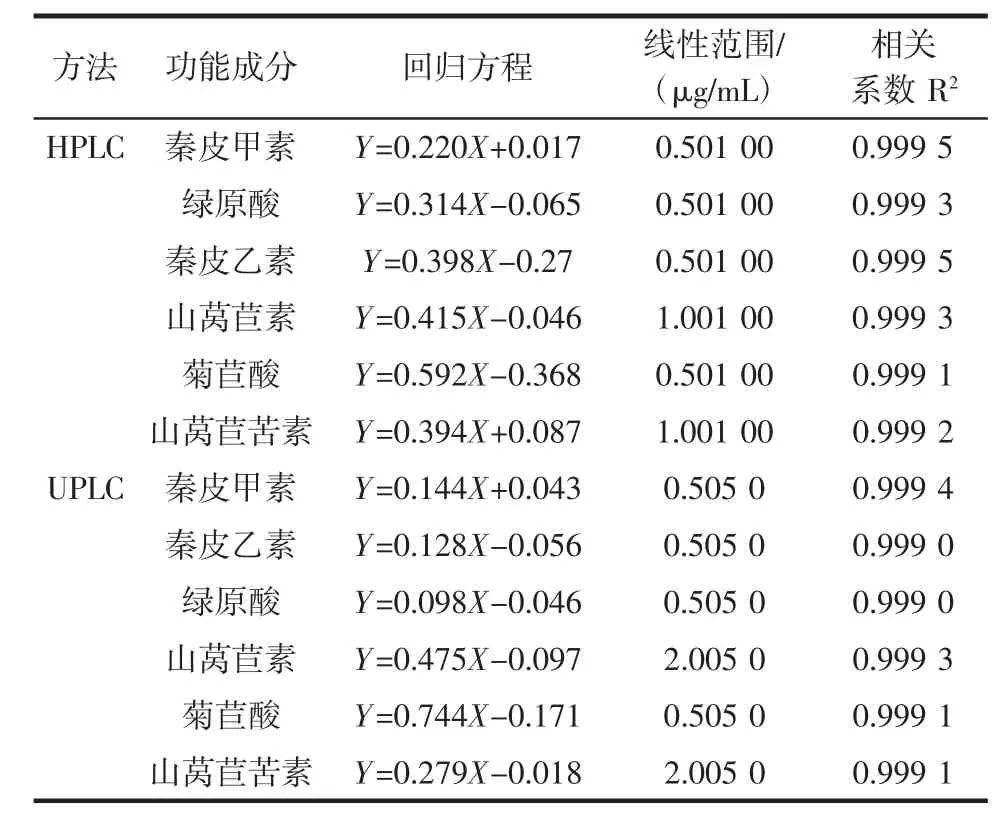
表2 6种功能成分的标准曲线回归方程、线性范围Table 2 Regression equation and linear range of standard curves for the six components
由表2可知,6种功能成分的浓度与峰面积具有良好的相关性。以10 μg/mL的混合标准溶液连续重复进样8次进行精密度试验,6种功能成分测定结果的相对标准偏差(relative standard deviation,RSD)的最大值分别是0.058%(HPLC法)和0.079%(UPLC法),表明精密度满足方法学定量的要求。
2.5 方法的检出限和定量限
根据国家标准GB/T 27417—2017《合格评定化学分析方法确认和验证指南》对检出限和定量限的规定,以3∶1的信噪比确定方法的检出限,以10倍的信噪比确定方法的定量限。HPLC法和UPLC法测定6种化合物的检出限和定量限列于表3。
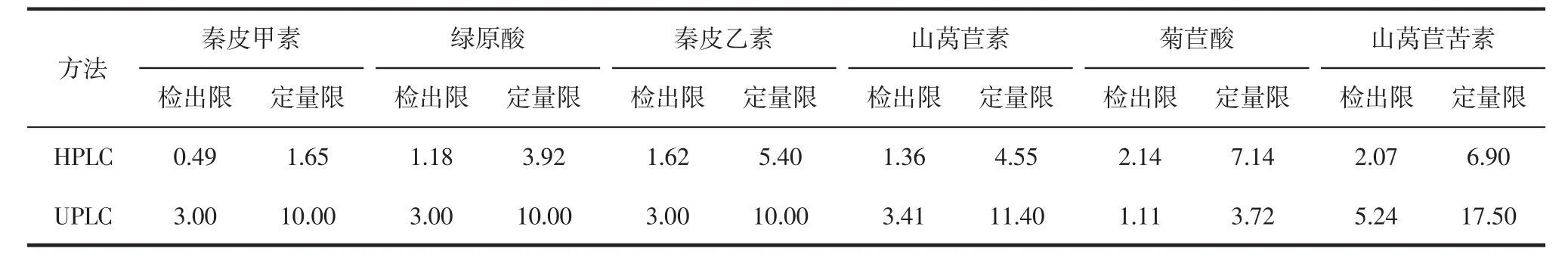
表3 HPLC法和UPLC法测定6种功能成分的检出限和定量限Table 3 Limit of detection and limit of quantitation of the six functional components determined by HPLC and UPLC mg/kg
由表3可知,相比HPLC法,UPLC法具有更高的检测灵敏度。这一结果可能由于UPLC法所使用的Accucore Vanquish C18+色谱柱性能和柱效影响了秦皮甲素、绿原酸、秦皮乙素、山莴苣素、菊苣酸和山莴苣苦素的分析效果,响应值偏低导致检出限和定量限均高于HPLC法。
2.6 方法的准确度和重复性试验
对方法的准确性进行考察,选择菊苣蓉样品进行加标回收试验。在1.3优化后的试验条件下,分别对200 μg/g添加水平的6个平行样品进行测定,回收率结果和重复性试验的RSD见表4。

表4 回收率试验结果Table 4 Recovery test result
HPLC法6种功能成分的平均回收率为97.0%~103.6%,RSD值均小于等于3.98%,UPLC法6种功能成分的平均回收率为97.3%~102.4%,RSD值均小于2.96%,符合国家标准GB/T 27417—2017对方法回收率和正确性的规定,表明方法是可靠和准确的。
菊苣蓉样品本底和加标样品的色谱图见图6。
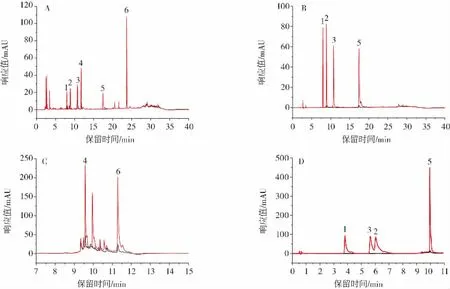
图6 菊苣蓉样品和加标样品的色谱图Fig.6 Chromatogram of chicory processed product sample and spiked sample
2.7 样品中6种功能成分的含量
菊苣根和菊苣蓉样品中的6种功能成分的含量见表5。

表5 样品中6种功能成分的含量Table 5 Content of the six functional components in the sample mg/kg
由表5可知,菊苣根中6种功能成分的含量大小为绿原酸>菊苣酸>山莴苣苦素>山莴苣素>秦皮乙素>秦皮甲素。由菊苣根提取的菊苣蓉中不含秦皮甲素和秦皮乙素,其它4种化合物的含量大小依次为山莴苣苦素>山莴苣素>菊苣酸>绿原酸,且大大低于它们在菊苣根中的含量,绿原酸的含量为最低。
菊苣根样品的HPLC法和UPLC法色谱图见图7。
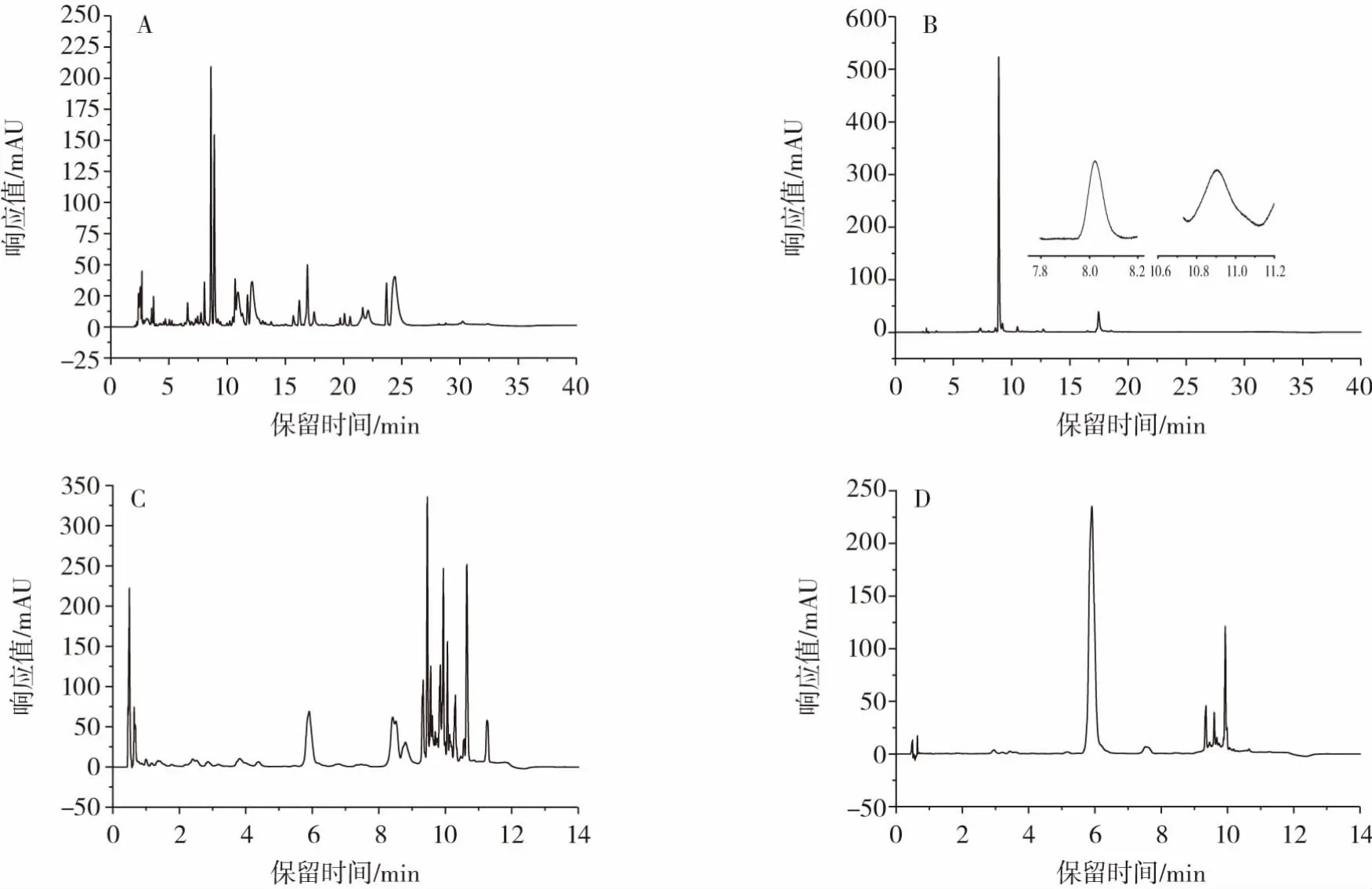
图7 菊苣根样品的色谱图Fig.7 Chromatogram of chicory root residue sample
由图7可知,两种分析方法均适用于菊苣样品中6种功能成分的含量测定。
3 结论
菊苣中富含多种生物活性物质,它们的含量是菊苣及其衍生产品品质的一个重要指标。本研究建立了测定菊苣及其相关产品中秦皮甲素、秦皮乙素、绿原酸、菊苣酸、山莴苣素和山莴苣苦素含量的HPLC和UPLC分析方法。采用HPLC法在25 min内6种功能成分分离度良好,应用UPLC法12 min内6种功能成分完全分离。优化了样品制备方法和色谱分离条件。采用70%甲醇水溶液超声提取功能成分,C18色谱柱分离,柱温30℃,以0.1%磷酸水溶液和乙腈作为流动相,HPLC法中流动相流速为1.0 mL/min,UPLC法中流动相流速为0.4 mL/min,紫外检测器258 nm对山莴苣素和山莴苣苦素进行检测,在波长330 nm对秦皮甲素、秦皮乙素、绿原酸和菊苣酸进行检测,两种方法重复性测定结果的相对标准偏差均小于4%,回收率在97.0%~103.6%范围内。HPLC法6种功能成分的检出限最低为0.49 mg/kg,最高为2.14 mg/kg,定量限最低为1.65 mg/kg,最高为7.14 mg/kg;UPLC法6种功能成分的检出限最低为1.11 mg/kg,最高为5.24 mg/kg,定量限最低为3.72 mg/kg,最高为17.50 mg/kg。方法学验证结果表明,两种分析方法准确性好,具有较好的精密度、重复性、稳定性和较大的线性范围,均适用于菊苣及其相关衍生产品中6种功能成分的含量测定。UPLC法的分析速度快,HPLC法适用范围更广泛,可以作为菊苣合理利用以及相关产品质量评价的科学依据,具有一定的理论意义和应用价值。

