通过足细胞Cdc50a基因敲除构建一种全新的肾小球硬化症小鼠模型
赵月,张倩,李静怡,陈桂兰,曾博
(西南医科大学心血管医学研究所,医学电生理学教育部重点实验室,四川 泸州 646000)
肾脏的主要功能是过滤血液、排泄废物和调节体内平衡(Gorriz&Martinez-Castelao,2012)。肾单位是尿生成的基本功能单位,每个人的肾脏大约有100万个肾单位,每个肾单位由肾小体及肾小管系统组成,肾小体又由肾小球及肾小囊构成,其中,肾小球作为肾脏的过滤单位,可以对血浆进行超滤,这一过程只允许水、葡萄糖、离子和含氮废物等低分子量物质从血液进入鲍曼氏空间,同时保留重要的蛋白(Barry.,2019)。肾小球由内皮细胞、系膜细胞、鲍曼包膜壁层上皮细胞和足细胞4种细胞组成(Lu.,2019)。足细胞是肾小球中分化程度最高的细胞类型,在肾小球滤过屏障中起着至关重要的作用,这些细胞形态复杂,由细胞体、主要足突和次要足突组成,相邻足突由狭缝隔膜连接,狭缝隔膜覆盖在肾小球基底膜的外部,也是尿蛋白和肾病综合征产生的最后屏障(Haraldsson.,2008)。因此,对滤过屏障的破坏,特别是对足细胞的破坏,是许多慢性肾脏疾病的标志,慢性肾脏疾病最终发展成局灶性节段性肾 小 球 硬 化(focal segmental glomerulosclerosis,FSGS)(Sang.,2020)。FSGS是研究足细胞病和蛋白尿最广泛使用的疾病模型之一(Bose&Cattran,2014)。蛋白尿与肾小球滤过率是慢性肾病的评估指标。蛋白尿是慢性肾病进展的有力标志,也是心血管死亡率增加的标志(Gorriz &Martinez-Castelao,2012)。
跨膜双分子层磷脂不对称是大多数生物膜的共同结构特征(Daleke&Lyles,2000)。研究表明,含有胆碱的磷脂[磷脂酰胆碱(PC)和鞘磷脂(SM)]定位于质膜的外层。相反,氨基磷脂[磷脂酰乙醇胺(PE)和磷脂酰丝氨酸(PS)]在这些膜的内侧富集。这种脂质组织是由许多磷脂转运体产生和维持的,其中,质膜氨基磷脂翻转酶能选择性地将磷脂酰丝氨酸从质膜的内侧运输到质膜的外侧(Yang.,2018)。PS翻转酶的P4-ATPases是一组磷脂转运体,是P型ATPases的一个亚家族。P4-ATPases产生并维持磷脂不对称,在细胞膜稳定性、囊泡运输、血液凝固、细胞极性和迁移、凋亡细胞清除、细胞分裂、精子获能和细胞信号转导等方面发挥重要作用(Folmer.,2012)。
CDC50(又称TMEM30)家族蛋白作为P4-ATPases的β亚基跨膜蛋白(除ATP9A和ATP9B外),通过异源二聚作用形成一个功能性磷脂转运复合物对P4-ATPases的折叠和转运起至关重要的作 用(Folmer.,2012;Yang.,2018)。CDC50A(又称TMEM30A)是在小鼠中表达最丰富和最普遍的CDC50家族成员,它是一种末端糖基化糖蛋白,通过辅助磷脂翻转酶将氨基磷脂(磷脂酰丝氨酸)从细胞质膜外侧翻转至内侧,以维持细胞内外磷脂的不对称分布,调节细胞存活和亚细胞结构的定位,对维持多种生理系统的正常功能至关重要(Yang F.,2019)。此前研究报道,CDC50A缺失会导致磷脂酰丝氨酸暴露于细胞外,作为凋亡信号引起细胞凋亡,从而引起一系列疾病:在视网膜中,视杆双极细胞表现为反应性胶质增生、胶质纤维酸性蛋白和CD68表达增加,光敏视网膜电图反应的缺失、锥视蛋白的错误定位及视锥细胞的缺失(Zhang.,2017;Yang F.,2019)。在小脑中,CDC50A缺失可导致早发型共济失调和小脑萎缩(Yang.,2018);在肝脏中,CDC50A缺失会损害小鼠胎儿肝的红细胞生成,通过影响胆汁盐转运体的正常表达和定位,导致肝内胆汁淤积(Liu.,2017;Yang Y.,2019);在造血系统中,CDC50A对造血细胞和白细胞的存活至关重要(Li.,2018);在胰腺中,CDC50A缺失会影响胰岛素分泌和葡萄糖敏感性,从而导致葡萄糖刺激胰岛素分泌受损(Yang.,2021)。CDC50A在重要器官中均有表达并维持着重要的生理功能(Folmer.,2012;Zhang.,2017;Stevens&Oltean,2018)。
肾脏作为人体最主要的代谢器官之一,行使着一系列的细胞内外运输功能,本研究推测基因在这些过程中也发挥着至关重要的作用。本研究通过构建一个足细胞特异性基因敲除(cKO)模型来阐明CDC50A在肾小球中的作用。实验结果显示,敲除小鼠的肾小球滤过率降低,滤过屏障功能严重受损,出现蛋白尿和FSGS。这种全新的肾小球硬化症小鼠模型表明,CDC50A在维持足细胞存活和肾小球滤过屏障完整性方面发挥着关键作用。
1 材料与方法
1.1 材料
2.5P-Cre转基因小鼠购自美国Jackson Laboratory,转基因小鼠由四川省人民医院朱献军教授提供。所有动物实验经西南医科大学实验动物伦理委员会审核批准,在医学电生理学教育部重点实验室开展[实验动物生产许可证号:SCXK(川)2018-17,实验动物使用许可证号:SCXK(川)2018-065]。所有动物实验均按照批准的方案和相关指南进行。小鼠在西南医科大学实验动物中心SPF动物房繁育,饲养过程中给予充足的饮水和饲料,光周期为12 h光照/12 h黑暗。
为了获得足细胞特异性基因敲除小鼠,本研究将基因中携带有flox序列的条件性敲除()小鼠与足细胞中表达Cre重组酶(2.5P-Cre)的转基因小鼠杂交,获得基因型为2.5P-Cre/小鼠,Cre阳性杂合子后代与小鼠进行杂交获得基因型为2.5PCre/(cKO)小鼠,同时选择小鼠作为对照组。
动物基因组DNA快速抽提试剂盒、一步法TUNEL细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司,2×Es Taq MasterMix购自康为世纪生物科技有限公司,FITC-Sinistrin示踪剂购自华东医药股份有限公司,小鼠基因型鉴定引物由北京擎科生物科技有限公司成都分公司合成,麻醉药物异氟烷由西南医科大学统一订购分配使用。
1.2 方法
1.2.1 肾小球特异性基因敲除小鼠模型研究使用的2.5P-Cre转基因小鼠为人NPHS2启动子驱动的足细胞特异性Cre重组酶表达小鼠,基因条件性敲除小鼠是在目的DNA片段两侧插入2个同方向的LoxP位点。当其与2.5P-Cre转基因小鼠交配后,在肾小球足细胞中表达的Cre重组酶对2个LoxP位点进行剪切和重组,导致靶基因被敲除。
2种转基因小鼠及其杂交后代的基因型鉴定使用2.5P-Cre特异性引物(2.5P-F:TGCCACGACCAAGTGACAGCAATG,2.5P-R:ACCAGAGACGCAAATCCATCGCTC,目的条带大小:200 bp)和特异性引物(Cdc50a-F:ATTCCCCTCAAGATAGCTAC,Cdc50a-R:AATGATCAACTGTAATTCCCC,目的条带大小:245 bp;WT:179 bp)对鼠尾DNA进行PCR扩增,根据产物电泳结果判断基因型。鼠尾DNA提取采用动物基因组DNA快速抽提试剂盒,取鼠尾(0.5~1 mm)于50 μL DNA Extraction Solution及2 μL Enzyme Mix混合溶液中,55℃金属浴30 min,95℃金属浴15 min,冷却后加入50 μL Stop Solution混匀震荡离心,用作PCR模板。PCR体系(20 μL):ddHO 7 μL,引物各1 μL,DNA 1 μL,2×Es Taq MasterMix 10 μL。PCR程序:95℃2 min;94℃20 s,53℃/55℃20 s,72℃20 s,35个循环;72℃1 min,10℃保存。产物经2%琼脂糖凝胶电泳分离后成像分析。
抓取小鼠背颈部将小鼠提起,当小鼠应激时会流出尿液,用EP管接取随机尿,操作过程中避免粪便掉落EP管中污染尿液,尿液采集后-80℃保存,避免尿蛋白降解,多次收集至500 μL,3 000 r·min,离心10 min,收集上清液送至西南医科大学附属中医医院检验科进行尿蛋白、肌酐及尿电解质检测。
肾小球滤过率(glomerular filtration rate,GFR)指单位时间内(每分钟)两侧肾生成的超滤液量,是衡量肾功能的重要指标之一。在实验前一天,用电动剃毛刀和脱毛膏将小鼠一侧从大腿上部至颈部进行脱毛至皮肤裸露,需要避开脊柱。用生理盐水配置FITC-Sinistrin荧光示踪剂溶液,配置浓度为35 mg·mL,配置后的溶液-20℃避光保存。FITC-Sinistrin示踪剂剂量为7 mg/100 g体质量。连接检测仪和电源,蓝色LED灯闪烁即接通电源,大约10 s后开始采集并存储数据,之前的存储在设备上的数据将在本次接通电源后自动删除。将检测仪上的LED灯与贴片透明窗口精准对接并粘贴在小鼠裸露皮肤上,同时用胶带固定。记录背景信号2~3 min,将小鼠进行异氟烷麻醉后静脉注射FITC-Sinistrin荧光示踪剂,测量期间小鼠放置在单独笼中,尽量保持安静,检测时间60~90 min后,把检测仪从小鼠身上取下进行数据读取和分析。
小鼠麻醉称重后迅速剖检,取双侧肾脏,PBS缓冲液洗涤血液并用干纸吸取水分,称定质量,计算肾脏指数=肾脏质量/体质量。
肾脏组织用10%中性甲醛固定24 h,冲洗,脱水,石蜡包埋后切片。进行PAS、HE染色,在光镜下观察肾脏组织病理变化。
使用一步法TUNEL细胞凋亡检测试剂盒对肾脏石蜡切片进行TUNEL检测:(1)二甲苯中脱蜡5~10 min。换用新鲜的二甲苯,再脱蜡5~10 min,无水乙醇5 min,90%乙醇2 min,70%乙醇2 min,蒸馏水2 min。(2)滴加20 μg·mL不含DNase的蛋白酶K,室温下作用10 min,37℃孵育1 h。(3)PBS缓冲液洗涤3次,每次15 min。(4)滴加TUNEL检测液(1个样本:TdT酶5 μL+荧光标记液45 μL+TUNEL检测液50 μL),37℃孵育60 min,PBS缓冲液洗涤3次,每次15 min。(5)滴加荧光淬灭剂封片后在显微镜下观察和采集图像。
数据集采用Shapiro-Wilk检验正态分布。若符合正态分布,通过Student’s-test或ANOVA确定统计显著性;反之,则使用非参数统计量计算。所有数据采用GraphPad Prism 7处理。显著性水平设置为α=0.05。
2 结果
2.1 杂交小鼠基因型
利用Cre-LoxP技术将2.5P-Cre小鼠和基因敲除小鼠进行杂交,获得基因型2.5P-Cre/(cKO组)及2.5P-Cre/(对照组)小鼠(图1)。
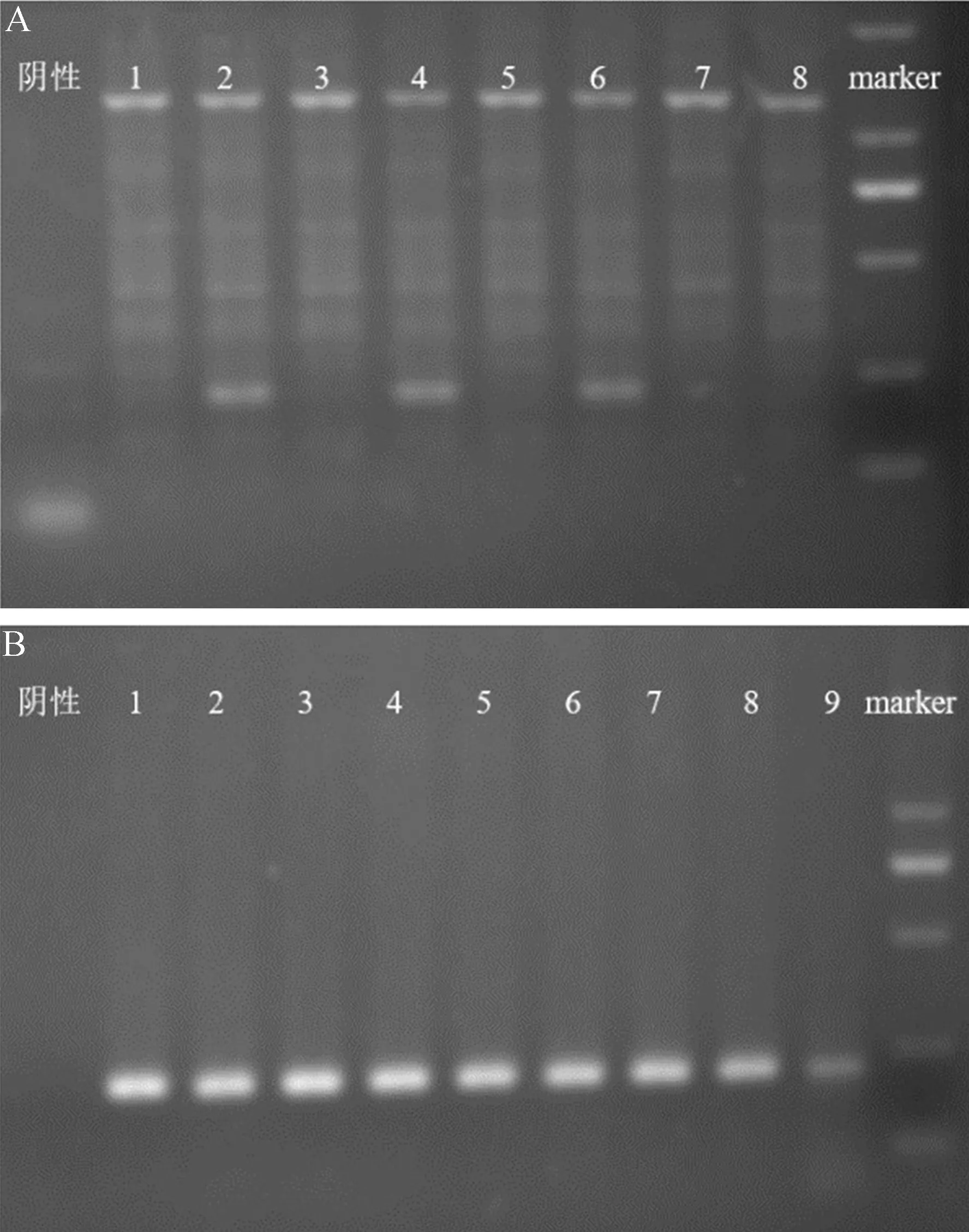
图1 转基因小鼠基因型PCR鉴定结果Fig.1 PCR genotyping of transgenic mice
2.2 cKO小鼠尿液表型特征
cKO组与对照组小鼠出生时的比例符合孟德尔定律,cKO组小鼠未见明显形态异常,但从出生后2.5个月开始,其蛋白尿水平比对照组小鼠显著增加,出生后3.5个月,蛋白尿水平继续上升(图2:A~C)。出生后2.5个月,2组的肾脏指数间差异有统计学意义(图2:D)。此外,3月龄小鼠的尿电解质在组间的差异无统计学意义(图2:E~I)。
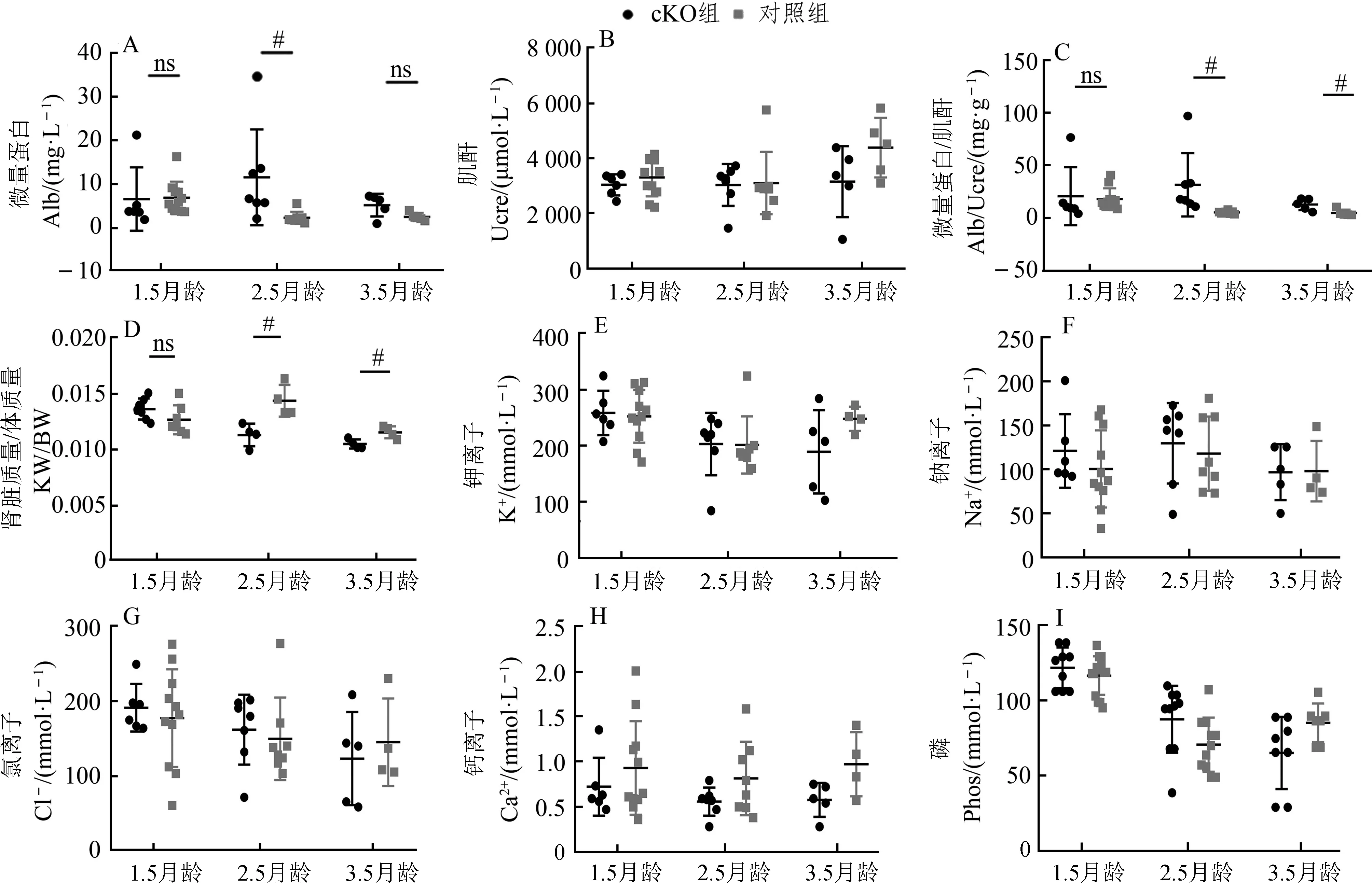
图2 Cdc50a基因敲除小鼠尿液表型特征Fig.2 Phenotypic characteristics of urine in Cdc50a gene knock-out mice
2.3 cKO小鼠肾小球滤过率变化表征
与对照组相比,cKO组小鼠的GFR从出生后2.5个月明显降低,并且在3.5个月时降低情况依旧保持(图3)。
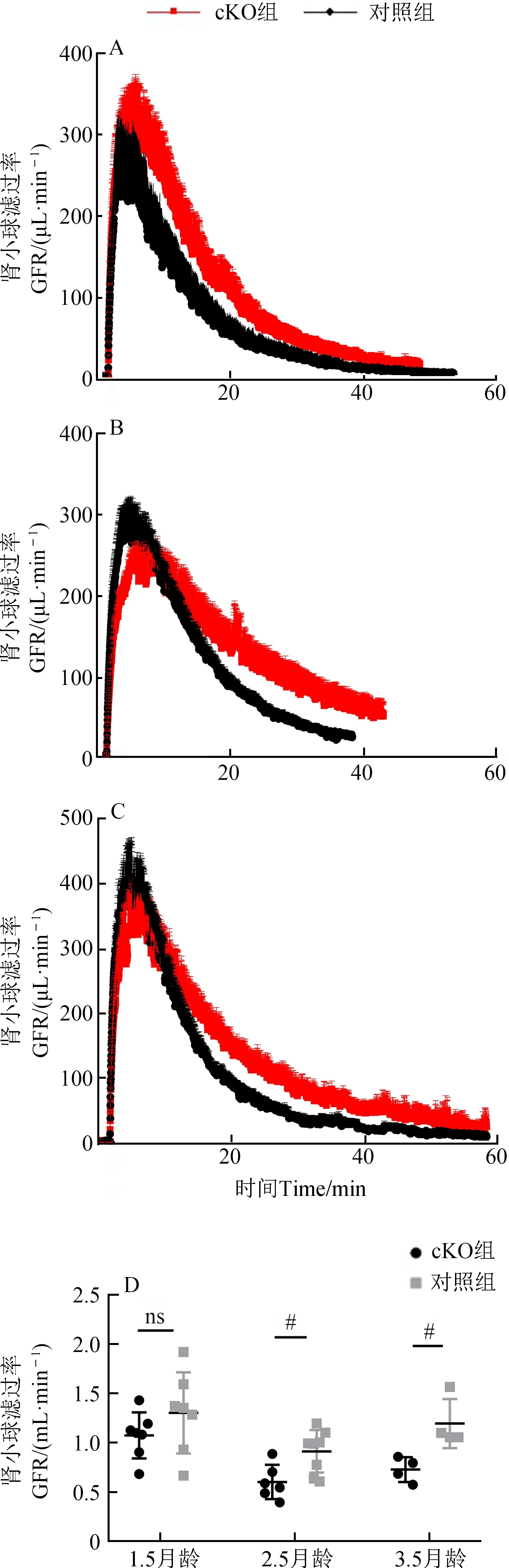
图3 Cdc50a基因敲除小鼠肾小球滤过率特征Fig.3 Characterization of glomerular filtration rate in Cdc50a gene knock-out mice
2.4 cKO小鼠足细胞凋亡情况
TUNEL检测结果显示,肾小球凋亡情况在1.5月龄小鼠间无显著性差异,而2.5月龄cKO组小鼠足细胞阳性标记数量显著增加,3.5月龄小鼠在组间有显著性差异(图4)。
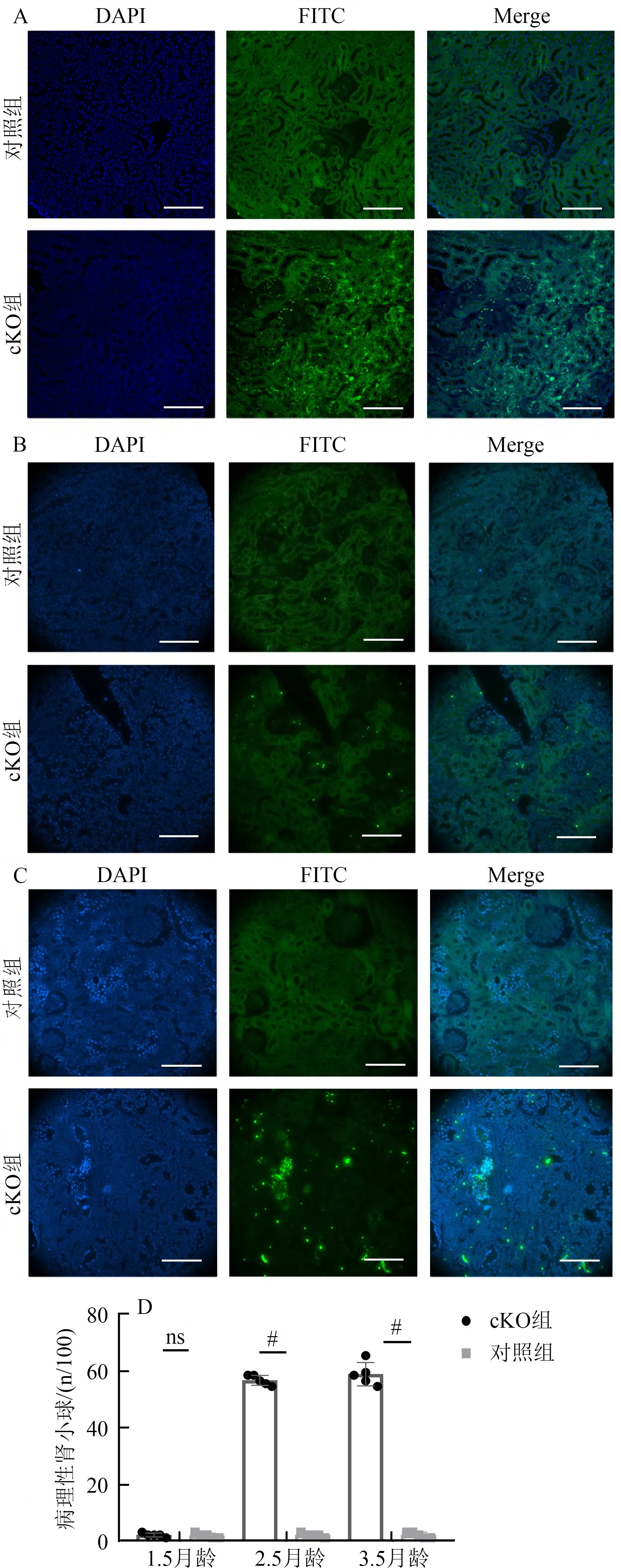
图4 Cdc50a基因敲除小鼠足细胞凋亡情况(TUNEL染色)Fig.4 Apoptosis of podocytes in Cdc50a gene knock-out mice(TUNEL staining)
2.5 cKO小鼠肾脏损伤情况
对1.5月龄、2.5月龄和3.5月龄的cKO组及同窝对照组小鼠的肾脏石蜡切片通过光镜分析以评估病理变化。肾脏切片的HE染色和PAS染色均显示2组小鼠无显著差异,主要肾脏变化证实与肾小球有关(图5:A)。1.5月龄时足细胞中基因敲除对肾脏大小及形态没有影响。而在2.5月龄基因敲除的小鼠中,组织学分析显示,除了节段性系膜增生及包膜粘连外,部分肾小球出现硬化表征(图5:B)。3.5月龄时,肾小球硬化加重(图5:C),并伴有不同程度的足细胞变形和丢失,这与肾小球滤过率结果一致。
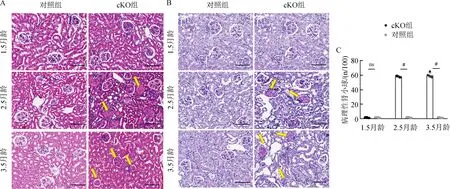
图5 Cdc50a基因敲除小鼠肾脏损伤情况Fig.5 Kidney injury in Cdc50a gene knock-out mice
3 讨论
足细胞损伤在多种肾脏疾病进展中被认定为独立的风险因素,也是导致肾小球硬化的起始因素,如DN、IgAN和FSGS(Lu.,2019;Sang.,2020)。足细胞在健康状态下正常维持稳态,遇到生理压力或病理刺激时,则会发生代偿性反应以保持功能,如通过合成肾小球基底膜的成分来维持肾小球滤过屏障;形成狭缝以及相互作用确保内皮细胞的活力。当刺激强度超过其代偿性作用,则会发生病理性损伤,如蛋白尿、节段性肾小球纤维化、肾小球基底膜增厚,最终导致肾小球硬化(Coresh.,2014)。
蛋白尿是足细胞损伤的早期结果,也是肾病的典型征象。基底膜细胞、肌动蛋白细胞骨架和细胞黏附分子形成了一个紧密的网络来稳定过滤屏障功能,这些成分的缺陷使得蛋白尿得以存在(Lu.,2019)。本研究发现cKO小鼠在2.5月龄时出现蛋白尿,并且与同窝对照小鼠相比有统计学差异(<0.05),表明肾小球足细胞出现损伤和丢失;同时与同窝对照小鼠相比,2.5月龄cKO小鼠的肾脏指数出现统计学差异,猜测肾小球滤过屏障受损可能使肾脏发生代偿性增生,并且随受损程度的增加而增加。此外,GFR检测结果也与此前动物实验研究中单肾单位水平的超滤是蛋白尿和肾小球硬化的危险因素结果一致(Brenner.,1996)。
PS翻转酶的β亚基CDC50A对于维持质膜磷脂的不对称分布以确保细胞信号转导至关重要(Daleke.,2000;Dhar.,2004;Ruggenenti & Remuzzi,2006;Turin.,2013;Liu.,2017),本研究小鼠肾脏石蜡切片的TUNEL染色显示,足细胞在2.5月龄时开始出现凋亡。这也证实了CDC50A敲除后,质膜上的PS暴露作为凋亡信号导致足细胞发生凋亡。此外,肾脏切片HE和PAS染色结果均显示,基因缺失会造成肾损伤,且损伤程度随月龄的增加进一步加重,直至可能发生肾衰竭。
CDC50A对于脑、肝脏、胰腺等重要器官的存活和功能发挥着至关重要的作用。本研究揭示了CDC50A在维持肾小球滤过屏障完整性方面的新作用。足细胞基因缺失致使足细胞变性,导致蛋白尿、GRF降低、系膜细胞增殖、系膜基质堆积、足细胞损伤和丢失、节段性肾小球纤维化,最终导致自发性肾小球硬化等一系列病理表型改变。这为理解足细胞损伤机制提供了另一种独特的视角,同时也构建了一种全新的自发性肾小球硬化症小鼠模型。

