四川凉山苦荞种子携带细菌多样性
白凯红, 阿别小兵, 陈 星, 蒋 娜, 李健强, 罗来鑫
(中国农业大学植物病理学系, 农业农村部有害生物监测与绿色管理重点实验室, 种子病害检验与防控北京市重点实验室, 北京 100193)
苦荞Fagopyrumtataricum是蓼科Polygonaceae荞麦属Fagopyrum的一年生作物,其营养丰富,含有丰富的蛋白质、纤维素、碳水化合物、微量元素等[1-2],还可以提高人体免疫力[3-4]、抗衰老[5]等,享有“五谷之王”的美誉。四川省凉山地区是我国荞麦起源中心之一,拥有全国乃至全世界最丰富的苦荞资源,也是种类最多样、种植最广泛、分布最集中的地区[6-8]。作为当地的主要粮食之一,凉山州的17个县均有苦荞种植,其中越西、昭觉、喜德、冕宁、美姑等县是苦荞的主产区[9-10]。凉山地区特殊的地理环境与独特的气候有利于荞麦的产量与品质,全州常年种植面积上百万亩,约占全国总种植面积的一半以上[6, 11]。
真菌、细菌、病毒、线虫等病原物均可引起荞麦病害[12],其中真菌病害报道较多,而细菌性病害报道却很少,仅见丁香假单胞菌Pseudomonassyringae和铜绿假单胞菌P.aeruginosa[13-14]引起的细菌性叶斑病,而关于荞麦种子携带细菌的报道更少。种子上携带的病原菌是田间病害发生的重要初侵染来源,种子携带的有益微生物也会对作物生长起到促进作用。加强对种子携带微生物的检测,有利于明确种子健康状况,挖掘有益微生物群体。种子带菌检测的技术主要有直接检测、洗涤检测、琼脂培养检测、免疫学检测、分子生物学检测等,近年来高通量测序技术也陆续应用在种子带菌检测中,但在荞麦种子健康检测中还未见报道。
本研究运用传统的分离培养和基于16S rRNA基因的扩增子测序方法,对凉山主要产区的苦荞种子携带的细菌进行了检测,旨在明确凉山州苦荞种子携带细菌的多样性,并为种子健康检测提供新的技术手段和方向。
1 材料与方法
1.1 材料
荞麦种子样品:采自四川省凉山州越西县、昭觉县、喜德县、冕宁县、普格县、美姑县和盐源县不同乡村的46份苦荞种子(表1)用于种子携带细菌的检测,其中选取不同地点的13份种子用于16S rRNA基因扩增子测序。

表1 来自四川省凉山苦荞种子样品信息1)

续表1 Table 1(Continued)
1.2 试剂与仪器
LBA培养基:5 g/L酵母浸粉、5 g/L氯化钠、10 g/L胰蛋白胨、16 g/L琼脂。
供试试剂:1% NaClO;AxyPrepDNA凝胶回收试剂盒,AXYGEN;Omega-soil DNA Kit,Omega Bio-Tek;TruSeqTM DNA Sample Prep Kit,TransGen。
供试仪器:K30型金属浴,干式恒温器,Alphamager HP凝胶成像仪,H1650R离心机(cence®湘仪),ABSON MiFly-6小型离心机(合肥艾本森科学仪器有限公司),球磨仪(Retsch MM400),MyCycler580BR型PCR仪(Bio-Rad),ABI GeneAmp®9700型PCR仪(ABI),DYY-12型电泳仪与DYY-6C电泳仪(北京市六一仪器厂),粉碎研磨仪TL-48R(上海万柏生物科技有限公司),NanoDrop 2000(Thermo Scientific),微型荧光计TBS380(TurnerBioSystems),MISEQ测序仪Illumina Miseq(Illumina)。
1.3 分离培养结合16S rRNA基因序列鉴定
分离培养:从每一份供试的苦荞种子中随机选取100粒,放入灭菌的50 mL锥形瓶中,加入10 mL无菌水,置于摇床中振荡培养30 min(120 r/min),之后吸取2 mL培养液,用无菌水进行10倍梯度稀释,稀释液均匀涂布于LBA培养基上,将培养皿置于28℃培养箱中黑暗培养,2 d后开始观察、记录、计算分离频率(分离频率=某分离物总数/分离物的总数×100%),并进行细菌的纯化分离培养。
形态学鉴定:观察菌落颜色、大小、形状、边缘特征、有无分泌物等。
分子生物学鉴定:挑取1个单菌落置于10 μL无菌水中,在金属浴100°C加热10 min破壁获得总DNA。利用细菌通用引物27F/1492R(5′-AGAGTTTGATCCTGGCTCAG-3′/5′-GGTTACCTTGTTACGACTT-3′)[15]扩增16S rRNA基因序列。PCR体系(25 μL)为:16.89 μL ddH2O、2.5 μL 10×rTaqDNA 聚合酶缓冲液、2.4 μL dNTPs(2.5 mmol/L)、1 μL 上游引物(10 μmol/L)、1 μL 下游引物(10 μmol/L)、0.25 μLrTaqDNA 聚合酶(2.5 U/uL)、1 μL DNA模板。PCR反应程序为:95℃预变性10 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min 30 s,35个循环;72℃延伸10 min。最后将符合目标条带的样品进行测序(北京博迈德科技发展有限公司),并将所得序列在NCBI(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)数据库中进行同源性比对。
1.4 基于16S rRNA基因扩增子测序的多样性分析
样本预处理:在50 mL离心管里加入种子至10 mL刻度线,再加入10 mL灭菌水,涡旋振荡5 min,种子洗脱液转移至新管中备用。
DNA 提取、文库构建、数据分析:利用Omega-soil DNA Kit对基因组DNA进行抽提,利用扩增16S rRNA V3-V4区域通用引物385F/806R(5′-ACTCCTACGGGAGGCAGCAG-3′/5′-GGACTA-
CHVGGGTWTCTAAT-3′)进行PCR扩增,以检测是否满足后续扩增子测序要求。满足要求后,通过文库构建,进行Miseq测序,对数据进行质控过滤处理以及去嵌合体后获得最终的有效数据(effective tag),之后进行物种注释和分析,包括OTU(operational taxonomic units)分析、Alpha多样性分析、Beta多样性分析。
2 结果与分析
2.1 分离培养结合16S rRNA基因序列鉴定苦荞种子携带细菌
对46份苦荞种子携带的细菌进行分离培养,共获得618株细菌分离物。经形态学和分子生物学鉴定,获得的细菌分离物隶属于10个属,分别为赖氨酸芽胞杆菌属Lysinibacillus、节杆菌属Arthrobacter、芽胞杆菌属Bacillus、假单胞菌属Pseudomonas、微杆菌属Microbacterium、泛菌属Pantoea、短小杆菌属Curtobacterium、鞘氨醇单胞菌属Sphingomonas、类芽胞杆菌属Paenibacillus、根瘤菌属Rhizobium,具体分离物的菌落形态如图1所示,上述细菌的16S rRNA基因序列与NCBI上已知对应属的细菌序列的比对结果相似性均在97%以上。通过对苦荞种子细菌分离物的分离频率计算与分析,泛菌属的分离频率最高,为52.5%,短小杆菌属、假单胞菌属、微杆菌属分别为20.7%、16.5%、5.5%,其他菌群占比为4.8%(图2)。
2.2 基于16S rRNA基因扩增子测序多样性分析的苦荞种子携带细菌的检测
2.2.1OTU分析
对选取的13份苦荞种子携带的细菌进行高通量测序,基于16S rRNA基因扩增子测序获得的细菌被划分为19个门(phylum)、40个纲(class)、81个目(order)、151个科(family)、279个属(genus)、430个种(species),共624个OTUs。

图1 来自于苦荞种子的细菌分离物在LBA培养基上的菌落形态Fig.1 Colony morphology of bacterial isolates from tartary buckwheat seeds on LBA medium

图2 基于分离培养法对供试苦荞种子携带细菌的优势菌群分析结果Fig.2 Analysis of dominant microflora from tartary buckwheat seeds based on agar plating
2.2.2Alpha多样性分析
Alpha多样性分析结果表明(表2),13份苦荞种子样品文库的覆盖率(coverage)均在99%以上,说明测序深度高,样本中序列均能被测出,能反映种子真实的带菌情况。Alpha多样性分析中,ACE、Chao、Sobs的数值越大,表明菌群中所含有的OTU数目越多,菌群的丰富度(community richness)越大;另外,Shannon的值越大、Simpson的值越小,说明菌群的多样性(community diversity)越高。表2的结果说明,来自冕宁县的样品MNCQ-4的ACE(497.85)、Chao(501.70)、Sobs(483)、Shannon(4.304 8)的数值最大,Simpson(0.043 6)的值最小,说明MNCQ-4菌群的丰富度与多样性在13份种子样品中最大。而来自昭觉县的样品ZJ-5的ACE(162.22)、Chao(130.40)、Sobs(107)的数值最小,Simpson(0.272 7)的值最大,表明ZJ-5的丰富度与多样性最小。其余11份样品的细菌菌群丰富度与多样性介于MNCQ-4和 ZJ-5之间。
对苦荞种子携带细菌的物种组成进行分析(图3),结果表明,种带细菌主要有泛菌属、甲基杆菌属Methylobacterium、鞘氨醇单胞菌、马赛菌属Massilia、薄层菌属Hymenobacter、假单胞菌属、蓝细菌属Cyanobacteria、短小杆菌属、伯克氏菌属-副伯克氏菌属Burkholderia-Paraburkholderia、葡萄球菌属Staphylococcus、肠杆菌属Enterobacter、贪噬菌属Variovorax,其中泛菌属、甲基杆菌属、鞘氨醇单胞菌属、马赛菌属、薄层菌属、假单胞菌属在13份苦荞种子样品中均能被大量检测到。泛菌属所占比率最高,为最主要的优势菌群。
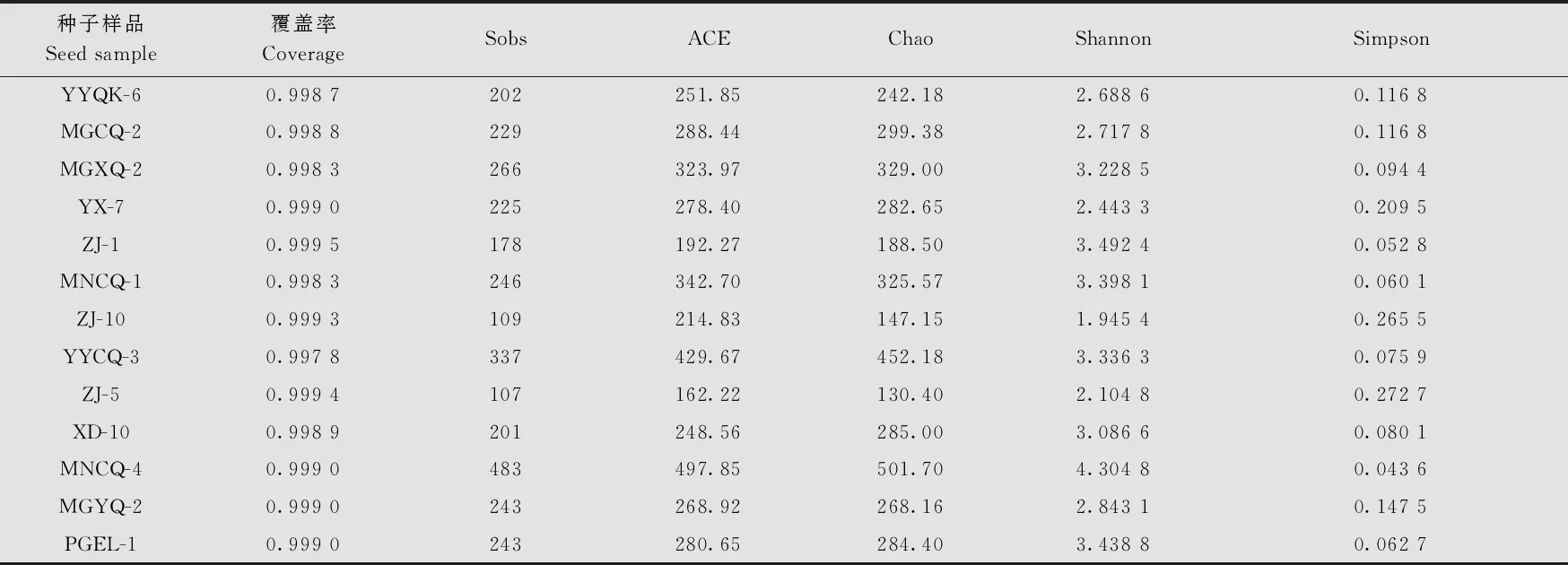
表2 基于16S rRNA基因扩增子测序对供试的13份苦荞种子携带细菌的Alpha多样性的评估结果统计

图3 基于16S rRNA扩增子测序对供试的13份苦荞种子携带细菌的物种组成分析结果Fig.3 Community analysis of 13 tartary buckwheat seeds carrying bacteria by 16S rRNA amplicon sequencing
2.2.3Beta多样性分析
2.2.3.1样本层级聚类分析
13份苦荞种子携带的细菌聚类分析结果如图4所示,来自同一个县的样品有的能聚在一支, 有的却相距很远。例如,来自昭觉县的样品ZJ-10与ZJ-5聚在一起,而另一个采自昭觉县的样品ZJ-1却与来自冕宁县样品MNCQ-1聚在一支;来自美姑县的样品MGXQ-2与MGYQ-2聚在一支,而采自美姑县的样品MGCQ-2却与来自盐源县的YYQK-6聚在一支。其中菌群多样性最相近的两个样品为来自盐源县的YYCQ-3与来自普格县的PGEL-1,来自冕宁县的MNCQ-4与其他样品的差异性最大,且与同是冕宁县的MNCQ-1差异性也很大。

图4 基于16S rRNA扩增子测序对供试的13份苦荞种子携带细菌的样本层级聚类树分析结果Fig.4 Sample hierarchy clustering tree analysis of 13 tartary buckwheat seeds carrying bacteria by 16S rRNA amplicon sequencing
2.2.3.2PCA分析
对苦荞种子携带细菌进行PCA分析,结果表明(图5),来自同一个地区的种子样品菌群多样性的差异性小,来自不同地区的种子样品差异性大,但其中来自冕宁县(MN)的种子与来自喜德县(XD)的种子携带细菌多样性相似,且冕宁县(MN)和喜德县(XD)种子与普格县(PG)种子、盐源县(YY)种子相似性大。在13份种子样品中,来自越西县(YX)种子样品与来自普格县(PG)种子样品的菌群多样性的差异性最大。

图5 基于16S rRNA扩增子测序对供试的13份苦荞种子携带细菌的PCA分析结果Fig.5 PCA analysis of 13 tartary buckwheat seeds carrying bacteria by 16S rRNA amplicon sequencing
3 结论与讨论
本研究通过分离培养法从46份供试苦荞种子中共鉴定到10个属的细菌,其中泛菌属为苦荞种子携带的优势细菌菌群。泛菌属部分种是重要的病原细菌,其寄主范围广,广泛分布在土壤、植物、动物上,其中成团泛菌Pantoeaagglomerans能够引起稻谷内颖褐变[16],是藜麦叶斑病[17]和烟草细菌性叶枯病的病原菌[18],并能影响紫花苜蓿种子的萌发及幼苗生长[19]等,因此本研究分离得到的泛菌属细菌是否能引起苦荞病害,还需进一步鉴定到种,并进行致病性试验后确认。
基于16S rRNA基因扩增子测序法仅从13份种子样品中就检测得到了279个属的细菌,表明其检测效率远高于传统的分离培养方法,其中泛菌属为优势菌群,与分离培养法的结果一致,说明泛菌属在苦荞种子中的丰度最高,推测苦荞所在的环境有利于泛菌属细菌生存。然而,两种方法都有彼此未检测和鉴定到的菌群,如分离培养法未鉴定到高通量测序中菌群丰度高的甲基杆菌属,16S rRNA基因扩增子测序未鉴定到分离培养法中分离频率较高的微杆菌属,可能由于专性厌氧的甲烷细菌属生长极其缓慢,分离培养比较困难,而16S rRNA基因扩增子测序法在扩增时丰度极高的泛菌属等其他优势菌群可能掩盖了丰度极低的菌群(如微杆菌属)。因此,想要准确了解种子携带细菌的多样性,还需要分离培养法与高通量测序相结合。
在PCA分析中,来自冕宁县(MN)的种子和来自喜德县(XD)、盐源县(YY)的种子所携带细菌多样性相近,推测是因为地理上冕宁县与喜德县、盐源县相邻,苦荞品种有交叉使得菌群丰度相似。昭觉县虽然与喜德县、普格县相邻,但菌群多样性却相差很大,可能由于其独特的地形、环境温湿度、海拔或品种的原因等引起,不同地点样品携带细菌的多样性结果还需要通过对更多样本的检测进行深入分析。
本研究从苦荞种子中鉴定到大量菌群,虽然大部分细菌目前还不确定是否是荞麦的致病菌,但仍有侵染荞麦或其他作物的可能,因此在荞麦播种前,要加强种子检疫和种子处理、选用抗病品种,以提高荞麦的品质与产量。

