细菌防御噬菌体机制研究进展
赵婷婷 , 郭子群 , 高云航,2 , 徐凤宇,2 , 赵传芳
(1.吉林农业大学动物医学院 , 吉林 长春 130118 ; 2.动物生产及产品质量安全教育部重点实验室 , 吉林 长春 130118 ; 3.中国农业科学院特产研究所 , 吉林 长春 130112)
噬菌体作为地球上数量最丰富的生物,能特异地拮抗宿主菌,在保护人类和动物免受耐药菌感染等方面具有潜在优势[1-2]。但体内外抗菌试验结果表明,噬菌体并不能完全杀灭宿主菌[3-4],说明细菌具有一定的防御噬菌体的能力。事实上,数十亿年来,细菌已进化出复杂的防御体系,其中的限制性内切酶、CRISPR/Cas系统等已应用于生物技术领域。近年来,揭示细菌防御噬菌体机制的进程加快,本文对此进行综述,希望为其在工农业生产中的应用提供参考。
1 抑制噬菌体吸附
噬菌体吸附于细菌表面的受体是其复制的开始(图1A),抑制吸附是细菌防止噬菌体感染最安全的方法。近年来研究发现细菌可通过以下方式抑制噬菌体吸附。
1.1 以外膜泡结合噬菌体 Reyes-Robles等[5]研究显示,霍乱弧菌分泌的天然诱饵外膜泡(Outer membrane vesicles,OMVs)可结合烈性噬菌体,无脂多糖O1(噬菌体ICP1的受体)的E7946ΔwbeL及O139株霍乱弧菌分泌的OMVs不能抑制ICP1(宿主菌为E7946)感染,而E7946株分泌的OMVs可以(图1B);由OMVs介导的对噬菌体ICP2的抑制作用依赖于ICP2的受体OmpU(图1C),表明此抑制作用具有OMVs所含噬菌体受体依赖性。
1.2 受体突变和表面修饰阻断吸附 韩生义[6]筛选到耐噬菌体SP1的QHM株沙门菌,并发现该菌株参与脂多糖(LPS)合成的rfaJ基因发生了G721T突变,使编码谷氨酸的GAG突变为终止密码子,影响糖基转移酶的合成,导致LPS结构不完整,阻断了噬菌体SP1吸附(图1D),并通过构建缺失株QHΔrfaJ证实了该结果。Harvey等[7]提出了利用糖基化掩蔽以IV型菌毛蛋白(T4P)为受体的铜绿假单胞菌噬菌体潜在结合位点的观点;作者研究发现,O抗原和D-阿拉伯呋喃糖聚合物糖基化可保护铜绿假单胞菌免受某些菌毛特异性噬菌体侵染,改变菌毛蛋白序列可阻止吸附(图1E)。
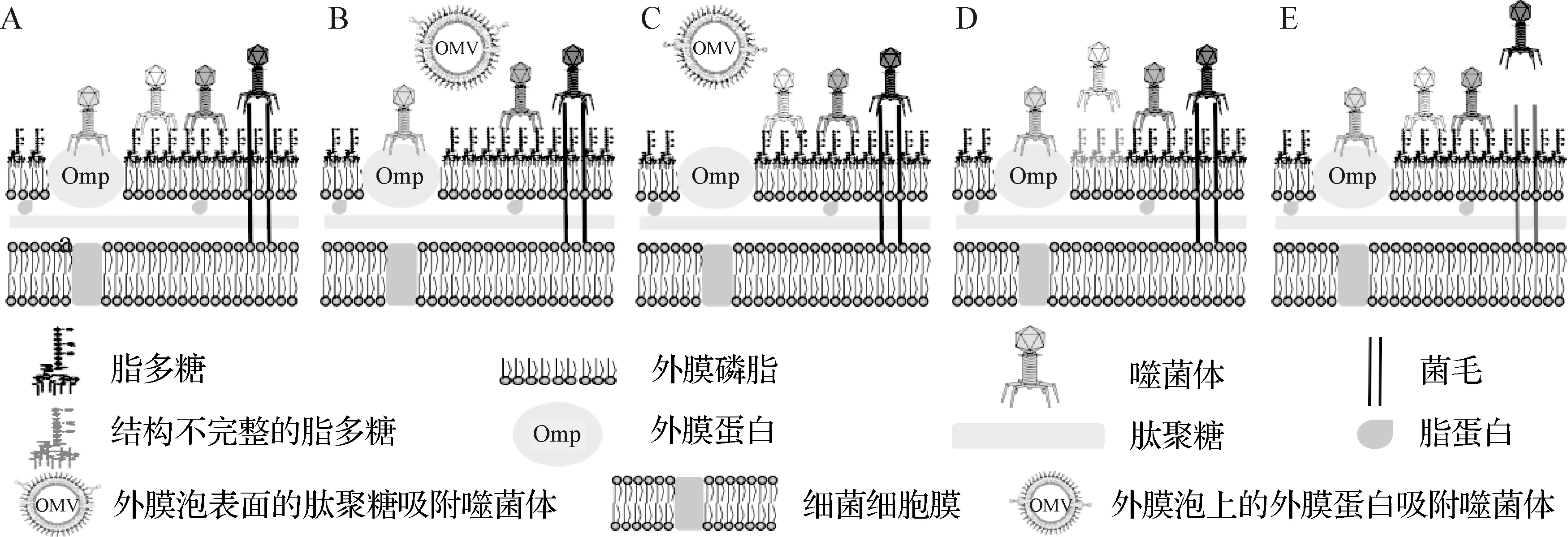
图1 细菌抑制噬菌体吸附的机制示意图A:噬菌体正常吸附于敏感菌表面受体; B:细菌释放的外膜泡上的脂多糖结合噬菌体,阻断噬菌体对菌体表面脂多糖受体吸附;C:细菌释放的外膜泡上的外膜蛋白结合噬菌体,阻断噬菌体对菌体表面相应外膜蛋白受体吸附; D:细菌脂多糖受体结构不完整阻断噬菌体吸附; E:细菌改变菌毛蛋白,阻止噬菌体对菌毛受体吸附
2 切割噬菌体核酸
噬菌体抗性菌利用先天或获得性防御系统切割噬菌体核酸,其中获得性防御系统规律成簇间隔短回文重复序列-CRISPR-相关蛋白(Clustered regularly interspaced short palindromic repeats-CRISPR-associated proteins,CRISPR-Cas)是近几十年中最重要的科学进展之一。这里介绍近几年报道的先天性防御系统,其发现于75%的原核生物中[8]。
2.1 与限制修饰有关的防御岛系统 Ofir等[9]报道,在细菌和古生菌中广泛的存在防御噬菌体系统-与限制修饰有关的防御岛系统 (Defence island system associated with restriction modification,DISARM),该系统由5个基因组成,包括编码甲基化酶的基因(drmMII)、解旋酶基因(drmA)、含有磷脂酶D(Phospholipase D,PLD)的基因(drmC)、含有解旋酶相关结构域(DUF1998)的基因(drmB)和功能未知基因(drmE);转移有副水杨芽胞杆菌9945A株DISARM的枯草芽胞杆菌能抵御3株有尾双链DNA噬菌体;其甲基化酶修饰CCWGG基序,作为自身DNA的标记,而限制侵染的噬菌体DNA(封二图2A)。

2.2 噬菌体排斥系统 2021年,Picton等[10]证明了费格森埃希菌的多重耐药质粒具有多而强大的防御噬菌体功能:表达Ⅰ型细菌排斥(Bacteriophage exclusion,BREX)防御系统、GmrSD家族的IV型DNA修饰依赖限制酶BrxU;BREX的效应物能识别噬菌体的非甲基化非回文BREX基序GCTAAT,防止噬菌体增殖,BrxU可切割经胞嘧啶修饰的DNAs,PglX使宿主DNA的GCTAAT序列在第5位被甲基化而获得保护(封二图2B)。
2.3 SspABCD-SspE及SspABCD-SspFGH硫代磷酸酯限制修饰系统 2020年,Xiong等[11]描述了在环磷弧菌、大肠埃希菌和Streptomycesyokosukanensis中存在的SspABCD-SspE硫代磷酸酯(Phosphorothioates,PTs)系统,它具有独特的遗传结构、生化功能和表型;本系统中SspB为切口酶(Nickase),可引入缺口以促进硫的掺入;系统中的SspABCD与SspE联合抵抗噬菌体:(1)SspE借助PTs激发的核苷三磷酸水解酶(Nucleoside triphosphate hydrolase,NTPase)活性感知序列特异性PTs发挥抗噬菌体活性;(2)SspE通过引入切口损伤削弱噬菌体DNA复制而抑制噬菌体增殖。2021年,Wang等[12]鉴定了SspABCD-SspFGH防御系统,发现SspFGH可破坏非PTs修饰的DNA,抑制噬菌体DNA复制,虽与SspABCD-SspE不同,但二者共存于36个细菌基因组中,共同保护细菌防御噬菌体(封二图2C)。
2.4 Ago的DNA干扰作用 细菌和古细菌中的Argonaute核酸酶(Ago)通过小DNA引导切割DNA的过程称为DNA干扰。Kuzmenko等[13]分析了丁酸梭菌Ago(CbAgo)的体内活性,表明CbAgo靶向多拷贝遗传元件,抑制质粒传播和噬菌体感染;CbAgo在同源序列间诱导DNA干扰,触发目标DNA降解,与位点特异性小DNA向导的加载依赖于其固有的核酸内切酶活性和细胞双链断裂修复机制;Ago含有氨基端(Amino-terminal,N)、PAZ(PIWI Argonaute Zwille)、MID(Middle)、PIWI(含有RNase-H样活性位点)结构域及L1、L2连接蛋白(封二图2D)。
3 抑制噬菌体核酸合成
Yasui等[14]描述了含有abpA和abpB基因质粒的大肠埃希菌可阻止T4、T2、T7和λ家族噬菌体复制,与野生株相比,缺失其一都会导致噬菌体后代增加20%;作者分离到7株T4噬菌体的抑制突变株,它们在过表达abpA和abpB的细菌中繁殖能力微弱,突变均位于编码对DNA复制起重要作用的DNA解旋酶基因41中;作者还证明abpA和abpB抑制T4噬菌体的DNA复制和晚期基因表达,也能抑制T7和λ噬菌体的DNA复制。
Viperin作为动物的一种干扰素诱导蛋白,可催化RNA聚合酶终止剂3′-脱氧-3′,4′-双脱氢-三磷酸胞苷(ddhCTP)产生而抑制多种病毒复制。Bernheim等[15]研究表明,与Viperin相似,原核生物的Viperins会促进ddhCTP、双脱氢-三磷酸鸟苷(ddhGTP)和双脱氢-三磷酸尿苷(ddhUTP)产生,抑制T7噬菌体转录。
4 流产感染
流产感染(Abortive infection,Abi),即感染噬菌体的细菌在噬菌体复制周期完成前通过“利他性”自杀阻止噬菌体传播,从而保护周围的细菌[16]。
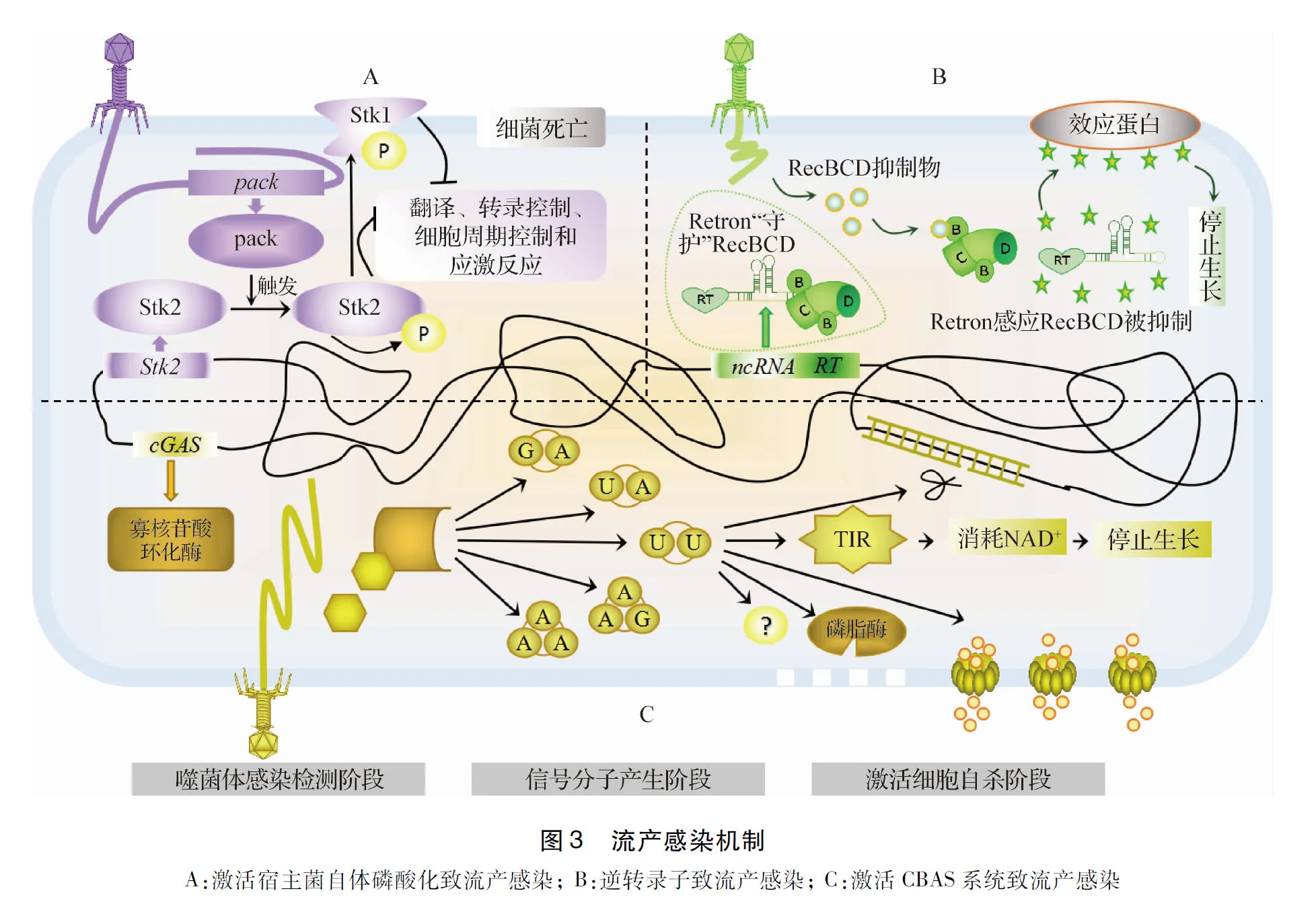
4.1 激活宿主菌自体磷酸化致流产感染 Depardieu等[17]发现,葡萄球菌中存在一种激酶介导的Abi机制,噬菌体感染时,其蛋白PacK触发葡萄球菌的真核生物样丝氨酸/苏氨酸激酶Stk2自体磷酸化,导致翻译、转录控制、细胞周期控制和应激反应等过程被抑制,使细菌死亡,防止噬菌体感染其他细菌(封二图3A)。
4.2 逆转录子致流产感染 Millman等[18]报道细菌的逆转录子Retrons 通过流产感染发挥广泛的防御噬菌体作用,此防御单元由三部分组成:逆转录酶(Reverse transcriptase,RT)、非编码RNA(Non-coding RNA,ncRNA)和效应蛋白;作者证明了Ec48(大肠埃希菌的Retron)可“守护”细菌的RecBCD复合物(降解噬菌体线性DNA及帮助细菌获得CRISPR的新间隔序列),噬菌体蛋白抑制RecBCD但激活Ec48,导致感染失败、细菌停止生长(封二图3B),形成了保卫周围细菌的防线。
4.3 激活环寡核苷酸为基础的抗噬菌体信号系统致流产感染 一些细菌中存在环寡核苷酸为基础的抗噬菌体信号(Cyclic oligonucleotide-based anti-phage signaling,CBAS)系统,此系统包括寡核苷酸环化酶(Oligonucleotide cyclase,cGAS)、信号分子、杀伤细菌的效应物和辅助基因。
Cohen等[19]研究表明,细菌的环GMP-AMP(Cyclic GMP-AMP,cGAMP)信号系统可感应噬菌体的感染,产生cGAMP,进而激活磷脂酶(Phospholipase),导致细胞膜完整性丧失。
Lau等[20]研究表明,细菌CBAS系统的效应物NucC与限制性核酸内切酶(Endonuclease)有关,NucC可独特地组装成同源三聚体,此三聚体与环三腺苷酸第二信使结合,促进NucC同源六聚体组装,从而有助于非特异性双链DNA断裂;在感染菌中,NucC的激活使细菌染色体完全破坏,导致细菌在噬菌体复制完成前死亡。
Ka等[21]报道,Thoeris防御结构由ThsA和ThsB组成;ThsA具有强大的NAD+降解活性,含有Sirtuin样和SLOG样双结构域;突变分析表明,NAD+降解与Thoeris抗噬菌体有关;ThsB的结构与Toll/IL-1受体(Toll/interleukin-1 receptor,TIR)结构域相似。2021年,Ofir等[22]研究表明,噬菌体感染触发TIR结构域产生环ADP-核糖异构体,激活 ThsA,耗尽细胞的NAD+,导致流产感染及细胞死亡。
2021年,Millman等[23]根据操纵子结构、信号分子和效应物对CBAS系统进行分类,确定了4种主要类型;效应物包括磷脂酶、跨膜螺旋(Transmembrane helices)、内切核酸酶、TIR结构域、磷酸化酶/ 核苷酶超家族(Phosphorylase/nucleosidase superfamily)、肽酶(Peptidase),分别通过降解细胞膜的磷脂、使细胞膜上成孔、降解DNA等方式使细菌自杀(封二图3C)。
5 干扰噬菌体装配
噬菌体可诱导染色体岛(Phage inducible chromosomal island,PICI)是整合于细菌染色体上的基因簇,可通过限制噬菌体增殖和携带重要毒力基因,为宿主菌提供适应优势[24]。在革兰阳性菌中,PICI的表达被转录抑制物抑制,而辅助噬菌体可产生一种抗阻遏物,导致从宿主染色体上切下PICI,PICI基因簇复制,并表达出可抑制辅助噬菌体晚期基因表达的蛋白,改变噬菌体衣壳大小,使PICI基因簇优先被包装,防止形成辅助噬菌体病毒子[25]。
霍乱弧菌具有可移动的PICI样元件 (Phage inducible chromosomal island-like element,PLE),在噬菌体ICP1感染期间通过从染色体上被切割而启动宿主抗噬菌体反应,保护霍乱弧菌免受ICP1感染,此过程依赖于PLE编码的Int[26]。McKitterick等[27]报道PICI样元件中的PLE1编码大丝氨酸重组酶,产物Int为重组方向性因子(Recombination directionality factor,RDF),是针对ICP1的特异蛋白,在噬菌体感染时切下PLE。
6 展望
在细菌与噬菌体的长期军备竞赛中,双方均获得相应的动力而共同进化,这其中也包括前噬菌体为保护宿主免受异型病毒攻击的贡献[28-29],使得他们相互拮抗[30],保持自身种群稳定。噬菌体抗性的进化对噬菌体的应用效果构成了不可避免的威胁,在应用噬菌体疗法过程中,需充分了解其使用范围及作用[1],考虑噬菌体与药物或噬菌体等的组合,以避免耐多噬菌体菌株的出现及蔓延。另一方面,对细菌防御噬菌体机制的深入研究可使人们充分了解抗噬菌体菌株特性,利于工农业生产中定向筛选更具优势的商品化菌株;同时为生物技术领域开发更多的可应用工具;也希望为进一步挖掘真核生物抗病毒的机制提供启示。

