金天格防治肌少-骨质疏松症的作用机制
马江涛 黄润龙 周文明 叶茂林 连晓航,3 李颖 黄红 黄宏兴*
1. 广州中医药大学,广东 广州 510405 2. 河南省洛阳正骨医院(河南省骨科医院),河南 郑州 450046 3. 广州中医药大学岭南医学研究中心中医骨伤科学实验室,广东 广州 510405 4. 广州中医药大学第三附属医院,广东 广州 510375 5. 广州中医药大学护理学院,广东 广州 510006
肌少-骨质疏松症(osteosarcopenia,OS)是一种以骨密度、骨微结构、肌力、肌量和肌肉功能下降为特征的老年综合征[1-2]。由于肌少症(sarcopenia,SP)目前尚无统一的诊断标准[3-6],因此OS的发病率仍不确定。一项包含1 105名65岁及以上老年人的荟萃分析[7]显示OS的发病率在5 %~37 %,女性比男性的发病率更高。OS引起患者跌倒、骨折、虚弱、致残率和致死率增加[8-10],严重影响老龄人群的生活质量和人均寿命。
面对OS较高的发病率和严重不良健康结局,目前尚无批准治疗OS的药物。OS的非药物治疗主要包括:抗阻和平衡训练,摄入足量蛋白质、维生素D、钙、肌酸等营养物。OS的药物治疗主要使用抗骨质疏松症(osteoporosis, OP)的药物,如地诺单抗、雌激素和选择性雌激素受体调节剂、睾酮和选择性雄激素受体调节剂、抗肌抑素抗体和脂肪酸合成酶抑制剂等[1-2,8],研究者希望通过“老药新用”来发现抗OP药物是否具有抗SP的作用,但这需要大量的临床前研究及高质量的随机对照试验来证明。
药效团模型基于药效特征元素,预测具有相同药理作用的化合物的靶点,从而可靠且快速虚拟筛选出特定化合物的靶点,为新药研发提供重要参考[11-13]。虎骨是一种稀缺名贵的中药材,具有祛风通络、强筋壮骨、消炎止痛的功效,长期应用于多个中药方剂中。然而由于国际公约禁止猎杀售卖虎骨,导致许多含有虎骨的方剂无法应用于临床。为解决这一难题,中国科研人员采用仿生学研究方法,研制出与野生虎骨在药理、药效、安全性等方面基本一致的人工虎骨粉,即金天格胶囊(JTG)[14-16]。JTG明显改善OP及骨质疏松性骨折(osteoporotic fracture,OPF)患者的骨密度、骨代谢、腰背痛及生活质量[17-21],但对SP的作用未见报道。本研究首先根据高效液相色谱法(HPLC)测定的JTG的成分进行药效团模型分析,预测JTG 防治OS的可能靶点及通路等。其次构建OS大鼠模型并药物干预,验证JTG防治OS的有效性。最后,根据药效团模型预测出的Akt/NF-κB/Bak信号通路,探讨JTG防治OS的作用机制。
1 材料和方法
1.1 材料
1.1.1数据库及软件:PubChem数据库、PharmMapper分析平台、GeneCards数据库、OMIM数据库、TTD数据库、PharmGkb数据库、DrugBank数据库、UniProt知识库、Bioconductor数据库、STRING在线网站、Perl软件、R软件。
1.1.2主要仪器:电子秤;大小鼠抓力测定仪(山东省医学科学院设备站,YLS-13A型);双能X线骨密度仪(美国Hologic,Discovery A型);micro CT仪(比利时Scanco Medical);Bio-Rad电泳仪/转膜仪;Bio-Rad全能型凝胶成像系统等。
1.1.3动物:6月龄健康雌性SD大鼠60只,SPF级,由广州中医药大学实验动物中心提供,合格证号44005800010521。喂食大鼠专用普通饲料及无菌用水。实验经过广州中医药大学实验动物伦理委员会批准并严格按照相关实验动物福利进行(批准号20190429001)。
1.1.4药品与试剂:地塞米松磷酸钠注射液(DXM,批号190501,广州白云山天心制药股份有限公司);戊酸雌二醇片(批号523A,拜耳医药保健有限公司广州分公司);金天格胶囊(批号190912,金花企业股份有限公司西安金花制药厂);Western及IP细胞裂解液、电泳液和转膜液(碧云天),抗磷酸化Akt抗体(CST),抗Akt抗体(CST),抗NF-κB p65抗体(CST),抗Bak抗体(CST),抗GAPDH抗体(CST),抗MuRF1抗体(Santa Cruz),抗Fbx32抗体(Abcam),HRP标记的羊抗兔IgG抗体(Abcam)等。
1.2 金天格胶囊(JTG)防治OS的药效团模型研究方法
1.2.1JTG的高效液相色谱(HPLC)分析:精密称取氨基酸对照品,加0.1 mol/L盐酸溶液配成对照品溶液。精密称取JTG胶囊内容物0.2 g配成供试品溶液。用高效液相色谱法(HPLC)测定每粒胶囊包含的氨基酸。结果表明JTG含有以下17种氨基酸:天冬氨酸(Asp)、谷氨酸(Glu)、L-羟脯氨酸(Hypro)、丝氨酸(Ser)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys)[22]。
1.2.2JTG所含氨基酸的靶点预测:首先在PubChem数据库中检索JTG所含17种氨基酸的2D和3D结构,下载包含3D结构信息的SDF文件。然后将每种氨基酸的3D结构文件上传PharmMapper分析平台,预测每种氨基酸的靶点。最后利用UniProt知识库,为预测出的每个靶点添加基因Symbol,得到JTG所含氨基酸的全部靶点。
1.2.3OS相关靶点选择:通过Gene Cards数据库、PharmGkb数据库、OMIM数据库、DrugBank数据库和TTD数据库,检索收集与“osteoporosis”、“sarcopenia”和“osteosarcopenia”相关的靶点,将所得OP靶点与SP靶点取交集,并与检索到的OS靶点取并集得到OS相关的所有靶点。
1.2.4交集靶点的蛋白互作网络(PPI)构建及核心靶点筛选:将JTG所含氨基酸的靶点与OS相关的靶点取交集,两者的交集靶点作为JTG防治OS的预测靶点。将预测靶点导入STRING在线网站,限定研究种属为智人,其他为默认设置,得到PPI网络。
1.2.5交集靶点的GO和KEGG富集分析:利用R语言软件的Bioconductor生物信息软件包,设定阈值P<0.05,对中药-疾病的交集靶点进行GO功能和KEGG通路富集分析。
1.3 金天格防治OS的动物实验研究
1.3.1分组、造模及给药:SD大鼠随机分为5组,即正常组(Control)、假手术组(Sham)、OS模型组(OS)、OS金天格组(OS+JTG)和OS雌二醇组(OS+E2)。其中模型组切除双侧卵巢,Sham组切除卵巢附近同样大小脂肪。术后大鼠连续3 d肌肉注射青霉素钠(8万单位/只)防感染。1周后模型组大鼠连续2周腹腔注射DXM [1 mg/(kg·d)]。3个月后,开始药物干预。OS+JTG组每天灌胃0.375 g/kg金天格,OS+E2组每天灌胃0.104 mg/kg戊酸雌二醇片。其他组每天给予10 mL/kg生理盐水灌胃,连续用药3个月。
1.3.2大鼠腓肠肌、比目鱼肌、股骨、子宫、肝脏和肾脏湿重测量:灌胃3个月后,开始取材。完整分离大鼠腓肠肌、比目鱼肌、股骨、子宫、肝脏和肾脏等,预冷PBS漂洗后,吸水纸吸除表面水分,分析天平测量湿重,多聚甲醛固定。
1.3.3大鼠体重、前肢抓力及体成分检测:每周定时测量大鼠的体重及前肢抓力。大鼠前肢抓力测量采用YLS-13A大小鼠抓力仪。测量前,让大鼠在抓力仪上适应3 min。测量时,当大鼠前爪抓紧抓力杆时,轻握鼠尾水平向后拉,记录抓力仪上的最大读数,测量3次取平均值。取材前,双能X线骨密度仪(DXA)检测大鼠的体成分,计算大鼠骨骼肌质量指数(SMI,全身瘦肉量/体重),骨矿含量百分比(BMC,骨矿含量/体重)和脂肪含量百分比(FAT,脂肪含量/体重)。
1.3.4大鼠全身及局部骨密度、股骨骨微结构检测:取材前,DXA测量大鼠全身骨密度(bone mineral density,BMD)。取材后,测量离体股骨的全长、股骨头、股骨近端、股骨干和股骨远端BMD。然后对离体左侧股骨远端进行micro CT扫描,扫描条件为55 kV和145 mA。首先运用仪器自带分析软件NRecon和DataViewer将所有扫描图像保存为水平位、冠状位和矢状位。其次运用CTAn软件选择股骨远端生长板上方1 mm的松质骨作为感兴趣区,对感兴趣区进行骨微结构检测。骨微结构检测参数包括:骨体积分数(BV/TV,%)、骨表面积和体积比(BS/BV,mm-1)、骨表面密度(BS/TV,mm-1)、骨小梁厚度(Tb.Th,mm)、骨小梁分离度(Tb.Sp,mm)和骨小梁数量(Tb.N,mm-1)。最后通过仪器自带分析软件(CTvox)重建股骨远端三维图像。
1.3.5大鼠腓肠肌Akt/NF-κB/Bak信号通路相关蛋白检测:灌胃3个月后,麻醉大鼠。迅速完整分离右侧腓肠肌,剔除干净周围软组织,预冷PBS漂洗后,超低温冰箱冻存。粉碎腓肠肌组织,裂解液裂解,提取总蛋白,BCA法测蛋白浓度。配制分离胶及浓缩胶、电泳液及转膜液,上样、电泳、转膜、脱脂奶粉封闭。p-Akt(1∶1 000)、Akt(1∶1 000)、NF-κB p65(1∶1 000)、Bak(1∶1 000)、MuRF1 (1∶1 000)、Fbx32 (1∶1 000)和GAPDH(1∶1 000)按照说明书要求配制并4 ℃孵育过夜。配制HRP标记的羊抗兔IgG抗体,室温孵育二抗1 h,利用全能型凝胶成像系统显影。
1.4 统计学处理


图1 金天格的高效液相色谱图Fig.1 High performance liquid chromatography chart of JTG
2 结果
2.1 金天格胶囊(JTG)防治OS的药效团模型研究结果
2.1.1JTG所含氨基酸和OS的靶点筛选结果:在PubChem数据库中检索JTG所含17种氨基酸的2D和3D结构,得到17种氨基酸的三维结构(图2A)。利用PharmMapper筛选后,剔除重复靶点,得到401个靶点,分别是:天冬氨酸(Asp)66个、谷氨酸(Glu)71个、L-羟脯氨酸(Hypro)34个、丝氨酸(Ser)44个、甘氨酸(Gly)1个、组氨酸(His)72个、精氨酸(Arg)68个、苏氨酸(Thr)56个、丙氨酸(Ala)0个、脯氨酸(Pro)2个、酪氨酸(Tyr)79个、缬氨酸(Val)35个、蛋氨酸(Met)71个、异亮氨酸(Ile)82个、亮氨酸(Leu)70个、苯丙氨酸(Phe)63个、赖氨酸(Lys)77个。
检索五大疾病数据库与OP、SP和OS疾病相关靶点后,得到198个OS相关的靶点。
2.1.2靶蛋白相互作用网络构建及核心靶点筛选结果:将198个OS疾病靶点与401个JTG中药靶点一一映射后,得到10个中药疾病交集靶点(图2B)。从10个交集靶点的PPI网络图及柱状图(图2C和2D)可知,EIF4EBP1、TP53和IGF1R位于网络的核心,邻接节点数目最多,可能为JTG防治OS的核心基因。
2.1.3交集靶点的GO功能和KEGG通路富集分析:GO功能富集分析主要从生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)(图2E和2F)3个方面阐释10个交集靶点可能具有的生物学功能。KEGG通路富集分析表明:PI3K-Akt信号通路、凋亡信号通路、丝裂原活化蛋白激酶(MAPK)信号通路等与JTG防治OS的交集靶点的相关性明显,见图2 G和2H。
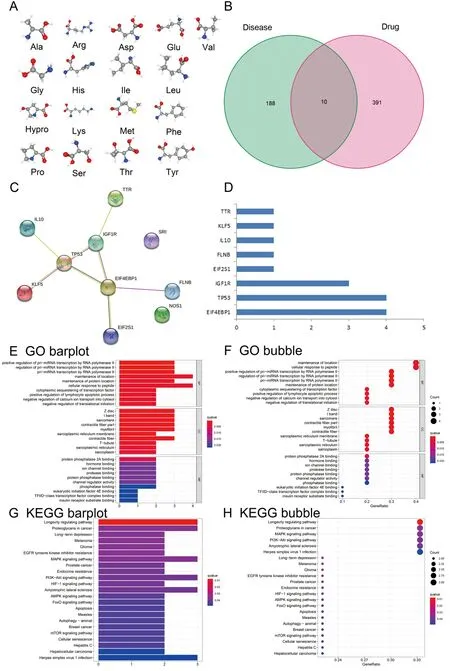
注:A:JTG所含17种氨基酸的三维结构;B:JTG与OS交集靶点的韦恩图;C:蛋白互作网络(PPI);D:核心靶点筛选的柱状图;E:GO条图;F:GO气泡图;G:KEGG条图;H:KEGG气泡图。图2 金天格胶囊(JTG)防治OS的药效团模型分析Fig.2 The pharmacophore model analysis for the effect of JTG on the prevention and treatment of OS
2.2 金天格防治OS的动物实验研究结果
2.2.1大鼠子宫、肝脏、肾脏、左侧腓肠肌及比目鱼肌湿重比较:与Control组和Sham组相比,OS组、OS+JTG组和OS+E2组大鼠的子宫和肾脏湿重明显下降,肝脏和比目鱼肌湿重无明显变化,表明子宫萎缩明显,去势联合地塞米松引起大鼠子宫萎缩,造模成功。与Control组相比,OS+E2组大鼠的腓肠肌湿重增加,OS+JTG组的腓肠肌湿重无明显变化,见图3A~3E。
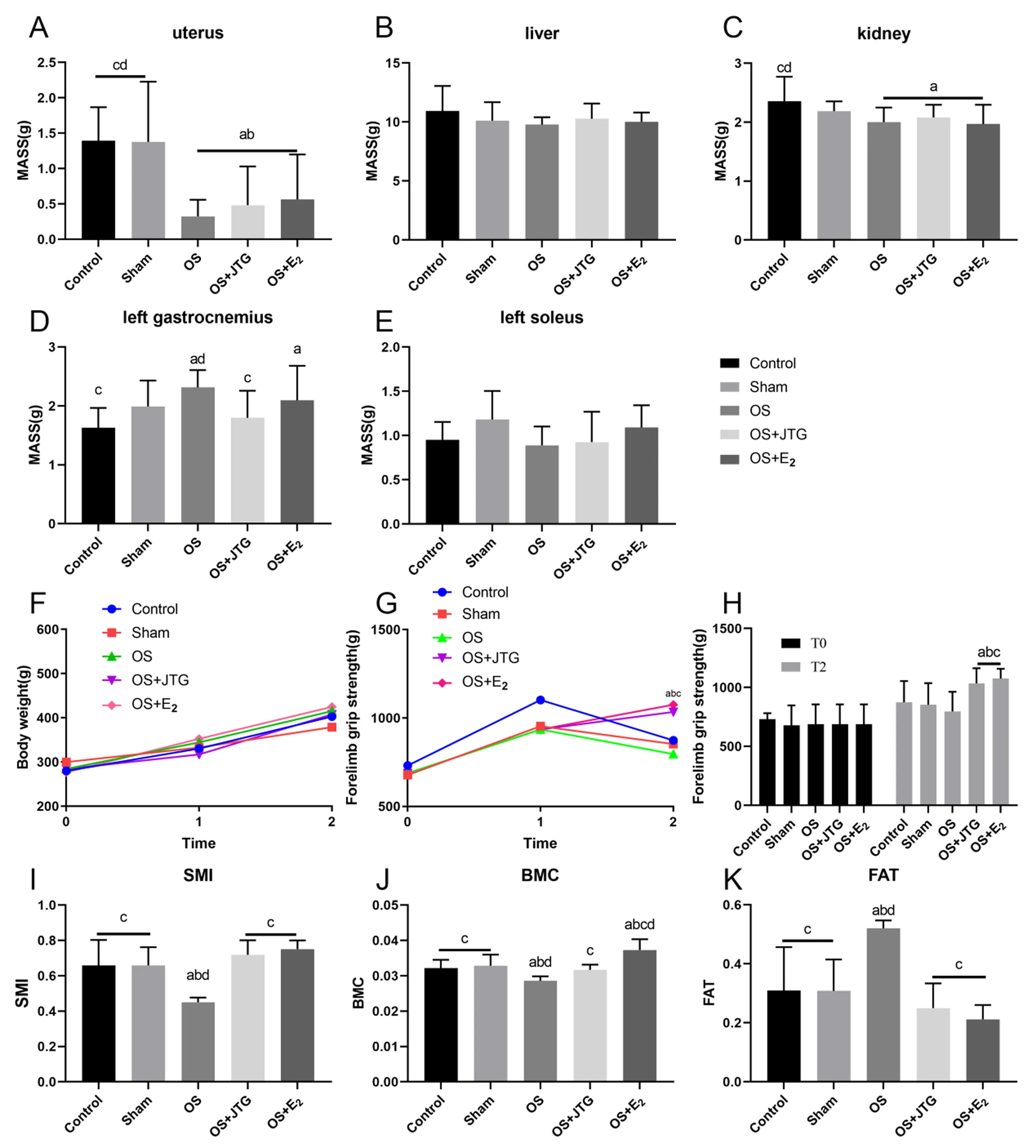
注:A:子宫湿重比较;B:肝脏湿重比较;C:肾脏湿重比较;D:左侧腓肠肌湿重比较;E:左侧比目鱼肌湿重比较;F:大鼠体重从造模开始前(T0),灌胃前(T1),到取材前(T2)的变化;G:大鼠前肢抓力随着时间的变化;H:大鼠前肢抓力在T0和T2的变化;I:大鼠骨骼肌质量指数(SMI)比较;J:大鼠骨矿含量比较;K:大鼠脂肪含量比较。图3 金天格改善OS大鼠前肢抓力和体成分Fig.3 JTG improved forelimb grip and body composition in OS rats
2.2.2大鼠体重、前肢抓力及体成分检测结果:从造模开始前(T0)、灌胃前(T1),到取材前(T2),各组大鼠的体重随着时间增加,各组间体重无明显差别。从T0到T1,大鼠前肢抓力随着时间增加;从T1到T2,药物干预组大鼠前肢抓力较其他组明显增加,表明JTG和E2明显提升OS大鼠前肢抓力。与Control组和Sham组相比,OS组大鼠SMI和BMC明显降低,FAT明显增加。与OS组相比,JTG和E2明显提升OS大鼠的SMI和BMC,降低FAT,见图3F~3K。
2.2.3大鼠骨密度、骨微结构比较:与Control组和Sham组相比,OS组大鼠的全身、股骨、股骨近端、股骨干和股骨远端骨密度均明显下降,股骨头骨密度无明显变化。与OS组相比,JTG和E2明显提高OS大鼠的全身骨密度,其他局部骨密度无明显变化,见图4A~4F。
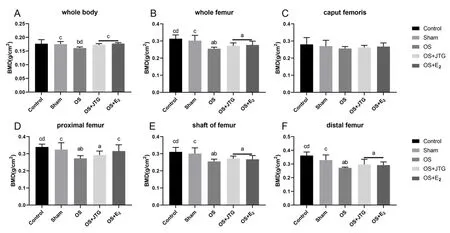
注:A:全身骨密度;B:股骨全长骨密度;C:股骨头骨密度;D:股骨近端骨密度;E:股骨干骨密度;F:股骨远端骨密度。图4 金天格改善OS大鼠的骨密度Fig.4 JTG improved bone mineral density in OS rats
与Control组和Sham组相比,OS组大鼠的骨微结构破坏严重。与OS组相比,JTG和E2明显改善OS大鼠的骨微结构,表明去势联合地塞米松使股骨远端松质骨明显骨质疏松,而JTG和E2明显逆转这一病变,股骨远端三维重建图形也证明了这一点,见图5A~5G。
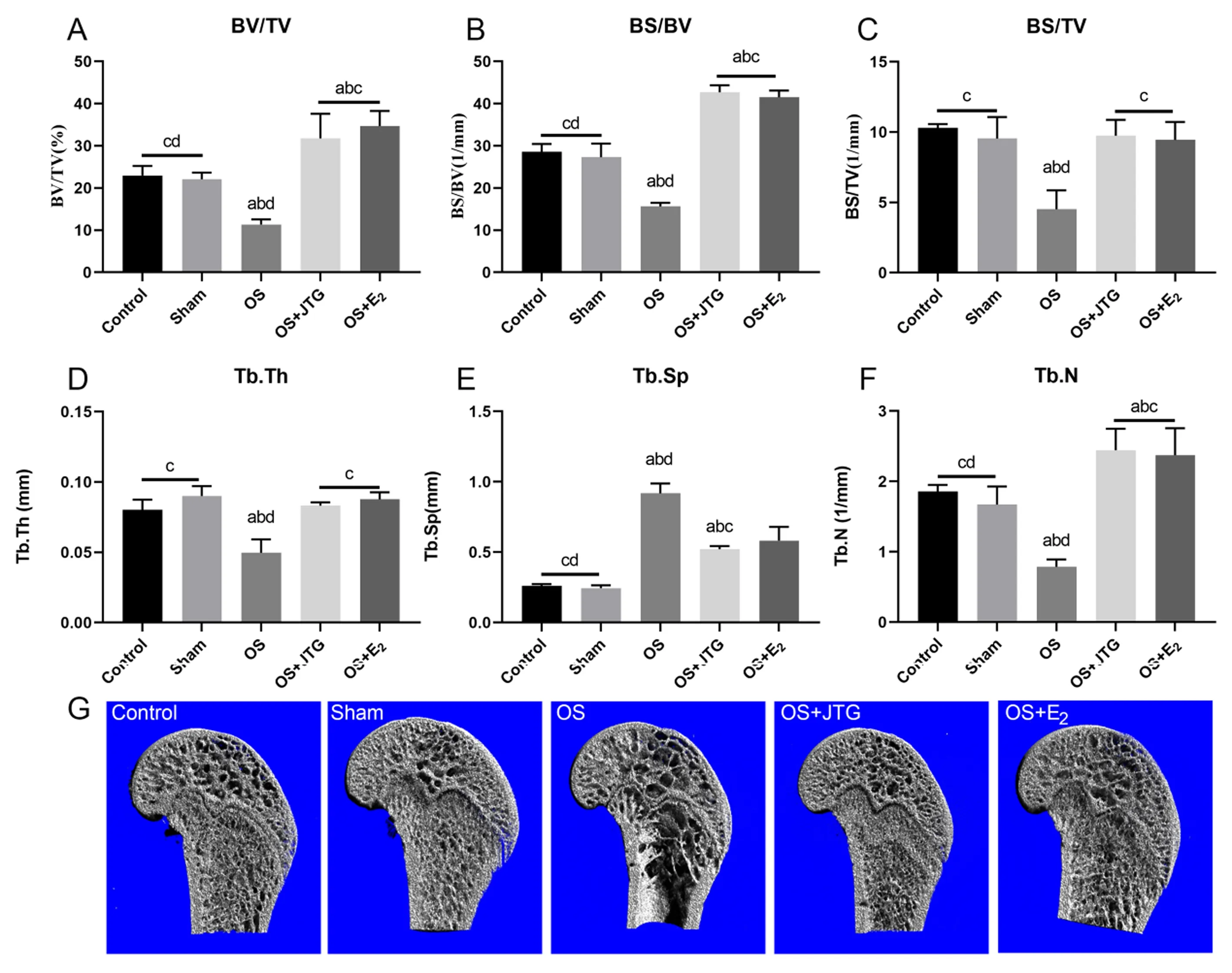
注:A:骨体积分数;B:骨表面积和体积比;C:骨表面密度;D:骨小梁厚度;E:骨小梁分离度;F:骨小梁数量;G:股骨远端三维重建图形。图5 金天格改善OS大鼠的股骨远端骨微结构Fig.5 JTG improved bone microstructure of the distal femur in OS rats
2.2.4大鼠腓肠肌Akt/NF-κB/Bak信号通路相关蛋白检测结果:与Control组、Sham组和OS组相比,OS+JTG组和OS+E2组大鼠腓肠肌p-Akt和NF-κB蛋白表达明显增加,促凋亡蛋白Bak和骨骼肌萎缩相关蛋白Fbx32表达明显降低,表明JTG和E2激活OS大鼠腓肠肌Akt/NF-κB/Bak信号通路,抑制骨骼肌萎缩相关蛋白Fbx32表达,见图6。
3 讨论
中医无OS病名,但根据本病的定义,本病当属“骨肉不相亲”范畴。脾虚肉痿,肾虚骨痿,脾肾俱虚,骨枯肉痿,发为本病[23-25]。补肾健脾、强肌壮骨,为本病的治则。JTG能否防治OS,目前还未见报道。本研究首先基于HPLC法和药效团模型,对JTG所含17种氨基酸进行药效团模型分析,发现JTG防治OS的作用机制可能与PI3K-Akt信号通路、凋亡信号通路等有关。然后利用去势联合地塞米松构建OS大鼠模型并药物干预,从OS表型特征和蛋白组学等方面探讨JTG防治OS的效果及作用机制。
目前对于OS大鼠模型的构建方法,国内外报道较少。国外学者尝试采用早衰型PolgA(D257A/D257A)小鼠[9]、SAMP8小鼠[26]或10月龄雌性大鼠[5]等模拟OS,这些早衰型小鼠或老龄鼠普遍存在造模成本高、周期长、技术复杂等问题,制约其动物模型构建。本研究采用复合造模法(去势+地塞米松)构建OS大鼠模型,OS大鼠表现为子宫萎缩,前肢抓力、全身骨骼肌质量指数、全身及局部BMD明显下降,股骨远端骨微结构破坏严重等表型特征,表明去势联合地塞米松可成功构建OS大鼠模型。
药效团模型研究表明JTG可能通过调控PI3K-Akt信号通路和凋亡信号通路等防治OS。JTG灌胃OS大鼠后,大鼠表现为前肢抓力、全身骨骼肌质量指数、全身及局部BMD明显增加,股骨远端骨微结构明显改善等表型特征,表明JTG可有效防治OS。在肿瘤的发病过程中,磷酸化的Akt能抑制细胞的凋亡与自噬,增加细胞增殖,调控细胞能量代谢。蛋白组学显示,JTG活性成分磷酸化Akt,活化的Akt促进NF-κB蛋白表达,抑制促凋亡蛋白Bak和肌肉萎缩相关蛋白Fbx32蛋白表达,抑制肌肉凋亡和萎缩,表明JTG可能通过激活Akt/NF-κB/Bak信号通路防治OS。
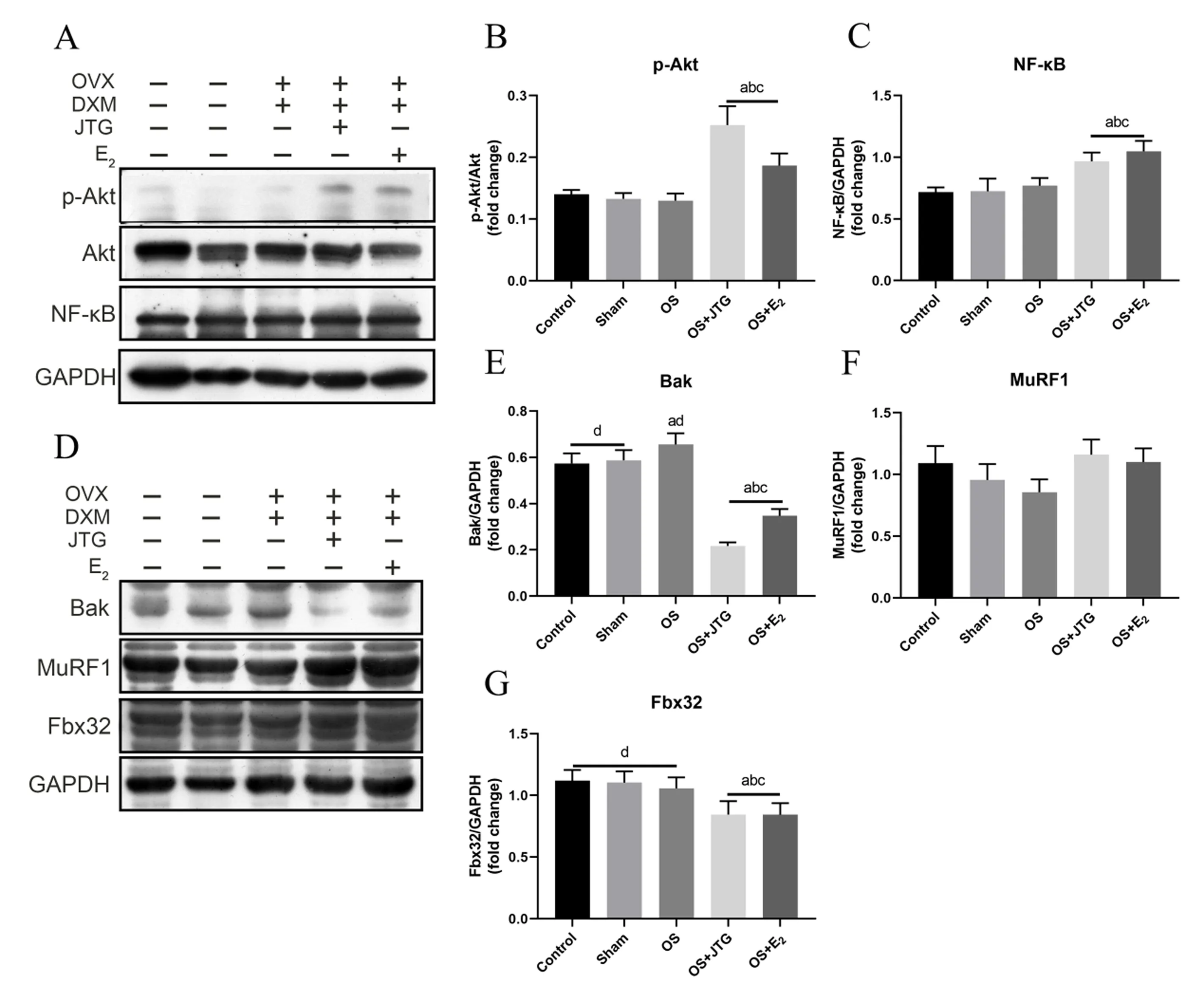
图6 金天格通过调控Akt/NF-κB/Bak信号通路相关蛋白表达来防治OSFig.6 JTG prevents and treats OS by regulation of Akt/NF-κB/Bak signaling pathway
本研究表明JTG明显改善OS大鼠的表型特征,作用机制可能与激活Akt/NF-κB/Bak信号通路有关。面对OS无药可用的窘境,JTG为防治OS带来了更多选择,但仍需要更多的临床前研究及大量随机对照试验来进一步明确其效果和作用机制。

