miR-124-3p靶向Axin1 调控糖尿病骨质疏松成骨的研究
王斌 麦彩园 汪志中 李新旭 董俊球*
1.佛山市三水区人民医院骨科,广东 佛山528100 2.广东省妇幼保健院产科,广东 广州510010
2型糖尿病患者在中国的发病年龄逐渐变小[1]。糖尿病患者常见的一种并发症为骨质疏松。在骨质疏松的糖尿病患者中,骨微结构受损,骨量减少和脆性骨折增加[2]。越来越多的证据表明,糖尿病会增加患骨质疏松症骨折的风险[3]。因此,必须开发有效的防治骨质疏松症的措施来预防和干预[4]。
近年来,miRNA对BMSCs及成骨细胞分化的影响已成为热点问题, 史宏利等[5]研究人BMSCs中miRNA的表达差异,体外研究证实miR-124-3p对BMSCs向成骨细胞分化起调控作用,在老年小鼠骨组织中也发现miR-124-3p表达上调,该miRNA在骨组织的退化及骨质疏松形成和发展过程中发挥较大作用。研究[6]表明,Wnt通路调节干细胞作用于成骨细胞分化,在糖尿病骨质疏松症的发生过程中发挥重要作用。BMSCs可激活骨诱导基因然后经过Wnt通路调控诱导骨分化[7]。Wnt的激活可以促进成骨,增加骨量,并促进骨的愈合,Axin1(axis inhibitor factor 1,轴抑制蛋白1)是Wnt/β-catenin通路里Wnt下游一个抑制骨形成的因子,它是一种多功能的构架蛋白,在许多重要的信号传导通路中扮演着重要的角色。它参与调节许多细胞功能,包括细胞增殖、干细胞再生、细胞凋亡、胚胎发育、代谢、分化和细胞运动[8]。
本研究中建立糖尿病诱导的骨质疏松模型,分析miR-124-3p通过Wnt通路的因子Axin1 对成骨分化产生的影响。
1 材料和方法
1.1 仪器及试剂
PCR检测系统、紫外分光光度计、流式细胞仪:Bio-Rad公司,美国。荧光素酶报告检测系统、骨密度仪:Progmega公司,美国。Trizol、RT-PCR试剂盒(M-MLV):碧云天公司,中国。ALP试剂盒、茜素红染色试剂盒、载体:Bio-Rad公司,美国。柠檬酸盐缓冲液、链脲霉素(STZ):研谨生物科技有限公司,中国。ELISA试剂盒:Takara公司,中国。培养液、Percoll液、胰酶、抗体、成骨诱导液、LipofectamineTM2000:无锡百迈格生物科技有限公司,中国。碱性磷酸酶染色试剂盒、茜素红染色溶液、miR-124-3p模拟物:Bio-Rad公司,美国。胎牛血清、p-MiR report质粒、293 T细胞:Invitrogen公司,美国。
1.2 实验对象
本研究方案经由佛山市三水区人民医院的伦理委员会审查通过。从中山大学实验动物中心购买糖尿病大鼠模型-SPF级SD雌性大鼠20只,年龄7~10周,体重130~200 g,分为对照组和实验组,每组10只。对照组腹腔注射柠檬酸盐缓冲液,实验组注射新鲜制备的2 %链脲霉素(STZ)(60 mg/kg)持续1周。空腹12 h后测量血糖,浓度为16.67 mmol/L,表明该模型的成功建立。所有大鼠于8周后被处死,摆锯于股骨近端1/3处截断,采集大鼠的骨髓组织及外周静脉血清,并储存在-80 ℃。
1.3 实验过程
20只大鼠分组为对照组10例、实验组10例,经过药物注射,ELISA检测血生化指标,骨密度仪测骨密度。BMSCs培养,流式细胞学鉴定。检测对照组和实验组miR-124-3p mRNA的表达。过表达miR-124-3p(模拟物)7、14、21 d,检测ALP、茜素红染色成骨能力。第7天检测miR-124-3p mRNA表达水平。实验组细胞用miR-124-3p模拟物转染,分为高糖组和低糖组,检测中Axin1 mRNA水平。构建载体,与模拟物共转染,荧光素酶报告基因检测miR-124-3p和Axin1靶向结合。将实验组BMSCs分为高糖组和低糖组,检测实验组BMSCs高糖组及低糖组miR-124-3p、Runx2 mRNA的表达及茜素红染色和ALP染色结果。检测实验组模拟物在高糖组及低糖组miR-124-3p、Runx2 mRNA的表达及茜素红染色和ALP染色结果。
1.4 ELISA检测生化指标
ELISA检测糖尿病模型大鼠的血清生化指标,β 胶原降解产物(β-CTX)、骨钙素(OC)、硬化素(SOST)评估骨的吸收和形成;总三酰甘油(TG)、总胆固醇(TC)评估脂质代谢;空腹血糖FPG和血红蛋白A1C-HBA1C评估葡萄糖代谢;骨密度仪检测大鼠腰椎骨密度(g/cm2)。验证糖尿病骨质疏松大鼠模型的有效性。
1.5 BMSCs培养
取骨髓2.5 mL,置于抗凝管中。将骨髓与等体积的含1 %双抗的培养液混合。离心,去除上清。重悬细胞,缓慢注入Percoll液,离心,吸取中间细胞层,加培养基,吹打混匀于培养箱进行培养。每24 h换液,显微镜下观察细胞。胰酶消化后,调节细胞浓度至2×105个/mL,培养。融合度达到70 %以上,传至3代。
1.6 BMSCs鉴定
细胞离心,分装于管中,离心后弃PBS液,保留50 μL,于每管细胞样品中加的CD34、CD45、CD73、CD105以及单克隆抗体各10 μL,孵育,清洗,重悬细胞,流式细胞仪进行检测。
1.7 转染
将转染模拟物(10 μL)和对照片段(200 nmol)溶解于150 μL光学MEM-细胞培养基中制备模拟混合物。LipofectamineTM2000 (5 μL) 溶解于150 μL的Opti-MEM I(1X)还原血清培养基作为转染溶液。细胞播种在6孔板,在碱性α-MEM培养基中培养过夜。将转染溶液和模拟混合物混合,在细胞密度达到80 %混杂度时加入细胞,并孵育20 min。然后将混合物加入细胞中,在37 ℃的5 % CO2环境中孵化,加入无青霉素/链霉素的完整培养基2 mL。将实验组BMSCs分为用30 mmol/L葡萄糖处理的高糖组和用5.6 mmol/L葡萄糖处理的低糖组。将实验组细胞转染模拟物(过表达),同法分高糖组和低糖组。
1.8 RT-qPCR实验
从BMSCs中用Trizol提取RNA。用Nano-100微量分光光度计进行定量。使用通用RT-PCR试剂盒(M-MLV)进行反转录。GoTaq® qPCR Master Mix(A6002)用于检测Axin1、Runx2、miR-124-3p的水平。使用Primerpremier5设计引物(表1)。miRNA的相对表达内参为U6,其他的相对表达内参为β-action。
1.9 双重荧光素酶报告基因检测
利用http://www.targetscan.org/vert_71/网站预测,miR-124-3p可能结合的Wnt通路靶位点Axin1。构建野生型靶基因3’端非翻译区荧光素酶报告基因载体pMIR-Axin1-WT及 miR-124-3p 靶序列突变型载体pMIR-Axin1-MT。将实验组BMSCs细胞接种于24孔板,用Lipofectamine 2000将pMIR-Axin1-WT、pMIR-Axin1-MT荧光报告载体与miR-124-3p 模拟物共转染到293 T细胞中。双荧光素酶报告基因系统检测荧光素酶活性。确定 miR-124-3p 靶向结合基因Axin1。
1.10 碱性磷酸酶(ALP)染色
用碱性磷酸酶染色试剂盒(Bio-Rad公司,美国)进行ALP染色。将细胞植入6孔板,用4 %对甲醛(pH 7.4)固定1~2 min,用磷酸盐缓冲盐(PBS)和三缓冲盐水(TBST)洗涤两次。加入ALP染色溶液覆盖细胞,在室温下阴凉处孵育15~20 min。丢弃ALP染料后,用PBS清洗细胞。然后在孔中添加适当量的PBS,显微镜下观察。在定量分析中,用10 %十二酰氯化吡啶去除ALP染料15 min,并测量在540 nm处的吸光度,然后计算出相对的ALP活性。
1.11 茜素红染色
将细胞种到6孔板中,4 %的多聚甲醛固定15~30 min。用PBS洗涤细胞3次,加入0.2 %茜素红染色溶液(pH 8.3)1~5 min。高葡萄糖条件转染miR-124-3p 模拟物,孵育,在显微镜下观察。然后用20 %甲醇和10 %醋酸的溶液溶解茜素红染料,并通过测量其在570 nm处的吸光度进行量化。然后计算相对茜素红染色。
1.12 统计学处理
2 结果
2.1 糖尿病模型大鼠的葡萄糖和脂质代谢
实验组TG、TC、FPG、HbA1C值上调(图1 a、b、c、d),β-CTX和SOST上调,OC和骨密度下调(图1 e、f、g、h)。

图1 糖尿病模型大鼠的葡萄糖和脂质代谢、骨密度(*P<0.05)Fig.1 Glucose and lipid metabolism and bone mineral density in diabetic model rats (* P <0.05)
2.2 BMSCs鉴定
流式细胞术分析BMSCs(图2):CD73和CD105的表达为阳性,CD34 和 CD45 的表达呈阴性。符合间充质干细胞的抗原特点,证实为BMSCs。
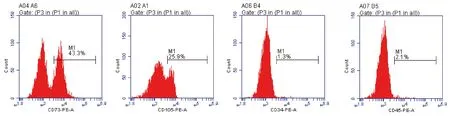
图2 流式细胞术分析BMSCs的细胞表面标记分子Fig.2 Flow cytometry analysis of BMSCs cell surface marker molecules
2.3 miR-124-3p调控BMSC成骨分化及高糖组中Axin1 RNA表达
对照组和实验组检测miR-124-3p表达,实验组明显低于对照组(图 3a)。过表达miR-124-3p(模拟物)7、14、21 d,ALP、茜素红染色随时间逐渐升高(图3b、c)。模拟物转染后7 d miR-124-3p表达水平显著升高(图3 d)。高糖组中Axin1 RNA表达水平上调,但用miR-124-3p模拟物转染时水平下降(图 3e)。
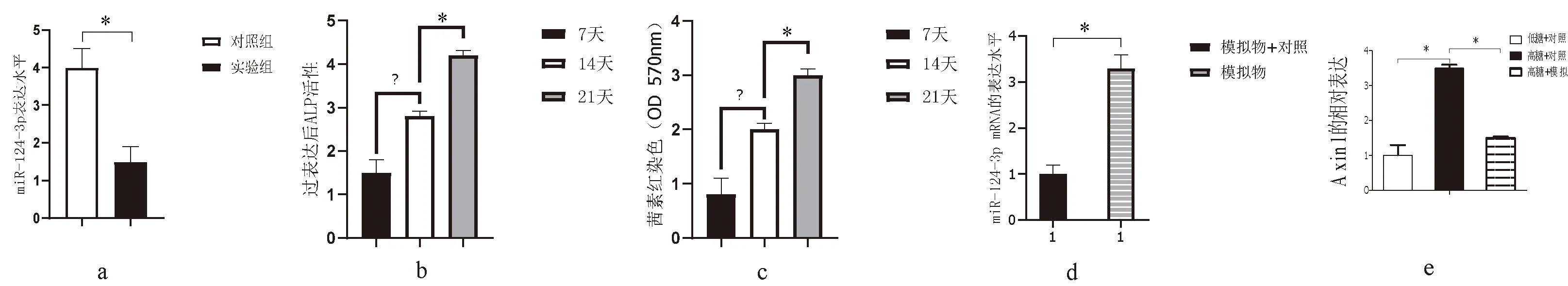
注:a:miR-124-3p在实验组、对照组表达;b、c :ALP、茜素红染色;d:模拟物转染miR-124-3p水平;e:高糖组中Axin1 表达及模拟物转染时水平;*P<0.05。图3 miR-124-3p调控BMSCFig.3 MiR-124-3 p regulation of BMSC
2.4 荧光素酶报告基因检测miR-124-3p和Axin1靶向结合
用数据库(www.targetscan.org)分析miR-124-3p和Axin1之间的关系,结果表明,miR-124-3p和Axin1具有靶向结合位点(图4)。
荧光素酶报告基因结果显示,miR-124-3p可抑制野生型野生型(pMIR-Axin1-WT)的萤光素酶活性,而不影响突变型(pMIR-Axin1-MT)活性(图4)。
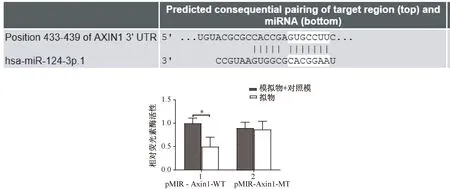
图4 Targetscan网站证明靶向结合位点,荧光素酶报告基因结果(*P<0.05)Fig.4 Targetscan site proof of targeted binding site, luciferase reporter gene results (*P<0.05)
2.5 高葡萄糖诱导对miR-124-3p表达的影响和成骨性分化
高葡萄糖摄入显著降低了miR-124-3p、Runx2表达(图5 a、b)。通过茜素红染色和ALP染色进行病理分析,发现高糖可抑制成骨分化,减少钙沉积,减少ALP表达(图5 c、d)。

图5 高葡萄糖和低葡萄糖诱导的细胞中的miR-124-3p、 Runx2及成骨的表达水平(*P<0.05)Fig.5 Expression levels of miR-124-3p, Runx2, and osteogenesis in high and low glucose induced cells (*P<0.05)
2.6 高血糖条件下miR-124-3p过表达(模拟物)对成骨分化的影响
Runx2的表达显示,高糖+对照明显低于低糖+对照组;高糖+miR-124-3p模拟物明显高于高糖+对照组。茜素红染色和ALP染色显示,高糖+对照明显低于低糖+对照组;高糖+miR-124-3p模拟物明显高于高糖+对照组。

图6 高血糖条件下miR-124-3p过表达对成骨分化的影响(*P<0.05)Fig.6 Effect of miR-124-3p over-expression on osteogenic differentiation under hyperglycemia (*P<0.05)
3 讨论
研究表明miRNA可以调节Wnt通路并参与成骨分化。miR-124-3p可通过调控Wnt通路促进成骨分化[9]。研究[10]发现,糖尿病性骨质疏松症患者中miRNA的差异会增加骨折的风险,miR-382-3p可以促进骨的形成。有证据[8]表明,Wnt通路及Axin1参与调节许多细胞功能,包括细胞增殖、干细胞再生、细胞凋亡、胚胎发育、代谢、分化和细胞运动。Wnt通路参与了糖尿病性骨质疏松症的骨骼形成[11]。miR-124-3p参与Wnt通路的调节,通过调节成骨干细胞形态、成骨细胞粘附和成骨细胞的转录来参与成骨分化过程[12]。在Wnt信号未被激活时,Axin1作为一个支架蛋白与Gsk-3β和 APC形成降解复合物,降解胞质中的 β-catenin,使其浓度较低。当Wnt被激活时,细胞内DVL募集,DVL拮抗降解复合物的活性可以使β-catenin质内聚积,继而发生核转位,在TCF/LEF的作用下,β-catenin引起下游靶基因转录[13]。
本研究ELISA检测血生化指标,实验组TG、TC、FPG、HbA1C值上调,β-CTX和SOST上调,OC和骨密度明显下调,验证了糖尿病骨质疏松大鼠模型建立的有效性。大鼠BMSCs培养后,流式细胞学鉴定,CD73和CD105的表达呈阳性,CD34 和 CD45 的表达呈阴性。符合间充质干细胞的抗原特点,证实为BMSCs。
实验组miR-124-3p表达明显低于对照组。过表达miR-124-3p(模拟物)7、14、21 d后,ALP、茜素红染色随时间逐渐升高。模拟物转染细胞后miR-124-3p表达水平显著升高。证明了糖尿病骨质疏松大鼠股骨miR-124-3p下调,miR-124-3p是一个成骨因子。
实验组细胞用miR-124-3p模拟物转染,结果高糖组Axin1 RNA表达水平上调,但用miR-124-3p模拟物转染时水平下降。用数据库研究miR-124-3p和Axin1具有靶向结合位点,荧光素酶报告基因结果显示miR-124-3p可显著抑制野生型pMIR-Axin1-WT的萤光素酶活性,而不影响突变型pMIR-Axin1-MT荧光报告基因活性。证实了miR-124-3p可靶向调节Axin1,两者为相反的关系。
RT-qPCR检测实验组BMSCs高糖摄入显著降低了miR-124-3p、Runx2表达;高糖可抑制成骨分化,减少钙沉积,减少ALP表达。这说明了高糖的成骨抑制性,高糖抑制miR-124-3p及成骨因子。高血糖条件下miR-124-3p过表达(模拟物)中Runx2的表达显示,高糖+对照明显低于低糖+对照组;高糖+miR-124-3p模拟物明显高于高糖+对照组。茜素红染色和ALP染色显示,高糖+对照明显低于低糖+对照组;高糖+miR-124-3p模拟物明显高于高糖+对照组。这说明高葡萄糖的情况下,miR-124-3p过表达可以逆转BMSC成骨标志物Runx2。茜素红染色和ALP染色证明,miR-124-3p过表达能恢复高糖对骨发生的抑制作用,同时升高高葡萄糖诱导的钙沉积和ALP的表达。
总之,本研究证明了 miR-124-3p能通过靶向抑制Axin1促进糖尿病骨质疏松症大鼠BMSC的成骨发生。本文为临床治疗糖尿病性骨质疏松症提供了新的理论,我们可以通过调控miR-124-3p及其靶因子Axin1的水平治疗糖尿病骨质疏松症。

