MicroRNA-196a靶向调节HDAC9对MC3T3-E1细胞成骨分化的影响
李华峰 张广凤 张旭 鞠文文 王婧婷 吴桐
1.深圳大学附属华南医院内分泌与代谢病科,广东 深圳 518111 2.深圳市第三人民医院放射科,广东 深圳 518111 3.中山市人民医院内分泌与代谢病科,广东 中山 528402 4.齐齐哈尔医学院附属第三医院内分泌与代谢病科,黑龙江 齐齐哈尔 161000 5.齐齐哈尔医学院精神卫生学院,黑龙江 齐齐哈尔 161000
骨质疏松由机体骨量减少所致,是导致老年人骨折及骨折后不愈合的重要原因[1],因此,探究成骨细胞介导的骨形成机制,有利于寻找促进骨形成的有效策略。成骨细胞在成骨分化过程中表现出各种特征,包括碱性磷酸酶(alkaline phosphatase,ALP)活性增加,细胞外基质合成增加,矿化程度增加等[2]。这些过程涉及多种基因的激活或抑制,MicroRNA(miRNA)是单链小RNA,通过介导mRNA降解或翻译抑制实现对靶基因表达的抑制[3],敲除miRNA生成所必需的Dicer酶,可显著抑制骨祖细胞向成骨细胞分化,影响胚胎存活[4]。近期报道[5]称miRNA-196a对成骨细胞的分化具有正向调节作用,然而具体机制待研究。本研究在Targetscan网站预测到组蛋白去乙酰化酶9(histone deacetylase 9,HDAC9)可能是miR-196a的靶基因,且已有研究显示HDAC9抑制剂可通过改善内源性间充质干细胞的成骨能力,促进小鼠骨量恢复[6],推测miR-196a可能靶向下调HDAC9表达,促进成骨分化。基于此,本研究采用miR-196a mimics和miR-196a inhibitor处理MC3T3-E1细胞,初步探究miR-196a在MC3T3-E1细胞成骨分化中与HDAC9的调控关系及作用机制。
1 材料和方法
1.1 材料
1.1.1细胞:小鼠MC3T3-E1细胞,购自中国医学科学院细胞资源中心。
1.1.2试剂:α-MEM培养基、胎牛血清(FBS)(Gibco公司);地塞米松、甘油磷酸钠、抗坏血酸(Sigma公司);RNA试剂盒(Omega Bio-Tek公司);反转录、TB Green®定量PCR试剂盒(TaKaRa公司);miR-196a-mimics及miR-196a-mimics-NC、miR-196a-inhibitor及miR-196a-inhibitor-NC、pCMV-HDAC9及pCMV-HDAC9-NC(上海吉玛公司);矿化结节(茜素红)染色试剂盒(碧云天);ALP检测试剂盒(日本WAKO公司);Histone H3、Histone H3(acetyl K9)、Histone H3(acetyl K14)、Anti-Histone H3(acetyl K23)、HDAC9、Runt相关转录因子2(runt-related transcription factor 2,Runx2)、ALP、骨桥蛋白(osteopontin,OPN)、胶原蛋白 I(collagen I,COL1)抗体,(Abcam公司);引物(上海生工公司),等。
1.1.3仪器:定量PCR仪(ABI公司);CO2培养箱、自动酶标仪(Thermo公司);倒置显微镜(Olympus公司);电仪及转膜装置(BioRad公司),等。
1.2 方法
1.2.1细胞培养和分组:MC3T3-E1细胞采用α-MEM培养基+10 % FBS培养,隔天换液,取对数期细胞进行实验。随机分组为:对照组(control,Cont)组(未转染,未诱导)、诱导组(未转染,进行成骨诱导)、miR-196a-mimics-NC组(转染miR-196a-mimics-NC后,进行成骨诱导)、miR-196a-mimics组(转染miR-196a-mimics后,进行成骨诱导)、miR-196a-inhibitor-NC组(转染miR-196a-inhibitor-NC后,进行成骨诱导)、miR-196a-inhibitor组(转染miR-196a-inhibitor后,进行成骨诱导)、miR-196a-mimics+pCMV-HDAC9-NC组(共转染miR-196a-mimics和pCMV-HDAC9-NC后,进行成骨诱导),miR-196a-mimics+pCMV-HDAC9组(共转染miR-196a-mimics和pCMV-HDAC9后,进行成骨诱导)。采用α-MEM培养基+10 % FBS培养至MC3T3-E1细胞贴壁24 h后,换为无血清α-MEM培养基,使用Lipofectamine 3000试剂盒将RNA序列和或pCMV-质粒转染进各组细胞中,6 h后更换α-MEM培养基+10 % FBS培养12 h,再加入10-7mol/L地塞米松、10 mmol/L甘油磷酸钠和50 μg/L抗坏血酸[7]进行成骨诱导,培养72 h检测。
1.2.2定量荧光PCR(qRT-PCR)检测:使用RNA试剂盒提取MC3T3-E1细胞中总RNA。核酸检测仪分析A260/A280比率和RNA质量后,反转录合成cDNA。按照TB Green®PCR试剂盒说明书分别对miR-196a和HDAC9进行qRT-PCR扩增,读取各基因和内参的循环数(Ct值),以GAPDH和U6为内参根据2-ΔΔCt公式计算HDAC9和miR-196a的表达量。miR-196a F:5’-UAGCAGCACAGAAAUAUU GGC-3’,miR-196a R:采用mRQ 3’引物;U6 F:5’-CTCGCTTCGGCAGCACA-3’、U6 R:5’-AACGCTT CACGAATTTGCG-3’;HDAC9 F:5’-TGCATCGG AAGCCTGCATAA-3’、HDAC9 R:5’-CGGTCTCT GTCTCCTCTTGC-3’;GAPDH F:5’-GGAGAGTGTTT CCTCGTCCC-3’、GAPDH R:5’-ACTGTGCCGTT GAATTTGCC-3’。
1.2.3ALP活性检测:收集1.2.1中MC3T3-E1细胞,加入150 μL曲拉通X裂解细胞,冻融两次后离心收集上清。取20 μL上清样品和100 μL底物缓冲液混匀,孵育15 min,加入100 μL终止液停止反应,震荡混匀后测量405 nm处光密度(OD),根据标准曲线计算ALP活性。
1.2.4矿化程度检测:收集1.2.1中MC3T3-E1细胞,PBS清洗后加入2 mL 4 %甲醛固定20 min,换为1 mL茜素红溶液染色15 min,吸取200 μL上述混合液加入96孔板,测量540 nm处OD值,矿化程度以相对OD表示。弃去剩余混合液后在倒置显微镜下拍照。
1.2.5双荧光素酶报告实验:构建包含miR-196a结合位点的HDAC9 3’UTR序列(WT)或其突变(MUT)的重组质粒,即为pGL3-HDAC9 3’UTR-WT和pGL3-HDAC9 3’UTR-MUT。MC3T3-E1细胞分组为pGL3-HDAC9 3’UTR-WT+mimics-NC组、pGL3-HDAC9 3’UTR-MUT+mimics-NC组、pGL3-HDAC9 3’UTR-WT+miR-196a mimics组、pGL3-HDAC9 3’UTR-MUT+miR-196a mimics组,将pGL3-HDAC 3’UTR-WT或pGL3-HDAC 3’UTR-MUT与mimics-NC或miR-196a mimics共转染至以上4组MC3T3-E1细胞中,6 h后换为α-MEM培养基+10 % FBS培养,48 h后测定荧光素酶活性,相对荧光素酶活性用海肾荧光素酶活性标准化。
1.2.6Western blot检测:使用RIPA裂解液裂解1.2.1中各组MC3T3-E1细胞并提取总蛋白,BCA法测定蛋白浓度。取30 μg蛋白进行电泳,电转印到PVDF膜,与5 %脱脂奶粉封闭液孵育后,加入1∶500或1∶1 000稀释的HDAC9、GAPDH、ALP、Runx2、COL1、OPN、Histone H3、Histone H3(acetyl K9)、Histone H3(acetyl K14)、Anti-Histone H3(acetyl K23)抗体4 ℃过夜,换为1∶2 000稀释的HRP标记二抗室温孵育1 h,ECL发光液避光显色后采集图像并分析条带灰度。
1.3 统计学处理

2 结果
2.1 miR-196a和HDAC9在MC3T3-E1细胞中表达情况
与Cont组相比,诱导组、miR-196a-mimics-NC组和miR-196a-inhibitor-NC组MC3T3-E1细胞中miR-196a表达增高(P<0.05),HDAC9 mRNA和蛋白表达降低(P<0.05);与miR-196a-mimics-NC组和诱导组相比,miR-196a-mimics组MC3T3-E1细胞miR-196a表达增高(P<0.05),HDAC9 mRNA和蛋白表达降低(P<0.05);与miR-196a-inhibitor-NC组和诱导组相比,miR-196a-inhibitor组miR-196a表达降低(P<0.05),HDAC9 mRNA和蛋白表达增高(P<0.05),见图1、表1。
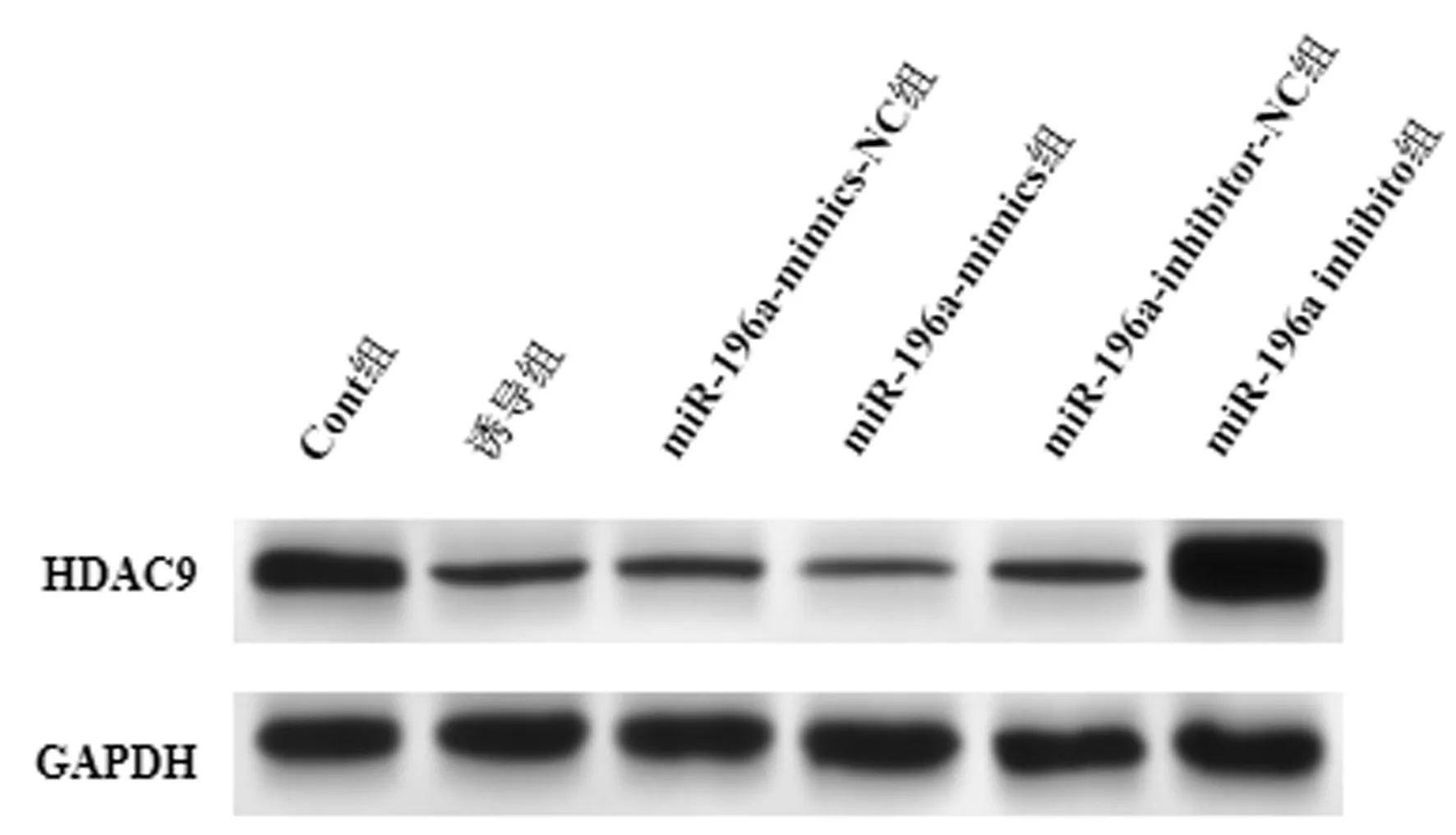
图1 Western blot检测HDAC9在各组MC3T3-E1细胞中表达Fig.1 The expression of HDAC9 of MC3T3-E1 cells in each group detected with Western blotting
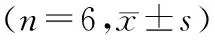
表1 miR-196a和HDAC9在MC3T3-E1细胞中表达情况
2.2 miR-196a对MC3T3-E1细胞成骨分化的影响
与Cont组相比,诱导组、miR-196a-mimics-NC组和miR-196a-inhibitor-NC组MC3T3-E1细胞ALP、Runx2、COL1、OPN蛋白表达、ALP活性及矿化程度增加(P<0.05);与miR-196a-mimics-NC组和诱导组相比,miR-196a-mimics组MC3T3-E1细胞ALP、Runx2、COL1、OPN蛋白表达、ALP活性及矿化程度增加(P<0.05);与miR-196a-inhibitor-NC组和诱导组相比,miR-196a-inhibitor组MC3T3-E1细胞ALP、Runx2、COL1、OPN蛋白表达、矿化程度及ALP活性降低(P<0.05),见图2,表2。
注:A:Western blot检测ALP、Runx2、COL1、OPN在各组MC3T3-E1细胞中表达。B:茜素红染色各组MC3T3-E1细胞(Scale bar=200 μm)。图2 miR-196a对MC3T3-E1细胞成骨分化的影响Fig.2 Effects of miR-196a on osteogenic differentiation of MC3T3-E1 cells
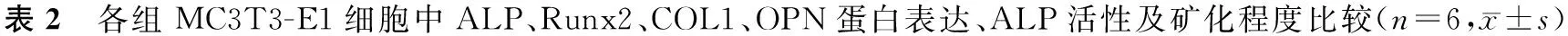
2.3 miR-196a可靶向调节MC3T3-E1细胞中HDAC9的表达
Targetscan网站预测显示,HDAC9 3’UTR区存在miR-196a的结合位点,见图3。双荧光素酶报告实验发现,pGL3-HDAC9 3’UTR-WT+mimics-NC组、pGL3-HDAC9 3’UTR-MUT+mimics-NC组、pGL3-HDAC9 3’UTR-WT+miR-196a mimics组、pGL3-HDAC9 3’UTR-MUT+miR-196a mimics组相对荧光素酶活性为(0.99±0.05)、(1.01±0.08)、(0.39±0.04)、(1.03±0.09),pGL3-HDAC9 3’UTR-WT+miR-196a mimics组显著低于其他三组(均P<0.05)。
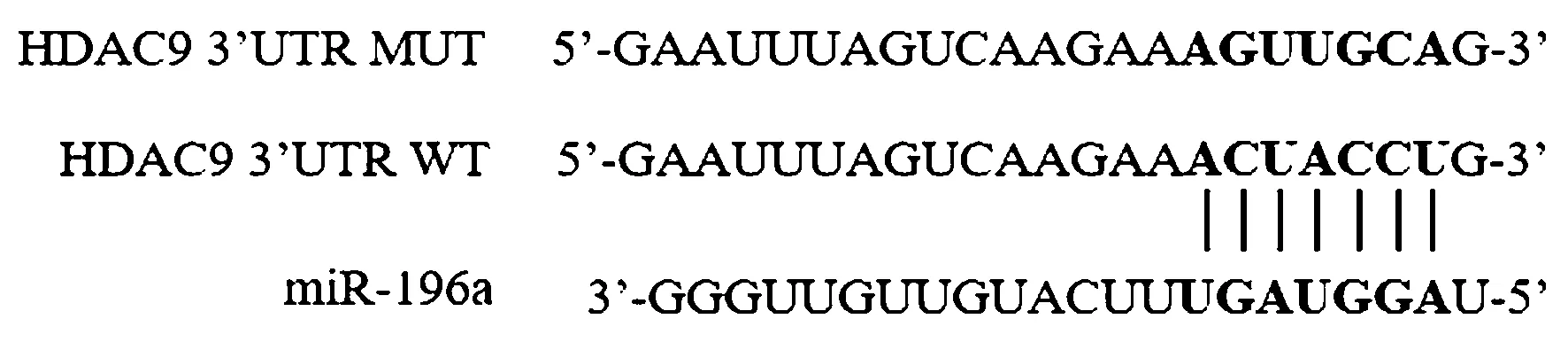
图3 Targetscan预测HDAC9 3’UTR与miR-196a的结合位点Fig.3 The binding site of HDAC9 3’UTR and miR-196a predicted with Targetscan
2.4 miR-196a对MC3T3-E1细胞Histone H3乙酰化水平的影响
与Cont组相比,诱导组、miR-196a-mimics-NC组和miR-196a-inhibitor-NC组MC3T3-E1细胞Histone H3 K9、K14和K23位点乙酰化水平增加(P<0.05);与miR-196a-mimics-NC组和诱导组相比,miR-196a-mimics组MC3T3-E1细胞Histone H3 K9、K14和K23位点乙酰化水平增加(P<0.05);与miR-196a-inhibitor-NC组和诱导组相比,miR-196a-inhibitor组MC3T3-E1细胞Histone H3 K9、K14和K23位点乙酰化水平降低(P<0.05),见图4,表3。

图4 Western blot检测各组MC3T3-E1细胞中Histone H3 K9、K14和K23位点乙酰化水平Fig.4 The acetylation levels of Histone H3 K9, K14, and K23 sites of MC3T3-E1 cells in each group detected with Western blotting
表3 各组MC3T3-E1细胞中Histone H3 K9、K14和K23位点乙酰化水平的比较
2.5 共转染miR-196a mimics和pCMV-HDAC9对MC3T3-E1细胞成骨分化的影响
与miR-196a-mimics组和miR-196a-mimics+pCMV-HDAC9-NC组比较,miR-196a-mimics+pCMV-HDAC9组MC3T3-E1细胞ALP、Runx2、COL1、OPN蛋白表达、ALP活性及矿化程度降低(P<0.05),见图5、表4。
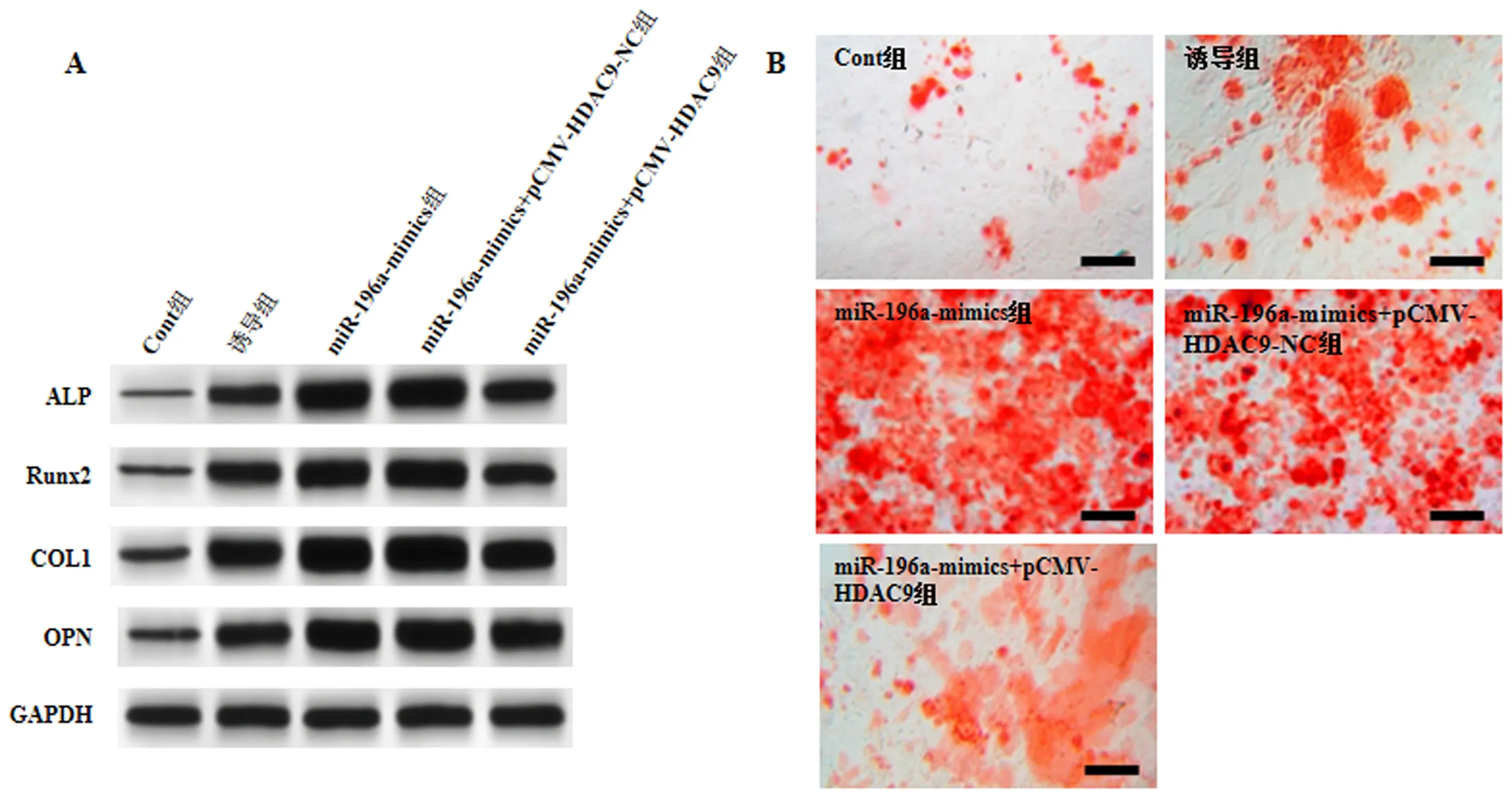
注:A:Western blot检测ALP、Runx2、COL1、OPN在各组MC3T3-E1细胞中表达。B:茜素红染色各组MC3T3-E1细胞(Scale bar=200 μm)。图5 共转染miR-196a mimics和pCMV-HDAC9对MC3T3-E1细胞成骨分化的影响Fig.5 Effects of co-transfection of miR-196a mimics and pCMV-HDAC9 on osteogenic differentiation of MC3T3-E1 cells
3 讨论
miRNA表达失调可能影响成骨细胞分化和骨形成,如miR-219a-5p在老年人骨组织中表达降低,过表达miR-219a-5p可增加ALP表达和活性,增强成骨活性[8];miR-335-5p在小鼠胚胎的成骨细胞中高表达,过表达miR-335-5p可诱导小鼠的成骨分化和骨形成,促进颅面骨缺损的修复[9];miR-664-3p在MC3T3-E1细胞成骨分化过程中表达下调,过表达miR-664-3p在体外可抑制成骨细胞活性和基质矿化,在体内则损害骨形成并引起骨量减少[10]。本研究发现,miR-196a在成骨诱导的MC3T3-E1细胞中表达增加,且高表达miR-196a后,MC3T3-E1细胞miR-196a表达、ALP、Runx2、COL1、OPN蛋白表达、ALP活性及矿化程度增加;低表达miR-196a则可显著降低MC3T3-E1细胞miR-196a表达、ALP、Runx2、COL1、OPN蛋白表达、ALP活性及矿化程度。成骨细胞是骨形成的主力细胞,首先合成并释放COL1累积大量细胞外基质,进一步成熟并发生矿化形成骨结节,最终实现骨量的增加[11]。Runx2为早期成骨细胞标志物,COL1为胞外基质中主要胶原成分,OPN、ALP为成熟成骨细胞标志物,其表达水平可反映成骨细胞的分化能力[12]。提示miR-196a在MC3T3-E1细胞中发挥促成骨分化作用。
miRNA主要通过与内源性mRNA竞争性结合,减少翻译蛋白质的mRNA数量或者抑制翻译,从而抑制蛋白表达[3]。如miR-143可通过靶向HDAC7抑制成骨细胞分化[13];miR-27a可直接抑制PR结构域蛋白16基因(TGF-β信号通路的负调节因子)表达,进而调节TGF-β信号通路促进骨细胞分化[14]。本研究预测发现,miR-196a与HDAC9 3’UTR存在结合位点,且荧光素酶报告实验显示,miR-196a mimics可显著降低pGL3-HDAC9 3’UTR-WT的荧光素酶活性,进一步证实miR-196a与HDAC9 3’UTR存在特异性结合。本研究还发现,miR-196a-mimics可显著降低MC3T3-E1细胞中HDAC9表达并增加Histone H3 K9、K14和K23位点乙酰化水平,而miR-196a-inhibitor则明显增加MC3T3-E1细胞中HDAC9表达,同时降低Histone H3 K9、K14和K23位点乙酰化水平,提示miR-196a可靶向负调控HDAC9表达。HDAC9属于Ⅱ类HDAC,通过移去组蛋白和/或其他蛋白质中赖氨酸侧链上的乙酰基来控制基因转录[15]。最近证据显示,HDAC是骨形成和重建的关键调节剂,其中HDAC3促进骨形成[16],而HDAC4[17]、HDAC8[18]和HDAC9[6]抑制骨形成。组蛋白乙酰化后构象发生改变,释放其聚合的DNA,有利于转录因子与DNA的结合,激活基因转录[19-20],而HDAC可降低组蛋白的乙酰化水平,维持DNA-组蛋白复合物的稳定,阻止转录因子对基因转录的激活[21]。推测转染miR-196a-mimics后,HDAC9蛋白水平降低,其调控的去乙酰化作用减弱,使得Histone H3 K9、K14和K23位点乙酰化水平升高,有利于DNA从组蛋白复合物中释放并与Runx2等转录因子结合,启动ALP、COL1、OPN等基因表达,促进成骨分化。
综上所述,miR-196a可靶向下调HDAC9表达,增加组蛋白乙酰化水平,促进MC3T3-E1细胞成骨分化。本研究仅在细胞层面探究了miR-196a的促成骨分化作用,接着将进行动物实验,从组织学角度探究miR-196a对成骨分化的作用。

