胰高血糖素样肽-1在骨质疏松症中的影响及作用机制的研究进展
丁海璇 李铁力 田园 杨丽
湖南师范大学附属第一医院 湖南省人民医院内分泌科,湖南 长沙410000
骨质疏松症(osteoporosis,OP)是一种骨微结构改变、骨密度降低、骨强度降低的代谢性骨病[1]。当下,全球骨质疏松症的发病率呈上升趋势,据估计,全世界的骨质疏松患者近2亿人,其中老年男性发病率约为60.72 %,老年女性的发病率高于男性,已高达90.87 %[2]。骨质疏松症引起的疼痛和骨折严重的降低了患者的生活质量,并给家庭和社会造成巨大负担,而目前骨质疏松症的治疗仍是有限的,GLP-1类似物及激动剂是一种新型降糖药物,而近年来GLP-1在骨质疏松症中的研究中越来越多,本文以GLP-1在骨质疏松症中的影响及作用机制作一简单综述,以期为骨质疏松症的预防与医治提供新的思路。
1 GLP-1的生物学功能
GLP-1是一种30或31个氨基酸长的肽激素,最早于1981年在琵琶鱼身上发现[3],1987年,在人类、大鼠和猪身上发现了由膳食诱导的GLP-1分泌[4]。GLP -1主要定位于L细胞[5],除了肠内分泌L细胞外,GLP-1蛋白还在大鼠、猴子和人类脑干孤束核中被发现[6]。此外,GLP-1的产生发生在胰岛内的α细胞中,口服碳水化合物和脂肪诱导GLP-1分泌,通过GLP-1受体(GLP-1 receptor,GLP-1R)在胰腺、肾脏、心脏、肺、脂肪、平滑肌等多个组织以及中枢神经系统的特定核中发挥作用[5]。研究[7-8]发现,GLP-1具有抑制食欲、延缓胃排空、改善心功能、减轻神经炎症、促进神经生长、调节血糖、血脂、骨代谢等多种生物学作用。而天然的GLP-1的半衰期很短,在被肾脏清除及二肽基肽酶-4识别裂解后,半衰期约1~2 min[9]。GLP-1RAs可与GLP-1Rs结合,发挥与GLP-1相同的作用,现在GLP-1RAs因其减轻体重、保护胰岛细胞、不良反应小等特性而被广泛应用于2型糖尿病(type 2 diabetes mellitus,T2DM)的治疗,同时也具有神经保护、抗感染、心血管保护、代谢调节等作用[10],在骨质疏松症中治疗应用及潜在价值已成为研究热点,具有良好的应用前景。
2 GLP-1在骨质疏松症中的保护作用机制
2.1 GLP-1通过调节糖代谢减缓骨质疏松
高血糖条件可损害成骨细胞和破骨细胞的形成[11-12],因为在长期的高血糖状态下,蛋白质、磷脂和核酸的非酶糖基化作用会导致晚期糖基化终产物(advanced glycation end products,AGEs)的不断形成和积累。过量的AGEs可能导致胶原蛋白的非酶交联,破坏成骨细胞与细胞外基质的粘连,导致骨脆性[13]。这些发现提示骨中AGEs的积累可能导致成骨细胞功能障碍。另一方面,AGEs也被认为可以增加破骨细胞的活性,AGEs受体在人破骨细胞中表达,刺激破骨细胞中核因子Kappa B的激活,从而增加细胞因子和活性氧的产生。而相关的促炎细胞因子和活性氧的不断积累,打破了破骨细胞与成骨细胞之间的平衡,增加了破骨细胞的分化,导致骨量丢失[14]。一些体外研究报道了AGEs刺激骨细胞产生白细胞介素-6[15],抑制成骨细胞表型表达[16],增加破骨细胞吸收[17]。在动物模型中,糖尿病控制的改善逆转了糖尿病引起的组织形态骨改变[18]。观察性研究[19]指出,当血糖水平得到更好的控制后,可以减少尿液中钙的流失,改善骨密度。因此有效的血糖控制对糖尿病相关性骨质疏松症的预防和治疗具有重要意义。GLP-1主要通过刺激胰岛素和抑制胰高血糖素的分泌、调节胃排空的生理作用来调节血糖水平,从而促进骨形成[20]。研究[21]发现GLP-1RAs及其类似物具有缓解糖尿病骨质疏松症的作用。因此,在临床研究中观察到的GLP-1RAs的合成骨效应可能是改善血糖控制的一个次要结果。
2.2 GLP-1通过调节脂代谢减缓骨质疏松
骨质疏松症与高脂血症密切相关[22],大多数骨质疏松症患者会发展为高脂血症[23]。脂质代谢紊乱导致极低密度脂蛋白(very low density lipoprotein,VLDL)和总胆固醇(total cholesterol,TC)水平升高,导致VLDL和TC在内皮细胞下层和内皮细胞层积聚。慢性脂肪的积累会导致动脉粥样硬化和血管管腔狭窄,血管结构和功能受损会影响血液流向许多器官,如视网膜、心脏、肾脏、中枢和外周神经系统的神经元等重要组织和器官,其中也包括骨骼,导致骨血供不足,骨组织将不能正常运作,并可能出现结构异常,如微裂纹[13]。
几项体外研究表明,GLP-1能够刺激脂肪来源的干细胞(adipose-derived stem cells,ADSC)[24]和骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)[25],进而促进成骨细胞分化,而抑制脂肪细胞分化。Meng等[26]研究发现,在BMMSC分化过程中,艾塞那肽通过β-catenin途径抑制脂肪形成并促进成骨细胞形成,对骨骼产生潜在的有益作用。此外,GLP-1R在脂肪细胞中表达,GLP-1RAs下调脂肪组织外植体和培养脂肪细胞上的成脂基因,同时增加脂溶标志物和脂联素的表达[27-29]。在高脂肪喂养的大鼠中,GLP-1逆转了高脂血症引起的骨量减少[30]。以上结果提示,GLP-1可以通过调节脂代谢在一定程度上改善骨代谢。
2.3 GLP-1通过改善骨血流减缓骨质疏松
研究表明血流对骨血管功能和成骨至关重要[31],而骨供血中断与骨量减少、骨坏死和骨再生受损关系密切[32]。然而,很少有人研究糖尿病患者骨血管和骨血流是否减少,以及是否有可能通过使用抗糖尿病药物来恢复其骨血管和骨血流。Fajardo[33]回顾了有关糖尿病骨微血管并发症的文献,但仍缺乏证据支持糖尿病骨骼脆弱性与这些血管并发症之间的联系。GLP-1RAs增强血管功能的潜力已在几项研究中得到证实[34-35]。目前肠促胰岛素的治疗在预防糖尿病血管并发症方面很有前景[36]。在一个T2DM合并肥胖的小鼠模型中,4周艾塞那肽的使用显著增加了胫骨血流,且观察到的骨形成增加可能部分归因于骨骼灌注增加[37]。目前还没有研究检验利拉鲁肽对骨血流的影响,因此,需要更多的研究来验证骨骼灌注是否与糖尿病的骨形成有关,以及GLP-1RAs是否可以通过增加血管形成,来用于治疗骨折愈合不良的糖尿病患者。
2.4 GLP-1通过与受体结合减缓骨质疏松
GLP-1已经被证明通过与甲状腺C细胞的GLP-1R结合,刺激降钙素的产生,从而间接抑制骨吸收[38]。因此,胰腺GLP-1R缺失的小鼠发生皮质性骨质减少,并通过相关通路促进破骨细胞的形成[39]。另一项研究[40]显示,激活GLP-1R对骨骼强度和质量有类似的积极影响,因为缺乏GLP-1R的小鼠显示出明显的机械性能受损,皮质厚度和骨外径减少,胶原基质成熟度降低。GLP-1的糖调节作用不仅通过胰腺GLP-1R发挥作用,也在成骨细胞上发挥作用[41]。没有GLP-1R的小鼠骨强度降低,破骨细胞数量和骨吸收活动增加,且胶原基质的成熟度显著降低[40]。艾塞那肽最近也被报道通过抑制骨吸收和促进老年切除卵巢的大鼠的骨形成来提高骨强度和改善骨微结构[42]。所有这些结果都表明GLP-1受体的激活可能具有直接的成骨作用。因此,可以预期GLP-1RAs在动物中的抗骨质疏松作用。
2.5 GLP-1刺激降钙素、硬化蛋白、骨钙素分泌减缓骨质疏松
GLP-1可能通过降钙素依赖的途径间接抑制骨吸收[43]。当GLP-1或其类似物激活时,对啮齿动物的降钙素分泌产生刺激作用[44],降钙素是一种有效的骨吸收抑制剂。Mabilleau等[40]提出,GLP-1激动剂对骨的作用可能是间接的,其间接途径主要通过靶向甲状腺降钙素的分泌来影响骨代谢,降钙素可以抑制破骨细胞的活性。有研究[45]表明,艾塞那肽刺激降钙素分泌,而利拉鲁肽对降钙素分泌没有影响,但两者均能促进体外破骨细胞分化,轻微减少每个破骨细胞的吸收面积。而有研究[44]报道,艾塞那肽和利拉鲁肽都刺激降钙素分泌。降钙素在骨转换中发挥着重要的作用,可能是GLP-1治疗的潜在靶点,但仍需要更多的研究来验证骨质疏松症患者的骨生成是否受到影响。
小鼠的高脂饮食导致血清硬化蛋白的增加和骨细胞网络组织的显著改变[46]。而很少有人研究GLP-1RAs是否会影响骨细胞产生硬化蛋白。虽然GLP-1R主要由未成熟的成骨细胞表达,但它也可能存在于与硬化蛋白共定位的骨细胞中[47],这表明GLP-1RAs可能影响硬化蛋白的产生。Kim等[47]证实糖尿病大鼠与对照组相比硬化蛋白水平升高,艾塞那肽治疗可以下调硬化蛋白水平。Pereira等[45]研究结果显示艾塞那肽降低了老年切除卵巢小鼠的硬化蛋白水平,而利拉鲁肽没有。总的来说,尽管存在一些争议,但大多数临床和实验研究表明,硬化蛋白可能在T2DM患者骨转换减少中发挥作用,并可能是GLP-1治疗的潜在靶点。但血清中硬化蛋白的来源尚不清楚,并且需要更多的研究来探讨GLP-1是否对T2DM患者硬化蛋白及骨生成产生影响。
肠促胰岛素通过调节成骨细胞的骨钙素合成促进全身能量代谢。一项体外研究[48]表明肠促胰岛素抑制了成骨细胞中甲状腺激素刺激的骨钙素合成,表明肠促胰岛素可以通过降低骨钙素水平来刺激骨形成。虽然有许多研究[45,49-50]证实艾塞那肽在T2DM大鼠中可增加血清骨钙素水平,但利拉鲁肽治疗的情况并非如此。
尽管许多骨细胞体外和动物模型的报道表明GLP-1RAs可影响骨骼释放骨钙素、硬化素等激素影响其他器官,但临床方面的证据仍然非常缺乏。
2.6 GLP-1通过分子机制减缓骨质疏松
2.6.1Wnt/β-catenin信号通路:Wnt信号转导有经典的β-catenin途径、平面细胞极性途径和Wnt/Ca2+途径等,其中β-catenin的细胞核内含量的变化是信号转导的关键步骤[51]。Ma等[42]揭示GLP-1的激活通过cAMP/PKA/β-catenin和PKA/PI3K/AKT/GSK3β信号,一方面能调节成骨细胞分化,另一方面能抑制BMMSC成脂分化。Meng等[26]的研究表明,使用GLP-1激动剂exendin-4激活GLP-1受体,引导BMMSC向成骨细胞分化,并通过促进β-catenin信号改善骨量。这一发现与最近的一项研究[52]相似,该研究表明GLP-1的促成骨作用依赖于典型的Wnt信号。
2.6.2Hedgehog/Gli1信号通路:Hedgehog-Gli1信号通路与骨质疏松疾病的发生联系紧密[53],研究[54]表明,激活Hedgehog/Gli1信号通路可以通过上调Runx2等促骨细胞因子的表达来促进骨形成,Runx2可增加骨代谢和质量。Gao等[55]用艾塞那肽处理成骨细胞,Hedgehog和Gli1的表达随艾塞那肽浓度的增加而增加,结果提示艾塞那肽可能通过上调Hedgehog和Gli1的表达来调节骨代谢,促进成骨细胞的分化,也证明了在成骨细胞分化过程中Hedgehog-Gli信号通路发挥着重要作用。然而Hedgehog-Gli1信号通路的作用机制尚未完全清楚,后续需要投入更多的研究来挖掘该信号通路在骨质疏松疾病中的潜力。
2.6.3OPG/RANKL信号通路:OPG/RANKL的表达比例被认为是破骨细胞生成活性的关键决定因素[42]。在一项链脲佐菌素诱导的糖尿病和双侧卵巢切除的大鼠用利拉鲁肽治疗8周的研究中,结果提示利拉鲁肽或GLP-1信号可能通过调节RANKL/OPG比值抑制破骨细胞,推测利拉鲁肽可能通过调控OPG、RANKL的表达,从而影响OPG与RANKL水平[56]。在Ma等[42]的研究中评估了艾塞那肽对卵巢切除的老年大鼠诱导的骨质疏松症的影响,研究发现艾塞那肽增加了OPG mRNA的表达,降低了RANKL mRNA的表达,这表明艾塞那肽通过增加OPG/RANKL比例抑制破骨细胞分化。
3 GLP-1RAs对骨质疏松症的治疗
GLP-1RAs被认为是治疗T2MD的新型降糖药,具有降低血压、降低空腹血糖水平、降低HbA1c、诱导体重减轻、低血糖发生率低等优点[57]。目前已上市的的GLP-1RAs包括利拉鲁肽(Liraglutide)、艾塞那肽(Exenatide)、利司那肽(Lixisenatide)、阿必鲁肽(Albiglutide)、度拉鲁肽(Dulaglutide)、索马鲁肽(Semaglutide)、贝那鲁肽(Beinaglutide)、聚乙二醇洛塞那肽(PEG-loxenatide)等,而Supaglutide现在临床试验中[58]。此外,GLP-1RAs因其具有神经保护、心血管保护和代谢调节作用,在治疗和预防神经心血管系统疾病、内分泌疾病和代谢性疾病方面具有重要价值。除了降低血糖水平,GLP-1RAs还对多种人体组织有积极的影响,一些研究[58]也表明GLP-1RAs对降低心血管事件风险、肥胖、肝病、多囊卵巢综合征、预防和治疗老年痴呆症、帕金森病及某些肿瘤的治疗有积极作用。
这些药物对T2DM等疾病的治疗益处,引起了人们对它们是否影响骨代谢机制的兴趣[21,59]。一些研究已经证明GLP-1激动剂影响骨转换。有报道称,GLP-1RAs可增强糖尿病患者的骨密度,改善骨质量,预防骨折。细胞和动物实验进一步发现,GLP-1RAs对绝经后骨质疏松、糖皮质激素性骨质疏松和老年性骨质疏松具有极好的潜在抗骨质疏松作用[1,59-60]。一项荟萃分析[61]纳入了38项随机对照试验,共39 795例T2DM患者,结果显示,GLP-1RAs的使用可显著降低患者骨折风险。Zhang等[59]的研究分析了54个GLP-1RAs治疗的T2DM患者,结果显示艾塞那肽治疗可能预防T2DM患者骨折。Montes等[62]也发现,非糖尿病绝经后女性餐后GLP-1水平与骨质疏松风险相关。我国白婧等[63]也有研究发现,利拉鲁肽能够提高2型糖尿病合并骨质疏松患者的骨密度。这些结果为目前用于糖尿病的GLP-1RAs可能成为治疗骨质疏松症的替代药物提供了方向。而在现在的临床实践中,GLP-1RAs能否预防和治疗骨质疏松症和脆性骨折仍存在争议,需投入更多的研究。
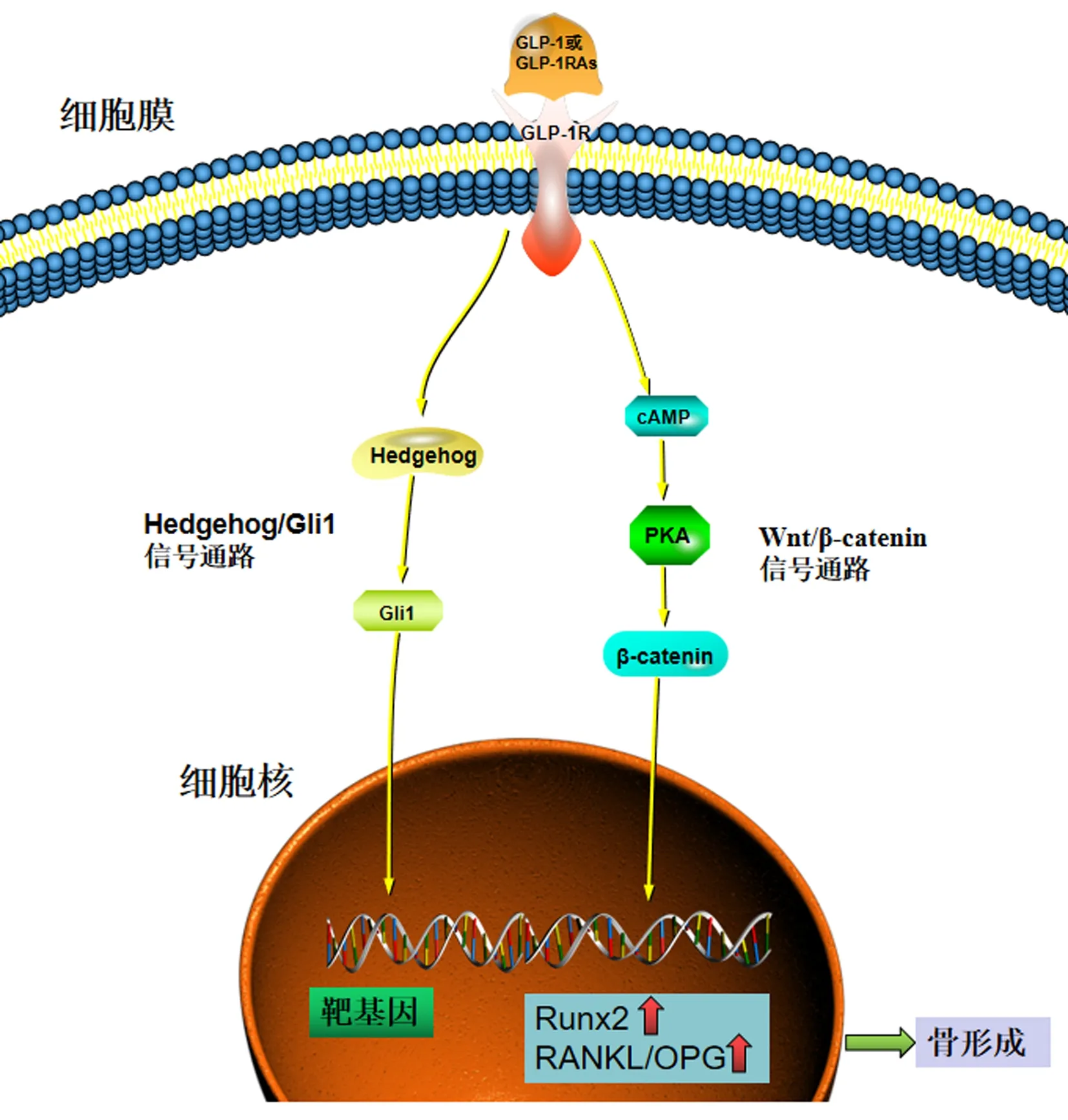
图1 GLP-1在骨质疏松症中的作用Fig.1 The role of GLP-1 in osteoporosis
4 小结与展望
综上所述,GLP-1在骨质疏松症中的影响和机制研究众多,可能通过调节血糖、血脂,改善骨血流,与相关受体结合,刺激降钙素、骨钙素、硬化素分泌,调节信号通路等相关途径延缓骨质疏松的进展。尽管GLP-1对骨折风险和骨质疏松疾病的具体作用尚未得到明确的定义和证明。但随着近年来越来越多的深入研究表明,GLP-1RAs在骨质疏松症治疗领域具有很大的研究潜力。在目前,我们对骨质疏松症的治疗是有限的,但在未来,GLP-1RAs能否作为治疗骨质疏松症的新型药物上市,是一件令人期待的事情。

