脂多糖对小鼠胫骨骨髓去除后早期骨形成的影响
徐伟 黄晨 谢美明 廖冬发
西部战区总医院战创伤救治中心,四川 成都 610083
骨组织是一种不断经历重塑的动态组织,由成骨细胞介导的骨形成和破骨细胞介导的骨吸收两个过程维持其动态平衡[1]。炎症反应与骨稳态维持密切相关[2]。急性炎症疾病如脓毒血症和全身多发创伤可导致骨稳态失衡。在骨髓炎、化脓性关节炎和植入物感染等骨科感染患者中,骨吸收增加和骨形成减少是其重要的病理特征[3]。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要成分。LPS诱导的炎症模型广泛应用于抗炎、免疫、损伤等研究[4]。LPS诱导的炎症模型可以较好的模拟细菌感染过程,其可通过激活破骨细胞中的Toll样受体4 (Toll-like receptor 4, TLR4),导致骨吸收增加,引起骨量丢失和骨破坏[5]。然而,在炎症性疾病中,LPS对骨形成功能的影响存在矛盾和争议,同时,LPS对骨形成的影响机制尚未完全阐明[6-9]。
骨髓去除模型(bone marrow ablation, BMX)是一种损伤诱导的骨髓腔内膜内成骨的实验模型,广泛用于研究相关生长因子或基因在体内骨形成和骨重建中的作用。BMX后的骨形成过程包括血肿形成、间充质细胞迁移增殖、成骨分化、形成新的骨组织,然后破骨细胞重吸收骨组织和骨髓重建过程,一般在BMX术后1周骨形成达到高峰[10]。本研究中,我们通过建立小鼠胫骨BMX模型,观察LPS对BMX后早期骨形成的影响并初步探讨其机制。
1 材料和方法
1.1 实验动物
2月龄雄性SPF级 C57BL/6J小鼠,饲养于西部战区总医院实验动物中心,重量20~25 g。所有实验动物的喂养和取材操作严格按照西部战区总医院实验动物管理委员会许可进行(批准号:2021EC2-07),符合动物实验的伦理要求。
1.2 小鼠胫骨BMX模型制作
参照既往文献报道的方法制作小鼠胫骨BMX模型[10]。简而言之,用戊巴比妥钠(100 mg/kg,腹腔注射)麻醉小鼠后,取左侧膝关节备皮并用碘伏消毒。在膝关节前内侧做5 mm皮肤切口,切开髌腱内侧的关节囊,使髌骨脱位,暴露胫骨平台。采用25号注射针头轻轻扭转,在胫骨平台钻孔,进入骨髓腔。采用27号针头注射器沿着圆孔插入髓腔后,向胫骨髓腔内快速注射3 mL温盐水,去除骨髓。将髌骨复位后,用7-0可吸收缝线缝合关节囊。皮肤用5-0尼龙线缝合。麻醉苏醒后,所有小鼠都可以自由活动,并在手术后自由进食和饮水。
1.3 LPS腹腔注射
BMX术后24 h,实验组小鼠给予一次剂量的LPS(0111:B4,Sigma)腹腔注射(10 mg/kg),对照组给予等量PBS腹腔注射。分别于BMX术后4 d或者7 d取材。
1.4 骨组织苏木精-伊红(HE)染色和形态计量
骨组织HE染色参照文献[11]方法进行。简而言之,胫骨取材后去除肌肉组织,将标本固定于4 %多聚甲醛中24 h,然后采用15 %乙二胺四乙酸进行脱钙2周。脱钙后采用标准流程进行石蜡包埋和切片,然后采用苏木精-伊红(HE)染色液(碧云天)进行染色。
组织形态计量学分析采用OsteoMeasure(OsteoMetrics, USA)软件进行,计量参数按照文献标准[12]进行分析。胫骨中新生骨组织骨体积与组织体积比(bone volume/tissue volume, BV/TV)测量的感兴趣区在胫骨近端生长板下方1.5 mm处测量,长度为1.5 mm。
1.5 免疫组织化学(Immunohistochemistry, IHC)
参照文献[10]方法对胫骨脱钙切片进行IHC染色。本研究使用的特异性抗体如下: b-catenin抗体(1∶200稀释,CST, 9562 S),Runx2抗体(1∶100稀释,Santa Cruz, sc-12488)和PCNA抗体(1∶100稀释,Santa Cruz, sc-25280)。
1.6 实时荧光定量PCR(RT-PCR)
采用Trizol试剂(Invitrogen)从小鼠胫骨干组织区域提取总RNA。采用反转录试剂盒(大连宝生物)合成 cDNA,根据试剂操作手册采用定量 PCR 试剂盒进行定量PCR。所有样本重复3次,采用管家基因(cyclophilinA)为内部参照。定量PCR所用引物如表1。

表1 定量PCR引物Table 1 RT-PCR primers in 5’-3’ direction
1.7 统计学处理
采用 SPSS 25.0软件进行统计学分析,计数资料以均数±标准差表示,所有数据经正态性检验均符合正态分布,采用独立样本t检验,采用Levene方差等同性检验检验方差是否具有齐性,以P<0.05为差异有统计学意义。
2 结果
2.1 成功建立BMX模型
为了排除胫骨干骺端原有骨小梁的干扰,我们选取胫骨干部位进行分析。HE染色显示,未手术组(Control)胫骨干骨髓腔中充满核蓝染的间充质细胞,几乎无骨组织(图1)。BMX术后1周,HE染色显示,胫骨干骨髓腔中大量新生骨组织占满骨髓腔(图1)。上述结果显示BMX诱导的骨形成模型建立成功。
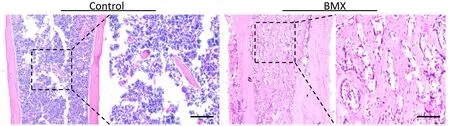
注:BMX后1周,HE染色显示胫骨干骨髓腔中充满新生骨组织,而未手术对照组胫骨干骨髓腔中只有少量骨小梁存在,BMX模型建立成功。bar=100 μm。图1 建立小鼠胫骨BMX模型Fig.1 Establishment of BMX model in mice tibia
2.2 LPS抑制BMX后早期骨形成
为了研究LPS对BMX骨形成的影响,我们对BMX后1周小鼠胫骨取材,进行组织病理分析。HE染色显示,LPS处理后胫骨骨髓腔中新生骨组织较对照组减少(图2A)。进一步采用组织形态计量显示,LPS处理后新生骨组织BV/TV较对照组显著减少(图2B)。上述结果提示LPS抑制BMX后骨形成。
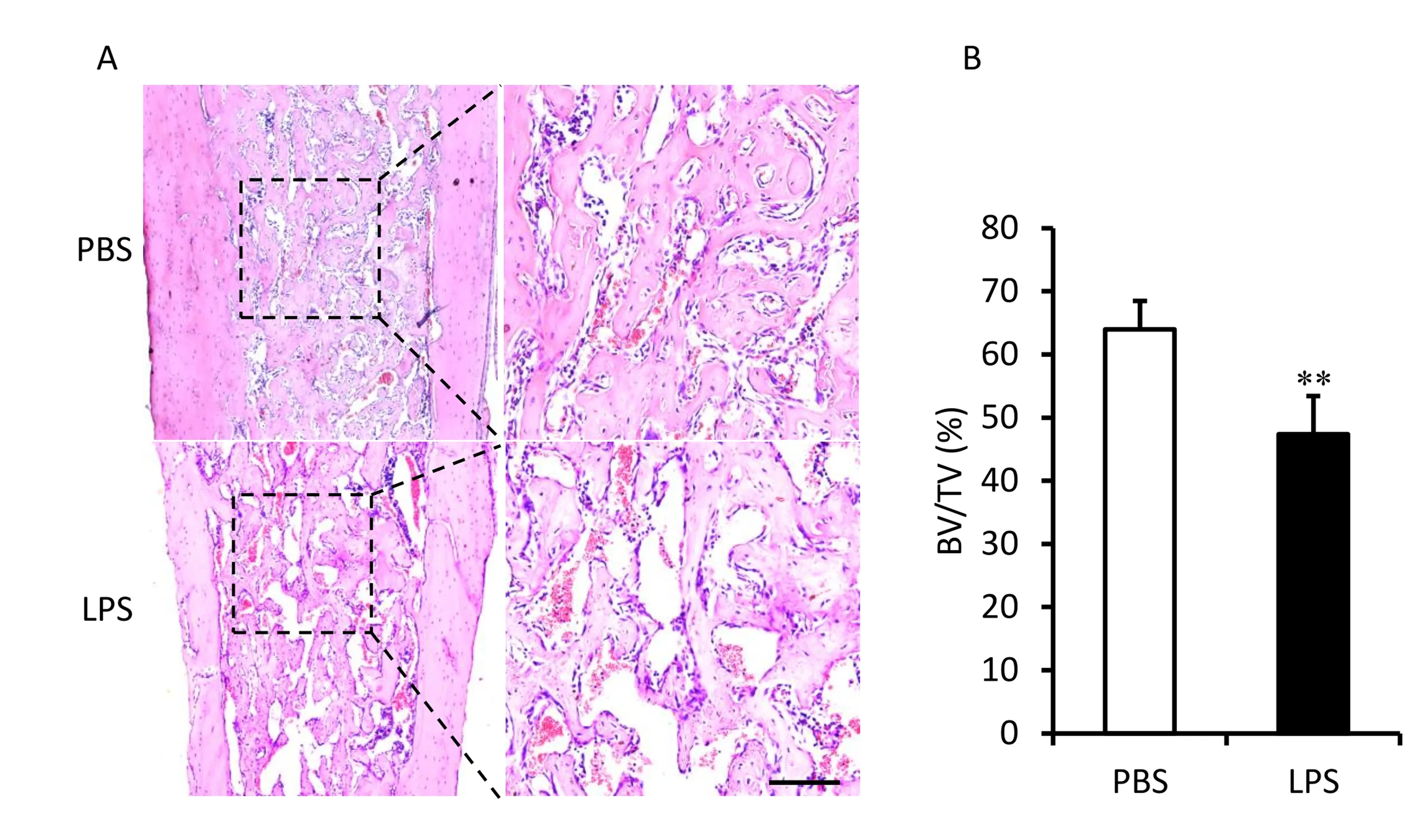
注:A:BMX后1周胫骨干组织病理切片后HE染色,bar=100μm;B:组织形态计量新生骨组织BV/TV。与PBS对照组相比,**P<0.01。图2 LPS抑制BMX后早期骨形成Fig.2 LPS inhibits bone formation after BMX
2.3 LPS抑制BMX后间充质细胞增殖和成骨分化
为了研究LPS引起BMX后骨形成减少的机制,我们首先检测了BMX后第4天骨髓腔中间充质细胞增殖情况。增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)IHC结果显示,LPS处理后PCNA阳性细胞较对照组明显减少(图3A),提示LPS抑制BMX后间充质细胞增殖。
进一步我们研究了LPS对BMX后1周成骨分化功能的影响。IHC结果显示,BMX后1周,LPS处理小鼠新生骨组织中Runx2阳性细胞较对照小鼠明显减少(图3B)。RT-PCR结果显示,BMX后1周,LPS处理小鼠新生骨组织中成骨分化相关标志基因Runx2、Op、Oc和AlpmRNA水平较对照小鼠明显降低(图3C)。上述结果提示,LPS处理可以抑制成骨分化。

注:A:BMX后4 d,PCNA IHC染色和PCNA阳性细胞定量;B:BMX后1周,Runx2 IHC染色和Runx2阳性细胞定量;C:BMX后1周,RT-PCR检测成骨分化相关标志基因Runx2、Op、Oc和Alp mRNA水平。与PBS对照组相比,*P<0.05,***P<0.001,bar=50 μm。图3 LPS抑制BMX后间充质细胞增殖和成骨分化Fig.3 LPS inhibits mesenchymal cells proliferation and osteogenic differentiation after BMX
2.4 LPS 抑制BMX后经典的Wnt/β-catenin信号
β-catenin IHC结果显示,BMX后1周,LPS处理小鼠新生骨组织中β-catenin阳性细胞数量较对照小鼠明显减少。RT-PCR结果显示,LPS处理小鼠新生骨组织中Wnt/β-catenin信号通路下游靶基因Lef1、Tcf1、CD44 和CyclinD1 mRNA水平较对照小鼠明显降低。上述结果提示,LPS 抑制了经典的Wnt/β-catenin信号。
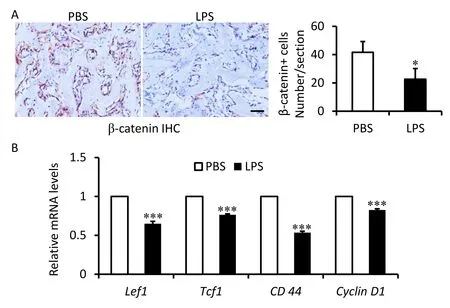
注:A:BMX后1周,β-catenin IHC染色和β-catenin阳性细胞定量。B:BMX后1周,RT-PCR检测新生骨组织中Wnt/β-catenin信号通路下游靶基因Lef1、Tcf1、CD 44 和Cyclin D1 mRNA水平。与PBS对照组相比,*P<0.05,***P<0.001,bar=50 μm。图4 LPS 抑制BMX后经典的Wnt/β-catenin信号Fig.4 LPS inhibits canonical Wnt/β-catenin signaling after BMX
3 讨论
慢性炎症性疾病如化脓性关节炎、骨髓炎和骨科内固定物感染中的过度骨吸收和骨破坏部分是由细菌感染诱导的炎症反应引起[13]。LPS是革兰氏阴性菌细胞壁的一种可以诱导炎症的糖脂质成分,已被证实是革兰氏阴性菌诱导骨破坏的介质[14]。一般情况下,LPS及LPS诱导的细胞因子可直接增强破骨细胞功能,增加骨吸收。然而,LPS对成骨细胞功能的影响以及在骨形成中的作用存在争议[5]。本研究中,我们采用BMX模型,研究LPS对骨形成的作用。我们发现LPS可以在体内抑制间充质细胞增殖,抑制成骨分化,导致BMX后早期骨形成减少。进一步机制研究发现,LPS抑制了BMX后经典的Wnt/β-catenin信号通路。
骨髓炎的特征性病理表现是骨重建失衡和骨量丢失,但同时也存在着过度的新骨形成[14]。有研究发现细菌感染引起的炎症反应通常会导致骨溶解和骨愈合受损,但矛盾的是,它也有促进骨形成的作用[15]。在人类内毒素血症患者中血清骨形成生物标志物I型前胶原N末端前肽水平升高[8]。Xing等[9]在体外研究中发现,LPS可以促进人牙周膜干细胞的成骨分化。而Nogueira等[16]研究发现LPS处理不影响大鼠胫骨钻孔模型中的骨形成和骨愈合过程。在体外实验中,低浓度LPS可以促进人BMSCs增殖和成骨分化,而高浓度LPS则抑制其增殖和成骨分化[17]。在成骨前体细胞(MC3T3-E1)中,LPS通过JNK通路诱导其凋亡,抑制其成骨分化[18]。LPS可以抑制BMP-2诱导的BMSCs成骨分化[19]。在体内实验中,Yang等[5]研究发现,LPS可以时间依赖性的抑制小鼠骨形成。腹腔内或局部注射LPS都会导致骨形成减少,导致骨愈合延迟[6-7]。造成上述结果不一致的可能原因与各研究中使用的材料和研究手段等不同有关。BMX是目前比较公认的可以在短时间内研究骨形成和骨重塑相关过程的模型。我们的研究发现LPS可以抑制BMX后早期的成骨分化和骨形成。
Wnt/β-catenin信号通路在成骨分化和骨形成中发挥着重要的作用[20]。近期有研究报道LPS与Wnt/β-catenin信号通路相互串话进而调节成骨细胞功能。Guo等[18]研究发现,LPS处理前成骨细胞系后,可以降低Wnt3a和β-catenin蛋白水平,升高GSK3β蛋白水平,进而抑制其成骨分化。而Xing等[9]研究发现,LPS可以通过激活Wnt/β-catenin信号通路,促进人牙周膜干细胞的成骨分化。在本研究中我们发现,BMX后1周,LPS处理小鼠新生骨组织中β-catenin阳性细胞较对照小鼠降低,Wnt/β-catenin信号通路下游相关靶基因表达降低。我们的结果提示LPS可能通过负向调节Wnt/β-catenin信号通路,从而抑制成骨分化,引起BMX后早期骨形成减少。
本研究中,我们仅探讨了LPS对BMX后早期(BMX后1周)骨形成的影响,LPS对BMX后晚期(BMX后2周和3周)骨形成的影响需进一步研究。同时,既往研究[17]报道,体外实验中LPS对BMSC的成骨分化和增殖影响具有剂量依赖性,LPS在体内对BMX后骨形成的影响是否具有剂量依赖性,需要进一步研究。本研究结果仅基于单个剂量和单个时间点,对相关机制的研究还不够深入,后续我们将采用不同剂量的LPS处理小鼠,观察不同剂量LPS对BMX后骨形成的影响。
综上所述,我们的研究结果显示,LPS处理可以抑制间充质细胞的增殖和成骨分化,导致BMX后早期骨形成减少,Wnt/β-catenin信号通路可能参与LPS抑制BMX后早期骨形成的过程。上述研究结果将深化我们对LPS及其与Wnt/β-catenin信号相互串话在骨形成中的作用,为寻找骨感染后促进骨再生的生物治疗提供了实验依据。

