睾丸Clock基因下调后小鼠精子前向运动百分率降低的机制
王禹蒙 成姝婷 后望 骆芷寒 代泽咏 江舟 肖静 汪宇辉 郭慧玲 刘延友
(四川大学华西基础医学与法医学院·国家卫生健康委员会时间生物学重点实验室,四川 成都 610041)
近日节律是生物体为适应周期变化的自然环境而产生的重要生理机制[1]。研究证明,近日节律系统与包括人类在内的哺乳动物的生殖具有十分密切的关系。为了更好的生存,物种通过漫长的进化将繁殖时间优化在具有温和天气的季节与充足的食物供应期内[2],这需要近日节律系统对昼夜长度变化以及环境温度变化具有精确的检测能力[3]。Clock(Circadian locomotor output cycles kaput)基因作为一种核心近日钟基因也在男性生殖中具有重要的作用[4]。不仅Clock 19/ 19突变可导致雄性小鼠生殖力受损,睾丸Clock基因表达量的下调也可显著降低雄性小鼠的生殖能力[5-6]。在本实验室前期研究中,发现特异性敲降小鼠睾丸Clock基因后,雄鼠子代数量显著减少可能是由于顶体蛋白酶活性降低而引起的受精率低下所致[7]。此外,我们还观察到睾丸Clock基因敲降后小鼠精子的前向运动百分率显著降低。精子的前向运动(Progressive motility,PR)是指精子细胞能够积极地以线性方式或者大直径圆周方式向前运动[8],是反映精子运动能力的一个重要指标,精子颈段或者尾段出现缺陷会导致精子细胞的前向运动能力受损,从而使精子难以突破雌性生殖道内不利的环境[9]。作为男性不育的一个可能因素,精子前向运动与Clock基因的关系研究报道尚少。本研究从小鼠睾丸组织的超微结构和睾丸Clock基因敲降小鼠精子差异蛋白功能聚类出发,探讨睾丸Clock基因对精子结构的影响以及可能的调节机制,为今后研究近日节律系统与男性生殖系统的关系提供一些思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级ICR雄性小鼠(8周龄)14只,购自成都达硕实验动物有限公司。所有小鼠随机分为实验组和对照组,每组6只,另2只小鼠作为免疫共沉淀实验样本。小鼠饲养于25℃ 12L:12D的光暗循环箱中,自由进食饮水。正式实验前小鼠先经过一周的环境适应。本研究经过医院伦理委员会审核通过。
1.1.2 实验试剂 Clock干扰质粒和阴性对照质粒(广州复能基因有限公司);细菌质粒提取试剂盒(美国OMEGA);Polyplusin vivo-jetPEI体内转染试剂(法国,Polyplus Transferion);Clock敲降shRNA慢病毒[云舟生物科技(广州)有限公司];组织RNA提取试剂盒(成都福际生物技术有限公司);RNA逆转录试剂盒、RT-qPCR试剂盒(南京诺唯赞生物科技股份有限公司);小鼠α-KGDH酶联反应分析试剂盒(江苏酶免实业有限公司);Protein A+G磁珠(上海碧云天生物技术有限公司);CLOCK Rabbit mAb(美国,Cell Signaling Technology);CD274 Polyclonal Antibody(爱必信(上海)生物科技有限公司);DLD Polyclonal Antibody(中国,Proteintech Group);电镜固定液(美国,ThermoFisher Scientific);其它试剂为国产分析纯,引物合成于上海生工生物工程股份有限公司。
1.1.3 主要仪器设备 实时荧光定量PCR仪(美国,Bio-Rad technologies);超微量紫外-可见光分光光度计Nanodrop One(美国,ThermoFisher);低温高速台式离心机(德国,Eppendrof);全波长酶标仪(MD,美国);PCR仪(杭州博日科技有限公司);微量注射器和手术器械等均为国产。
1.2 实验方法
1.2.1 获得质粒转染后睾丸样本 本实验采用脂质体包裹质粒后注射到睾丸的瞬时转染方法得到睾丸Clock基因下调的小鼠模型,由于该干扰质粒敲降效果在注射转染后第3 d达到峰值,故在第3 d获取睾丸样本。使用腹腔注射4%水合氯醛方式麻醉小鼠,每只小鼠注射10%水合氯醛200 μL,按照Polyplus in vivo-jetPEI体内转染试剂说明书,分别将Clock干扰质粒和阴性对照质粒的质粒-脂质体混合物用微量注射器注射入两组小鼠双侧睾丸中。继续饲养3 d后,颈椎脱臼法处死小鼠,撕开小鼠腹部皮肤后摘取双侧睾丸。去除睾丸鞘膜及白膜后即刻切取一侧睾丸中段放入室温的电镜固定液,将剩余的睾丸组织-80℃冷冻保存待检。
1.2.2 透射电镜检查 睾丸组织在电镜固定液中30 min后,将变硬的组织取出用手术刀切为薄片,再次放入电镜固定液中4℃固定3 h。装有睾丸样本的容器采用冰袋冷藏运输的方式送至武汉塞维尔生物科技有限公司完成制片和透射电镜扫描成像。
1.2.3 小鼠Clock基因下调睾丸的精子蛋白组 数据再分析实验室前期曾对小鼠Clock基因下调睾丸的精子进行了蛋白组检测,我们将其差异表达基因(DEGs)数据导入DAVID在线分析工具(https://david.ncifcrf.gov/summary.jsp)进行GO和KEGG的功能富集分析,其中GO包括BP(生物学功能)、CC(细胞组分)和MF(分子功能)。所得结果按照假阳性率(FDR)<0.001进行筛选。根据筛选结果选择关键基因进行后续验证。
1.2.4 实时荧光定量PCR(RT-qPCR)检测 每只雄鼠样本取出约100 mg-80℃冷冻的睾丸组织,液氮冷冻研磨成粉,并用组织RNA提取试剂盒按提取组织总RNA。使用Nanodrop One检测总RNA的浓度与纯度,并以RNA逆转录试剂盒将其逆转录为cDNA。使用RT-qPCR试剂盒对睾丸中的Clock基因和Dld基因表达量进行检测。实时荧光定量PCR仪系统设置如下:95℃ 5 min预变性;95℃ 10sec/60℃ 30sec循环反应(共40个循环);仪器默认程序采集溶解曲线。引物序列如下:ClockForward:ATGGTGTTTACCG TAAGCTGTAG,ClockReverse:CTCGCGTTACCA GGAAGCAT;Dld Forward:CGATGGCAGCACTC AGGTTA,Dld Reverse:CTGAACCCAGTTCCACA CCA;GapdhForward:TGCGACTTCAACAGCAAC TC,GapdhReverse:ATGTAGGCAATGAGGTCCAC。
1.2.5 酶联免疫吸附测定(ELISA) 每只雄鼠样本取出约1 g -80℃冷冻的睾丸组织,加入9 mL PBS缓冲液在冰上进行匀浆;转移匀浆液至离心管中,4℃ 2500 rpm离心20 min,去除上清液,收集沉淀;用PBS缓冲液洗涤沉淀3次后,在冰上使用超声破碎仪进行细胞破碎(设置工作2 s,冷却30 s),破碎后液体在4℃ 2500 rpm离心20 min,收集上清液用于α-KGDH活性的ELISA检测。按照小鼠α-KGDH酶联反应分析试剂盒说明书步骤进行上样、加酶、洗涤显色等操作,并以酶标仪450 nm波长测量吸光度。每个样本设置3复孔。
1.2.6 免疫共沉淀 将冷冻于-80℃的雄鼠睾丸组织样本取出约500 mg,液氮冷冻研磨后,加入600μL RIPA:PMSF=100:1蛋白裂解液裂解组织并收集裂解液。将Protein A+G磁珠解冻并取两管各20 μL,分别使用1×TBS清洗3次。将500 μL CLOCK Rabbit mAb抗体工作液和500 μL CD274 Polyclonal Antibody 抗体工作液分别与两管20 μL磁珠悬液混合,分别标记为“CLOCK”与“IgG”。将蛋白裂解液与“IgG”标记的磁珠-抗体混和液共同4℃孵育1 h,磁性分离后取上清液。然后将上清液再与“CLOCK”标记的磁珠抗体混合液共同4℃孵育过夜。孵育完成后将混合液95℃水浴加热5 min后磁性分离,取上清液使用DLD Polyclonal Antibody进行Western blot实验以定性检测样本中是否存在DLD蛋白。
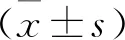
2 结果
2.1 实验组睾丸Clock基因被有效敲降 通过RT-qPCR,以Gapdh为内参检测实验组和对照组雄鼠睾丸组织中Clock基因的mRNA表达量。与对照组相比,实验组Clock基因的表达显著降低(P<0.001),说明我们获取的实验组雄鼠睾丸组织中的Clock基因在mRNA水平被成功降低了,见图1。

图1 实验组与对照组睾丸组织Clock基因相对表达量
2.2 实验组精子超微结构中线粒体出现异常对于透射电镜所展示出的两组睾丸切片组织中的超微结构,发现位于精子尾部中段的线粒体结构有异。实验组睾丸精子中多处线粒体之间出现较大间隙(见图2A),且有双层排布现象(见图2C),这些线粒体大小不均,有部分甚至出现明显固缩现象(见图2B、图2C);而对照组精子线粒体结构及排布未见明显异常(见图2D)。两组睾丸组织中精子尾部轴丝的“9+2”微管结构均未见异常。

图2 实验组与对照组小鼠睾丸精子尾部中段电镜图
2.3 DEGs的功能注释再分析结果 利用本实验室前期检测所得的小鼠Clock基因下调睾丸的精子蛋白组数据进行了生物信息学再分析。通过DAVID在线功能注释工具,我们将筛选出的差异蛋白的DEGs显著富集聚类到了5条CC条目(见图3A)和3条BP条目(见图3B)中,MF则未能富集到条目。DEGs在8条KEGG条目中显著富集(见图3C),包括:氨基酸生物合成(Biosynthesis of amino acids)、碳代谢(Carbon metabolism)、抗生素生物合成(Biosynthesis of antibotics)、代谢通路(Metabolic pathways)、乙醛酸盐与双羧酸代谢(Glyoxylate and dicarboxylate metabo-lism)、丙酮酸代谢(Pyruvate metabolism)、柠檬酸循环(TCA cycle)和糖酵解/糖异生(Glycolysis/Gluco-neogenesis)。在富集程度最显著的TCA循环通路中,我们选择关键差异蛋白DLD作后续验证。

图3 DEGs GO CC BP KEGG Pathway富集气泡图(FDR<0.001)
2.4 两组睾丸α-KGDH酶活性比较 由于DLD为α-KGDH的关键亚基,通过ELISA检测,测量了两组小鼠睾丸组织中的α-KGDH活性。实验组小鼠睾丸组织样本中的α-KGDH活性(24.263±2.933)U/L与对照组(29.666±4.505)U/L比较显著降低(P<0.05)。
2.5 两组睾丸Dld基因mRNA水平比较 通过RT-qPCR,对两组小鼠睾丸组织中Dld基因mRNA水平进行了检测。相对于对照组小鼠,实验组的Dld基因表达量也出现了明显的降低(P<0.05),见图4。

图4 实验组与对照组睾丸组织Dld基因相对表达量
2.6 CLOCK蛋白与DLD蛋白能够相互作用 在小鼠睾丸组织样本CLOCK蛋白沉淀产物中检测到了DLD蛋白存在,说明CLOCK蛋白与DLD蛋白存在相互作用,见图5。

图5 小鼠睾丸组织CLOCK蛋白与DLD蛋白Co-IP结果
3 讨论
本实验室前期研究发现,敲降雄性小鼠睾丸Clock基因不仅会因其精子顶体蛋白酶活性降弱而导致受精率降低,其精子的前向运动百分率也受到了影响[10]。前向运动率过低的精子活动能力较弱,可能导致精子难以完成正常的受精作用,从而在一方面导致不育的发生[11]。支持精子活动的能量由ATP提供,精子内的ATP由糖酵解和氧化磷酸化形成。糖酵解主要发生部位位于精子尾部鞭毛,但供能较少。大部分ATP的产生均由尾部中段线粒体中的氧化磷酸化产生[12-13],有研究人员推测,具有更大体积尾部中段的精子具有更高的线粒体密度,这可以使精子的运动能力提升[14]。由此可推测,精子颈部及尾部的结构变化均可能导致能量代谢的异常,于是我们通过透射电镜观察以求证实Clock基因低表达对精子结构可能造成的影响。
本实验在使用siRNA干扰质粒下调小鼠睾丸Clock基因的表达后,以透射电镜的方法对该组小鼠的睾丸组织超微结构进行了观察。结果发现,该组睾丸组织内精子细胞的线粒体结构出现异常,主要表现为精子尾部中段的线粒体排列混乱、部分线粒体出现双层排列、空泡化和萎缩,线粒体腔内有凋亡小体形成。线粒体是为精子供能的主要细胞器,精子细胞中大约 15%~22% 的总体积被线粒体占据[15]。精子线粒体功能的缺陷会严重损害精子所需的能量产生,并且可能是弱精子症的潜在原因[16]。
为了研究睾丸Clock基因低表达引起睾丸内精子线粒体结构和排列发生异常的原因,将实验室前期研究所得的睾丸Clock基因敲降小鼠的精子蛋白组数据进行了再挖掘。将这些数据的DEGs整理后通过DAVID在线分析工具进行了GO和KEGG条目的聚类富集,并以FDR<0.001对富集结果进行了筛选。结果发现,这些DEGs的细胞组分大多来自精子纤维鞘、纤毛、线粒体等,这与我们电镜结果显示的精子超微结构异常相符,而BP的结果提示这些DEGs可能会影响到糖代谢,这也就提示了该线粒体可能不仅存在结构的异常,其功能可能受到了影响。KEGG的富集结果更是强烈提示三羧酸循环的信号通路存在异常,因此我们查看了参与此信号通路的DEGs,结果发现了三羧酸循环限速酶之一的α-KGDH复合体的一个亚基组成蛋白DLD。α-KGDH作为物质与能量代谢中十分重要的一个酶复合体,其在TCA循环与氨基酸代谢中均起着关键调控的作用[17-19]。另外由于在TCA循环中α-KGDH能将酮戊二酸在NAD+与CoA的作用下催化为琥珀酰CoA[20-21],由此也对表观遗传中蛋白质琥珀酰化具有关键的调节作用。推测Clock基因可能是通过对α-KGDH酶活性的调节而影响线粒体的代谢产能的。接下来,检测了实验组小鼠睾丸中α-KGDH的酶活性,发现确实比对照组出现了明显的降低。我们又在实验组小鼠睾丸组织中验证了Dld基因转录本水平的降低,这与前期蛋白组结果数据中DLD的变化趋势相一致。因此,Clock基因很可能可以通过对Dld基因转录的调节而影响DLD蛋白的表达量。那么,Clock基因是否还能够影响DLD蛋白的功能呢?为此,我们还以免疫共沉淀的方法研究了CLOCK蛋白与DLD蛋白的相互作用。结果表明CLOCK蛋白与DLD蛋白在自然情况下确实存在相互作用。
4 结论
睾丸Clock基因对于精子线粒体的形态及功能有着重要的调节作用。睾丸Clock基因的下调会导致精子线粒体超微结构的异常,并通过对DLD蛋白表达量和功能的调节影响α-KGDH的酶活性,最终导致小鼠精子因线粒体三羧酸循环异常而出现前向运动百分率降低。
——一道江苏高考题的奥秘解读和拓展

