NGF中和抗体、DAPT对食管癌Eca109细胞p75NTR核表达及细胞增殖、侵袭能力的影响
邓江华,李秋实,朱兵兵,陈晶晶,慕晓玲
食管癌(esophageal cancer,EC)一直以来都因其高发病率和死亡率而备受关注,据2020年统计数据显示,其发病率居全球癌症发病的第7位,死亡率居第6位[1]。肿瘤干细胞理论的提出以及近年来的研究进展为食管癌的靶向治疗提供了新途径。
p75神经营养因子受体(p75 neurotrophin receptor,p75NTR)可作为食管癌的肿瘤标志物,同时也是神经生长因子(nerve growth factor,NGF)的受体。本课题组李秋霞 等[2]发现食管癌Eca109细胞不仅表达且自分泌NGF,并通过对比NGF处理前后p75NTR在Eca109细胞及细胞球中的核表达变化,推断NGF促进了p75NTR向细胞核转移。本研究将继续探讨NGF中和抗体、γ-分泌酶抑制剂3,5-二氟苯乙酰-L-丙氨酰-S-苯基甘氨酸-t-丁酯(3,5-difluorophenylacetyl-L-alanyl-S-ph -enylglycine-t-butyl ester, DAPT)对Eca109细胞p75NTR核表达的影响,用NGF处理所有Eca109细胞,同时单独或联合使用NGF中和抗体、DAPT处理,通过分析p75NTR、Ki67的表达变化,进一步证实NGF和γ-分泌酶对p75NTR向细胞核转移的促进作用,并探究NGF中和抗体、DAPT对Eca109细胞增殖能力和侵袭能力的影响。
1 材料与方法
1.1 材料人食管鳞癌Eca109细胞(中国科学院上海细胞库);高糖DMEM培养液、胎牛血清(fetal bovine serm,FBS)、磷酸盐缓冲液(PBS)、含乙二胺四乙酸(EDTA)的胰蛋白酶(美国Gibco公司);青链霉素混合液(双抗)(上海索莱宝生物科技有限公司);4′,6-二脒基-2-苯基吲哚(DAPI)核染色液、DAPT(美国Sigma公司);外源性重组人NGF、小鼠抗人Ki67单克隆抗体、兔抗人NGF单克隆抗体、兔抗人p75NTR单克隆抗体(英国Abcam公司);山羊抗兔 IgG-FITC二抗、山羊抗鼠IgG-TRITC二抗(北京中杉金桥生物技术有限公司);CCK-8试剂盒(日本同仁化学研究所);1.2 μm孔径Matrigel Matrix基质胶(美国BD公司);24孔Transwell小室(美国Millipore公司)。
1.2 方法
1.2.1细胞准备 Eca109细胞接种于含10%FBS和1%双抗的DMEM高糖培养基,于37 ℃、5%CO2培养箱内培养。培养24~48 h期间,用普通光学显微镜观察细胞生长状态,选取对数生长期的细胞用于实验。
1.2.2免疫荧光细胞化学检测 取对数生长期的细胞,以外源性重组人NGF(100 ng/ml)处理细胞6 h,对于使用NGF中和抗体、DAPT单独或联合处理细胞,则是在加入外源性重组人NGF(100 ng/ml)的基础上分别加入NGF中和抗体(兔抗人NGF单克隆抗体,1 ∶2 500)、DAPT(10 μmol/L)以及联合加入NGF中和抗体(1 ∶2 500)和DAPT(10 μmol/L),均处理24 h。用含EDTA的胰蛋白酶消化,1 000 r/min 离心5 min,再用含10%FBS和1%双抗的DMEM高糖培养基重悬细胞后进行细胞计数,细胞以8×103个/ml浓度滴加在放有盖玻片的6孔板中,置于37 ℃、5%CO2培养箱中进行细胞爬片,24 h后取出盖玻片进行固定以及封闭。用稀释好的一抗(兔抗人p75NTR单克隆抗体、小鼠抗人Ki67单克隆抗体,均为1 ∶100)充分覆盖进行孵育,4 ℃过夜。次日复温后用PBS泡洗(泡洗3次,每次3 min),滴加稀释好的荧光二抗(山羊抗兔IgG-FITC、山羊抗鼠IgG-TRITC,均为1 ∶100),室温孵育2 h后再用PBS泡洗(泡洗3次,每次3 min),DAPI染色10 min,用PBS泡洗(泡洗3次,每次3 min),封片后在激光共聚焦显微镜下观察着色部位及荧光强度。
1.2.3CCK-8法检测细胞增殖情况 按照CCK-8试剂盒说明书进行操作,将细胞用含EDTA的胰蛋白酶消化,1 000 r/min离心5 min,稀释成1×105个/ml浓度,按每孔100 μl接种至96孔板,单独或联合加入NGF、NGF中和抗体和DAPT,并设空白组(未作任何处理),置于37 ℃、5%CO2培养箱中,分别于24、48、72 h滴加CCK-8工作液(每孔10 μl),孵育2 h。酶标仪450 nm处检测各孔吸光度(optical density,OD)值,对结果进行记录、统计,并描绘细胞增殖曲线。
1.2.4Transwell细胞侵袭实验 用无血清的DMEM高糖培养基稀释基质胶(基质胶 ∶培养基=1 ∶8),稀释后的工作液加入上室面,4 ℃条件下晾干。吸弃残余培养基,各孔均加入60 μl含有10 g/L BSA的无血清培养基,37℃作用30 min。用无血清培养基将细胞密度调为1×105/ml,取100 μl加入上室,下室加入600 μl含有20%FBS的培养基,去除气泡,放入培养箱,48 h后取出Transwell小室,弃去上室内的培养基和基质胶,用棉签拭去上室残留的细胞,特别是边缘,将棉签弄尖沿壁转一圈,4%多聚甲醛固定20 min。0.1%结晶紫染色后用PBS洗去残留染液,每个小室在显微镜下选取上、下、左、右、中5个200×视野的细胞,对显色细胞进行计数。对于单独或联合应用NGF、NGF中和抗体和DAPT处理的细胞,则是预先加入处理剂培养24 h,再进行Transwell细胞侵袭实验。
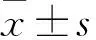
2 结果
2.1 NGF、NGF中和抗体和DAPT对Eca109细胞p75NTR、Ki67表达的影响结果显示,两种蛋白在细胞上均有表达,其中Ki67荧光在NGF处理前后均位于细胞核;p75NTR荧光在NGF处理前,位于细胞核的数量很少,主要位于细胞质,在NGF处理后,p75NTR荧光位于细胞核的数量增多,见图1。

图1 NGF对Eca109细胞p75NTR、Ki67、DAPI表达的影响 ×200
此外,为了进一步观察NGF中和抗体、DAPT对p75NTR核表达的影响,课题组在用NGF处理所有Eca109细胞的同时,单独或联合加入NGF中和抗体、γ-分泌酶抑制剂DAPT处理后检测p75NTR、Ki67的表达定位。结果显示,NGF中和抗体、γ-分泌酶抑制剂DAPT处理后,p75NTR和Ki67在细胞中均有表达,与NGF中和抗体、DAPT处理前相比,Ki67荧光在Eca109细胞中仍全都位于细胞核,p75NTR荧光位于细胞核的数量均减少,且NGF中和抗体和DAPT联合使用后,p75NTR荧光位于细胞核的数量最少,差异有统计学意义(F=106.074,P<0.001),见图2、3。

图2 NGF联合NGF中和抗体、DAPT对Eca109细胞p75NTR、Ki67、DAPI表达的影响 ×200

图3 p75NTR核定位表达统计结果A:NGF组;B:NGF+NGF中和抗体组;C:NGF+DAPT组;D:NGF+NGF中和抗体+DAPT组;与NGF组比较:***P<0.001,****P<0.000 1;与NGF+NGF中和抗体+DAPT组比较:##P<0.01
2.2 NGF中和抗体、DAPT对Eca109细胞增殖能力的影响CCK-8法检测结果显示,NGF中和抗体、DAPT对Eca109细胞的增殖能力均有抑制作用,且使用NGF中和抗体和DAPT联合处理细胞,其抑制作用较单独使用更强,差异有统计学意义(F=52.261,P<0.001),见图4。

图4 NGF中和抗体、DAPT对Eca109细胞增殖能力的影响与空白组比较:***P<0.001;与NGF中和抗体+DAPT组比较:##P<0.01
此外,为了进一步观察在NGF作用下,NGF中和抗体、DAPT对Eca109细胞增殖能力的影响,用NGF处理所有Eca109细胞,同时单独或联合使用NGF中和抗体、DAPT处理细胞,结果显示,Eca109细胞的增殖能力同样被抑制,且NGF中和抗体和DAPT联合处理的抑制作用较单独使用也更强,差异有统计学意义(F=148.086,P<0.001),见图5。

图5 NGF作用下NGF中和抗体、DAPT对Eca109细胞增殖能力的影响与NGF组比较:***P<0.001;与NGF+NGF中和抗体+DAPT组比较:##P<0.01
2.3 NGF中和抗体、DAPT对Eca109细胞侵袭能力的影响Transwell细胞侵袭实验结果显示,经NGF中和抗体、DAPT处理后,穿膜细胞数量明显减少,因细胞侵袭能力的大小与穿膜细胞数量呈正相关,即经NGF中和抗体、DAPT处理后,Eca109细胞的侵袭能力降低,且使用NGF中和抗体和DAPT联合处理细胞,其抑制作用较单独使用更强,差异有统计学意义(F=63.13,P<0.001),见图6。
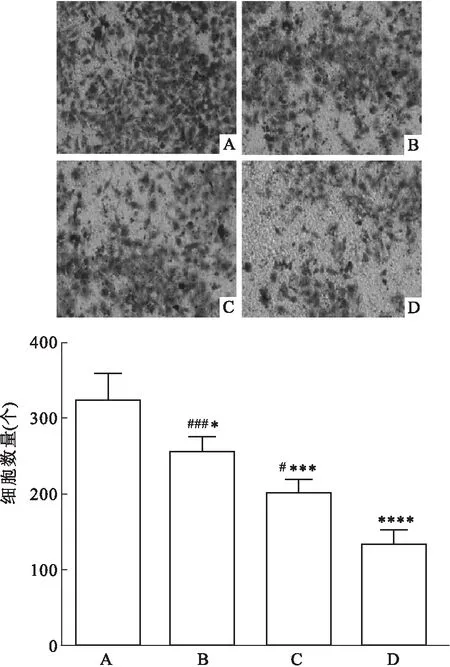
图6 NGF中和抗体、DAPT对Eca109细胞侵袭能力的影响 ×200A:空白组;B:NGF中和抗体组;C:DAPT组;D:NGF中和抗体+DAPT组;与空白组比较:*P<0.05,***P<0.001,****P<0.000 1;与NGF中和抗体+DAPT组比较:#P<0.05,###P<0.001
同样地,用NGF处理所有Eca109细胞,同时单独或联合使用NGF中和抗体、DAPT处理细胞,结果显示,Eca109细胞的侵袭能力同样降低,且NGF中和抗体和DAPT联合使用的抑制作用较单独使用也更强,差异有统计学意义(F=52.191,P<0.001),见图7。

图7 NGF作用下NGF中和抗体、DAPT对Eca109细胞侵袭能力的影响 ×200A:NGF组;B:NGF+NGF中和抗体组;C:NGF+DAPT组;D:NGF+NGF中和抗体+DAPT;与NGF组比较:**P<0.01,****P<0.000 1;与NGF+NGF中和抗体+DAPT组比较:#P<0.05
3 讨论
NGF发挥作用的途径是与其两种受体结合,分别是酪氨酸激酶(tyrosine kinase,TrkA)受体和p75NTR[3]。其中,NGF能诱导p75NTR的裂解,伴随γ-分泌酶调控的膜内部裂解而释放p75NTR的胞内结构域,并以γ-分泌酶依赖的方式促进其胞内结构域的核转移[4]。p75NTR目前已被鉴定为食管癌干细胞的标志物,在食管癌中,与不表达p75NTR的癌细胞相比,表达p75NTR的癌细胞具有较高的自我更新和增殖能力,且癌症的存活和维持依赖于p75NTR的表达。表达p75NTR的癌细胞显示出干细胞相关基因表达量的增加[5]。本课题组前期研究[6-7]中,以无血清成球培养法富集食管癌Eca109干细胞样细胞,发现p75NTR核阳性表达的Eca109细胞球表现出食管癌干细胞的某些特性,且随着细胞球p75NTR核阳性表达率的增加,其表现的干细胞特性增强,由此建立了p75NTR的核表达情况与食管癌干细胞的联系,即p75NTR核表达阳性的食管癌细胞可能为食管癌干细胞。
近年来,NGF在肿瘤领域所发挥的作用受到越来越多的关注。在人神经胶质瘤中,NGF可以促进脑肿瘤起始细胞增殖,并且NGF中和抗体可以抑制脑肿瘤起始细胞的增殖[8];在乳腺癌组织中,NGF及其受体TrkA出现异常的高表达[9];在胰腺癌组织中,NGF的表达水平远高于正常组织,且NGF对胰腺癌细胞的生长作用取决于TrkA和p75NTR表达量的水平以及它们之间的比率[10]。肿瘤细胞是通过自分泌和旁分泌NGF,促进自身细胞增殖,在乳腺癌、胰腺癌中已经研究确切。本课题组前期已发现食管癌Eca109细胞表达且自分泌NGF,在使用NGF处理细胞后检测p75NTR的表达变化,发现NGF促进了p75NTR的核转移[2]。本研究继续探讨NGF中和抗体对p75NTR核转移的影响,进一步证实了课题组前期的发现。
本研究基于前期实验结果,应用NGF处理食管癌Eca109细胞,同时单独或联合使用NGF中和抗体、DAPT处理细胞,结果显示,NGF可以促进p75NTR的核转移,NGF中和抗体、DAPT处理Eca109细胞后,Eca109细胞中p75NTR核阳性率明显降低,其增殖、侵袭能力也相应被抑制,且NGF中和抗体与DAPT联合使用较单独使用的抑制作用更强。总之,NGF中和抗体、DAPT均可抑制p75NTR的核转移,降低Eca109细胞的增殖、侵袭能力。
DAPT,γ-分泌酶的小分子抑制剂,因其有效的抗癌作用获得广泛关注。包括DAPT能有效减少乳腺导管内原位癌(ductal carcinoma in situ,DCIS)诱导的细胞球形成[11];DAPT可阻断NGF介导的脑肿瘤起始细胞的增殖[8]。Wang et al[12]发现,侵袭性脑胶质瘤中,p75NTR发生可调控的膜内蛋白水解,促进肿瘤的迁移和侵袭,而γ-分泌酶抑制剂的使用可明显抑制该作用。同样地,在结肠癌、子宫颈癌中也有相关报道[13-14]。因此,γ-分泌酶可能是癌症中潜在的广泛治疗靶标。然而,目前γ-分泌酶抑制剂对食管癌的影响的相关报道仍较少。
基于肿瘤干细胞理论,现已初步明确NGF在维持肿瘤干细胞未分化状态方面发挥着关键作用。Tomellini et al[15]在探究NGF及其前体proNGF对乳腺癌干细胞的影响中,发现NGF或proNGF是以增加静止/慢增殖的肿瘤干细胞对称分裂的数量来富集乳腺癌干细胞,其受体p75NTR通过调控多能性转录因子,介导乳腺癌干细胞的自我更新,证实NGF/proNGF-p75NTR轴在调控乳腺癌干细胞的自我更新方面起着关键作用。本实验证实,在食管癌中,NGF-p75NTR轴同样参与调控食管癌干细胞的自我更新,但具体NGF-p75NTR轴发挥作用的机制及p75NTR核转移的方式尚不清楚,有待进一步研究。

