自噬激活在抑制丙泊酚诱导的神经元凋亡中的作用
梅 静,喇宏玲,徐桂萍
随着医疗水平的进步,越来越多老龄患者选择手术治疗。虽然不少老人原发疾病成功治愈,但术后认知功能障碍发生率正不断增加[1]。严重影响了老年患者生存状态和生活质量。丙泊酚是一种临床常用的镇静、麻醉药物,具有起效快、易于控制剂量、无明显蓄积等优点。但已有不少文献[2-3]报道丙泊酚在老龄患者的应用中常引起术后认知功能障碍,其涉及机制主要为海马区神经元凋亡。
神经元凋亡是细胞程序性死亡方式,神经元自噬是细胞自我分解代谢过程。凋亡与自噬信号调控之间存在复杂的交织,自噬过度激活或抑制都可能造成细胞凋亡[4]。已有研究[5-6]显示,神经元自噬与凋亡都分别参与了丙泊酚诱导的大鼠术后认知功能障碍的过程。因此,该研究探讨自噬的激活与抑制对丙泊酚诱导的神经元凋亡的影响。
1 材料与方法
1.1 主要试剂和仪器丙泊酚乳状注射液(100 mg/10 ml,批号:2019050901,西安立邦制药有限公司);丙泊酚原料药(10 mmol/L,批号:HY-294057,纯度≥99.0%,美国MCE公司);雷帕霉素(10 mmol/L,批号:HY-3501-2196,纯度≥99.0%,美国MCE公司);氯喹(25 g,批号:018J5342,纯度≥99.0%,美国Sigma公司);PI/Annexin V染色试剂盒(美国Thermo公司);TUNEL染色试剂盒(德国Roche公司);鼠源单克隆Anti-mTOR抗体、兔源多克隆Anti-Beclin-1、鼠源单克隆Anti-Bcl-2抗体、兔源多克隆Anti-Bax(武汉三鹰生物技术有限公司);兔源单克隆重组Anti-LC3抗体、兔源单克隆重组Cleaved-caspase-3抗体(美国Abcam公司);鼠源单克隆Anti-β-actin抗体、HRP标记山羊抗鼠/兔IgG(H+L)(上海碧云天生物技术有限公司)。流式细胞仪(型号:Cyto Flex,贝克曼库尔特生命科学公司);生物显微镜(型号:BX53,日本Olympus公司);电子透射显微镜(型号:CX7 Pro,美国Thermo公司);显影仪(型号:5100R,上海天能生物技术公司)。
1.2 试验方案
1.2.1离体试验 取2×106个原代神经元接种于96孔板中,分为对照组、丙泊酚组、雷帕霉素组、氯喹组。二甲氧唑黄比色法[2,3-Bis-(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilide,XTT]检测不同浓度丙泊酚对细胞活力的影响,流式细胞术检测100 μmol/L雷帕霉素与20 μmol/L氯喹干预对丙泊酚诱导细胞凋亡的改善作用,Western blot检测自噬与凋亡蛋白表达。
1.2.2在体试验 32只老龄大鼠,雄性,SPF级,12月龄,体质量500~600 g,由新疆医科大学动物试验中心提供。适应性喂养1周,随机分为对照组、丙泊酚组、雷帕霉素组与氯喹组。取非对照组大鼠,腹腔注射丙泊酚乳状注射液,剂量100 mg/kg,持续1周。大鼠麻醉期间,雷帕霉素组大鼠连续1周注射雷帕霉素,剂量50 mg/kg,氯喹组大鼠连续1周注射氯喹,剂量10 mg/kg。接下来,Morris水迷宫检测大鼠认知功能,TUNEL 染色检测大鼠海马神经元凋亡,电子透射显微镜观察细胞内自噬小体数量,Western blot检测自噬与凋亡相关蛋白表达。
1.3 原代神经元提取与给药取E16~18孕鼠,解剖后获得胎鼠,解剖出完整大脑,分离去除软膜、血管。取海马组织,用眼科剪反复剪切成碎块,消化,以培养基混悬,取40 μm筛网过滤制成单细胞悬液。离心收集沉淀,加入培养基,取6孔板每孔接种约1×107细胞。培养3~4 d后,0.25%胰酶消化后用于后续检测。
1.4 XTT检测取加药处理完成的细胞,每孔加入100 μl 含PMS的XTT染色液,37 ℃避光孵育2 h,在酶标仪450 nm波长处测定吸光度值(absorbance value, A)。细胞凋亡比例=(A对照孔-A试验孔)/(A对照孔-A背景孔)×100%
1.5 流式细胞术取加药处理完成的细胞,胰蛋白酶消化细胞,PBS洗涤,加入PI与Annexin V染色液,避光孵育5 min。流式细胞仪检测PI与Annexin V阳性细胞表达比例。
1.6 Morris水迷宫试验Morris水迷宫试验分为训练期与测试期。训练期将大鼠自各个象限依次放入水中,自由游泳寻找逃生平台(位于第Ⅲ象限),共90 s。若大鼠登上站台,则记录这段时间为逃避潜伏期。若大鼠90 s内无法登上平台则引导至平台,记逃避潜伏期为90 s,连续训练4 d。第5天开展测试,撤去逃生平台,将大鼠放入水中,自由探索90 s,记录大鼠游泳速率,首次穿越逃生平台象限时间,穿越逃生平台次数及90 s内在第Ⅲ象限中停留时间占比。
1.7 TUNEL 染色取大鼠心脏灌流,取脑组织,4%多聚甲醛固定,4 ℃储存备用。取脑组织梯度乙醇脱水,石蜡包埋,切成厚度3~5 μm切片,PBS清洗,加入含0.5% Triton X-100的PBS孵育5 min。取切片滴加蛋白酶K孵育15 min,PBS清洗。滴加TUNEL反应混合液,37 ℃避光孵育60 min。PBS清洗,滴加streptavidin-HRP工作液,避光孵育30 min。PBS清洗,滴加DAB显色液,室温孵育3 min终止。生物显微镜下观察,深棕色染色细胞为TUNEL阳性细胞。
1.8 高尔基染色取大鼠海马组织,在齿状回区截取约1 mm3组织,固定在预冷的2.5%戊二醛中,4 ℃储存。次日,PBS洗涤,以预冷的1%锇酸固定2 h,再以PBS洗涤,梯度丙酮脱水。以丙酮/环氧树脂复合物浸透包埋组织,37 ℃下过夜。修块后使用超薄切片机将组织切成60~80 nm超薄切片,最后应用5%醋酸铀浸润0.5~1 h,枸橼酸铅染色5~10 min,双蒸水清洗后封片。利用电子透射显微镜观察各组细胞内溶酶体与自噬小体数量。
1.9 Western blot收集细胞与大鼠脑组织样本,匀浆后裂解收集蛋白,煮沸变性后冷冻保存。制备SDS-PAGE电泳凝胶,等量样品上样。电泳条件设为4 ℃、30 V / 30 min,100 V / 60 min,当上样缓冲液达到凝胶底部则终止。通过湿法将凝胶上目标蛋白转移至PVDF膜上,转膜条件设为4 ℃、2 mA / 60 min。取PVDF膜放入封闭液中封闭2 h,4 ℃孵育一抗抗体稀释液(1 μg/ml)过夜。次日PBST清洗条带,以二抗稀释液(0.5 μg/ml)室温孵育2 h。PBST清洗PVDF膜,PVDF膜上滴加ECL超敏发光液,通过显影仪显影获得目的蛋白发光条带。

2 结果
2.1 自噬激活改善丙泊酚诱导神经元凋亡随着丙泊酚浓度增加,原代神经元细胞活力不断下降。由于丙泊酚浓度为50 μmol/L时,细胞活力降低至(82.85±2.97)%,而当浓度达到100 μmol/L时,细胞活力降低至(65.94±3.36)%。本研究接下来细胞试验中选择丙泊酚剂量为50 μmol/L。流式细胞术检测显示,对照组神经元Annexin V+/ PI+(Q1)区几乎没有凋亡细胞。在丙泊酚干预下,与对照组相比,神经元Q1区凋亡细胞占比增加(P<0.001)。然而,在雷帕霉素干预下,Q1区凋亡细胞比例降低(P<0.001)。与此同时,氯喹干预虽然提高了丙泊酚诱导原代神经元细胞凋亡,但差异无统计学意义(P>0.05)。见图1。

图1 原代神经元中细胞凋亡检测结果A:XTT检测不同浓度丙泊酚对原代神经元的影响;B:Annexin V+/ PI+(Q1)区量化统计结果;C:流式细胞术检测自噬对丙泊酚诱导原代神经元的影响;与对照组比较:###P<0.001;与丙泊酚组比较:***P<0.001
2.2 自噬激活减少了原代神经元中凋亡相关蛋白表达与对照组相比,丙泊酚干预造成细胞凋亡,适应性调节了自噬相关蛋白的表达,其中LC3 Ⅱ/LC3 Ⅰ与Beclin-1表达增加(P<0.001)。但是,这无法逆转丙泊酚造成的神经元凋亡。因此,丙泊酚组中Cleaved-caspase-3、Bax表达增加(P<0.001),且Bcl-2表达减少(P<0.001)。此外,与丙泊酚组相比,雷帕霉素干预进一步提高了LC3 Ⅱ/LC3 Ⅰ (P<0.001)与Beclin-1表达(P<0.01),且凋亡相关蛋白Cleaved-caspase-3、Bax表达减少(P<0.001),且Bcl-2表达增加(P<0.01)。与此同时,丙泊酚、氯喹对p-mTOR蛋白表达的影响很小,且与丙泊酚组相比,氯喹的干预降低了LC3 Ⅱ/LC3 Ⅰ (P<0.05)与Beclin-1表达(P<0.001),但对凋亡相关蛋白表达没有影响。见图2。

图2 原代神经元中LC3 Ⅱ/LC3 Ⅰ、p-mTOR、Beclin-1、Cleaved-caspase-3、Bcl-2、Bax蛋白表达与对照组比较:##P<0.01, ###P<0.001;与丙泊酚组比较:*P<0.05, **P<0.01, ***P<0.001
2.3 自噬激活改善丙泊酚诱导大鼠学习记忆功能障碍Morris水迷宫训练中,随着大鼠训练次数增加,各组逃避潜伏期都出现了降低。自第3天起,与对照组相比,丙泊酚组大鼠逃避潜伏期增加(P<0.05),且在第4天,与丙泊酚组相比,雷帕霉素组大鼠逃避潜伏期减少(P<0.05)。然而,与丙泊酚组相比,氯喹组大鼠逃避潜伏期相似。在测试中,各组大鼠游泳速率没有改变,与对照组相比,丙泊酚组大鼠首次到达平台时间增加(P<0.01),在第Ⅲ象限停留时间(P<0.01)与穿越平台次数减少(P<0.05)。与丙泊酚组相比,雷帕霉素组大鼠首次到达平台时间减少(P<0.01),且第Ⅲ象限停留时间占比增加(P<0.05)。与此同时,氯喹对大鼠水迷宫测试相关指标没有影响。见表1、2。

表1 各组大鼠水迷宫训练期间逃避潜伏期时长比较

表2 各组大鼠水迷宫测试期间游泳速率、首次到达平台时间、第Ⅲ象限停留时间占比与穿越平台次数比较
2.4 自噬激活的大鼠神经元细胞中自噬小体数量增加大鼠海马神经元高尔基染色显示,与对照组相比,丙泊酚组中自噬小体数量没有变化。与丙泊酚组相比,雷帕霉素组自噬小体数量增加,且氯喹组自噬小体数量减少。见图3。

图3 各组大鼠脑组织海马神经元中自噬小体数量 ×10 000A:对照组;B:丙泊酚组;C:雷帕霉素组;D:氯喹组;红色箭头:自噬小体
2.5 自噬激活改善丙泊酚诱导大鼠海马神经元凋亡大鼠海马神经元TUNEL染色显示,与对照组相比,丙泊酚组与氯喹组中TUNEL染色阳性细胞数量增加(P<0.001),与丙泊酚组相比,雷帕霉素组TUNEL染色阳性细胞数量减少(P<0.01),且氯喹组阳性细胞数量无明显变化,差异无统计学意义(P>0.05)。见图4。
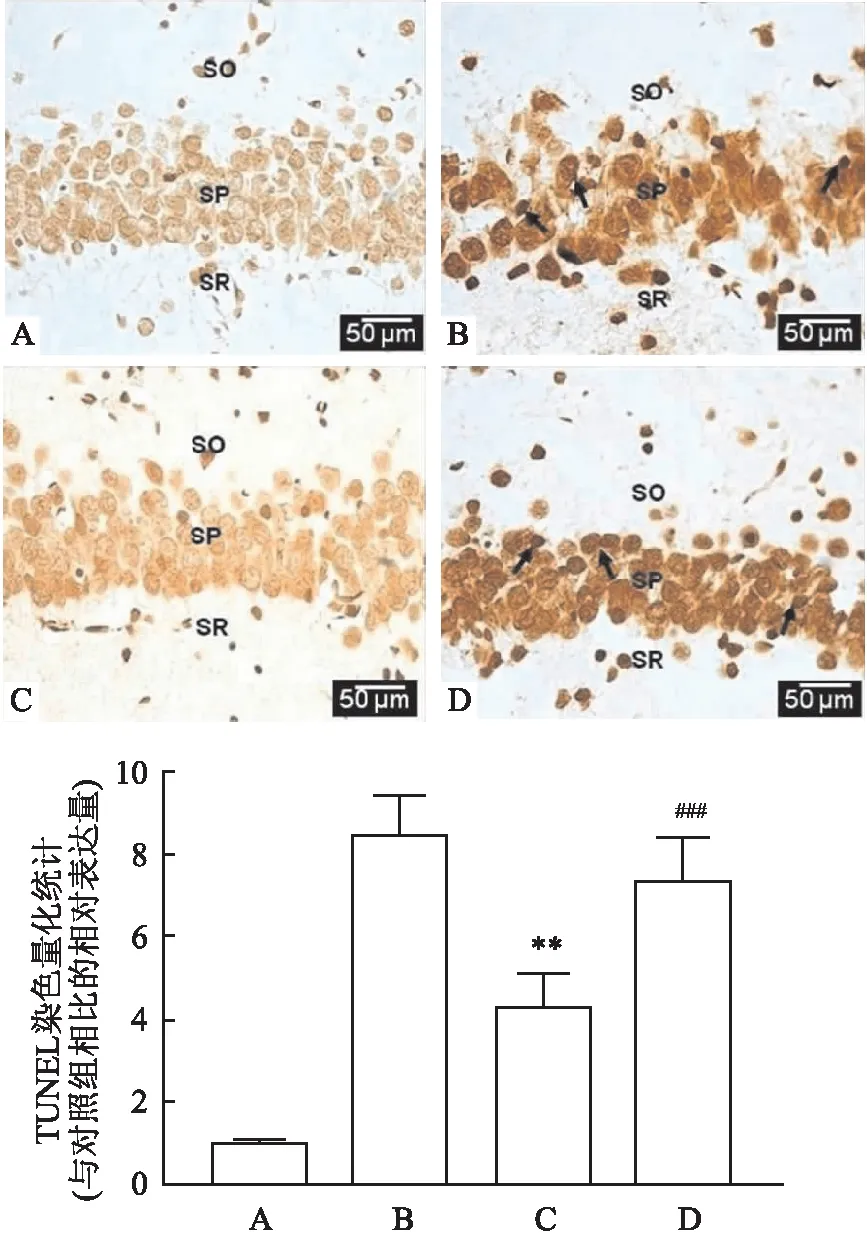
图4 各组大鼠海马CA1区神经元TUNEL染色与量化统计 ×200A:对照组;B:丙泊酚组;C:雷帕霉素组;D:氯喹组;SO:定向层;SP:锥体层;SR:辐射层;与对照组比较:###P<0.001;与丙泊酚组比较:**P<0.01
2.6 自噬激活减少丙泊酚诱导大鼠海马神经元凋亡相关蛋白表达与对照组相比,丙泊酚和氯喹对p-mTOR表达没有影响,但雷帕霉素降低了p-mTOR表达水平(P<0.001)。与对照组相比,丙泊酚组LC3 Ⅱ/LC3 Ⅰ与Beclin-1表达没有变化,且丙泊酚组中Cleaved-caspase-3、Bax表达增加(P<0.001),Bcl-2表达减少(P<0.001)。与丙泊酚组相比,雷帕霉素干预提高了LC3 Ⅱ/LC3 Ⅰ (P<0.001)与Beclin-1表达(P<0.01),而凋亡相关蛋白Cleaved-caspase-3、Bax表达减少(P<0.001),且Bcl-2表达增加(P<0.001)。此外,与丙泊酚组相比,氯喹干预后的细胞内LC3 Ⅱ/LC3 Ⅰ、Beclin-1与凋亡相关蛋白表达没有改变。见图5。
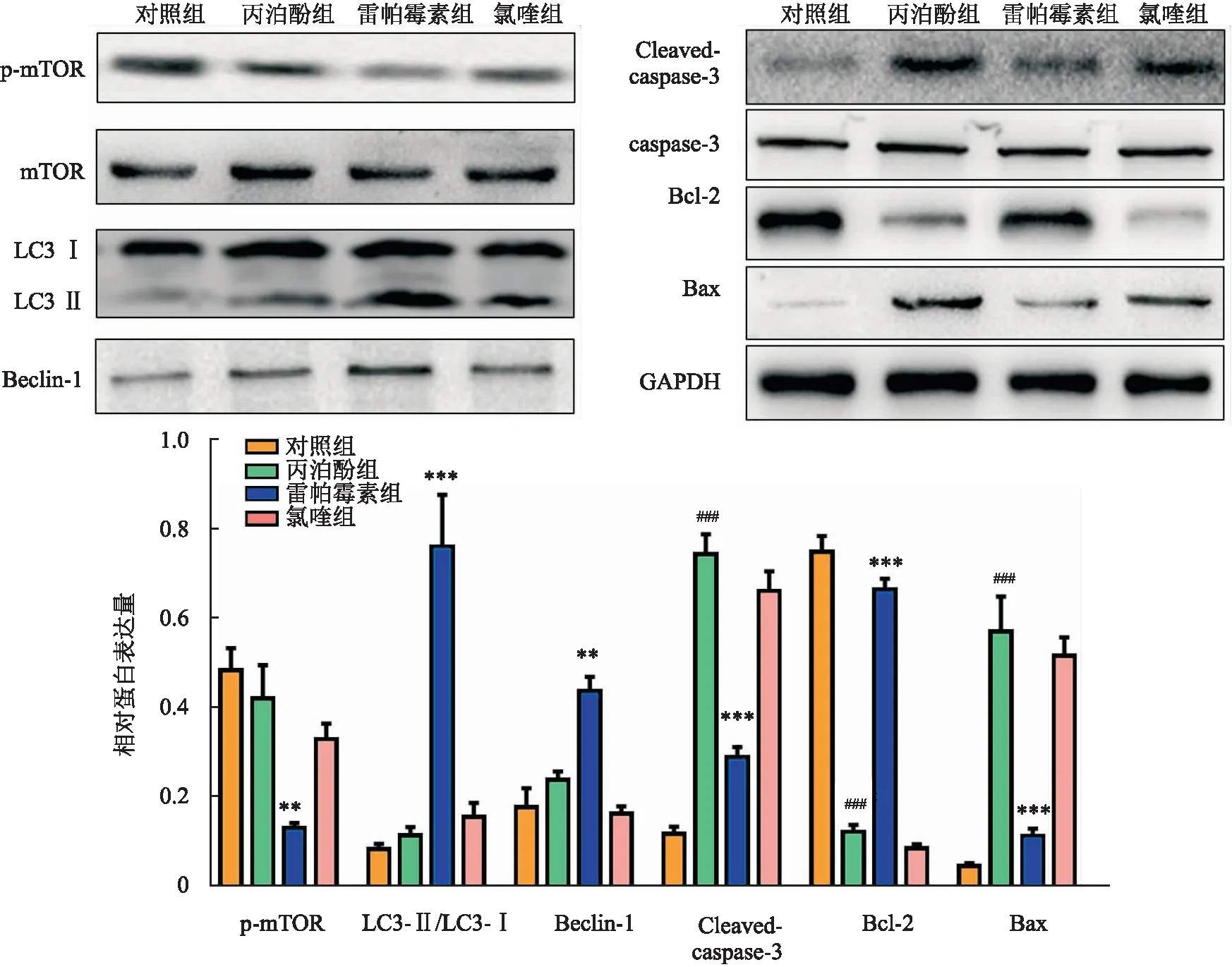
图5 各组大鼠脑组织中LC3 Ⅱ/LC3 Ⅰ、p-mTOR、Cleaved-caspase-3、Bcl-2、Bax 表达与对照组比较:###P<0.001;与丙泊酚组比较:**P<0.01, ***P<0.001
3 讨论
术后认知功能障碍是一种老龄患者常见的全麻手术并发症,老龄患者中,全麻手术后1周内术后认知功能障碍发生率高达25%,部分患者症状会持续到术后3个月[7]。丙泊酚是一类临床常用的麻醉诱导剂,具有诱导迅速、苏醒迅速、剂量易控制且对血液循环影响低的优点[8]。然而,不少研究[2-3]显示丙泊酚会引起患者或试验动物认知功能障碍。本研究以丙泊酚多次麻醉大鼠,通过Morris水迷宫分析大鼠认知功能,评价大鼠行为学习与空间记忆能力。结果显示,训练期间,丙泊酚组大鼠逃避潜伏期比对照组延长,且在第5天测试中,丙泊酚组大鼠在第Ⅲ象限停留时间占比与穿越平台次数减少。因此,本研究中大鼠术后认知功能障碍模型构建成功。与此同时,本研究显示,自噬激动剂雷帕霉素治疗后降低了丙泊酚麻醉小鼠逃避潜伏期。此外,相关研究[9-10]显示丙泊酚可以通过减少氧化应激反应改善大鼠认知功能,本研究与之相悖,其原因可能是文献中丙泊酚作为治疗药物使用,剂量较低,发挥了中枢神经保护作用。与本研究中低剂量丙泊酚正向调节原代海马神经元细胞活力的结果相一致。
海马是哺乳动物学习与记忆的重要区域,海马区神经元凋亡是大鼠认知功能损伤的主要原因[11]。Li et al[12]研究在20月龄老年大鼠中,以100 mg/kg丙泊酚麻醉诱导,再以50 mg/kg麻醉维持3 h,造成大鼠术后1~2周内出现了明显的认知功能障碍。屠海军 等[13]研究也有显示,在2月龄成年大鼠中,300 mg/kg丙泊酚麻醉会降低大鼠海马组织内谷氨酸含量,并升高γ-氨基丁酸水平,导致大脑神经元正常兴奋难以维继,最终造成神经元凋亡,出现认知功能障碍。这些研究证实了丙泊酚会损伤大鼠海马神经元。本研究结果显示,丙泊酚可使离体原代神经元细胞活力降低。大鼠海马神经元中,TUNEL染色结果显示,丙泊酚组大鼠海马出现神经元凋亡。在此过程中,无论是离体原代神经元还是海马区神经元,都伴随着凋亡蛋白Cleaved-caspase-3与Bax表达增加,且抑凋亡蛋白Bcl-2表达减少。然而,在自噬诱导剂雷帕霉素的干预下,凋亡蛋白Cleaved-caspase-3与Bax表达减少,抑凋亡蛋白Bcl-2表达增加。
自噬是通过形成自噬小体将细胞内异常蛋白或受损细胞器包裹,与溶酶体融合,最终通过溶酶体将自噬底物降解,以获得能量循环,维持细胞稳态的一种生理活动。LC3本是自由散布于细胞质中,在一系列酶促作用下定位于自噬体膜上,并向LC3 Ⅱ转变,调节自噬小体的形成。由于LC3 Ⅱ是特异性分布的自噬体泡膜上的蛋白,所以LC3 Ⅱ/LC3 Ⅰ 比值可作为自噬体形成数量多少的指标[14]。Beclin-1是自噬的正向调节因子,与Ⅲ型磷脂酰肌醇三磷酸激酶(PI3K)结合后可促进自噬的发生[15]。雷帕霉素是一种自噬激动剂,通过抑制mTOR蛋白磷酸化诱导自噬的发生[16]。而自噬抑制剂氯喹则是通过抑制PI3K表达,减少PI3K与Beclin-1形成复合物,从而阻断自噬的发生[17]。本研究结果显示,丙泊酚虽然造成神经元凋亡,但自噬相关蛋白表达增加,这可能是机体出现损伤后的适应性保护行为。雷帕霉素治疗则诱导自噬相关蛋白LC3 Ⅱ/LC3 Ⅰ与Beclin-1表达增加,自噬小体数量增加,抑制了神经元凋亡。然而,氯喹对丙泊酚诱导后神经元凋亡没有影响,甚至存在部分加剧的情况。这提示激活自噬都能够有效减少神经元凋亡。
综上所述,丙泊酚不仅诱导了神经元凋亡,还启动了机体代偿性的自噬功能。虽然丙泊酚激活自噬的原因仍有待探讨,但抑制mTOR信号则是激活自噬的最有效途径。因此,以mTOR抑制剂雷帕霉素干预抑制了mTOR信号活化,提高了细胞自噬水平,并改善了神经元凋亡。

