靶向B细胞成熟抗原在多发性骨髓瘤中的治疗进展*
刘佳慧 邱录贵 安刚
多发性骨髓瘤(multiple myeloma,MM)是克隆性浆细胞异常增殖性疾病,随着蛋白酶体抑制剂(protease inhibitors,PIs)、免疫调节剂(immunomodulatory drugs,IMiDs)、CD38 单抗和自体造血干细胞移植等在临床上的应用,MM 患者生存获得较大的改善,但多数患者终会复发或变成难治性,MM 目前仍是一种无法治愈的疾病。B 细胞成熟抗原(B cell maturation antigen,BCMA)在恶性浆细胞中高表达,在正常组织细胞(除浆细胞和部分成熟B 细胞)和CD34+干/祖细胞上不表达,这使得其成为MM 的靶向位点[1]。目前,许多靶向BCMA 的免疫治疗包括嵌合抗原受体(chimeric antigen receptor,CAR)-T 细胞、双特异性抗体(bispecific antibodies,BsAbs)和抗体药物偶联物(antibod-drug conjugate,ADC)已进入临床试验阶段,使得复发/难治性MM(relapsed/refractory MM,RRMM)患者的缓解率和生存得到进一步提高。本文就近年来MM 靶向BCMA 免疫治疗的研究进展进行综述。
1 靶向BCMA 的CAR-T 细胞治疗
CAR-T 细胞治疗是将患者或健康人群的T 细胞在体外通过基因工程技术进行嵌合抗原受体修饰(包括胞内激活区和共刺激区域、跨膜区、胞外的铰链区和抗原结合区),进而靶向特异癌细胞表面抗原,以介导杀伤肿瘤作用。靶向BCMA 的CAR-T 细胞治疗的临床研究也相继在RRMM 患者中开展,见表1。
1.1 bb2121 和bb21217
bb2121(ide-cel)是由美国BMS 和Bluebird Bio公司共同开发的携带4-1BB 共刺激信号结构域和鼠单链可变区片段(single-chain fragment variable,scFv)的靶向BCMA CAR-T 细胞。根据RRMM 患者的Ⅰ期剂量递增及扩展(CRB-401)临床试验数据显示,62例患者中,总客观缓解率(objective response rate,ORR)达75.8%,严格意义上的完全缓解(stringent complete response,sCR)率/完全缓解(complete response,CR)率为38.7%,疗效随着输注剂量的增多而提高。总体安全性可控,细胞因子释放综合征(cytokine release syndrome,CRS)总发生率为75.8%,大部分为1~2 级,仅6.5% 为3 级CRS;神经毒性发生率为44%,基本为1~2 级[2]。bb2121 在RRMM 中的Ⅱ期临床试验(KarMMa)共纳入128 例患者,平均随访时间为13.3个月,总体ORR 达到73%(94/128),sCR/CR 达到33%(42/128),26%(33/128)患者获得微小残留病(minimal residual disease,MRD)10-5阴性,中位缓解持续时间(median duration of response,mDOR)为11.3 个月,中位无进展生存期(median progression-free survival,mPFS)为12.1 个月[3]。随后,研究者在bb2121 离体培养过程中添加了PI3K 抑制剂bb007,以增加记忆样T 细胞,降低高分化或衰老T 细胞的比例,并且改良形成了bb21217。CRB-402 是bb21217(150×106、300×106或 450×106)的Ⅰ期剂量递增研究,在接受治疗的69 例RRMM 患者中,总体ORR 达68%,sCR/CR 达29%,mDOR 为17 个月,且该研究证实了记忆样T 细胞的增多与CAR-T 细胞扩增的峰值及mDOR 成正相关[4],目前该项目招募结束,正在进一步随访中。
1.2 JNJ-4 528(cilta-cel;LCAR-B38M)
JNJ-4 528(cilta-cel;LCAR-B38M)是由南京传奇公司开发的针对2 个不同BCMA 表位(VHH1 和VHH2)的第二代CAR-T 细胞产品,旨在提高靶向亲和力。中国多中心Ⅰ期临床试验(LEGEND-2)结果显示,57 例RRMM 患者的总体ORR 达88%,CR 达74%(42/57),且92.9% 的CR 患者MRD(8 色流式)检测呈阴性。90%的患者发生CRS,其中7%的患者为3 级CRS[5]。在美国正在进行的Ⅰb/Ⅱ期临床研究(CARTITUDE-1)结果也显示,97 例RRMM 患者总体ORR 达97.7%,其中sCR 为 83%,61 例MRD 可评估的患者中,92% 达MRD(10-5)阴性。2 年PFS 率和总生存(overall survival,OS)率分别为60.5%和74.0%,sCR 患者的2 年无进展生存(progression-free survival,PFS)率为71%,单药、低剂量的JNJ-4 528 即可引起早期、深度且持续的缓解[6]。目前,cilta-cel 正在不同的MM 患者队列中做进一步研究[CARTITUDE-2(NCT04133636)],包括初治MM 患者和不同类型RRMM 患者,如治疗线数≤3 线、既往接受过靶向BCMA 治疗的RRMM 患者等。
1.3 ALLO-715
ALLO-715 是首个同种异体靶向BCMA 的CART 细胞,该CAR-T 细胞破坏了TCRα 恒定基因[降低移植物抗宿主病风险(graft versus host disease,GvHD)]和CD52 基因(允许抗CD52 单抗ALLO-647 进行选择性和长期宿主淋巴清除术),此外还增加了利妥昔单抗识别区(必要时在体内清除CAR-T 细胞,提高安全性)。Ⅰ期剂量递增临床试验(universal)初步结果显示,ALLO-715 安全性可控,无GvHD 和神经毒性事件的发生,CRS 均为1 ~2 级。31 例RRMM 患者总体ORR 为33.3%,相较于其他自体CAR-T 细胞,疗效略差,异体CAR-T 细胞的治疗还有待于进一步技术的革新来提高总体疗效[7]。
1.4 GC012F
GC012F 是全球首个基于FasT CAR 技术、同时靶向BCMA 和CD19 的CAR-T 细胞产品,可同时兼顾骨髓瘤细胞及其前体细胞。FasT CAR 技术可将CAR-T 细胞激活、转导和扩展3 个步骤转变为单个“并发激活-转导”步骤,制备时间从2~6 周缩短至22~36 h。上海长征医院报道了Ⅰ期剂量递增临床试验的初步结果,16 例RRMM 患者总体ORR 为93.8%,在最高剂量水平组ORR 和CR 率均为100%,且在MRD 可评估的患者中,3 个月(n=11)和6 个月(n=10)时的MRD 均为阴性,所有患者均发生CRS,其中12.5%(2/16)的患者为3 级CRS;未观察到任何级别的神经毒性[8]。GC012F 较其他类型CAR-T 细胞的显著优势是其高效的制备工艺极大缩短了患者的等待期,对于侵袭性较强的RRMM 患者有利。该临床试验仍在招募中。
1.5 其他类型的BCMA CAR-T 细胞
其他类型的BCMA CAR-T 细胞目前也处于临床试验中(表1)[9-16],很多研究中心在尝试技术上的革新来进一步增加其通用性、有效性、持久性和安全性:PBCMA-101 通过应用高比例的干细胞记忆T 细胞和非病毒载体平台(piggyBacDNA 修饰系统)构建CART 细胞,旨在提高效能的同时将毒性降低[10];FHVHBCMA-T 包含完全人源纯重链结合域(FHVH33),其仅有人重链的抗原识别域,无接头或轻链结构域,旨在降低免疫原性、提高其在体内持久性[12];FCARH、JCARH125、MCARH171、HRAIN BCMA-T 也通过增加安全靶点-截短的表皮生长因子受体(EGERt)来增加其在患者体内应用的安全性[13-16]。总体看,靶向BCMA CAR-T 细胞治疗疗效较好,ORR 达70%~100%,为RRMM 患者的治疗带来希望。

表1 BCMA CAR-T 细胞疗法在研最新数据汇总
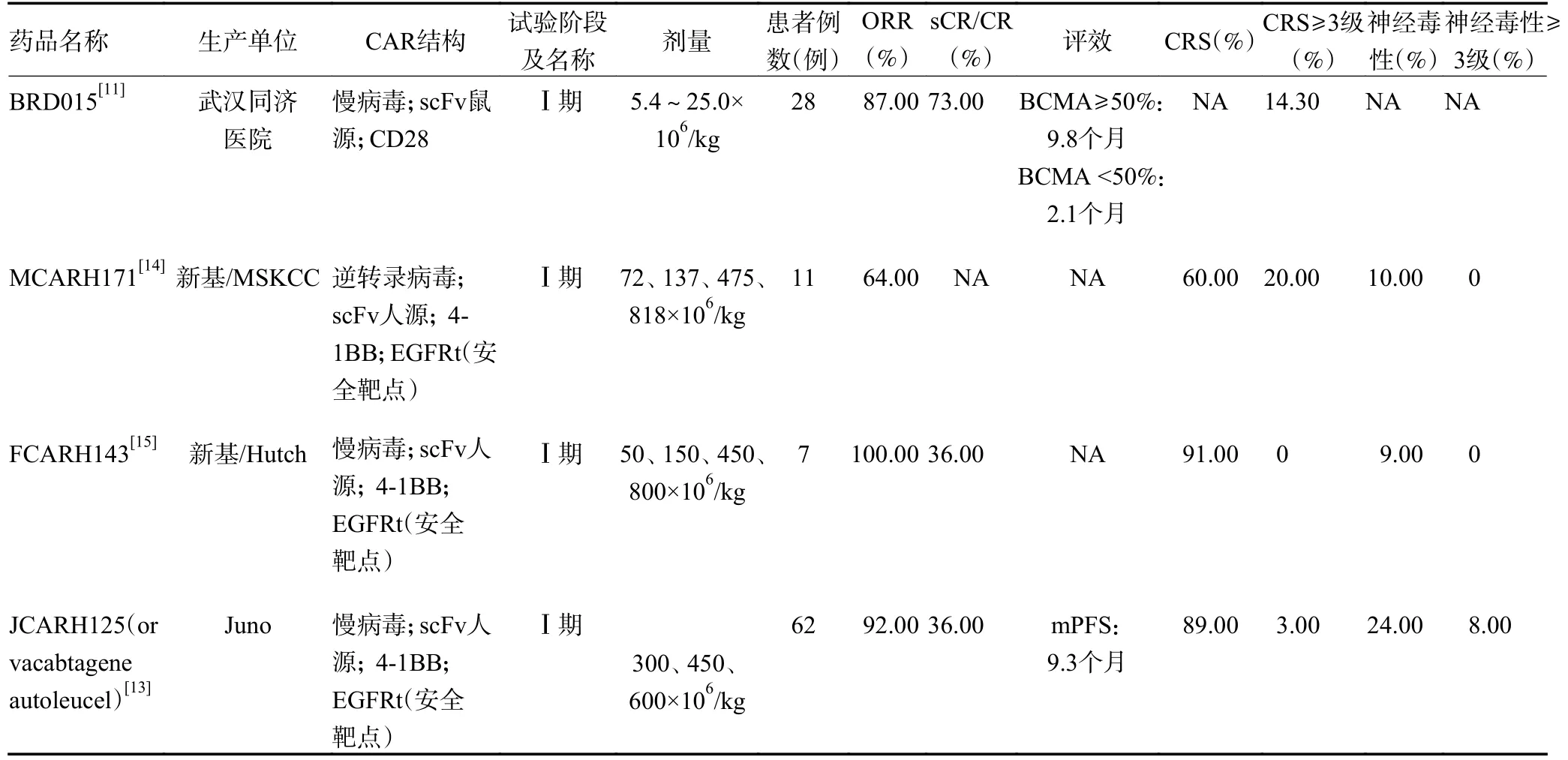
表1 BCMA CAR-T 细胞疗法在研最新数据汇总 (续表1)
2 靶向BCMA 的双特异性抗体(BsAbs)药物治疗
双特异性抗体(BsAbs)可同时靶向肿瘤抗原和效应细胞的标记分子,将效应细胞募集到肿瘤细胞上,进而杀伤肿瘤细胞。按照是否含有Fc 结构域,BsAbs主要分为两类:1)具有Fc 结构域的BsAbs,其能表现出Fc 介导的效应功能,包括抗体依赖性的细胞介导的细胞毒性作用(antibody-dependent cellular cytotoxicity,ADCC)和补体介导的细胞毒作用(complementdependent cytotoxicity,CDC)。此外,Fc 结构域还可增加BsAbs 的稳定性和延长其血清半衰期;2)缺少Fc 结构域的BsAbs,由2 个scFv 和1 个肽接头组成,如双特异性T 细胞衔接器(BiTE),其结构简单小巧容易构建且组织穿透力强,但该种BsAbs 血清半衰期短、功效低需要多次给药[17]。靶向MM 特异性抗原的BsAbs 正在进行临床前研究和临床开发,见表2[18-26]。

表2 MM 双特异性抗体在研最新数据汇总
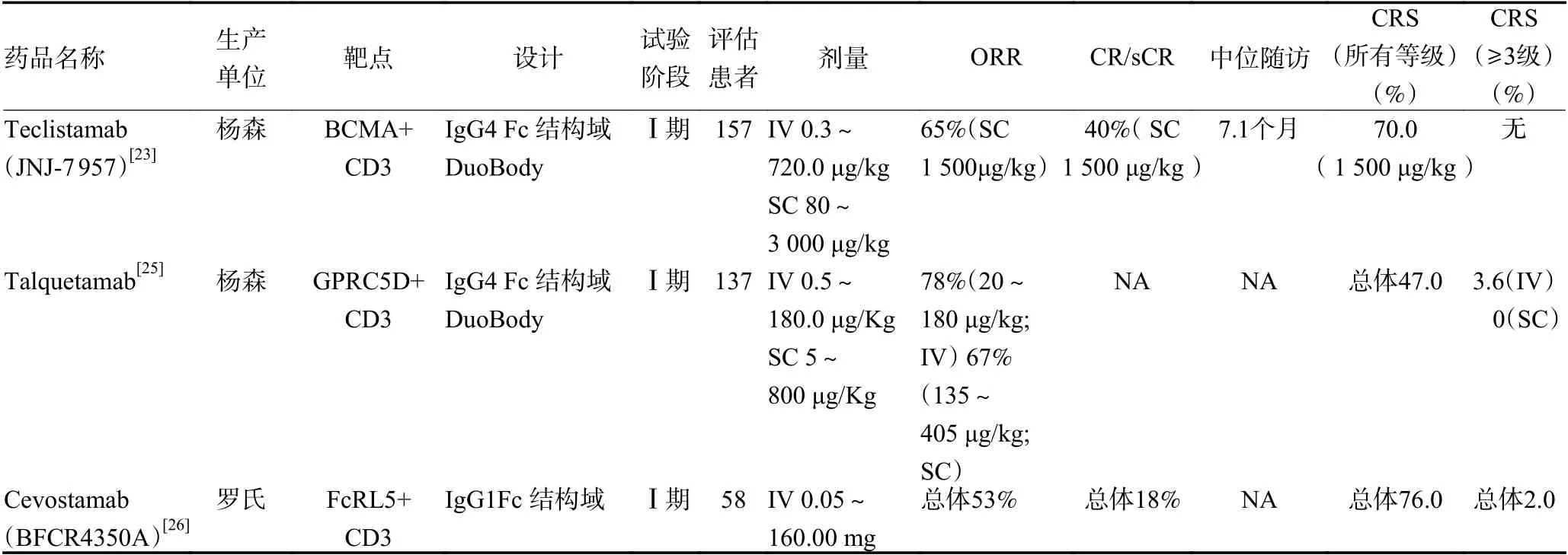
表2 MM 双特异性抗体在研最新数据汇总 (续表2)
2.1 AMG420/AMG701
AMG420 为BCMA/CD3 BiTE BsAbs,其半衰期非常短,需要持续输注才能保持功效。AMG420 的Ⅰ期临床试验最新随访结果显示,42 例RRMM 患者中,总体ORR 达31%,在最高耐受剂量400 μg/d 组,ORR 达70%(7/10),其中5 例获得了MRD 阴性CR,有治疗反应的患者其中位OS 达32 个月。总体CRS发生率为38.1%,3 级以上的CRS 仅1 例(2.4%)[20]。尽管AMG420 具有良好的疗效,但需每日持续静脉输注,AMG701 相较于AMG420 多了Fc 结构域,延长了其血清半衰期,因而可以每周给药。AMG701 的Ⅰ期剂量递增临床试验结果显示,在3~12 mg 剂量时ORR 为36%(16/45),其中4 例患者持续MRD 阴性(20 个月)。最常见的不良事件(adverse event,AE)为CRS (61%)、贫血(43%)、腹泻(31%)、中性粒细胞减少(23%)和血小板减少(20%),大多数 CRS 事件为≤2 级[21]。该项目仍在进行中,随后将进行Ⅱ期剂量扩展队列。
2.2 CC-93 269
CC-93 269 是一种人源化IgG1 基于“2+1”模式的T 细胞连接器,其与BCMA 二价结合(增强靶向结合MM 的效力),与CD3ε 一价结合。其Ⅰ期剂量递增试验(NCT03486067)的中期结果显示,30 例RRMM 患者总体ORR 为43%,13 例患者在第4 个周期前达到MRD 阴性(10-5),9 例接受最大剂量治疗患者的ORR 为89%,且sCR/CR 率为43%。最常见的3 级以上AE 是中性粒细胞减少(43%)、贫血(37%)、感染(30%)等,77%的患者出现CRS(大多为2 级以下)[22]。该研究仍在继续招募扩大剂量治疗组患者。
2.3 Teclistamab
Teclismatab(JNJ-64 007 957)是一种人源化 IgG4 DuoBody 双特异性抗体,一项Teclismatab 在RRMM患者中进行的单臂Ⅰ期研究(MajesTEC-1)探索了静脉/皮下给药及剂量递增情况下其安全性、耐受性和初步疗效。157 例患者接受治疗,其中40 例患者接受了Ⅱ期推荐剂量(1 500 μg/kg,皮下,每周1 次),ORR为65%,非常好的部分缓解(very good partial remission,VGPR)以上为58%,中位随访7.1 个月,26 例应答者中有22 例(85%)生存并继续治疗。28 例患者出现CRS(70%,均1~2 级),26 例(65%)出现中性粒细胞减少症(16 例为3 级以上)[23]。Teclismatab 联合其他药物如DARA 等的临床试验正在招募中。
其他靶向BCMA 的BsAbs 如PF-06863135、REGN5458、TNB-383B 等的疗效,见表2[18-26]。单药BsAbs 在RRMM 患者的ORR 可达30%~60%,在高剂量组可达80%~90%。另外,和CAR-T 细胞疗法相比,BsAbs 能更迅速地应用到患者中,3 级以上CRS 的发生率也比CAR-T 细胞疗法显著更低。目前,MM 在研的BsAbs 主要靶向BCMA,此外靶向GPRC5D[25](一种高特异性表达于浆细胞、毛囊的靶点)、FcRL5[26](表达于B 细胞、浆细胞以及MM 细胞)等的BsAbs 也初步表现出疗效,这些靶点与BCMA不重合,给BCMA 靶点丢失或靶向BCMA 治疗耐药的RRMM 患者提供更多的选择。
BsAbs 的局限性:1)需要持续给药;2)不良反应目前无法做到门诊管理;3)关于MM BsAbs 的研究多数还处于早期临床阶段,和其他药物如蛋白酶体抑制剂、免疫调节剂、抗CD38 单抗等联合应用的疗效还有待揭示。总之,BsAbs 是较有应用前景的药物,但仍需更多的临床数据支持。
3 靶向BCMA 的ADC 药物治疗
抗体药物偶联物(ADC)由具有生物活性的小分子药物、靶向肿瘤相关抗原的单克隆抗体(monoclonal antibody,mAb)和连接器组成,一旦mAb 结合到其特定的靶细胞,ADC 就被内化,释放出细胞毒性药物诱导肿瘤细胞损伤和死亡。目前,在研的MM 靶向BCMA ADC 的药物,见表3[27-30]。
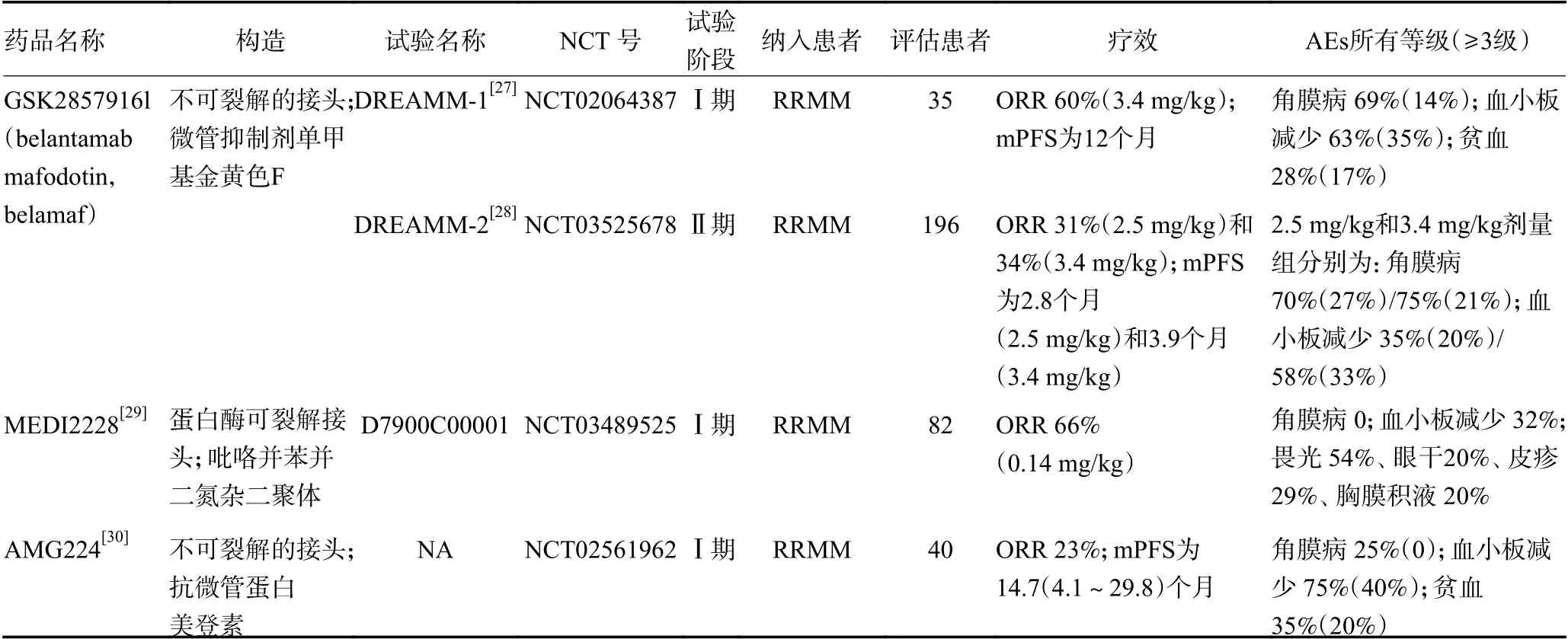
表3 BCMA 抗体药物偶联物药物在研最新数据汇总
3.1 GSK2857916
GSK2857916(belantamab mafodotin)是首个被美国食品药品监督管理局(FDA)批准用于RRMM 患者的靶向BCMA ADC 药物,其人源化IgG1 mAb 与微管抑制剂单甲基金黄色F(monomethyl auristatin F,MMAF)通过不可裂解的连接器偶联。Ⅰ期临床试验(DREAMM-1)数据显示,35 例RRMM 患者总体ORR 为60%,mPFS 为12 个月,mDOR 为14.3 个月。角膜事件很常见(69%),大多数为≤2 级(54%),分别导致 46%和49%的患者减少和中断剂量,均不需要停止治疗[27]。该药Ⅱ期临床试验(DREAMM-2)共招募196 例患者,分为两个剂量队列:2.5 mg/kg 和3.4 mg/kg。两队的ORR 分布为31% 和34%,mPFS分别为2.8 个月和3.9 个月,mDOR 分别为11 个月和6.2 个月,总体1 年OS 率为53%。最常见的 3 级以上AE 是角膜病变(2.5:27%;3.4:21%)、血小板减少症(2.5:20%;3.4:33%)、贫血(2.5:20%;3.4:25%)、肺炎(2.5:4% ;3.4:11%)和中性粒细胞减少症(2.5:9%;3.4:15%),因为AE 导致的停药相对少见(2.5:8%;3.4:10%)[28]。基于此项多中心DREAMM-2 试验的结果,GSK2857916 于2020 年8月初在美国被批准用于治疗RRMM。目前,正在对GSK2857916 做单药或与其他药物合用的其他研究。
3.2 MEDI2228
MEDI2228 是一种由完全人源化的抗BCMA 抗体通过蛋白酶可裂解接头与吡咯并苯并二氮杂(pyrrolobenzodiazepine,PBD)二聚体连接的ADC 药物。其与抗原结合后迅速内化,然后PBD 在DNA 的凹槽中形成交联,通过DNA 损伤的积累导致细胞死亡。MEDI2228 作为单药治疗RRMM 患者的Ⅰ期剂量递增及扩展试验(NCT03489525)的最新结果显示,共82 例患者纳入研究,在0.14 mg/kg 剂量组中(纳入41 例)ORR 可达66%,治疗相关AE 包括畏光(54%)、血小板减少(32%)、皮疹(29%)、γ-谷氨酰转移酶升高(24%)、干眼症(20%)和胸腔积液(20%),无角膜病不良事件报道[29]。目前,此药物还处于早期临床研究,初步结果提示该药安全且有效,是很有前景的ADC 药物。
针对其他抗原(如CD38、CD74、CD46 等)的ADC 药物也正在开发并表现出抗肿瘤作用,RRMM患者无需治疗等待即可使用ADC 药物。此外,ADC药物和CAR-T 细胞治疗及双特异性抗体药物相比,其治疗不需要依赖T 细胞的活性就可发挥抗肿瘤作用。但是ADC 药物也有缺陷。首先,ADC 药物也需要持续输注;其次,此类药物的主要挑战在于可控毒性范围内达到疗效,如GSK2857916 的药物不良事件就是眼毒性,由细胞毒性药物MMAF 脱靶作用引起(角膜不表达BCMA),但迄今为止,所有参与ADC 试验的患者角膜病变均是可逆的,且通过使用润滑性滴眼剂和及时调整剂量或中断治疗,多数患者可耐受。
4 结语与展望
综上所述,目前已进入将单克隆抗体新型治疗整合到MM 治疗的新时代,而BCMA 抗原无疑是其中最具有代表性的靶向抗原之一。靶向BCMA 的免疫治疗(包括CAR-T 细胞、BsAbs 和ADC)在RRMM患者中的ORR 达70%~100%,上述研究数据均进一步验证了BCMA 是治疗MM 有前景的新靶点。CAR-T 细胞和BsAbs 为恢复抗MM 宿主免疫力提供了新方法,而ADC 药物可用于免疫系统严重受损的RRMM 患者。此外,和其他药物,如PIs、IMiDs 等的联合应用也将进一步提高其抗MM 的免疫作用和临床疗效。因此,亟需开展更多的研究,以提高上述治疗方法的安全性、有效性、持续性和便携通用性。

