基于病毒载体的非洲猪瘟疫苗研究进展及展望
张 新,王秋霞,李文霞,袁梦淇,赵小天,4,杨晓柯,刘兴友,李永锋*,仇华吉*
(1.河南科技学院动物科技学院,河南 新乡 453003;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150069;3.新乡学院,河南 新乡 453003;4.天津农学院动物科学与动物医学学院,天津 300384)
非洲猪瘟(African swine fever,ASF)是由ASF 病毒(ASFV)感染引起的一种急性、高度传染性、致死性动物传染病[1],临床上以高热、皮肤发绀和脏器广泛性出血为主要特征[2]。世界动物卫生组织(WOAH)将ASF 列为法定报告动物疫病,我国将其列为一类动物疫病[3]。ASFV 可感染所有品种和年龄的家猪和野猪,持续感染的野猪和软蜱是家猪感染ASFV 的重要传染源。迄今为止,ASF 已被报告存在于33 个国家。2020 年1 月至2022 年1 月间,ASFV 感染超过100万头家猪和2.8 万头野猪,损失的动物超过160 万头(通过INs 和FURs 报告的数据),其中有6 个国家首次报告ASF 疫情,同时有10 个国家报告其扩散到新的区域,表明ASF 在新的国家和染疫国家的新地区持续蔓延(https://www.oie.int/en/document/asf_situation_report_3/)。我国自2018 年8 月在辽宁沈阳暴发首例ASF 以来,疫情不断扩散,并呈现全国蔓延态势[4]。因目前尚无安全有效的ASF 疫苗,导致疫情控制难度增加,一经发现只能大规模扑杀,给我国的养猪业造成了严重损失。
ASFV 为双股线状DNA 病毒,是非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的成员,也是目前已知的唯一虫媒DNA 病毒[5]。ASFV 病毒粒子直径175 nm~215 nm,具有二十面体立体对称结构,由内到外主要由5 部分组成:含病毒基因组DNA 的拟核、内核芯壳、内膜、衣壳和囊膜[6]。ASFV 基因组长度为170 kb~194 kb,有150~167 个开放阅读框,编码50 多种结构蛋白和100 多种非结构蛋白。ASFV 是一种大型的胞内复制病毒,易感细胞为单核细胞、巨噬细胞,能够破坏宿主的免疫系统。
自20 世纪60 年代开始,大量学者开展了ASF 疫苗的相关研究。目前,灭活疫苗、亚单位疫苗和DNA 疫苗均不能对猪提供有效的免疫保护,至今仍无商品化疫苗。ASF 灭活疫苗因缺乏刺激机体产生细胞免疫反应的能力,所以不能对免疫猪提供保护[7],反而观察到抗体依赖性增强(Antibody-dependent enhancement,ADE)作用[8]。弱毒疫苗免疫猪通常能抵抗同源病毒的攻击,而对异源病毒的攻击产生的抵抗作用有限甚至无保护作用[9],且其安全性不能得到保证。目前鉴定出的ASFV 保护性抗原较少,虽然ASF 亚单位疫苗和DNA 疫苗能够诱导猪产生免疫反应,但仅能提供有限的免疫保护。病毒载体疫苗由于毒力基因的缺失,或使病毒无法复制,安全性较高,是ASF 疫苗研发的重要方向。本综述对ASF 各类病毒载体疫苗的抗原选择、载体类型、免疫程序和保护效力等方面进行综合比较分析,以期为研制安全高效的ASF 病毒载体疫苗提供一定的理论支持和借鉴。
1 基于病毒载体的ASF 疫苗
病毒载体疫苗是一类通过重组DNA 技术,将病毒改造成弱毒疫苗后作为载体来表达其他病原抗原性基因的新型疫苗。病毒载体疫苗具有弱毒疫苗和灭活疫苗的优势,能够同时表达自身抗原蛋白和外源抗原蛋白。目前对于ASF病毒载体疫苗的研究,主要选用腺病毒(Adenoviruses,AdV)、痘病毒(Poxviruses)、杆状病毒(Baculoviruses)等载体表达ASFV 抗原基因,以诱导机体产生体液免疫应答和细胞免疫应答[10]。研究人员将表达ASFV 8个蛋白(B602L、B646L、CP204L、E183L、E199L、EP153R、F317L和MGF505-5R)的重组AdV 免疫猪,再用重组痘病毒加强免疫后利用104HAD50CSFV OUR/T88/1 株攻毒,猪全部存活[11]。评价表达ASFV 35 种抗原的重组AdV 免疫效果的结果显示,虽然免疫后的猪不能抵御强毒株的攻击,但在抗体阳性动物的组织中检测出较低的病毒滴度,这表明重组AdV 诱导的免疫反应有助于抑制ASFV 的复制[12]。部分研究表明,病毒载体疫苗可以诱导猪产生强烈的体液免疫和细胞免疫反应,可对ASFV 强毒株的攻击提供一定的免疫保护(表1)。
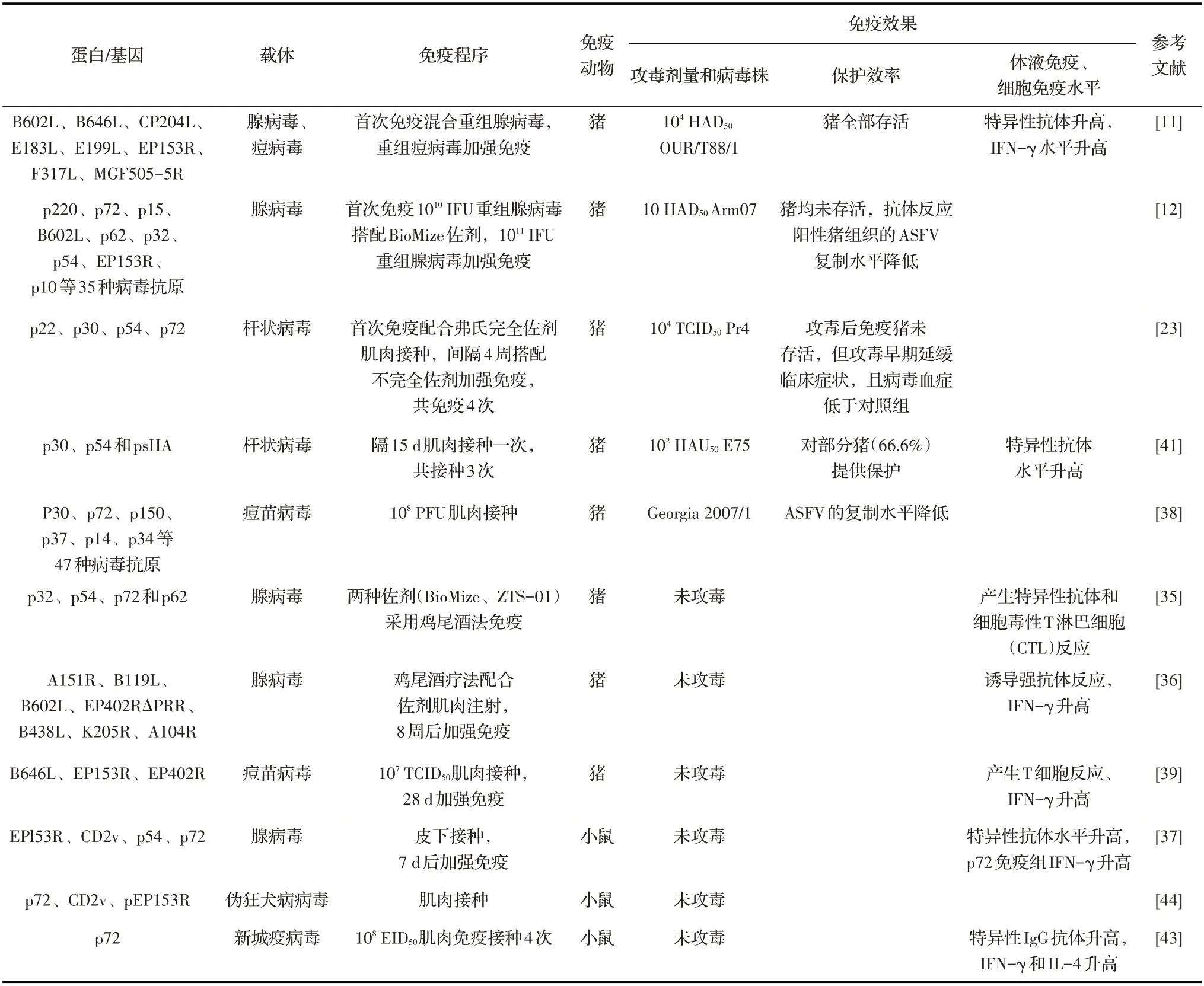
表1 表达不同ASFV抗原的病毒载体疫苗诱导的免疫保护效力
2 ASFV 的抗原选择
2.1 p54蛋白p54蛋白是由ASFVE183L基因编码的结构蛋白,位于病毒衣壳的内部,约25 ku,含有一段跨膜区域,主要集中在衍生的内质网膜处。该蛋白出现在病毒复制早期[13],参与病毒粒子组装,以及病毒粘附宿主细胞过程,是ASFV 的主要免疫原性蛋白[14]。此外,p54 蛋白在病毒衣壳的运输和诱导细胞凋亡方面发挥重要作用[15]。在病毒内化过程中,p54 蛋白通过独特的半胱氨酸形成以二硫键连接的同型二聚体,与细胞质中8 ku 的微管马达动力蛋白轻链(DLC8)直接结合,使病毒进入宿主细胞内的复制位点[16]。在ASFV 早期感染阶段,p54 蛋白能激活Caspase-9 和Caspase-3,进而诱导细胞凋亡。同时,p54 蛋白与Bcl-2 家族凋亡蛋白Bim-3 竞争结合DLC8,将Bim-3 从DLC8 上解离,从而诱导细胞凋亡[17]。在病毒复制过程中,p54 蛋白通过招募宿主内质网膜,将其转化为ASFV 囊膜的前体,其中p54 蛋白的跨膜结构发挥重要作用。E183L基因的缺失会影响ASFV 的稳定性。通过氨基酸序列分析发现,p54蛋白为ASFV 的特异性蛋白,不与其他病毒蛋白氨基酸序列重叠,具有良好免疫原性,可以刺激机体产生特异性抗体,能够用于病毒感染的血清学诊断的靶标[18]。所以在研制ASF 载体疫苗过程中,可以将E183L基因作为重要的候选基因。
2.2 p30 蛋白由CP204L基因编码的p30 蛋白是ASFV 的主要结构蛋白,具有高度保守的线性表位区域,蛋白大小为23.6 ku。p30 属于病毒的早期蛋白,位于病毒包膜的内膜,能够促进病毒的内化[19],在病毒侵入宿主细胞的过程中起重要作用。有研究表明,p30 蛋白在病毒DNA 合成开始之前产生,可在ASFV感染宿主细胞4 h 后检测到该蛋白的表达,随后持续存在于整个病毒复制周期[20],是一种理想的血清学诊断抗原。同时,p30 蛋白包含优势抗原决定簇,具有良好的免疫原性,能够诱导宿主较强的免疫应答[21]。
2.3 p72 蛋白由B646L基因编码的p72 蛋白是ASFV 的主要结构蛋白,分子量约为73.2 ku,是病毒粒子二十面体衣壳的重要组成部分,位于病毒粒子的中层或表层,在病毒蛋白中含量最高,约占整个病毒粒子蛋白的32%。p72 蛋白在病毒感染的晚期表达,该蛋白的表达常作为病毒复制的标志[22]。p72 参与ASFV 的吸附和侵入过程,能够抑制病毒与细胞结合,针对p72 的抗体可以阻断病毒与巨噬细胞的结合,但产生的抗体却不足以抵抗ASFV 的攻击,并不能起到有效的免疫保护作用[23]。p72 蛋白在宿主细胞内合成后分布于细胞质和内质网的囊泡中,随后在内质网上形成核衣壳。不同病毒株之间的p72 蛋白均有相同的保守序列,且氨基酸序列同源性为97.8%~100%,稳定性较强,极少发生变异[24]。对其三维结构的研究显示,p72 含有4 个主要抗原暴露表位(ER),分别为ER1、ER2、ER3 和ER4,这4 个抗原暴露表位可能参与受体的结合和中和性抗体的结合,是ASFV 的主要保护性抗原。相对于早期蛋白p30 和p54,晚期蛋白p72 具有较好的免疫原性。ASFV 感染猪可产生针对p72 的高水平抗体[25],因此p72可以作为检测抗原,在精准检测中发挥重要功能。此外,由于p72 良好的免疫原性,在疫苗研制方面也是一个优势蛋白。将表达ASFV p72 蛋白的重组AdV 免疫小鼠后,可诱导其产生特异性抗体以及分泌特异性IFN-γ。
2.4 CD2v 蛋白ASFV CD2v 蛋 白 由EP402R基 因 编码,与宿主T 细胞表面黏附因子CD2 的结构与功能类似。CD2v 蛋白约为41 ku,是由信号肽、两个免疫球蛋白样结构域、跨膜区、酸性结构域和富含亮氨酸的结构域组装而成的一种跨膜糖蛋白,属于宿主免疫调控相关蛋白,存在于病毒粒子的囊膜中,具有较强的免疫原性,为ASFV 的重要保护性抗原[26],主要在ASFV 感染的后期表达。CD2v 主要在病毒毒力、免疫应答调节、红细胞吸附以及在组织趋向性、免疫逃避等方面发挥作用。
CD2v 是ASFV 的血凝素,免疫CD2v 的猪可产生血凝抑制及单核细胞感染抑制抗体,对同种血清型的ASFV 具有较高保护作用[27],因此CD2v 的表达对于亚单位疫苗产生的部分保护也是必需的。在弱毒疫苗研发过程中,EP402R基因缺失株对猪无致病性,且可以保护猪抵抗强毒株的攻击[28-29]。综上所述,CD2v 蛋白是开发ASF 疫苗的重要候选靶标。
2.5 pEP153R 蛋白pEP153R 蛋 白 是 由ASFVEP153R基因编码的非结构蛋白,也称为C型亮氨酸样蛋白,编码153 个氨基酸残基,分子量为18.3 ku,其含有中央跨膜区,C 型凝集素样结构和细胞附着序列,蛋白中存在多个N-糖基化、磷酸化和豆蔻酰化位点,在病毒感染的早期和晚期转录。病毒感染细胞后,其参与感染细胞与红细胞的吸附。有研究发现,pEP153R 蛋白是通过抑制MHC-I 分子从内质网到细胞膜的胞外分泌过程,从而抑制MHC-I 分子的表达[30]。同时pEP153R 可抑制ASFV 感染细胞的死亡及Caspase-3 的活性,从而抑制ASFV 引起的细胞凋亡。EP153R基因缺失株免疫猪再用105HAD50ASFV(I Lisbon 60)攻毒后猪全部存活[31]。
3 病毒载体类型
3.1 AdV 载体AdV 是一类线性双链DNA 病毒,无包膜,呈二十面体对称结构。目前利用AdV 作为病毒载体较为广泛,是一种将外源基因导入动物体内并实现表达的媒介,其在基因治疗、基因免疫等方面应用开发得较早。基于AdV 载体的安全性高、宿主范围广泛、病毒颗粒相对稳定,可携带较长的外源基因,递送和表达外源基因能力强,其构建及其包装易于操作等优点[32],因此其常作为载体用于疫苗的研发。另外,AdV 能快速有效增殖,易于制备高滴度的病毒。AdV 载体在携带外源基因进入宿主细胞后只能瞬时表达,不会将基因整合到宿主细胞基因组中[33],同时表达产物具有天然蛋白的活性,能够刺激机体对外源蛋白产生强烈的特异性免疫反应[34]。基于AdV 载体在抗原递送及安全性等方面的优势,在构建ASF 载体疫苗方面具有很大的潜力,已有很多研究团队开展了相关研究。
将ASFV 的p32、p54、p72 和多聚蛋白pp62 编码基因分别插入AdV 载体,利用两种佐剂采取鸡尾酒式免疫猪,能够快速诱导针对ASFV 抗原的特异性抗体和CTL 反应[35]。此外,又将ASFVA151R、B119L、B602L、EP402RΔPRR、B438L、K205R和A104R基因分别插入到AdV 载体中,辅以佐剂以鸡尾酒疗法对猪免疫,构建的重组AdV 能够诱导机体产生强烈的抗原特异性IgG 反应和IFN-γ 的分泌[36],但是以上免疫猪均未进行攻毒试验。谢灵志构建了表达ASFV EP153R、CD2v、p54 和p72 蛋白的重组AdV,以CTLA4 部分序列为先导序列作为佐剂来增强免疫效果,均能诱导小鼠产生特异性抗体,且CTLA4 为佐剂的重组AdV 免疫组能诱导更好的体液免疫反应[37]。虽然用AdV 载体表达ASFV 抗原可以诱导猪产生良好的体液免疫和细胞免疫反应,但是对抗原的选择、不同的免疫程序所诱导的免疫反应、保护效力的高低,还需要进一步评估。
3.2 痘病毒载体痘病毒是一类结构复杂的双链DNA 病毒,基因组约180 kb~300 kb,病毒粒子呈砖形或椭圆形,是研究最早的病毒疫苗载体之一。目前主要的痘病毒载体包括痘苗病毒、牛痘苗病毒、鸡痘病毒、猪痘病毒和羊痘病毒等。痘病毒载体的宿主范围广,因而适用于多种类型病毒基因的表达,对外源基因插入耐受性强,能够插入较长的外源基因片段且表达水平较高。此外,痘病毒安全性好,不会整合到宿主基因组,增殖滴度高、稳定性强,可通过多种途径接种,且能诱导机体产生体液免疫和细胞免疫反应,接种后保护期持续时间较长。
有研究将筛选出的47 种ASFV 抗原整合到重组痘苗病毒载体中,进行猪的免疫和攻毒试验,结果显示,虽然重组痘苗病毒免疫后不能保护猪免受强毒株的攻击,但是能够诱导猪产生ASFV 特异性体液和细胞免疫反应,血液和淋巴组织中的病毒基因组水平与对照组相比显著降低[38]。选择的抗原可能是该类重组病毒载体不能提供足够保护的重要原因。将表达3 种ASFV 抗原(B646L、EP153R、EP402R)的重组痘苗病毒免疫猪后,能够诱导其T 淋巴细胞增殖和IFN-γ 分泌,却未能诱导体液免疫应答[39]。细胞免疫反应是ASF 疫苗诱导免疫保护的重要指标,该重组病毒可能对猪有一定的保护效果,但该研究未进行攻毒试验。后期将评估痘病毒载体在猪中的安全性,并将表达的抗原优化处理,以便在诱导猪产生细胞免疫反应的基础上,同时诱导其产生体液免疫应答,才能有望提高疫苗的保护效果。
3.3 杆状病毒载体杆状病毒是一类有囊膜的双链环状DNA 病毒,基因组为80 kb~180 kb,编码90~180个病毒蛋白。病毒为一端较大一端较小的长杆状,主要感染无脊椎动物,对人和哺乳动物无感染性。随着对杆状病毒研究的不断深入,杆状病毒的应用也越来越广泛。该病毒本身并不能在哺乳动物细胞中复制,也不会在这类细胞中增殖和扩散,表明以杆状病毒为载体的疫苗安全性好,通过对病毒基因组修饰改造,在适当的启动子作用下,杆状病毒可以作为外源蛋白的表达载体。杆状病毒作为病毒载体也具有很多明显优势:病毒外源基因容量大,基因组上有多个限制性内切酶酶切位点,可以携带较大的外源基因或多个外源基因,操作简便,构建效率高;外源蛋白的生物活性近似于天然蛋白;病毒部分基因的启动子属于强启动子,能够高效表达外源目的蛋白[40]。目前已有报道,利用重组杆状病毒制备的疫苗可以诱导机体产生针对多种抗原较高的体液免疫及细胞免疫反应。
研究显示,将表达ASFV p30、p54 和psHA 融合蛋白的重组杆状病毒经肌肉接种猪3 次,能诱导其特异性T 细胞反应,并能对强毒的攻击提供部分保护[41]。另一项研究证实,用表达p22、p30、p54和p72蛋白的重组杆状病毒经肌肉接种猪3 次,能延缓强毒攻击引起的临床症状和病毒血症[23]。以上结果表明p22、p30、p54 和p72 可 作 为ASFV 候 选 保 护 性 抗原,在今后构建的病毒载体疫苗表达这些抗原,有望提高载体疫苗的保护效率。
3.4 新城疫病毒载体新城疫病毒(Newcastle disease virus,NDV)在分类上属于副黏病毒科(Paramyxoviridae)禽腮腺炎病毒亚科(Avulavirinae)正腮腺炎病毒属(Orthoavulavirus),为单股负链RNA 病毒,基因组全长约15 kb。病毒粒子多呈球形,有囊膜,直径约为100 nm~250 nm,主要编码6 种结构蛋白:基质蛋白、磷蛋白、核衣壳蛋白、大分子蛋白、血凝素-神经氨酸酶和融合蛋白[42]。随着反向遗传学技术的发展,NDV 被开发成一种安全有效的病毒载体来递呈外源蛋白,具有极为突出的优点:NDV 遗传相对稳定,并且只有一个血清型,病毒株之间发生重组及毒力返强的可能性极小;生物安全性良好,NDV基因组复制在细胞浆内完成,不会整合到宿主基因组中;NDV载体疫苗免疫方法简单,可以通过多种途径免疫,例如滴鼻、点眼和饮水等方式;能够引起有效的黏膜免疫、细胞免疫和体液免疫反应,显示出优良的免疫原性;此外,构建好的载体疫苗可利用于鸡胚生产,生产成本低廉,便于规模化生产。
研究表明,表达ASFV p72 蛋白的重组NDV 在鸡胚中复制良好,以108EID50重组病毒经肌肉注射途径接种小鼠,每隔2 周共免疫4 次,结果显示,该重组病毒在小鼠体内产生了高滴度的p72 特异性IgG 抗体,并诱导其T 细胞的增殖和IFN-γ、IL-4 的分泌[43]。该重组病毒可同时诱导小鼠产生体液免疫和细胞免疫应答,但当时ASF尚未在我国出现,因此未对猪进行免疫和攻毒试验,该重组病毒能否在猪体内产生有效的免疫保护还有待进一步研究。
3.5 伪狂犬病病毒载体伪狂犬病病毒(Pseudorabies virus,PRV)属于疱疹病毒科(Herpesviridae)α疱疹病毒亚科(Alphaherpesvirinae)水痘病毒属(Varicellovirus),为线性双链DNA 病毒。在形态上呈球形或椭球形,成熟病毒粒子直径约160 nm,主要由脂质双层衣壳、皮层、囊膜及核仁构成,基因组全长约150 kb。研究者发现,一些已知的毒力基因缺失、突变或替代后,能够显著降低PRV 的毒力而不影响PRV 的复制,表明PRV 可以成为外源基因插入表达的重要载体。PRV作为载体,宿主范围广泛,安全性好;外源基因容量大,可同时插入多个外源基因,不影响病毒的复制和免疫原性;PRV所表达的外源蛋白可以正常翻译后加工、修饰,表达产物具有天然蛋白质的活性,并且保留了其相应的功能,可以诱导机体产生持续时间较长的体液与细胞免疫反应。
有研究者在gE和gI双基因缺失PRV 株的基础上构建出表达ASFV p72、p54、p30、CD2v 和pEP153R蛋白的5 种不同重组PRV,均与亲本病毒具有相似的生长特性,免疫小鼠后无死亡情况,具有很好的安全性[44]。以PRV 为载体表达ASFV CD2v蛋白,构建的重组病毒具有良好的遗传稳定性和复制能力[45]。表明PRV 可作为表达ASFV 抗原的候选病毒载体,但目前的研究均未进行猪的免疫或攻毒试验。此外,PRV为猪源病毒,免疫猪后是否会影响免疫效果也未知。
4 存在的问题与展望
ASF 作为一种“百年老病”,给世界养猪业带来严重的损失和威胁。防控ASF最有效的措施是控制传染源、切断传播途径和保护易感动物。但是随着经济全球化的快速发展,跨地域的人员和贸易交流越来越频繁,养殖密度高、模式多样,部分从业人员生物安全意识淡薄,给ASF的防控和根除带来了严峻挑战。所以研发出安全有效的ASF 疫苗,保障生猪供应,是我国生猪养殖急需解决的问题。
ASF 疫苗的研究已接近60 年,各国科学家对多种疫苗进行了研发尝试,但是ASFV 基因组结构庞大且复杂,编码蛋白众多且易变异,同时ASFV 具有较为完备的免疫逃避机制,病毒致病机理尚不清楚,所以至今仍无商业化的疫苗。载体疫苗能够诱导宿主产生多种免疫应答,一些载体自身具有佐剂的性质,能够增强疫苗的免疫效果。病毒载体来源丰富,还可以开发多价疫苗,起到一针防多病的作用。将编码免疫原的病毒载体进行疫苗标记,在接种疫苗后利用配套的检测方法可以区分自然感染动物和疫苗接种动物。基于杆状病毒、AdV 和痘病毒等载体的研究,表明病毒载体疫苗可诱导产生有效的体液免疫和细胞免疫反应,对ASFV 强毒株的攻击提供一定的免疫保护。然而,尽管很多病毒载体疫苗的研制已经取得了很大的进展,但是在临床应用方面还存在一些缺陷,在ASFV 攻击后这些疫苗的保护作用有限,其对宿主存在着潜在的安全隐患,某些情况下会增强病毒的感染能力和临床症状,还可能受母源抗体的干扰,以及中和抗体可能会影响免疫效果等。但是随着生物技术的进步,病毒载体疫苗以不可比拟的优势,将会得到更加深入的研究和广泛的应用。
未来针对病毒载体的ASF 疫苗需要解决的几个关键问题:(1)在目前研究中发现,部分ASFV 蛋白所诱导产生的非中和抗体可能存在着增强疾病感染的风险(ADE 效应),引起严重的机体病理反应,因此在构建ASF 病毒载体疫苗时应考虑缺失该类蛋白;(2)加强对ASFV 的生物学特性的研究,采用生物信息学方法,以ASFV 全基因组序列为基础,分析功能未知的基因,分析鉴定病毒蛋白的结构和抗原表位,根据其细胞定位、疏水性、抗原性的预测结果,初步筛选出候选抗原蛋白编码基因[46]。利用反向疫苗学研究策略,对候选抗原分别克隆表达和表达蛋白的免疫保护性测定,为疫苗研究提供有效的候选抗原;(3)疫苗的免疫原性依赖于抗原蛋白有效的转录和翻译,可以通过优化筛选出的抗原基因,从而提高抗原基因的表达,增强载体疫苗的免疫原性;(4)目前表达ASFV 抗原基因的载体有很多,使用合适的载体递呈这些抗原,是目前研制载体疫苗的重要问题。此外,优化已有的实验性疫苗,搭配新型佐剂,探究疫苗的免疫剂量、免疫程序和免疫途径等,从而增强疫苗的免疫效果。
ASF 防控任重而道远,在研制出有效的商品化疫苗之前,科学的ASF 常态化生物安全防控手段同样至关重要。随着新技术的不断发展,以及对ASFV基因组研究的不断深入,基于病毒载体的ASF 疫苗有望成为防控ASF 的有力手段。

