鹅星状病毒衣壳蛋白间接ELISA检测方法的建立
张帆帆,李海琴,谭美芳,杨 群,涂凌云,康冬柳,罗士仙,黄奕雯,曾艳兵,谭 佳,黄江南,谢金防,韦启鹏*,康昭风*
(1.江西省农业科学院畜牧兽医研究所,江西 南昌 330200;2.南昌市动物疫病预防控制中心,江西 南昌 330008;3.吉安市畜牧兽医局,江西 吉安 343099;4.泰和县畜牧兽医局,江西 吉安 343799)
鹅星状病毒(Goose astrovirus,GoAstV)是一种近年来新发现的可引起3 周龄内的雏鹅痛风的病毒,以关节肿胀,内脏器官表面、关节腔有大量尿酸盐沉积为基本特征,死亡率高达30%[1-2]。该病自2017年在我国主要养鹅地区陆续发生,并迅速蔓延至全国,给养鹅业造成了严重的经济损失,严重威胁我国养鹅业的发展。目前市场尚无GoAstV 商品化疫苗和特效药,因此迫切需要建立一种高效的检测方法监测GoAstV。GoAstV 是一种无囊膜的、单链正义RNA病毒,病毒基因组大小约7.2 kb,包含5′非翻译区(5′-UTR)和3′-UTR 及2 个开放阅读框(ORF),分别编码多聚酶蛋白1a/1b 和衣壳(Cap)蛋白[3]。其中Cap蛋白是诱导机体产生保护性抗体的主要抗原,而该蛋白编码基因5′端相对保守,可用于建立高效、准确、快速的分子生物学诊断技术的靶标,为鹅群中GoAstV 感染的诊断及流行病学调查提供切实可行的方法[4]。
目前对于GoAstV 的检测方法主要包括RT-PCR、RT-LAMP、荧光定量RT-PCR、病毒分离鉴定等[1,5-6]。Zhang 等通过将鹅痛风样品接种鹅胚分离了GoAstV,并利用GoAstV 的ORF2 基因保守序列,设计引物建立了检测GoAstV 的RT-PCR 方法[1]。张玉霞等根据GoAstV ORF1b 基因设计了一组特异性的LAMP 引物,建立了特异、快速检测GoAstV 的RT-LAMP 方法[5]。Wan 等根据GoAstV ORF1b 保守序列设计了特异性引物和探针建立了GoAstVTaqMan 荧光定量RTPCR 方法,该方法灵敏性高、特异性强,可快速有效地检测GoAstV[6]。而针对GoAstV 抗体的血清学检测方法,刁有祥等以原核表达获得的GoAstV ORF1b重组蛋白为包被抗原,建立了快速、有效的GoAstV间接ELISA 抗体检测方法[7]。张鑫宇同时利用GoAstV Cap 蛋白和Cap 蛋白C 端为包被抗原,建立了GoAstV血清抗体水平监测的间接ELISA 方法[8]。孙敏等利用原核表达系统表达Cap 蛋白的C 末端,并以其为抗原包被酶标板,建立了特异性强、重复性好的竞争ELISA 抗体检测方法[9]。然而,目前尚未发现利用表达Cap 蛋白N 末端保守区域建立检测GoAstV抗体的间接ELISA 方法,GoAstV 已经在主要养鹅地区广泛流行,因此建立一种成本低,快速高效的间接ELISA方法迫在眉睫。本研究原核表达GoAstV 截短重组Cap蛋白(rCap),并以纯化并截短的rCap 为包被抗原,建立GoAstV 间接ELISA 抗体检测方法。为GoAstV 抗体的检测和血清流行病学调查以及免疫监测提供技术手段。
1 材料与方法
1.1 主要实验材料GoAstV JXGZ 株由本实验室分离保存;GoAstV、鹅细小病毒(GPV)、鹅圆环病毒(GoCV)、禽流感病毒(AIV)、新城疫病毒(NDV)、坦布苏病毒(TMUV)、鹅呼肠孤病毒(GRV)、大肠杆菌(E.coli)鹅源阳性血清均由江西省农业科学院畜牧兽医研究所保存;GoAstV 阳性血清为攻毒康复后的雏鹅血清;200份鹅阴性血清由本实验室保存;670份临床鹅血清采自江西及周边省份各年龄段的鹅;原核表达质粒pCold I、大肠杆菌DH5α、BL21(DE3)感受态细胞、EcoR I、XhoI 限制性内切酶、T4 DNA Ligase 和DNA Marker 均购自宝日医生物技术(北京)有限公司;预染蛋白Marker 购自北京全式金生物技术有限公司;可溶型单组分TMB 底物溶液购自天根生化科技(北京)有限公司;HRP 标记的兔抗鹅IgG(IgG-HRP)购自北京义翘神州科技股份有限公司;Ni 层析介质(NTA)、PDVF 膜、ECL Plus 超敏发光液均购自北京索莱宝科技有限公司;SDS-PAGE 凝胶试剂盒购自武汉塞维尔生物科技有限公司。
1.2 rCap 的诱导表达、纯化及反应原性的western blot鉴定根据GoAstV JX01/China/2021株(MZ576222)的ORF2 基因序列,按照大肠杆菌密码子的偏好性、mRNA 结构的稳定性及GC 含量等原则优化密码子后,由武汉金开瑞生物工程有限公司合成ORF2 基因。将合成的ORF2 基因克隆至pCold I 载体中构建重组质粒pCold I-Cap,并经PCR、酶切和测序鉴定。将鉴定正确的重组质粒pCold I-Cap 转化至大肠杆菌BL21(DE3)构建重组菌pCold I-Cap/BL21(DE3),将重组菌接种于LB 液体培养基(Amp+)中,培养至OD600nm为0.6~0.8 时加入终浓度1 mmol/L 的IPTG,置16 ℃诱导表达20 h,收集菌液,PBS 重悬、超声波破碎后分别收集上清及沉淀。将表达的rCap 利用Ni亲和纯化层析柱纯化,纯化后的rCap 经SDS-PAGE电泳后转PVDF 膜,以GoAstV 阳性血清(1∶100)为一抗,以兔抗鹅IgG-HRP(1∶2 000)为二抗孵育,显色后进行重组蛋白的western blot 鉴定。
1.3 间接ELISA 方法反应条件的优化与建立将纯化的rCap 和GoAstV 鹅阳性血清倍比稀释,采用棋盘滴定法,确定最佳抗原包被浓度和血清稀释倍数。抗原包被浓度依次为20 μg/mL、10 μg/mL、5.0 μg/mL、2.5 μg/mL、1.25 μg/mL;血清稀释度依次为1∶25、1∶50、1∶100、1∶200、1∶400、1∶800。在确定抗原包被浓度及血清稀释倍数后,对封闭液、封闭时间、血清孵育时间、兔抗鹅IgG-HRP 稀释倍数及TMB 显色时间进行优化,确定最佳反应条件。
1.4 临界值的确定利用优化后的GoAstV间接ELISA方法检测200 份鹅阴性血清(经病毒中和试验确定为GoAstV 阴性)。根据生物统计学原理计算平均值(-x)和标准差(s),并以此确定血清样品的阳性或阴性临界值,临界值的计算公式为-x+3s。
1.5 特异性试验利用本研究建立的GoAstV间接ELISA 方法对已知的GPV、GoCV、AIV、NDV、TMUV、GRV、E.coli阳性血清检测,同时设立GoAstV 阳性血清为对照,每种血清设置2 个重复,评价间接ELISA方法的特异性。
1.6 敏感性试验将GoAstV 阳性鹅血清2 倍倍比稀释(1∶50~1∶3 200),以GoAstV 阴性鹅血清为阴性对照,利用本研究建立的间接ELISA 方法检测,同时利用病毒中和试验检测[10],比较二者的检测结果,确定本研究建立的间接ELISA 方法的敏感性。
1.7 重复性试验选取同一批次包被的酶标板,随机抽取4 份GoAstV 阳性血清样品进行批内重复性试验检测,每份血清设置8 个重复;选取4 个不同批次包被的酶标板,对上述4 份阳性血清进行批间重复试验,每份血清设置4 个重复;计算批内和批间变异系数(CV),评价该ELISA 方法的重复性。
1.8 符合率试验选取本实验室保存的120 份临床鹅血清,利用本研究建立的间接ELISA 和病毒中和试验同时检测,通过Kappa 检验进行分析,计算两种检测方法的符合率。
1.9 临床样品的检测选取本实验室保存的670 份临床鹅血清样品,利用本研究建立的间接ELISA 方法检测,统计血清阳性检出率。
2 结 果
2.1 rCap 的表达及纯化结果对构建的重组质粒pCold I-Cap 经PCR、酶切与测序鉴定,结果表明重组质粒构建正确。将pCold I-Cap 转入BL21(DE3),获得pCold I-Cap/BL21(DE3)重组菌,16 ℃经IPTG 诱导20 h 后收集全菌离心、PBS 重悬、超声破碎后分别对上清和沉淀进行SDS-PAGE 检测。结果显示,重组蛋白在上清和沉淀中均有表达,大小约为29 ku,与预期蛋白大小一致。重组蛋白经Ni 亲和纯化层析柱纯化后,经western blot 鉴定,结果显示,PVDF 膜上出现29 ku 的特异性条带(图1),表明rCap 可以被GoAstV 阳性血清识别,具有很好的反应原性。
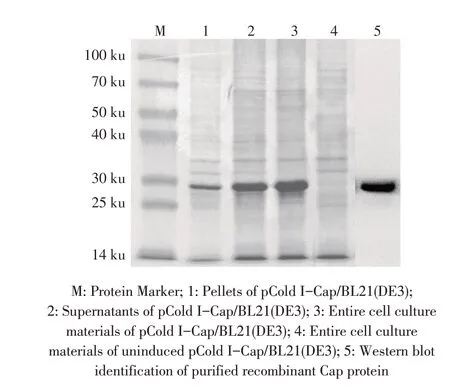
图1 rCap表达的SDS-PAGE和纯化的western blot检测结果Fig.1 SDS-PAGE and western blot analysis of recombinant GoAstV Cap protein
2.2 间接ELISA 方法的优化结果利用纯化的rCap经棋盘滴定法确定抗原最佳包被浓度为2.5 μg/mL,4 ℃包被过夜;最佳封闭条件为10%马血清37 ℃封闭90 min;待检血清最佳稀释度为1∶50,37 ℃孵育45 min;兔抗鹅IgG-HRP 最佳稀释度为1∶2 000,37 ℃孵育60 min。最后加入显色剂TMB 于37 ℃显色15 min(表1)。

表1 间接ELISA检测方法反应条件的优化结果Table 1 The optimized conditions of the indirect GoAstV-ELISA
2.3 临界值的确定利用本研究建立的间接ELISA方法检测200 份GoAstV 阴性血清样品。检测结果经计算-x为0.161,s为0.032,临界值为-x+3s=0.257,即OD450nm≥0.257 为阳性,OD450nm<0.257 判定为阴性,阴性样品结果正态分布图见图2。
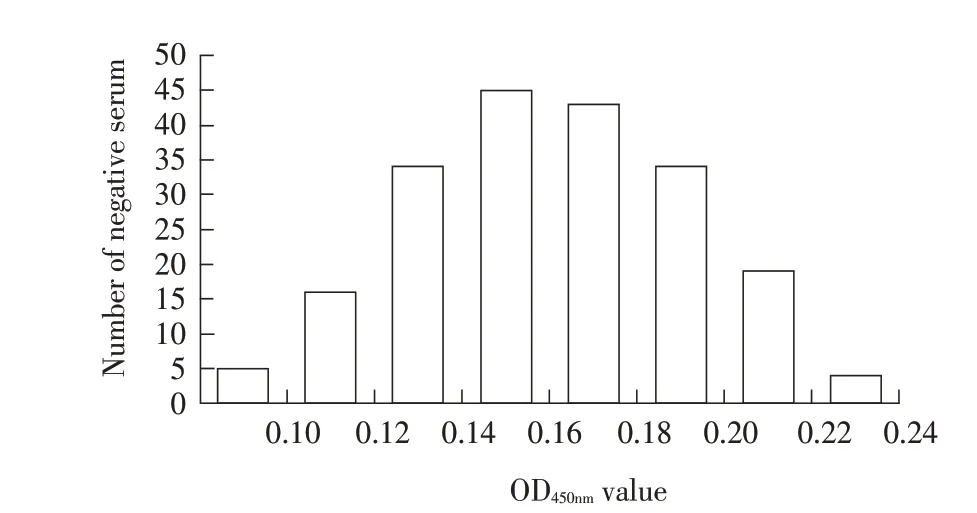
图2 阴性血清样品结果正态分布图Fig.2 Normal distribution diagram of negative serum samples
2.4 特异性试验结果利用本研究建立的间接ELISA 方法对GPV、GoCV、AIV、NDV、TMUV、GRV、E. coli阳性血清和GoAstV 阳性血清进行检测,结果显示,除GoAstV 阳性对照血清为阳性外,其他7 种常见病原阳性血清检测结果均为阴性(表2),表明建立的间接ELISA 检测方法特异性较强。
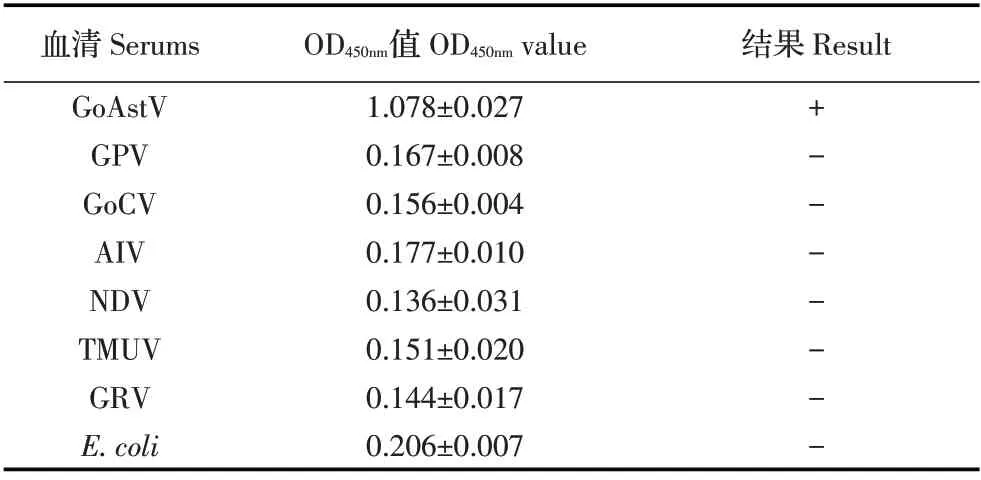
表2 间接ELISA方法的特异性试验结果Table 2 The results of specificity evaluation of indirect ELISA
2.5 敏感性试验结果利用本研究建立的间接ELISA 方法对不同稀释度的GoAstV 阳性血清及GoAstV阴性血清进行检测,结果显示,本研究建立的间接ELISA方法能够检测的GoAstV阳性血清的检测下限为1∶400;而病毒中和试验对阳性血清的检测下限为1∶200(表3)。表明本研究建立的间接ELISA 方法的敏感性较高。
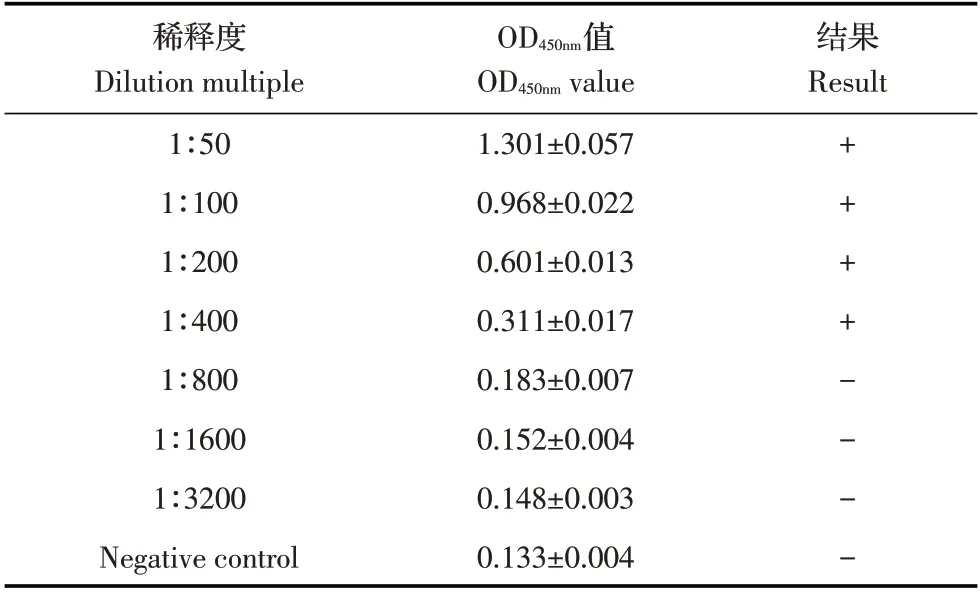
表3 间接ELISA方法的敏感性试验结果Table 3 The sensitivity test of indirect ELISA
2.6 重复性试验结果利用本研究建立的间接ELISA方法对4份不同的临床血清样品分别进行批内和批间重复性试验,统计学分析结果显示其变异系数分别为0.6%~2.0%和3.8%~6.0%,变异系数均小于10%(表4)。表明本研究建立的间接ELISA方法重复性较好。

表4 间接ELISA方法的重复性试验结果Table 4 The repeatability evaluation of the indirect ELISA
2.7 符合率试验结果利用本实验建立的间接ELISA 方法和病毒中和试验同时对120 份鹅血清进行检测,结果显示间接ELISA 方法检测出43 份阳性血清,77 份阴性血清;病毒中和试验检测出36 份阳性血清,84 份阴性血清,二者的总符合率为94.2%,Kappa 系数为0.868,二者具有较高的符合率和一致性,表明该间接ELISA 方法检测结果较准确。
2.8 临床样品的检测结果利用本研究建立的间接ELISA 方法对江西及周边省份采集的670 份鹅血清样品进行检测,结果显示,其中阳性血清样品214份,阴性血清样品456 份,阳性率为32.0%。结果表明江西及周边省份鹅群中GoAstV 感染率较高,且本研究建立的间接ELISA 方法可用于临床样品的检测。
3 讨 论
星状病毒是一种具有广泛宿主范围的病毒,可以分为感染哺乳动物(人、猪、绵羊、牛、猫等)的哺乳动物星状病毒和感染禽类(鸡、鸭)的禽星状病毒。哺乳动物星状病毒主要引起宿主胃肠炎和腹泻,而禽星状病毒感染主引起鸡肾炎、肝炎、肠炎等。自2017 年以来,我国华北、华中、华南等多地鹅场暴发了一种以关节痛风和内脏痛风为主要特征的致死性传染病,该病由一种新型GoAstV 引起,该病毒主要侵害5 日龄~20 日龄的雏鹅,感染的鹅各内脏器官及关节出现大量白色尿酸盐沉积,给养鹅产业带来严重的经济损失[11]。余明兴等对福建地区患鹅肿大关节、有尿酸盐沉积的内脏组织检测,结果显示GoAstV 的阳性率为33.33%[12]。苗艳等对采集的50 份组织样品检测,GoAstV 的阳性率为70.00%,与GPV 混合感染率为4.00%[13]。最新研究发现,GoAstV可使番鸭和樱桃谷鸭发生肾出血、肿胀、内脏尿酸盐沉积,死亡率高达61%,结果表明GoAstV在家养水禽之间存在跨物种传播的可能,并且可以对水禽造成严重的危害[14-16]。因此,建立一种适合大规模快速检测GoAstV的方法对防控GoAstV的流行与传播意义重大。
目前,GoAstV 的检测主要以RT-PCR 为主,该方法需要采集鹅内脏器官提取病毒核酸后检测,大规模检测对于养殖户存在一定困难,并且GoAstV 为RNA 病毒,对检测人员和设备均具有较高的要求,不适合临床大规模监测;本研究首次建立的GoAstV间接ELISA 抗体的检测方法敏感度高、特异性强、重复性和稳定性好,可以用于临床样品中GoAstV 抗体的检测。Cap 蛋白是GoAstV 唯一的结构蛋白,ORF2 基因转录翻译后可被胰蛋白酶水解加工成VP34、VP27/29 和VP25/26,其中VP34 来自Cap 蛋白高度保守的N 端,组成病毒的衣壳结构,VP27/29 和VP25/26 来自Cap 蛋白高度变异的C 端,以二聚体形式组成病毒突起的外表面结构[4]。Cap 蛋白高度保守的N 端相对于其高度变异的C 端,具有更高的保守性且在病毒中含量高,是建立GoAstV血清学检测方法的首选抗原[4]。相对于包涵体蛋白,可溶性蛋白纯化简单,不需要溶解、复性等步骤,可大幅降低生产成本,且包涵体抗原性比可溶性蛋白差。为此,本研究根据GoAstV Cap 基因N 末端的保守区域,构建pCold I-Cap 重组原核表达质粒,经低温诱导表达纯化获得高纯度的可溶性rCap,经western blot 分析表明,rCap具有很好的反应原性。利用纯化的rCap 作为包被抗原,经各反应条件优化,最终确定了最佳反应条件,建立了GoAstV间接ELISA抗体的检测方法,且该方法特异性强、敏感性高、重复性好,与病毒中和试验的符合率较高为94.2%。利用建立的间接ELISA 方法对江西及周边省份采集的670 份鹅血清检测,结果显示GoAstV 可以感染各年龄段的鹅,总阳性率为32.0%,与Zhang 等的研究结果相似[1];调查数据还显示雏鹅GoAstV 抗体的阳性率最高,为42.3%(113/267),这也充分表明江西及周边地区GoAstV的感染水平较高。综上所述,本研究建立的GoAstV间接ELISA抗体的检测方法,可以用于临床GoAstV 的抗体检测,为GoAstV感染疫病的防控提供了切实可行的方法。

