铜绿假单胞菌oprD基因DNA疫苗和重组亚单位疫苗的免疫效果研究
宫 强,翟文汉,李雅静,田佳雨
(河南科技大学河南省食品微生物工程技术研究中心,河南 洛阳 471023)
铜绿假单胞菌又称绿脓杆菌,广泛分布于水、空气、土壤等自然环境以及人类和多种动物的皮肤、呼吸道及肠道中。该菌属于人畜共患条件性病原菌,是医院内部重要的致病菌之一,尤其是烧伤病人及重症监护室病人易感染该菌,常表现为肺炎、急性脑膜炎、败血症等,严重威胁着人类的健康[1]。除人类外,多种动物如禽类、水貂、猪、牛等也可感染铜绿假单胞菌,从而给养殖业造成危害。目前无论医学临床还是兽医临床上对于该菌的控制措施仍然以抗生素治疗为主。然而近年来,铜绿假单胞菌对多种抗生素如头孢菌素类、β 内酰胺类、碳青霉烯类等均产生了严重的耐药性,甚至对部分抗生素的耐药性达到了100%[2-4]。其中耐碳青霉烯类铜绿假单胞菌已被WHO 列为急需新药开发以控制感染的三大病原菌之一[5]。因此,需要采取更加有效的措施来预防和控制该病。对于细菌类疾病的防控,除应用抗菌药物外,疫苗免疫仍为有效的手段之一。目前关于铜绿假单胞菌疫苗的研究报道虽然不少,然而迄今为止在人医和兽医临床上均无可供选择的商品化疫苗,因此研制针对该菌的新型有效疫苗迫在眉睫。本研究构建了铜绿假单胞菌oprD基因的DNA 疫苗和重组亚单位疫苗,通过小鼠实验检测了两种疫苗单独应用及先后应用时诱导的免疫应答水平及为小鼠提供的保护效果,以期为铜绿假单胞菌新型疫苗的开发提供一定的参考。
1 材料与方法
1.1 菌种、实验动物及主要试剂铜绿假单胞菌CAU0792 株购自中国兽医药品监察所;健康6 周龄~8 周龄BALB/c 小鼠购自河南科技大学医学技术与工程学院;真核表达载体pcaggs-HA 由中国农业科学院哈尔滨兽医研究所王春来副研究员惠赠;原核表达载体pET-32a为本实验室保存;羊抗鼠HRP-IgG购自诺唯赞生物科技公司;限制性核酸内切酶SacI、NheI、BamH I 和XhoI 均购自TaKaRa 公司;小鼠IFN-γ 和IL-4 ELISA 检测试剂盒购自生工生物工程(上海)股份有限公司。
1.2oprD基因重组质粒的构建与鉴定根据铜绿假单胞oprD基因序列(KJ482590.1)及pcaggs-HA 的多克隆位点设计合成用于扩增该基因的PCR 引物:5′-CGAGCTCATGAAAGTGATGAAGTGGAGCGC-3′/5′-C TAGCTAGCTTACAGGATCGACAGCGGATAGTCGA-3′,下划线分别为SacI 和NheI 位点。以提取的铜绿假单胞菌基因组DNA 为模板,采用上述引物经PCR 扩增oprD基因,经序列测定正确后将其纯化片段SacI/NheI 双酶切后与同样经酶切处理的真核表达载体pcaggs-HA 连接,转化入大肠杆菌DH5α 感受态细胞,提取质粒,经上述两种限制性核酸内切酶酶切鉴定阳性的重组质粒命名为pOPRD。
1.3 重组OprD 蛋白亚单位疫苗、灭活疫苗和外膜蛋白疫苗的制备根据原核表达载体pET-32a 多克隆位点设计合成用于扩增oprD基因的特异性引物:5′-CGGGATCCATGAAAGTGATGAAGTGGAGCGC-3′/5′-CCCTCGAGTTACAGGATCGACAGCGGATAGTCGA-3′,下划线部分分别为BamH I 和XhoI 位点。以铜绿假单胞菌基因组DNA 为模板,采用上述引物PCR 扩增该基因并测序,随后将其与pET-32a 连接后转化入大肠杆菌DH5α 感受态细胞中,提取质粒进行酶切鉴定,阳性重组质粒命名为pET-OPRD。将pET-OPRD质粒转化入大肠杆菌BL21(DE3)感受态细胞中,以IPTG 诱导表达,并以Ni-IDA 蛋白纯化试剂盒对目的蛋白纯化后进行SDS-PAGE 分析,并测定重组蛋白浓度。随后向纯化后的重组蛋白中加入总体积6%的吐温-80 搅拌均匀后作为水相,将白油和司班-80 按照94∶6 的比例混匀,再向其中加入总体积2%的硬脂酸铝混合后作为油相,水相和油相按照1∶2 的比例混合后充分乳化,制备成重组OprD 蛋白亚单位疫苗,使其中的蛋白浓度为1 mg/mL。同时制备铜绿假单胞菌悬液并调整其浓度为2×1010cfu/mL,经甲醛灭活后按上述方法制备水相和油相,乳化后制备铜绿假单胞菌的灭活疫苗。同时参考文献[6]方法提取铜绿假单胞菌的外膜蛋白,并按照上述方法制备成外膜蛋白疫苗(OMP 疫苗)。
1.4 小鼠的免疫6 周龄~8 周龄健康BALB/c 小鼠共210 只,随机均分为7 组,分别为DNA 疫苗组、重组亚单位疫苗组、DNA 疫苗初免-重组亚单位疫苗加强免疫组(简称初免-加强免疫组)、外膜蛋白疫苗组、灭活疫苗组、空载体pcaggs-HA 对照组和PBS 对照组。大量制备重组质粒pOPRD 及空载体pcaggs-HA,以pH7.2 的PBS 调整至1 μg/μL。DNA 疫苗组、空载体pcaggs-HA 对照组和PBS 对照组的小鼠分别每只肌肉注射免疫100 μL 的重组质粒pOPRD、空载体pcaggs-HA 和PBS。重组亚单位疫苗组、外膜蛋白疫苗组和灭活疫苗组的小鼠分别每只背部皮下多点注射100 μL 的重组亚单位疫苗、OMP 疫苗和灭活疫苗。上述各组均免疫3 次,每次间隔2 周。初免-加强免疫组初次免疫时每只小鼠肌注100 μL 的重组质粒pOPRD,二免和三免时背部皮下注射100 μL 的重组亚单位疫苗。
1.5 各组小鼠血清特异性抗体检测上述各组小鼠以相应疫苗从初次免疫后第1 周开始,每周采血分离血清,分别以2×109cfu/mL 的铜绿假单胞菌菌悬液、20 μg/mL 的铜绿假单胞菌外膜蛋白和20 μg/mL纯化的重组OprD 蛋白为包被抗原,以1∶2 000 稀释的羊抗鼠HRP-IgG 为二抗,经间接ELISA方法测定各免疫组小鼠的血清特异性抗体水平,共检测6周[6]。
1.6 各组小鼠脾淋巴细胞增殖试验每次免疫后2周时,每组各随机取5 只小鼠,脱颈剖杀后按常规方法无菌分离制备脾淋巴细胞悬液,调整细胞浓度为1×107个/mL。于96 孔细胞培养板中加入50 μL上述细胞悬液,同时设立阴性对照孔,实验孔和阴性对照孔各设3 个重复。分别向各实验孔及阴性对照孔中加入50 μL 铜绿假单胞菌外膜蛋白和50 μL 细胞培养液。随后将其放置于37 ℃5% CO2培养72 h,再向各孔加入5 mg/mL 的MTT 10 μL,继续于CO2培养箱中反应3 h。随后离心弃上清,向各孔加入150 μL 的DMSO,37 ℃放置10 min,以酶标仪测定OD570nm值,按公式刺激指数(SI)=OD570nm(实验孔)/OD570nm(阴性对照孔)计算,分析各组小鼠脾淋巴细胞增殖情况。
1.7 各组小鼠脾淋巴细胞IFN-γ和IL-4 分泌水平的测定每次免疫2 周后,按上述方法制备各组小鼠的脾淋巴细胞悬液,以铜绿假单胞菌外膜蛋白刺激后在37 ℃5%CO2培养72 h,离心取上清,以小鼠IFN-γ 和IL-4 检测试剂盒测定各免疫组小鼠脾淋巴细胞分泌的这两种细胞因子浓度。
1.8 小鼠攻毒试验第3 次免疫后2 周时,以铜绿假单胞菌CAU0792 菌液对各免疫组剩余小鼠经肌肉注射攻毒,攻毒剂量为1.35×1010cfu/只,攻毒后继续饲养2 周,每日观察记录小鼠的存活情况,绘制各免疫组小鼠的存活曲线,计算保护率。
1.9 统计学分析采用SAS 9.4 统计学软件进行数据分析,采用单因素方差分析各疫苗组间差异,以P<0.05 为差异显著。
2 结 果
2.1 重组质粒pOPRD 和pET-OPRD 的酶切鉴定结果PCR 扩增铜绿假单胞菌的oprD基因,并将其分别与真核表达载体pcaggs-HA 和原核表达载体pET-32a 连接,转化入大肠杆菌感受态细胞后提取质粒,分别以限制性内切酶SacI/NheI 和BamH I/XhoI 双酶切鉴定。结果显示,琼脂糖凝胶电泳均出现1 340 bp的目的条带(图1),大小与预期相符。表明重组质粒pOPRD 和pET-OPRD 正确构建。
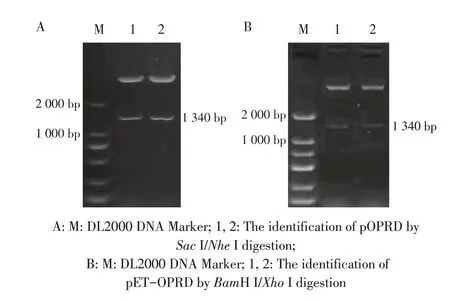
图1 重组质粒pOPRD(A)和pET-OPRD(B)的双酶切鉴定结果Fig.1 Electrophoresis of the two enzymes digestion of pOPRD(A)and pET-OPRD(B)
2.2 重组OprD 蛋白的表达及纯化结果将重组质粒pET-OPRD 转化入大肠杆菌BL21(DE3)感受态细胞中,以IPTG 进行诱导表达,并利用Ni-IDA 蛋白纯化试剂盒对目的蛋白进行纯化,纯化产物进行SDSPAGE 分析。结果显示,有分子量大小约为65 ku 重组目的蛋的表达,与预期大小一致,且经纯化后可得到较纯的特异性目的蛋白(图2),表明重组OprD蛋白正确表达,且获得了该纯化蛋白。经测定纯化蛋白浓度达2.36 mg/mL。
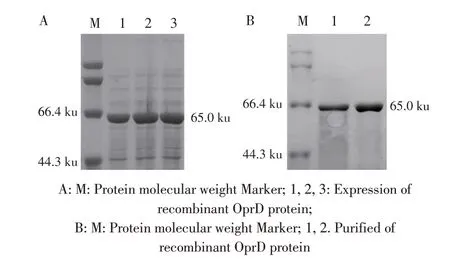
图2 重组OprD蛋白的表达(A)与纯化(B)鉴定结果Fig.2 Expression(A)and purification(B)of recombinant OprD protein
2.3 各组小鼠血清抗体检测结果初次免疫后每周断尾采血,分离血清,分别采用间接ELISA 方法测定各组小鼠的血清特异性抗体水平。结果显示,随着免疫次数的增加,各疫苗诱导的小鼠血清抗体水平均呈明显上升趋势,而pcaggs-HA 对照组和PBS 对照组的血清抗体则始终处于较低水平。初次免疫后,虽然以不同包被抗原检测到的各组抗体水平有所不同,但各疫苗组之间并无显著差异(P>0.05)。以铜绿假单胞菌菌悬液为包被抗原时的测定结果显示,二免后灭活疫苗组和外膜蛋白疫苗组的抗体水平仍无显著差异(P>0.05),但两者均显著高于其他各疫苗组。三免后灭活疫苗组的抗体水平显著高于外膜蛋白疫苗组(P<0.05),而外膜蛋白疫苗组则显著高于DNA 疫苗组、重组亚单位疫苗组和初免-加强免疫组(P<0.05),但后三者之间始终差异不显著(P>0.05)(图3A)。
以铜绿假单胞菌的外膜蛋白为包被抗原检测各疫苗诱导的小鼠血清抗体水平,结果显示,从第3 周开始外膜蛋白疫苗组的抗体水平显著高于其他疫苗组(P<0.05)。从第4周开始初免-加强免疫组和灭活疫苗组的抗体水平显著高于DNA 疫苗组和重组亚单位疫苗组(P<0.05)。初免-加强免疫组和灭活疫苗组之间始终无显著差异(P>0.05),DNA 疫苗组和重组亚单位疫苗组之间也始终无明显差异(P>0.05)(图3B)。
以重组OprD 蛋白为包被抗原检测各免疫组的血清抗体,结果显示,从第3 周开始,初免-加强免疫组和重组亚单位疫苗组的抗体水平显著高于DNA 疫苗组(P<0.05),而DNA 疫苗组又显著高于灭活疫苗组和外膜蛋白疫苗组(P<0.05),但初免-加强免疫组和重组亚单位疫苗组之间始终无明显差异(P>0.05)。从第4 周开始,外膜蛋白疫苗组的抗体水平显著高于灭活疫苗组(P<0.05)(图3C)。

图3 免疫小鼠血清抗体检测的结果Fig.3 The levels of serum antibodies in immunized mice
上述抗体检测结果表明,虽然以不同抗原检测到的各疫苗诱导小鼠产生的抗体水平差异较大,但总体上本研究制备的各类疫苗均可诱导小鼠产生较强的体液免疫应答水平。
2.4 各组小鼠脾淋巴细胞增殖试验结果每次免疫2 周后制备免疫小鼠脾淋巴细胞悬液,以铜绿假单胞菌外膜蛋白诱导后,采用MTT 法测定各组小鼠脾淋巴细胞的增殖水平,结果显示,初次免疫后各疫苗组小鼠脾淋巴细胞的SI值虽然有所不同,但在统计学上均无显著差异(P>0.05);第2次免疫后,DNA疫苗组的SI值显著低于其他4个疫苗组(P<0.05),而后四者之间则差异不显著(P>0.05);三免后,初免-加强免疫组和外膜蛋白疫苗组的SI 值显著高于重组亚单位疫苗组和灭活疫苗组(P<0.05),且重组亚单位疫苗组和灭活疫苗组的SI值又显著高于DNA疫苗组(P<0.05)(图4)。表明铜绿假单胞菌外膜蛋白诱导的初免-加强免疫组和外膜蛋白疫苗组小鼠的脾淋巴细胞增殖能力最强,重组亚单位疫苗组和灭活疫苗组次之,而DNA疫苗组则最差。

图4 免疫小鼠脾淋巴细胞的增殖试验结果Fig.4 Splenic lymphocytes proliferation in vaccinated mice
2.5 免疫小鼠脾淋巴细胞IFN-γ和IL-4 分泌水平测定结果每次免疫后2 周时制备免疫小鼠的脾淋巴细胞悬液,以铜绿假单胞菌的外膜蛋白为刺激物,利用ELISA 试剂盒检测各免疫组小鼠脾淋巴细胞分泌的IFN-γ 和IL-4的浓度。结果显示,初次免疫后各疫苗诱导小鼠脾淋巴细胞分泌的IFN-γ 和IL-4的浓度均无明显差别(P<0.05)。二免和三免后初免-加强免疫组小鼠分泌的IFN-γ 浓度显著高于其他各组(P>0.05)。虽然第2 次免疫后灭活疫苗组和外膜蛋白疫苗组的IFN-γ 浓度与DNA 疫苗组和重组亚单位疫苗组之间无显著差异(P>0.05),但第3 次免疫后前两组小鼠脾淋巴细胞分泌的IFN-γ 浓度显著高于后两组(P<0.05)(图5A)。IL-4 检测结果则与脾淋巴细胞增殖试验结果类似,二免和三免后初免-加强免疫组、外膜蛋白疫苗组、重组亚单位疫苗组和灭活疫苗组小鼠脾淋巴细胞分泌的IL-4 浓度显著高于DNA 疫苗组(P<0.05)。且三免后初免-加强免疫组和外膜蛋白疫苗组的IL-4浓度高于重组亚单位疫苗组和灭活疫苗组(P<0.05)(图5B)。表明各疫苗均具有一定的诱导免疫小鼠产生IFN-γ 和IL-4的能力,尤以DNA疫苗初免-重组亚单位疫苗加强免疫时效果更好。
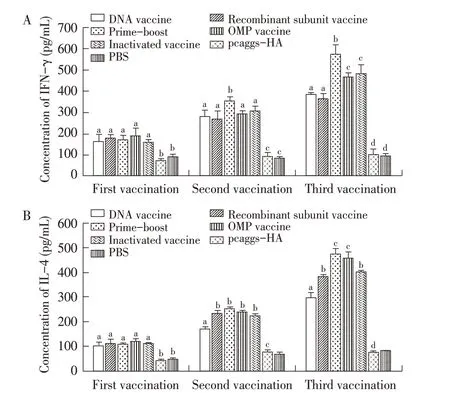
图5 免疫小鼠脾淋巴细胞分泌的IFN-γ(A)和IL-4(B)水平Fig.5 Levels of IFN-γ(A)and IL-4(B)from spleen lymphocytes of vaccinated mice
2.6 小鼠免疫保护试验结果各免疫组小鼠于三免2 周后以铜绿假单胞菌攻毒,继续饲养观察2 周,绘制小鼠的存活曲线,计算保护率。结果显示,空载体pcaggs-HA 对照组和PBS 对照组的小鼠在攻毒后4 d 内迅速死亡。DNA 疫苗组小鼠在攻毒当天即出现死亡现象,而其余各免疫组则在攻毒后2 d 陆续出现死亡小鼠。DNA 疫苗组、重组亚单位疫苗组、初免-加强免疫组和外膜蛋白疫苗组的小鼠分别于第6 d、第5 d、第4 d 和第4 d 后存活数量不再发生变化,灭活疫苗组仅在攻毒后2 d 死亡一只小鼠。上述各免疫组的保护率分别为53.3%、60%、73.3%、80%和93.3%(图6)。表明以铜绿假单胞菌oprD基因制备的DNA疫苗和重组亚单位疫苗均可为免疫小鼠提供一定的临床保护,且两者采用初免-加强免疫策略时的效果优于各单一疫苗免疫。

图6 攻毒后各组小鼠存活曲线Fig.6 Survival curve of vaccinated mice after challenge
3 讨 论
铜绿假单胞菌作为重要的人畜共患病原菌之一,近年来因其耐药性的迅速增强而受到研究者和临床医学工作人员的关注。为解决该病原菌的耐药性所带来的临床治疗之难题,研制针对该菌的有效疫苗势在必行。虽然目前尚无可用的商品化疫苗,但针对铜绿假单胞菌的多种疫苗包括灭活疫苗、重组亚单位疫苗、DNA 疫苗、多表位疫苗等均有相关研究报道[7-10]。本研究室前期以铜绿假单胞菌的oprL、oprF和flgE基因构建了多种单价DNA 疫苗、融合DNA 疫苗和联合DNA 疫苗,动物试验结果显示融合和联合DNA 疫苗的免疫效果优于单价DNA 疫苗,但仍不及灭活疫苗[11-14]。因此需进一步研究更加有效的铜绿假单胞菌新型疫苗。
DNA 疫苗和重组亚单位疫苗自上世纪八九十年代问世以来,因具有工艺简单、成本较低、性质稳定等优点而备受关注,两种疫苗均可诱导较为有效的体液免疫应答和细胞免疫应答反应[15-16]。选择有效的抗原基因是影响新型疫苗免疫效果的关键因素之一。目前可用于相关新型疫苗研究的铜绿假单胞菌免疫原基因包括外膜蛋白基因、鞭毛蛋白基因以及外毒素基因等[17],其中又以外膜蛋白基因制备重组亚单位疫苗和DNA 疫苗的研究报道较多。铜绿假单胞菌的外膜蛋白对于该菌的生长繁殖、环境适应、致病性及耐药性均起到至关重要的作用。由于不同血清型铜绿假单胞菌的外膜蛋白具有高度的一致性,因此外膜蛋白是该菌理想的候选疫苗分子。在铜绿假单胞菌的外膜中至少存在D、E、F、G、H 等16 种外膜蛋白[18],其中OprD 蛋白是铜绿假单胞菌对碳青霉烯类抗生素耐药的主要介质,与细菌的耐药性关系密切,且有研究表明该蛋白具有一定的免疫原性[19-21]。但以该蛋白编码基因制备新型疫苗的相关报道较少。本研究以oprD基因同时制备了DNA 疫苗和重组亚单位疫苗,检测了两种疫苗单独免疫和采用DNA 疫苗初免-重组亚单位疫苗加强免疫策略时的免疫效果。
血清抗体水平可反映疫苗诱导体液免疫应答的能力,本研究测定了各疫苗免疫后小鼠针对铜绿假单胞菌菌悬液、外膜蛋白和重组OprD 蛋白产生的血清特异性抗体水平。由于包被抗原不同,因此检测到的各疫苗诱导的抗体水平也有所不同。分析结果可知,当包被抗原与疫苗成分相同或相近时,测得的抗体水平最高,例如以铜绿假单胞菌菌悬液为包被抗原时测得的灭活疫苗组的血清抗体水平明显高于其他各组,而分别以外膜蛋白和重组OprD 蛋白为包被抗原时测得的外膜蛋白疫苗组和重组亚单位疫苗组的抗体水平则相对较高。总体而言,DNA 疫苗初免-重组亚单位疫苗加强免疫时诱导免疫小鼠抗体应答的能力优于两种疫苗单独免疫。
免疫小鼠的淋巴细胞增殖水平和细胞因子分泌水平可在一定程度上反映疫苗诱导机体免疫应答能力的高低。本研究测定了铜绿假单胞菌外膜蛋白诱导下各免疫组小鼠脾淋巴细胞的增殖水平及其分泌的Th1 型细胞因子IFN-γ 和Th2 型细胞因子IL-4 的浓度。结果表明随着免疫次数的增加,各疫苗诱导的免疫小鼠脾淋巴细胞增殖能力和两种细胞因子的分泌水平均有所提高。第2 次和第3 次免疫后,初免-加强免疫组的IFN-γ 浓度明显高于其他各组,表明以oprD基因的DNA 疫苗初免后再以该蛋白的重组亚单位疫苗加强免疫可诱导较好的Th1 型免疫应答。三免后初免-加强免疫组的SI 值和IL-4 的浓度与外膜蛋白疫苗组相当,显著优于其他各组,表明初免-加强免疫也可诱导较好的Th2 型免疫应答。攻毒试验结果也显示DNA 疫苗初免-重组亚单位疫苗加强免疫为小鼠提供的保护效果优于DNA 疫苗单独免疫和重组亚单位疫苗单独免疫。本研究首次以铜绿假单胞菌的oprD基因制备了DNA 疫苗和重组亚单位疫苗,并以初免-加强免疫的方式检测了两种疫苗联合应用时的免疫效果,从而为铜绿假单胞菌新型疫苗及其免疫策略的研究奠定了基础,为铜绿假单胞菌相关疾病的防控提供了实验参考。

