氟通过AKT/mTOR/ULK1 信号通路对破骨细胞自噬的影响
张馨怡,刘文涛,李利娟,柴冰茹,徐枭喻,白生宾
新疆医科大学基础医学院 组织学与胚胎学教研室,新疆乌鲁木齐 830000
地方性氟中毒是我国“十四五”期间地方病学优先发展领域之一,有研究显示部分地区地表水氟含量超标,并呈现季节性变化。截至2020 年底,我国仅饮水型地方性氟中毒病区县达1 041个,病区村更高达7 万余个,数十万儿童患氟斑牙、氟骨症[1-2]。骨稳态依赖于破骨细胞对骨的吸收和成骨细胞的骨形成作用,并达到动态平衡。这种紧密耦合过程的失衡会破坏骨形成-骨吸收稳态,导致骨质疏松等骨溶解性疾病。适量氟可诱导成骨细胞分化或抑制破骨细胞功能从而促进成骨,使骨质增多,促进钙沉积,而过量氟可促进破骨细胞骨过度吸收导致脆性骨折等疾病。因此,研究影响破骨细胞骨吸收相关因素对骨溶解性疾病的治疗至关重要。一定量的氟可影响破骨细胞的生成和活化,破骨细胞活化后的骨吸收过程又与自噬密切相关,自噬是细胞物质被溶酶体或液泡降解并循环利用的过程,但自噬在适量氟影响破骨细胞骨吸收过程中的作用机制尚未阐明。本研究以RAW264.7 细胞诱导形成的破骨细胞为研究对象,氟化钠、自噬抑制剂氯喹、自噬激动剂雷帕霉素干预后,分析AKT/mTOR/ULKl信号通路在氟离子调控破骨细胞自噬中的可能作用机制,探究氟对骨吸收产生的影响,一方面探索一定剂量的氟是否能作为骨保护因素抑制骨吸收,一方面为慢性氟中毒的公共预防和治疗提供更充分有效的理论依据。
材料与方法
1 细胞、主要试剂和仪器 采用RAW264.7细胞诱导形成的破骨细胞和配套专用培养基(武汉普诺赛生命科技有限公司),磷酸盐缓冲液(美国GIBCO 公司),氟化钠(NaF;天津致远化学试剂有限公司),自噬抑制剂氯喹(CQ;美国MedChemExpress 公司),自噬激动剂TTNPB(RAP;美国MedChemExpress 公司),p-AKT(瑞士Bioss 公司),p-mTOR(瑞士Bioss 公司),p-ULK1(瑞士Bioss 公司),SYBR Green PCR 试剂盒(北京全式金生物技术有限公司),逆转录试剂盒(赛默飞世尔科技有限公司),SDS-PAGE 凝胶快速制备试剂盒(Biosharp 公司),Rb anti-beta-Actin(瑞士Bioss 公司)。CO2恒温培养箱(美国精骐),倒置生物显微镜系统(宁波舜宇仪器有限公司),荧光显微镜(宁波舜宇仪器有限公司),酶标仪(北京凯奥公司),激光共聚焦显微镜(日本尼康公司),梯度PCR 仪(美国伯乐公司),超微量分光光度计(北京凯奥公司)。
2 细胞培养 本实验分为破骨细胞(Control)组、破骨细胞+氟(NaF) 组、破骨细胞+CQ(CQ)组、破骨细胞+CQ+氟(CQ+NaF) 组、破骨细胞+RAP(RAP)组、破骨细胞+RAP+氟(RAP+NaF)组。将诱导形成的破骨细胞培养于专用高糖DMEM完全培养基,于37℃、5% CO2培养箱中培养,取对数期细胞轻轻拍打培养瓶底将细胞拍打下来,用移液枪吹打混匀,转移至15 mL 的离心管中,室温下1 000 r/min 离心5 min,弃去上清,加入1 mL 完全培养基重悬,轻轻吸至24 孔板中,每孔加500 mL 培养基,放置于细胞培养箱中继续培养。
3 激光共聚焦显微镜检测自噬小体 采用激光共聚焦显微镜专用培养皿,加入细胞悬液,放入培养箱中静置24 h,等待细胞贴壁取对数生长期细胞根据分组进行刺激。课题组前期研究结果显示氟化钠10 mg/L 刺激24 h 为最佳刺激浓度和时间,因此NaF 组给予氟化钠10 mg/L 刺激,24 h后进行检测;CQ 组给予自噬抑制剂CQ 5 mmol/L;CQ+NaF 组给予10 mg/L NaF、5 mmol/L CQ 刺激24 h;RAP 组给予自噬激动剂RAP 5 mmol/L;RAP+NaF 组给予10 mg/L NaF、5 mmol/L RAP刺激24 h。吸出培养基,PBS 清洗3 遍,每次3 min。2% 多聚甲醛溶液固定20 min,吸出固定液,PBS 清洗3 遍,每次3 min。加入0.1% Triton X-100 进行细胞透化,15 min 后,吸出液体,用PBS 清洗3 遍,每次3 min。加入BSA 封闭20 min,去除BSA,用PBS 清洗3 遍,每次3 min,加入一抗p-AKT 抗体4℃孵育过夜。吸出一抗,用PBS 清洗3 遍,每次3 min,加入荧光二抗37 ℃孵育1 h,用PBS 清洗3 遍,每次3 min,加入DAPI 细胞核衬染10 min,用PBS 清洗3 遍,每次3 min,上机镜检。荧光二抗为红色荧光566 nm,DAPI 为蓝色荧光359 nm,采图。
4 荧光定量PCR 检测各组细胞Cathepsin K 和TRAP 的基因表达水平 吸净培养液,收集细胞采用Trizol 法提取mRNA,用RNase-Free 的水溶解RNA 沉淀,浓度测定。逆转录cDNA 共20 μL体系:RNA 5 μL;Random Primer 1 μL;Waternuclease-free 6 μL ;5 × Reaction Buffer 4 μL;RiboLock RNase Inhibitor 1 μL;10 mmol/L dNTP Mix 2 μL;RevertAid M-MuLV RT 1 μL。程序设定42℃变性60 min;25℃退火5 min;70℃延伸5 s,-80℃保存。荧光定量PCR 检测各组骨吸收基因Cathepsin K 和TRAP 的基因表达水平,共20 μL 体系:SYBR® Select Master Mix 10 μL;上下游引物分别0.5 μL;模板2 μL;ddH2O 7 μL。程序设定94℃预变性30 s;94℃变性5 s,60℃退火30 s,45 个循环;4℃保存。见表1。
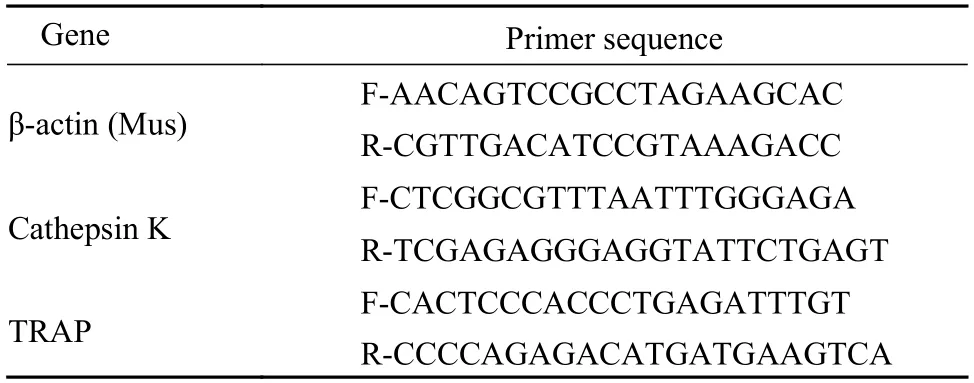
表1 Cathepsin K 与TRAP 引物序列Tab.1 Cathepsin K and TRAP primer sequence
5 Western blotting 检测各组细胞中p-AKT、pmTOR、p-ULK1 蛋白表达水平 定量后的蛋白采用SDS-PAGE 分离,用45μm 孔径PVDF 膜湿转法进行转膜,脱脂奶粉室温封闭1 h,TBST 洗膜3 次,每次10 min。p-AKT、p-mTOR、p-ULK1一抗室温孵育10 min,4℃过夜,TBST 洗膜3 次后加入Goat anti-rabbit lgG/HRP 二抗室温孵育1 h。用TBST 洗膜3 次,每次10 min。ECL 加到膜上后反应3~ 5 min,化学发光成像系统自动曝光,保存图片。
6 统计学方法 本实验采用Image J 制图。各组之间比较采用GraphPad Prism 8.3.0 软件包进行单因素方差分析并制图。P<0.05 为差异有统计学意义。
结 果
1 激光共聚焦显微镜示自噬小体 红色荧光示自噬小体,蓝色荧光示细胞核。与Control 组相比,NaF 组、RAP 组、RAP+NaF 组明显促进自噬小体的产生(P<0.05),CQ 组明显抑制自噬小体的产生(P<0.05)。见图1、图2。

图1 激光共聚焦显微镜示自噬小体 A:Control 组;B:NaF组;C:CQ 组;D:CQ+NaF 组;E:RAP 组;F:RAP+NaF 组Fig.1 Laser confocal microscopic examination of autophagy bodies A: Control group;B: NaF group;C: CQ group;D: CQ+NaF group;E: RAP group;F: RAP+NaF group

图2 自噬小体数量(aP<0.05,bP<0.01,vs Control)Fig.2 Number of autophagosomes (aP<0.05,bP<0.01,vs Control)
2 荧光定量PCR 检测各组骨吸收基因Cathepsin K 和TRAP 的基因表达水平 与Control 组相比,Cathepsin K 基因在NaF 组、CQ 组、CQ+NaF组、RAP+NaF 组中表达量均明显降低;TRAP基因在NaF 组、CQ+NaF 组、RAP+NaF 组中表达量均明显降低,在RAP 组中表达量明显升高。见图3。

图3 各组Cathepsin K 与TRAP 基因的表达量(aP<0.05,bP<0.01,vs Control)Fig.3 Expression levels of Cathepsin K and TRAP genes in each group (aP<0.05,bP<0.01,vs Control)
3 Western blotting 检测各组细胞中p-AKT、pmTOR、p-ULK1 蛋白表达水平 与Control 组相比,p-AKT 在NaF 组(P<0.05)、CQ+NaF 组(P<0.05)、RAP 组(P<0.01)、RAP+NaF 组(P<0.01) 中蛋白表达量上调,差异有统计学意义。与Control 组相比,p-mTOR 在NaF 组(P<0.01)、CQ+NaF 组(P<0.05)、RAP 组(P<0.01)、RAP+NaF 组(P<0.01)中蛋白表达量上调,差异有统计学意义。与Control 组相比,p-ULK1 在RAP 组(P<0.01)、RAP+NaF 组(P<0.01) 中蛋白表达量上调,差异有统计学意义。见图4、图5。

图4 各组细胞中p-AKT、p-mTOR、p-ULK1 蛋白表达量Fig.4 Protein expression levels of p-AKT,p-mTOR and p-ULK1 in cells of each group

图5 各组细胞中p-AKT(A)、p-mTOR(B)、p-ULK1(C)蛋白表达水平(aP<0.05,bP<0.01,vs Control)Fig.5 Protein expression levels of p-AKT (A),p-mTOR (B) and p-ULK1 (C) in cells of each group (aP<0.05,bP<0.01,vs Control)
讨 论
氟作为人体必需的微量元素,对青少年骨骼和牙齿的发育尤为重要,2.6 g 氟能够维持成年人身体健康,但摄入过量会造成体内氟蓄积,引起氟中毒。氟中毒是一种世界性地方病,我国地方性氟中毒主要为饮水型、燃煤污染型和饮茶型。氟对骨亲和力很强,过量氟导致的氟骨病分为骨质疏松型、骨软化症和骨硬化型,当前研究的热点集中在氟对骨细胞、成骨细胞、破骨细胞的激活或抑制作用,但骨相关疾病中一定剂量氟如何对破骨细胞产生作用导致骨吸收或抑制骨吸收仍未有明确定论。
本研究发现10 mg/L 氟能够促进自噬小体的形成从而增强自噬。当细胞受到氟刺激时,自噬是选择性清除受损细胞器以实现细胞成分循环的一种方式,其中自噬小体形成是一个受调控的膜重塑过程,涉及自噬体膜前体的产生、自噬体膜前体的组装-形成吞噬体、吞噬体的伸长-完成自噬小体的形成。自噬小体的运输及其与溶酶体的融合是完成自噬成熟和降解的重要步骤[3]。
自噬一定程度上可维持正常骨代谢,但自噬水平过高则引起骨相关细胞凋亡,加剧骨吸收,造成溶骨性疾病。破骨细胞通过分泌盐酸和蛋白水解酶,包括Cathepsin K 和TRAP,溶解矿物质和降解有机成分,并广泛存在于破骨细胞和骨吸收陷窝内[4-6]。Cathepsin K 是一种参与骨吸收的溶酶体半胱氨酸蛋白酶,主要作用机制是其可以切割占骨有机基质90%以上的1 型胶原的螺旋和末端肽区域从而致溶骨。TRAP 也被称为紫色酸性磷酸酶,50 多年来一直是破骨细胞和骨吸收的确定标志物,能够脱磷酸化骨基质蛋白,如骨桥蛋白、整合素结合唾液蛋白等,并产生活性氧以降解骨基质,与骨密度呈负相关。本研究显示自噬抑制剂CQ 降低破骨细胞自噬,CQ 能协同氟对Cathepsin K 基因和TRAP 基因进行下调;自噬激动剂RAP 能够增强破骨细胞自噬,氟拮抗RAP 激动自噬的作用,抑制TRAP 基因上调。综上所述,10 mg/L 氟刺激24 h 后能降低Cathepsin K 基因与TRAP 基因的表达,从而抑制破骨细胞骨吸收能力。
蛋白激酶B(protein kinase B,AKT)及其下游分子哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)与破骨细胞增殖和活化密切相关。微管蛋白1 轻链3(LC3)通过Kindlin3 介导内外信号调节整合素的激活,从而影响破骨细胞的迁移和最上游AKT 的激活[7-9]。mTOR 作为细胞代谢活动的中转站,被认为是调节细胞生长、增殖、分化、自噬和凋亡等最基本细胞功能的关键因子,其活性取决于生长因子、激素、营养和应激信号,此外mTOR 在决定骨稳态方面也起着重要作用,是破骨细胞成熟和存活所必需的。mTOR早期作为自噬负调控因子受AKT 活化的影响,晚期激活自噬,形成的自噬小体为促进骨髓间充质干细胞向成骨细胞分化提供能量,促进成骨,减少骨吸收[10]。在体内,mTOR 激活显著降低幼龄大鼠破骨细胞数量。在体外,mTOR 信号通路激活可减少小鼠的破骨细胞增殖,但也有学者报道,mTOR 活化后促进破骨细胞增殖并加剧骨吸收[11-12],本研究显示10 mg/L 氟化钠刺激24 h 后,通过上调p-AKT 和p-mTOR 的表达可促进破骨细胞自噬,mTOR 磷酸化水平升高,同时降低Cathepsin K 和TRAP 基因的表达,一方面增强自噬,一方面降低骨吸收活性,可能与破骨细胞体外能量代谢方式不同有关,也可能该刺激时间点位于破骨细胞循环中正在分裂的阶段,或分裂后待融合阶段,导致破骨细胞骨吸收相关基因表达水平的降低[13-14]。ULK1 通常参与调节骨稳态和骨溶解性转移,ULK1 表达上调可抑制破骨细胞分化,主要作用于PIK3C3 上游,磷酸化FLCN,促进自噬。AKT/mTOR 的活化晚期可诱导ULK1、ATG13、FIP200 聚合,诱导产生自噬膜,从而启动自噬小体的形成,而自噬小体的数量和分布又与破骨细胞的凋亡密切相关,自噬小体数量增加[15-19],与本研究显示氟能协同RAP 使p-ULK1表达量增高,增强自噬结果一致,ULK1 激活后可能延缓破骨细胞衰老,但氟干预加剧自噬,可能导致其走向凋亡,也可能是破骨细胞循环的中间环节,致使其分裂为子细胞作为破骨细胞的储备细胞。
以10 mg/L 氟给药能够抑制骨吸收,可能对维持骨骼结构和功能有一定程度的积极作用,但氟作为药物在体内可能存在脱靶效应和潜在的不良反应,对于氟诱导自噬致破骨细胞骨吸收的抑制靶点和氟在体内影响破骨细胞形成、活性、功能仍需深入研究。

