乙醇和谷氨酰胺转氨酶联合处理对乳清分离蛋白凝胶特性的影响
曾涣煌,梁秀萍,李思琪,刘夫国
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
蛋白质作为重要的生物大分子之一,在传统以及新型食品中具有关键作用。蛋白质的凝胶特性是蛋白质获得理想感官和质构的重要性质,调控蛋白质的凝胶特性可以扩展其在食品工业领域中的应用。乳清分离蛋白(WPI)因具有丰富的营养和优良的凝胶特性,在蛋白质凝胶的生产与应用中占据重要地位。从结构上看,WPI由一系列球状蛋白组成,包括α-乳白蛋白(α-lactalbumin)、β-乳球蛋白(β-lactoglobulin)、牛血清白蛋白(BSA)、免疫球蛋白等[1]。在营养价值方面,WPI具有较高的生物活性和支链氨基酸含量,拥有含硫氨基酸,可以维持体内谷胱甘肽的水平,且具有抗癌等特性[2]。
WPI凝胶的制备方式分为热处理和冷诱导,二者在原理上都是对WPI采取一定的变性处理。其中,热处理为传统制备方法。当体系加热至85℃以上时,WPI通过硫醇/二硫键交换机制产生的共价键和氢键、疏水相互作用、静电作用、范德华力等非共价相互作用,形成随机交联的聚集体[3]。热处理工艺虽然简单,但其能耗较高且不利于凝胶中热敏性化合物的递送[4];此外,WPI凝胶的热变性过程还会受到蛋白质浓度、离子强度和pH值的影响。因此,出现了以预热处理为起点的WPI冷诱导凝胶制备方式。WPI冷诱导凝胶制备主要分为两个阶段,一是预热高于等电点的中性(pH≈7.0)低离子强度蛋白质溶液,使其在一定程度上变性以形成可溶性聚合物(稳定的分散体);二是进行酸化以达到等电点,形成酸诱导的冷凝胶,或者添加单价、二价和多价阳离子盐以降低蛋白间的排斥力,形成盐诱导的冷凝胶。与传统的热处理凝胶相比,冷诱导凝胶显示出诸多优越性能,如更高的凝胶强度和持水能力以及更低的临界凝胶浓度[5]。Ni等研究了WPI分子聚集行为对预热温度以及蛋白质和钙浓度的依赖性[6]。Kharlamova等也对酸诱导的WPI凝胶化进行了研究,证实热激活酸诱导WPI凝胶的胶凝速率显著高于钙处理凝胶[7]。与热处理法相比,冷诱导胶凝通过变性引发WPI分子内部不同官能团暴露,使其中的多肽链之间产生氢键、静电和疏水相互作用,进而加强凝胶的空间结构及稳定性。
近年来,随着WPI凝胶在食品工业应用中的纵向深入,通过酶和醇改性WPI使其形成冷诱导凝胶的方法得到关注,分别采用谷氨酰胺转氨酶(TG酶)交联和乙醇诱导WPI制备冷凝胶的方法得到了更多的研究与完善。TG酶的最佳酶促温度在50 ℃左右,其在约1 h内即可高效修饰WPI,使WPI部分交联形成分子量在55~200 kDa的高分子量聚合物[8],其作用机制为催化蛋白质中赖氨酸(Lys)上ε-氨基和谷氨酸(Gln)上γ-羟基酰胺基之间的结合反应,形成ε-(γ-谷氨酰胺基)赖氨酸异肽键(G-L共价键),该键强度是氢键和疏水相互作用力的20倍左右[9]。WPI中α-乳白蛋白和β-乳球蛋白固有的球状结构(二硫键包埋其中)及氨基酸构成决定了其表面具有较少的TG酶作用位点,不利于酶促反应[10-11],故单纯使用TG酶改性需要预热处理WPI以暴露更多的酶促位点。该操作虽然能够使凝胶结构更为致密,但易破坏体系中的热敏性成分,较难匹配凝胶生产的多样性。
乙醇作为一类小分子有机溶剂,具有亲水性羟基(—OH)和疏水短碳链(CH3—CH2—),为两亲分子,可与蛋白质发生不同作用。在对蛋白质的影响上,乙醇的低极性会使蛋白质周围的电荷密度发生变化,进而使相对疏水的基团暴露[12]。Yoshizawa等的研究也表明乙醇能够通过改变带电基团的自由能来增强分子间的静电排斥力,并与溶质-溶剂相互作用,协同决定蛋白质-蛋白质相互作用的程度,使蛋白质在宏观上出现可溶性聚集体或沉淀[13]。Kleemann等对此做出了详细解释:由于乙醇导致体系相对介电常数降低,蛋白质上的部分反离子失去迁移率并在带电荷的氨基酸侧链上积累,产生偶极-偶极相互作用,形成新的更强的疏水相互作用和氢键,进而造成分子的致密堆积,宏观上即形成凝胶[14]。选用乙醇诱导的WPI凝胶优势在于其可作为递送体系保护热敏成分(例如维生素B1和益生菌等)[4]。此外,热诱导WPI的临界质量分数为10%~12%[15],而乙醇诱导形成WPI凝胶的方法可以通过提高乙醇浓度及加快变性速率来降低WPI的成胶临界浓度[16]。综上,乙醇诱导处理对TG交联的WPI冷凝胶具有工艺优化、提质增效等实际生产意义。但乙醇对TG酶也具有一定程度的变性作用,会干扰TG酶的酶促作用,故需要寻求二者协同的最佳工艺以制备优质的WPI冷凝胶。
本文旨在探究乙醇诱导与TG酶交联对WPI改性的相互作用,揭示冷诱导WPI凝胶的形成机理并表征其各项性能;进而寻求WPI凝胶的最优制备工艺,使在一定蛋白质浓度下能够形成性状更为优良的WPI凝胶,提高WPI凝胶的生产效率和质量,满足当下新型蛋白凝胶食品的多元化需求。
1 材料与方法
1.1 材料与仪器
乳清分离蛋白(纯度90%),上海普洛钦国际贸易有限公司;谷氨酰胺转氨酶(活性120 U/g),江苏一鸣生物有限公司;无水乙醇(分析纯),天津市致远化学试剂有限公司;Fast Green F7252,西格玛奥德里奇贸易有限公司。
84-1A多头磁力搅拌器,金坛区西城新瑞仪器厂;TA Q2000差示扫描量热仪,美国TA仪器公司;DHR-1流变仪,美国Waters公司;LGJ-10C冷冻干燥机,北京四环科学仪器厂有限公司;S-3400N扫描电子显微镜,日本日立公司;LECIA TCS SP8生物激光共聚焦显微镜,德国莱卡公司;TA.XT Plus物性测定仪,英国Stable Micro Systems Ltd公司;Vetex70傅里叶近红外光谱仪,德国布鲁克公司;5804R高速冷冻离心机,德国Eppendorf公司;JM-B电子天平,余姚市纪铭称重校验设备有限公司;PB-10 pH计,计赛多利斯科学仪器(北京)有限公司;QL-901涡旋混合器,海门市其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 水凝胶的制备
配制质量浓度120 g/L的WPI溶液,室温下过夜搅拌使其充分溶解;用2 mol/L的NaOH溶液将WPI溶液的pH值调至7.0;WPI溶液在8 000 r/min条件下离心20 min,取上清液。设置2组样品,乙醇-TG酶联合处理组中添加TG酶溶液,控制酶活力为120 U/g;向单独乙醇处理组添加等体积的蒸馏水作为空白。将2组样品共置于50 ℃水浴锅中,水浴2 h,使乙醇-TG酶联合处理组的TG酶交联WPI;交联结束后冷却样品至常温并向2组样品中添加无水乙醇,控制乙醇的最终体积分数分别为0、30%、40%、50%、60%,室温下静止4 h,形成冷诱导WPI凝胶。
1.2.2 扫描电子显微镜(SEM)观察
通过SEM观察水凝胶的微观结构。将冷冻干燥后的样品固定在双面胶带上,再涂上一层30 nm金色的溅射涂层,使其导电45 s,在320 V条件下放大1 000倍对其表面结构进行观测。
1.2.3 生物激光共聚焦显微镜(CLSM)观察
参考Wagner等的方法并加以调整,借助CLSM观察WPI凝胶的微观结构[17]。控制WPI溶液和乙醇的总体积为100 μL,按照此前设计的梯度浓度将适量WPI溶液滴加于载玻片的空腔内,添加10 μL Fast Green(质量浓度0.1 g/L,溶于蒸馏水)对WPI溶液进行染色,随后在载玻片空腔内滴加乙醇使其诱导WPI变性,最后盖上盖玻片孵育2 h,待其在腔内形成凝胶后放置于4 ℃冰箱内贮存24 h稳定,并最大限度减少测量前水或乙醇的蒸发。观测时,用波长633 nm的He-Ne激光扫描记录,在40倍物镜下获得CLSM图像,最后在x-y平面上将图像大小调整为2 048×2 048像素,平均8次扫描来生成每张图像,且所有测量均在20 ℃下进行并至少平行3次。
1.2.4 差示量热扫描(DSC)分析
使用DSC对冻干样品的热行为进行测定。将冻干后的样品研磨成粉末,在50 ℃下干燥48 h,取3.0 mg样品置于铝盘中,用铝盖密封。样品以10 ℃/min的加热速率从20 ℃加热到200 ℃。记录DSC曲线,依据热分析图分析样品的变性温度峰值(Td)和变性焓(ΔH)。
1.2.5 傅里叶变换红外光谱(FT-IR)分析
参照Yu等的方法,通过傅里叶变换红外光谱仪记录WPI凝胶样品的红外光谱[18]。将冻干样品2 mg与198 mg 溴化钾(KBr)混合,研磨成细粉压片,在4 000~400 cm-1波数范围内扫描64次,观察其在酰胺A、B带和酰胺Ⅰ、Ⅱ、Ⅲ带的吸收峰变化。用OMNIC 8.2数据处理软件对原始数据的酰胺Ⅰ带(1 700~1 600 cm-1)进行二阶导数处理,并用9个平滑点的Savitzky Golay算法分析WPI凝胶样品吸收峰的变化。
1.2.6 流变特性分析
参照Liang等的方法,使用动态剪切流变仪表征水凝胶的流变性质[19]。在25 ℃条件下,使用40 mm平行板,设置间距为1 mm。在样品外缘涂上一层薄薄的硅油,防止水分蒸发。频率扫描使用1%的固定应变,从0.1~100 rad/s来确定水凝胶的储能模量(G′)和损耗模量(G″)。G′反映水凝胶的弹性(类固相)性质,G″反映其黏性(类流体)性质。损耗角正切值(Tanδ)为G″与G′之比(G″/G′),Tanδ值小于1为类固体性质,大于1为类流体性质。流动扫描在剪切速率为0.1~100 s-1范围内测定水凝胶表观黏度(η)的变化。
1.2.7 持水力测定
参照Yu等的方法[18],将2 g样品置于10 mL离心管内,在10 000 r/min条件下离心10 min,过滤除去上清液,记录离心前后样品的质量,并计算持水力(CWH):
CWH=(M2-M1)/(M3-M1)×100%。
(1)
式中:CWH代表持水力;M1代表空离心管的质量(g);M2代表样品离心后的总质量(g);M3代表样品离心前的总质量(g)。
1.2.8 硬度测定
在50 mL烧杯中制备WPI凝胶,然后使用配有P/0.5R圆柱形测试探头的物性测定仪测定硬度。采用的测量参数为:预试速度1.0 mm/s,测试速度1.0 mm/s,触发力3 g,测试后速度1.0 mm/s,穿刺距离10.0 mm,测量温度25 ℃。使用仪器提供的软件计算凝胶硬度,每个样品平行测定3次。
1.2.9 数据处理
对每个样本进行3次独立的重复分析,结果表示为3个测定的平均值。所有图都由Origin 8.6绘制,采用单因素方差分析(ANOVA)及Duncan多极差检验,比较两组均值间的显著性差异,P<0.05。
2 结果与分析
2.1 WPI凝胶的结构表征
2.1.1 样品外观
单独乙醇诱导组和乙醇-TG酶联合处理组WPI的外观如图1所示。当乙醇体积分数为0时,单独乙醇诱导组和乙醇-TG酶联合处理组样品宏观上均呈流动态;当乙醇体积分数为30%时,单独乙醇处理组的黏度增加,但并未形成倒置凝胶,而乙醇-TG酶联合处理组形成固态凝胶,这是由于较低乙醇浓度对WPI的改性不充分,不能使其形成凝胶,而TG酶预处理提高了乙醇诱导样品的胶凝性。中体积分数乙醇(40%、50%)单独醇诱导组和乙醇-TG酶联合处理组样品都能够形成凝胶,但二者的凝胶质地存在显著差异。单独醇诱导组凝胶质地黏软,手指按压变形后无反弹,呈乳白色,透明度低;乙醇-TG酶联合处理组凝胶质地较干、硬,手指按压后有反弹恢复现象,透明度较高,可见该乙醇体积分数具备形成质地良好凝胶的条件。随着乙醇体积分数的继续升高(60%),乙醇对WPI的变性出现“可逆”效果,即此前暴露的疏水基团相互间重新形成疏水核心,导致WPI的溶解度提高[20];宏观上表现为连续相中不溶性聚合物的体积和数量减小,表观黏度下降,流动性增强,凝胶倒置性消失。Tanford等认为此现象是由于β-乳球蛋白经历了特殊的“Tanford transition”,蛋白质二聚体分解为2个单体,从而暴露出先前隐藏的羧基,宏观上表现为体系的聚集度降低[21]。

图1 乙醇单独处理和乙醇-TG酶联合处理WPI凝胶表观图Fig.1 Appearance of WPI gels induced by ethanol alone and ethanol-TG
2.1.2 WPI凝胶的扫描电子显微镜观察
扫描电子显微镜可以用来观察各种蛋白质凝胶的微观结构。图2为单独乙醇处理组和乙醇-TG酶联合处理组WPI凝胶的SEM微观结构。单独乙醇处理WPI(图2a~2e)出现了和Feng等相似的实验结果[16],即在无乙醇条件下,WPI呈现出破碎光滑的“玻璃片状”结构,其破碎形态可能是由冻干过程导致。随着乙醇体积分数的升高(30%、40%),WPI片状结构内部出现裂横,直到整体结构全部裂解,这可能与乙醇使WPI结构展开有关[22]。当乙醇体积分数为50%时,部分分散的WPI分子依靠氢键和分子间相互作用重新连接,形成具有细小空隙的三维网状结构,使体系的流变特性得到显著提高,这与其后续剪切模量的结果相吻合。当使用体积分数为60%的乙醇单独诱导WPI时,出现了此前已说明的变性可逆现象,WPI表面变得粗糙,此前的细小空隙闭合并相互挤压,形成块状和颗粒结构。与单独乙醇处理组相比,乙醇-TG酶联合处理组WPI(图2f~2j)则出现了明显的桥接结构,这是由于TG酶的共价交联作用在WPI分子间形成了新的酰胺键。当乙醇体积分数为40%时,联合处理WPI出现了所谓的“蜂巢状”结构[23]。随着乙醇体积分数的提高,联合处理组也出现了和单独乙醇处理组相似的现象,即凝胶表面变粗糙,结构出现破裂与重组,并在乙醇60%体积分数下形成表面颗粒物,但TG酶在一定程度上抑制了该现象,使WPI凝胶在高浓度乙醇溶剂中仍具有保持一定三维网状结构的能力。

图2 不同乙醇体积分数下单独乙醇处理和乙醇-TG酶联合处理WPI凝胶的SEM图像Fig.2 SEM images of WPI gels treated with ethanol alone and ethanol-TG under different ethanol concentrations注:E-WPI代表乙醇单独处理WPI,E-T-WPI代表乙醇-TG酶联合处理WPI。
2.1.3 WPI凝胶的生物激光共聚焦显微镜观察
使用生物激光共聚焦显微镜可以进一步表征凝胶的微观结构,单独乙醇诱导组和乙醇-TG酶联合处理组WPI的CLSM图像如图3所示。经染色后的WPI在图像中显示为红色,而凝胶孔隙显示为黑色阴影,故可通过二者的形态位置来观察WPI凝胶的内部结构及蛋白质的分布状态。图3a~3e反映了乙醇单独诱导WPI凝胶的内部结构随乙醇体积分数变化而发生的改变。在低体积分数乙醇(10%、30%)诱导下,WPI发生的变性不足以形成凝胶,含有较少的孔隙,分布均匀(图3a、3b)。随着乙醇体积分数升高至40%,乙醇对WPI的变性作用增强,WPI开始发生大面积聚集,整体分布逐渐不均匀,并出现了边界模糊且不规则的大空腔结构(图3c);这可能是由于乙醇使WPI内部的疏水基团暴露,增强了分子间的疏水相互作用,使分子开始致密堆积。当乙醇体积分数达到50%时,WPI凝胶空腔边界逐渐清晰,结构不断向内挤压,分隔出独立的不规则空腔(图3d),这与Kleemann等报道的结果相似[14]。当乙醇过度改性WPI时(体积分数60%),可见此前凝胶的不规则孔状结构转变为大量的细小球状孔隙(图3e);这与SEM结果中的对应现象一致,WPI分子在过量乙醇作用下开始在凝胶表面不断结合,填合孔隙。
与单独乙醇处理组WPI凝胶相比,乙醇-TG酶联合处理组WPI在30%乙醇体积分数下即形成了凝胶结构(图3g),这与Ercili-Cura等发现TG处理过的凝胶更早硬化的结果相一致[24];其连接结构也与单独乙醇处理时有所不同,具有可见的“枝条状”结构,这可能归因于TG酶的共价桥接作用,即形成分子内或分子间异肽键而发生的共价交联[25]。在体积分数为40%的乙醇作用下,WPI凝胶形成了边界清晰的大孔隙(图3h),这与SEM所拍摄的(图2h)“蜂巢状”结构相类似。随着乙醇体积分数升高至50%,WPI凝胶孔隙也出现了压缩现象(图3i),这可能与大孔隙对应较小的基数而小孔隙对应较大的基数有关,即空腔总体积未发生明显变化。当乙醇体积分数达到60%时,体系此前的坚固孔隙转变为细小的球状(图3j),与对照组相比,表现为孔隙数量的增加。综上所述,TG酶的添加使得中、低乙醇浓度下的WPI凝胶结构增强,而对高浓度乙醇诱导WPI胶凝的促进作用并不显著,这可能与高浓度乙醇对TG酶的抑制作用有关[26]。
2.1.4 WPI凝胶的傅里叶变换红外光谱分析
傅里叶变换红外光谱测量经常用于表征高分子聚合物之间的相互作用[27]。为了进一步研究乙醇-TG酶联合改性WPI的胶凝机制,对样品中的WPI进行了FT-IR分析。图4a为单独乙醇处理和乙醇-TG酶联合处理WPI凝胶的FT-IR谱图。与无乙醇处理相比,乙醇诱导WPI的红外光谱并未产生新峰,证实乙醇不会使WPI分子中产生新键[28]。波数为3 440 cm-1和3 193 cm-1的2个峰分别由N—H和O—H的伸缩振动引起,表明凝胶结构中存在分子间和分子内氢键[7]。单独乙醇处理组在波数3 244 cm-1左右出现单峰,而乙醇-TG酶联合处理组出现了宽峰现象(3 325~3 254 cm-1),表明联合处理组WPI在O—H伸缩振动的基础上出现了新的N—H伸缩振动,这可能是因为在TG酶的作用下,谷氨酰胺和赖氨酸残基形成共价交联产生酰胺键,随之产生了很强的分子间相互作用。在2 900~2 800 cm-1出现的峰归属于C—H键伸缩振动,其出现在凝胶后期,反映了该时期WPI凝胶的氧化和被破坏过程[29]。

图4 傅里叶变换红外光谱Fig.4 Fourier transform infrared spectrum注:E-WPI代表乙醇单独处理WPI,E-T-WPI代表乙醇-TG酶联合处理WPI。网络版为彩图。

2.1.5 WPI凝胶的差示扫描量热分析
差式扫描量热分析可通过热转变温度(Td)和焓变值(ΔH)的变化来分析蛋白质的变性过程。本实验利用DSC研究了乙醇和TG酶对WPI凝胶热性能的影响,结果如图5所示。
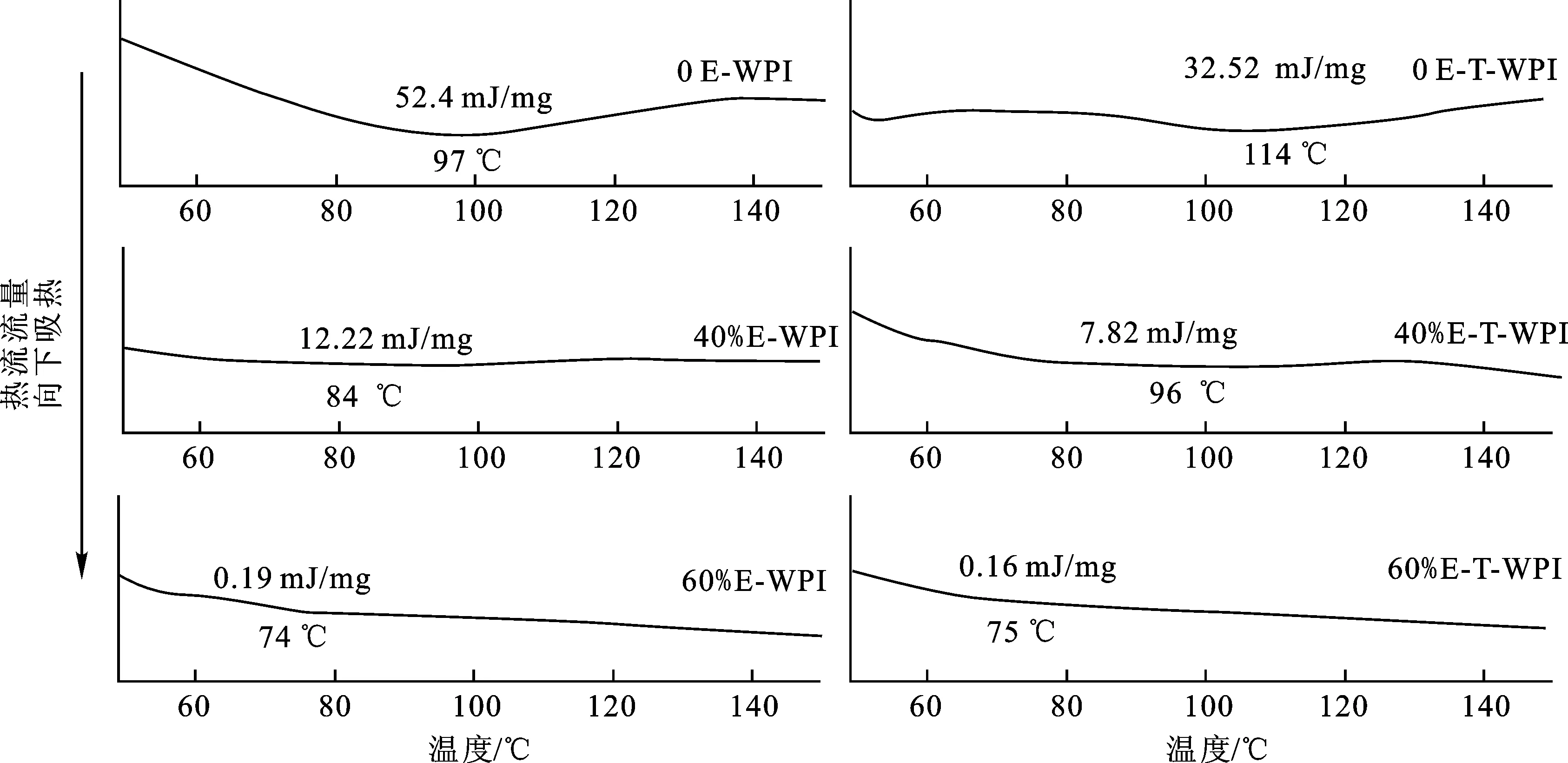
图5 不同乙醇体积分数下单独乙醇处理和乙醇-TG酶联合处理WPI凝胶的热流曲线Fig.5 Heat flow curves of WPI gels treated with ethanol alone and ethanol-TG under different ethanol concentrations注:E-WPI代表乙醇单独处理WPI,E-T-WPI代表乙醇-TG酶联合处理WPI。
所有样品的热转变温度都在70~120 ℃之间,这可能归因于凝胶中结合水的蒸发[19]。单独乙醇处理组WPI凝胶的热转变温度随着乙醇浓度的增加呈现递减现象,这与此前报道的乙醇降低WPI热变性温度的结果一致[33]。与热转变温度对应的是上述体系焓变值随着乙醇浓度的增加不断减小,这可能是由于乙醇显著改变了WPI分子中非共价键(氢键、疏水相互作用、分子间作用力、静电斥力等)的力学平衡,促使WPI预变性,削弱了WPI的热敏效果[34]。在体积分数为60%的乙醇作用下,WPI凝胶体系并未出现明显的热吸收峰,可知乙醇几乎使WPI完全变性,蛋白质的高级有序结构被松散为无序结构,在升温中并未出现显著热变化。对比单独乙醇处理组和乙醇-TG酶联合处理组WPI凝胶的热流曲线可知,在TG酶的交联作用下,WPI凝胶的热变性温度显著提高,这可能是因为TG酶在WPI中形成了谷氨酰胺和赖氨酸残基的共价交联,提高了WPI分子间的凝聚力及有序水平(降低了焓变值),进而增加了凝胶的热稳定性。
2.2 WPI凝胶的流变特性
应用动态振荡测量探究乙醇-TG酶联合处理对WPI凝胶流变特性的影响(图6)。单独乙醇处理组WPI的剪切模量如图6a所示,在低体积分数乙醇(0、30%)作用下,呈流动态的改性WPI在储能模量上并无显著差异;而在体积分数为40%的乙醇诱导下,WPI储能模量高于损耗模量,形成了固态凝胶,这表明乙醇诱导WPI形成凝胶的浓度存在阈值[13]。随着乙醇体积分数继续升高,WPI在50%时出现最大储能模量,此后便呈下降趋势。这是由于在体积分数50%时,乙醇对WPI疏水相互作用的破坏和氢键的转化与其他次级键间达到最优平衡,有利于凝胶的形成[35];当乙醇体积分数继续升高时,其综合作用力不利于空间网络结构形成,故储能模量下降。乙醇-TG酶联合处理组WPI的剪切模量如图6b所示,与单独乙醇处理组相比,TG酶的酶促预处理使得中浓度乙醇诱导的WPI凝胶储能模量得到较大提高。显然,TG酶的交联作用有利于提高凝胶的聚集度,从而提高储能模量[19]。
WPI凝胶的表观黏度如图6c所示。可以看出,样品的表观黏度对剪切速率具有依赖性。这是因为剪切速率的增加会导致液滴絮凝物或蛋白质聚集体逐渐变形和被破坏,从而降低流动阻力并降低黏度[22]。呈流动态的样品(乙醇体积分数为0、30%时)具有极低的黏度,随着乙醇浓度的提高,样品黏度得到一定提高。乙醇-TG酶联合处理组WPI凝胶的表观黏度优于单独乙醇处理组,并在乙醇体积分数为40%时出现最大值。这是由于在形成三维网状结构的基础上,TG酶的进一步作用形成了WPI分子间的酰胺键,提高了结构的紧密度,从而使联合处理组凝胶表现出比单独乙醇处理组更高的黏度。

图6 单独乙醇处理(a)和乙醇-TG酶联合处理(b)WPI凝胶的剪切模量及表观黏度(c)Fig.6 Searing modulus of WPI gels induced by ethanol alone (a) and ethanol-TG (b) and apparent viscosity of the WPI gels(c)注:E-WPI代表乙醇单独处理WPI,E-T-WPI代表乙醇-TG酶联合处理WPI。网络版为彩图。
2.3 WPI凝胶的功能特性
2.3.1 持水力
研究表明,凝胶强度越大,持水力越强。另外,随着体系孔尺寸的减小,将水保持在凝胶中的毛细作用力会增加,导致蛋白质基质保留更多的水并提高持水力值[36]。
单独乙醇诱导和乙醇-TG酶联合处理WPI凝胶的持水力测定结果如图7所示。由于在体积分数为0的乙醇作用下,WPI未形成凝胶,故该条件下样品的持水力较低。当乙醇体积分数达到50%时,单独乙醇诱导组和联合处理组的WPI凝胶分别出现了最强持水力,且乙醇-TG酶联合处理组的持水力强于乙醇诱导组,表明TG酶对乙醇诱导WPI凝胶的持水力具有增强作用,这可能是由于TG酶使WPI分子间形成了酰胺键,提高了WPI分子间的交联度,体系形成了三维网状结构,可固定部分醇水混合物[37]。在体积分数60%的乙醇作用下,单独乙醇诱导组和联合处理组的WPI凝胶持水力均显著下降,这与乙醇对WPI的过度改性有关,体系中此前暴露的疏水基团相互间重新形成疏水核心,使不溶性聚合物的体积和数量减小。综上所述,在乙醇体积分数低于50%的条件下,乙醇-TG酶联合处理组WPI凝胶的持水力显著高于单独乙醇诱导组。
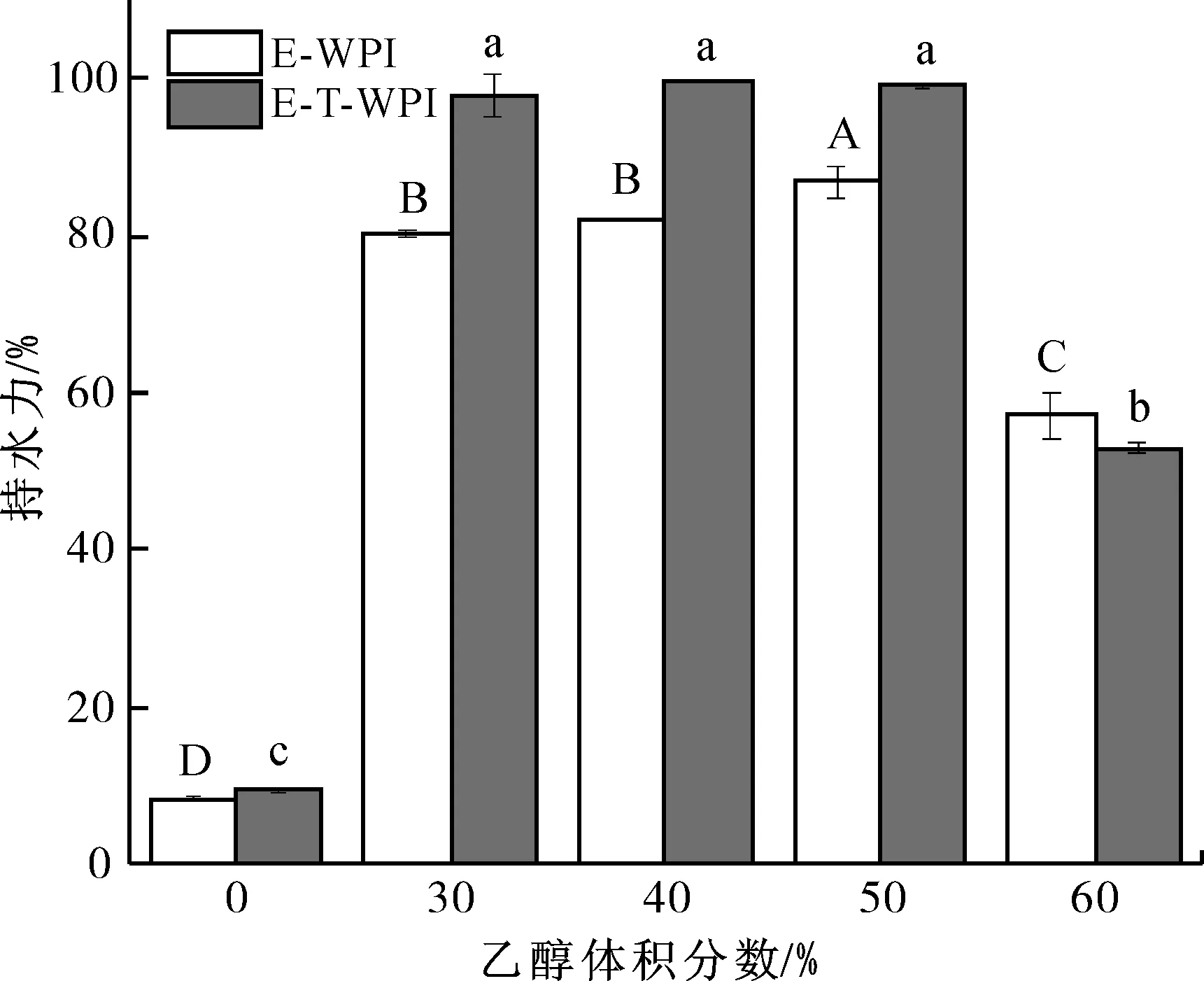
图7 单独乙醇诱导和乙醇-TG酶联合处理WPI凝胶的持水力Fig.7 Water holding capacities of WPI gels induced by ethanol alone and ethanol-TG
2.3.2 硬度
硬度主要反映蛋白质凝胶的质地特性,与食品的感官有关[38]。通过质地多面剖析(TPA)来测定各组样品的硬度,结果如图8所示。体积分数为0的乙醇处理组未形成凝胶,故未给出其硬度数据,其他乙醇处理组和乙醇-TG酶联合处理组WPI凝胶的硬度均呈现出先升高后降低的趋势。这是由此前说明的“Tanford transition”所造成的,即高浓度乙醇会使蛋白质二聚体解体,凝胶连结处结构松散,硬度下降。乙醇-TG酶联合处理组WPI凝胶的硬度显著高于单独乙醇处理组;在乙醇体积分数为40%时,联合处理组WPI凝胶的硬度最大,表明此体积分数下乙醇和TG酶对WPI的综合作用达到平衡,凝胶性能达到最佳。

图8 单独乙醇处理和乙醇-TG酶联合处理WPI凝胶的硬度Fig.8 Hardness of WPI gels induced by ethanol alone and ethanol-TG
2.4 WPI凝胶的形成机理
本研究选用TG酶交联和乙醇诱导促使WPI变性形成冷诱导凝胶,通过对以上结果的分析与讨论,推测形成冷诱导凝胶可能存在的机理如下:
首先,在合适的TG酶活性(120 U/g)与WPI浓度(120 g/L)下,WPI的分子间相互作用增强,达到了临界成胶浓度,能够形成稳定的WPI凝胶。其次,在适宜的TG酶活性下,WPI中的赖氨酸和谷氨酰胺形成赖氨酸异肽键,WPI的凝聚度和稳定性得到提高[39]。最后,一定浓度乙醇的诱导使WPI进一步变性,WPI分子内/间的氢键、疏水相互作用、分子间作用力、静电斥力等各项作用力被重新改变,达到形成凝胶的平衡条件,即在常温下形成结构完整的WPI冷诱导凝胶。结合实验结果可知,乙醇可以使WPI的二级结构发生改变,一定浓度的乙醇能够通过增加α-螺旋的数量,增强WPI的凝聚度[20]。此外,在对样品酰胺Ⅰ带光谱进行分析时,发现WPI二级结构中β-折叠的数量增加,使得分子间致密堆积,在宏观上形成高紧实度的凝胶。
如图9所示,不同体积分数(低、中、高)乙醇对WPI的改性程度不同,微观结构也呈现出不同形态。WPI在中体积分数乙醇诱导下从分散的球状结构逐渐聚集并暴露出内部疏水基团,形成稳定的凝胶孔隙,而在高体积分数乙醇诱导下的疏水相互作用反而下降,凝胶表面结构被破坏,变得粗糙。在TG酶的催化作用下,虽然一部分WPI能够形成新的酰胺键,但宏观上并不能形成凝胶,需要乙醇进一步诱导使其形成冷诱导凝胶。在联合处理组WPI凝胶中,中体积分数乙醇使WPI形成了稳定的“蜂巢状”结构,而TG酶共价交联WPI加固了凝胶孔隙,进一步形成了流变特性与功能特性较优的蛋白质凝胶。
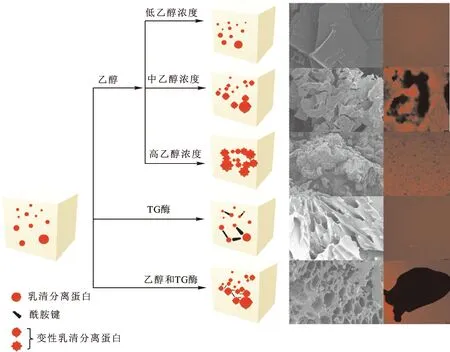
图9 凝胶形成机理推测Fig.9 The presumed formation mechanism of gels注:网络版为彩图。
3 结语
本研究在使用TG酶交联和不同浓度乙醇诱导WPI形成稳定水凝胶的基础上,对其微观结构进行表征,对其流变特性与功能特性进行评价,探究WPI凝胶网络的形成机理,筛选出最适乙醇浓度,获得了流变与功能特性最佳的WPI凝胶。通过实验得到以下结论:在120 U/g TG酶与120 g/L WPI的条件下,体积分数为40%的乙醇诱导能形成流变与功能特性最优的WPI凝胶;乙醇能提高WPI二级结构中α-螺旋的比例,增强体系的氢键和疏水作用,形成维持WPI凝胶的三维网状结构;TG酶在该凝胶形成工艺中具有交联作用,可以提高WPI二级结构中β-折叠的比例,促进乙醇诱导WPI凝胶的形成。从整体来看,TG酶与乙醇联合处理凝胶的性能优于单独乙醇诱导凝胶,其形成的网络结构更加致密,质地更加均匀,凝胶强度更大。相对于传统的热诱导凝胶,该冷凝胶制备工艺能耗较低,能够提质增效;同时,本研究构建的具有较高乙醇浓度的蛋白凝胶,对于开发富含醇溶性活性成分(如姜黄素、类胡萝卜素等)的功能食品具有重要参考价值。

