海藻酸钠-酪蛋白复合乳液凝胶的制备与结构特性表征
袁 凯,李培源,郭 绰,杨旭东,杨 曦,郭玉蓉
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
乳液凝胶是一类被乳状液填充、具有凝胶网络结构、机械性能良好的软物质[1]。乳液凝胶因兼具乳液和凝胶的特点,性质独特,近年来被广泛用于功能活性成分负载[2]、固体脂肪替代[3]及酸奶、奶酪、肉制品加工等方面[4-6]。乳液凝胶的制备方式简单,通常将乳液分散于凝胶的前体溶液中,再诱导溶液发生凝胶化即可得到乳液凝胶[7]。多糖和蛋白质在乳液凝胶的制备中非常关键,它们不仅是食品体系中常见的聚合物,而且对调控食品微观结构具有重要作用[8]。制备多糖或蛋白质乳液凝胶时,既可以单独选用多糖或蛋白质作为凝胶前体溶液,也可以选择多糖和蛋白质的混合溶液作为凝胶前体溶液[1,9],采用不同制备方式获得的乳液凝胶具有不同的理化性质[10]。与单一的多糖或蛋白质乳液凝胶相比,多糖-蛋白质复合乳液凝胶更具优势。例如,蛋白质具有较好的表面活性,可以乳化并稳定乳滴,而多糖具有良好的增稠和持水能力[9],通过结合多糖和蛋白质各自的优点,可赋予多糖-蛋白质乳液凝胶更加优良的特性。已有研究表明,多糖-蛋白质复合乳液凝胶在风味物质控释[11-12]、低脂食品构建[13-14]、功能成分包埋[3,5]等方面比单一的多糖或蛋白质乳液凝胶更具潜力。
从结构上分析,影响乳液凝胶性质的主要因素包括乳液连续相的性质、乳滴性质及乳滴和连续相之间的相互作用等[10],这三个因素也受乳液凝胶制备方式的影响。对多糖-蛋白质复合乳液凝胶而言,多糖和蛋白质在乳滴表面的吸附行为是影响乳液凝胶结构特性的重要因素,包括多糖和蛋白质的界面竞争吸附、基于静电相互作用的多层吸附、多糖和蛋白质在界面的体积排斥效应等[8,15-17]。不同的界面吸附机制不仅影响乳滴的大小、稳定性,也影响乳滴和连续相之间的相互作用,并最终影响乳液凝胶的性质。目前,在有关乳液凝胶的研究中,乳滴的界面行为及其与连续相之间的相互作用已经得到广泛研究[8,18-19]。然而,在多糖和蛋白质的混合体系中,聚合物浓度较高,连续相会发生离散型相分离,表现出复杂的相行为。此时,连续相形成分离的两相,一相以蛋白质为主、包含少量多糖,另一相以多糖为主、包含少量蛋白质[20],乳液凝胶的结构也因此更加复杂。但是,针对连续相的复杂相行为对乳液凝胶结构特性的影响目前还没有相关报道。
基于此,本研究以海藻酸钠和酪蛋白2种常见的食品聚合物为试材,分别制取由2种聚合物稳定的乳液;再通过将海藻酸钠/酪蛋白制备的乳液与另一聚合物混合,添加葡萄糖酸内酯酸化复合体系,诱导酪蛋白凝胶化,制备海藻酸钠-酪蛋白复合乳液凝胶[21-22]。以该乳液凝胶为模型体系,采用流变学和电子显微技术探究不同制备方式(乳化剂不同)和海藻酸钠添加量对上述乳液凝胶结构特性的影响,并讨论其形成机制,以期为开发新型凝胶类食品提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
酪蛋白(纯度92%)、海藻酸钠(sodium alginate,Alg)、葡萄糖酸内酯(glucono-δ-lactone,GDL)、1, 2-丙二醇、尼罗蓝A、尼罗红均购自上海源叶生物科技有限公司;油菜籽购自当地华润万家超市;其他化学试剂由西安晶博生物科技有限公司提供,均为分析纯。
1.2 实验设备
PL203电子天平,梅特勒-托利多仪器上海有限公司;EYELA OSB-2100恒温水浴锅,上海爱朗仪器有限公司;TA.XT.Plus质构仪,英国Stable Micro System公司;FV1200激光共聚焦显微镜(confocal laser scanning microscope, CLSM),日本奥林巴斯公司;AR-G2流变仪,美国TA公司;T25 digital ULTRA-TURRAX均质机,德国IKA公司;PHS-3C pH计,上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 样品制备
称取80.0 g酪蛋白粉末于400 mL去离子水中,50 ℃水浴并不断搅拌6 h至酪蛋白完全水化,用去离子水补充体系体积至500 mL,得到质量浓度160 g/L的酪蛋白母液。称取5.0 g海藻酸钠粉末置于90 mL去离子水中,室温下(20 ℃)水化6 h,用去离子水补充体系体积至100 mL,得到质量浓度为50 g/L的海藻酸钠母液。
海藻酸钠-酪蛋白复合凝胶的制备:分别取50 g/L的海藻酸钠母液4、8、15 mL与50 mL 160 g/L的酪蛋白母液混合,用去离子水补充体系体积至80 mL。称取4.0 g GDL溶于20 mL去离子水中,并立刻添加至上述海藻酸钠-酪蛋白混合体系中,充分搅拌30 s后,室温下(20 ℃)静置12 h至凝胶形成[23-24]。复合体系中酪蛋白的质量浓度为80 g/L,海藻酸钠的质量浓度分别为2 g/L、4 g/L和7.5 g/L,GDL的质量浓度为40 g/L。以不添加海藻酸钠的纯酪蛋白凝胶作为对照。
海藻酸钠-酪蛋白复合乳液凝胶的制备:采用2种方法制备复合乳液凝胶(如图1)。
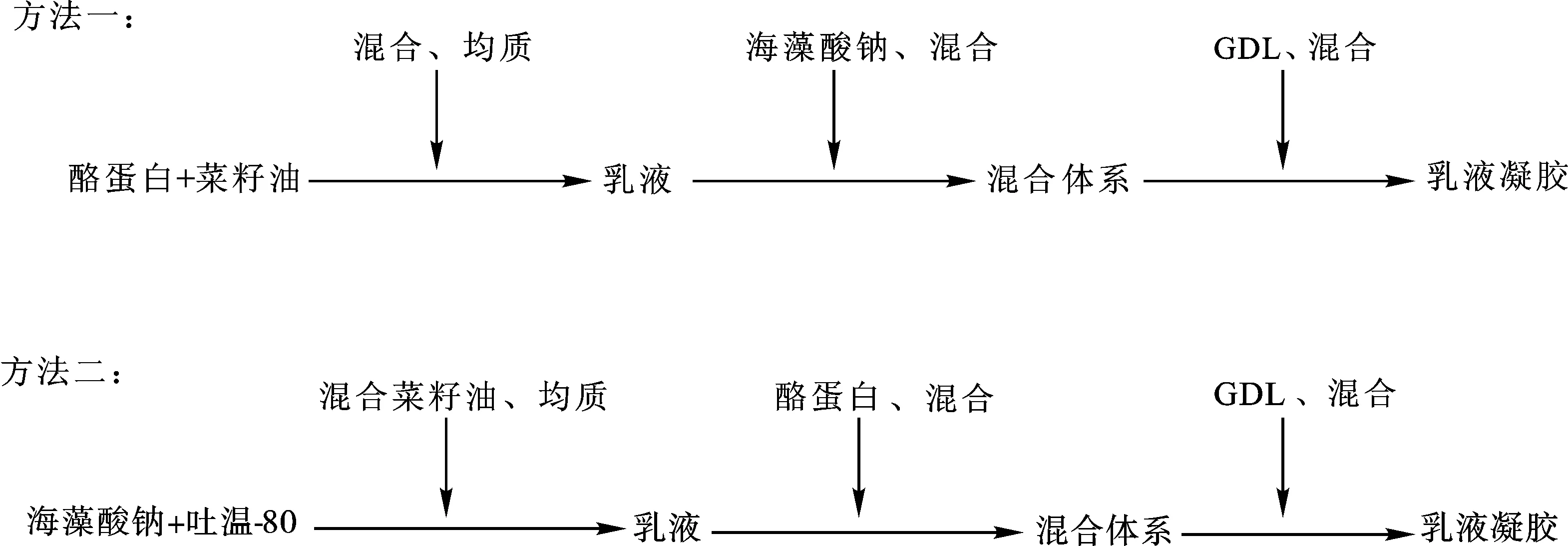
图1 海藻酸钠-酪蛋白复合乳液凝胶的制备Fig.1 Preparation of the sodium alginate-casein composite emulsion gels
方法一:将50 mL 160 g/L的酪蛋白母液与25 mL菜籽油混合后,在20 000 r/min的转速下均质5 min形成酪蛋白乳液[25]。分别将4、8、15 mL 50 g/L的海藻酸钠母液加去离子水补充至30 mL,再与上述酪蛋白乳液混合并搅拌均匀。之后,将4.0 g GDL溶于20 mL去离子水,并立刻添加至上述混合体系,搅拌均匀后室温(20 ℃)下静置12 h形成海藻酸钠-酪蛋白复合乳液凝胶[7]。
方法二:分别将4、8、15 mL 50 g/L的海藻酸钠母液用去离子水补充体积至30 mL,添加1 mL吐温-80并混合均匀。上述溶液与25 mL菜籽油混合后,在20 000 r/min的转速下均质5 min,并与50 mL质量浓度为160 g/L的酪蛋白母液混合均匀。后续采用与方法一相同的步骤添加GDL制备海藻酸钠-酪蛋白复合乳液凝胶。
1.3.2 凝胶破裂强度测定
将GDL与方法一/方法二中未添加GDL的复合乳液混合搅拌后,立即倒入10 mL烧杯,室温(20 ℃)下平衡12 h后取出凝胶,采用质构仪测定凝胶的破裂强度。参数[26]设定为:TPA压缩模式,探头为P/36R(直径36 mm的圆柱状平头探头),测试前速度为2.0 mm/s,测试速度为1.0 mm/s,测试后速度为2.0 mm/s,应变为40%,感应力为5.0 g。以凝胶破裂点探头所记录的力为凝胶强度,单位为g。每个样品重复测定3次。
1.3.3 激光共聚焦显微镜观察
将20 mg尼罗蓝A溶解于10 mL 50 ℃的去离子水中,得到质量浓度为2 g/L的尼罗蓝A染色液。然后将1 mL尼罗蓝A染色液加入至50 mL 160 g/L的酪蛋白母液中,搅拌,避光静置3 h,标记酪蛋白[27]。20 mg尼罗红溶解于10 mL的1, 2-丙二醇中,制备质量浓度为2 g/L的尼罗红染色液,移取1 mL尼罗红染色液至100 mL菜籽油中,搅拌3 h,标记油滴。之后参照1.3.1中的制备方法制备复合乳液凝胶,加入GDL后,滴加一滴样品于载玻片上,加盖玻片,室温(20 ℃)下避光静置12 h。采用激光共聚焦扫描显微镜观察复合乳液凝胶的微观结构。设置尼罗蓝A荧光的激发波长为488 nm,尼罗红荧光的激发波长为633 nm,分别对酪蛋白及油滴成像。合并酪蛋白和油滴形貌的荧光图像后,得到整个复合体系的激光共聚焦图谱。同时,以不含海藻酸钠的纯酪蛋白凝胶作为对照。
1.3.4 复合乳液凝胶流变学特性测定
采用AR-G2流变仪对样品进行时间扫描。按照1.3.1中的方法制备样品凝胶,加入GDL后,立即移取2 mL样品于流变仪样品台,采用直径为20 mm的粗面平行板(板间间距为1 mm)立刻进行时间扫描,监测储存模量G′与损耗模量G″的变化趋势[28]。测定温度设置为20 ℃,应变范围为1%(线性黏弹区范围内),频率为1 Hz。
1.3.5 复合乳液凝胶pH值测定
为了追踪添加GDL后复合凝胶的pH值变化,采用pH计测定凝胶形成过程中不同时间节点的pH值。将pH计感应探头直接插入凝胶基质,待pH计指数稳定后,记录数值[29]。
1.4 数据分析
上述测定均重复3次,每次测试均需更换样品。所有图表均使用Origin 2018软件进行绘制,利用IBM SPSS 19.0软件进行差异显著性分析(P<0.05为差异显著)。
2 结果与分析
2.1 海藻酸钠-酪蛋白复合凝胶的制备及表征
成功制备海藻酸钠-酪蛋白复合凝胶是后续构建复合乳液凝胶的第一步。本研究制备的复合凝胶分别包含质量浓度为0 g/L、2 g/L、4 g/L和7.5 g/L的海藻酸钠及80 g/L的酪蛋白。采用尼罗蓝A标记酪蛋白并在CLSM下成像,结果见图2。荧光模式下,绿色区域代表酪蛋白的位置,黑色区域代表海藻酸钠的位置。当海藻酸钠的质量浓度为0 g/L时,凝胶结构呈现均匀的绿色,表明酪蛋白明显聚集。随着体系中海藻酸钠的质量浓度从2 g/L增加至4 g/L,凝胶结构由酪蛋白主导的单一网络结构转变为“水包水”乳液结构;其中,酪蛋白为连续相,海藻酸钠为分散相。当海藻酸钠的质量浓度继续增加至7.5 g/L时,凝胶结构转变为由酪蛋白与海藻酸钠共同组成的双连续相结构。添加吐温-80的复合凝胶微观结构并未发生显著改变。

图2 复合凝胶的CLSM形貌Fig.2 CLSM images of composite gels注:网络版为彩图。
不同质量浓度海藻酸钠的复合凝胶强度如表1所示。可以看出,随着海藻酸钠质量浓度的增加,凝胶强度呈现出先增加后降低的趋势,在4 g/L的海藻酸钠质量浓度下,复合凝胶强度最大。这是因为起初随着海藻酸钠质量浓度的增加,体系相分离逐渐明显,促进了酪蛋白一相的聚集,加强了酪蛋白连续相的强度。而当海藻酸钠质量浓度继续增加至7.5 g/L时,海藻酸钠一相的体积增加,但其分散相不形成凝胶,因此削弱了复合凝胶的强度[30]。与未添加吐温-80的凝胶相比,加入吐温-80后,凝胶强度略有增加,这可能是由于吐温-80作为小分子表面活性剂,可以和酪蛋白胶束中的疏水区域结合,从而干扰酪蛋白的胶束结构,降低酪蛋白在溶液中的溶解度,使酪蛋白在酸化过程中更容易因溶解度降低而聚集[31]。但整体而言,吐温-80的添加并未显著影响海藻酸钠-酪蛋白复合凝胶的强度。

表1 复合凝胶强度Tab.1 The strength of composite gels 单位:g
2.2 海藻酸钠-酪蛋白复合乳液凝胶的制备及表征
2.2.1 复合乳液凝胶的CLSM形貌及强度变化
如图3所示,方法一与方法二制备的复合乳液凝胶外观均呈乳白色。当海藻酸钠浓度较低时,乳液凝胶表面相对光滑,反之则较为粗糙,这可能是因为海藻酸钠浓度较高时酪蛋白和海藻酸钠发生了相分离,影响了凝胶质构。2种制备方法相比,方法二制备的乳液凝胶具有更光滑的表面,可能是因为吐温-80加入后提高了体系的乳化效果。激光共聚焦成像结果显示,随着海藻酸钠浓度的增加,方法一制备的复合乳液凝胶从初始酪蛋白主导的网络结构逐渐转变为由酪蛋白与海藻酸钠共同组成的双连续相结构(图3a),该变化趋势与2.1中复合凝胶的变化趋势一致,表明油滴的加入并未影响复合乳液凝胶体系的相分离趋势。在方法二中,复合乳液凝胶也出现了从网络结构到双连续相结构的转变,但吐温-80的加入降低了凝胶结构的转变程度(图3b)。此外,虽然2种乳液凝胶的制备方法不同,但油滴均一直位于酪蛋白主导的网络结构中,这可能是由于酪蛋白本质上是一种蛋白质,具有比海藻酸钠更高的表面活性[32]。

图3 复合乳液凝胶的CLSM形貌Fig.3 CLSM images of composite emulsion gels注:网络版为彩图。
凝胶强度是反映凝胶内部网络结构的重要参数,复合乳液凝胶强度的测定结果如图4所示。在0~7.5 g/L的海藻酸钠质量浓度范围内,方法一制备的乳液凝胶强度呈现先上升后下降的趋势,与2.1中复合凝胶强度的变化趋势相似。而方法二制备的复合乳液凝胶强度呈现出随着海藻酸钠质量浓度增加而持续上升的趋势,这可能是因为乳液凝胶制备方法不同改变了体系各组分间的相互作用,影响了相分离速率,导致凝胶强度出现了不同的变化。

图4 复合乳液凝胶强度Fig.4 The strength of composite emulsion gels注:不同字母表示差异显著(P<0.05)。
2.2.2 复合乳液凝胶的流变学特性和结构演化
葡萄糖酸内酯诱导的酪蛋白聚集是时间依赖性过程,因此本研究对凝胶形成过程中的流变特性进行时间扫描,通过监测凝胶形成过程中体系储存模量G′和损耗模量G″的变化,得到凝胶网络形成随时间的变化关系。如图5所示,添加GDL之初,所有样品的G″高于G′,表明此时样品中损耗模量占主导,即样品仍具有流动性,且未形成凝胶网络。随着时间的延长,所有样品的G′和G″均有所增加,但G′的增加速率高于G″,表明凝胶网络开始形成;随后出现了G′和G″的交点,该点所对应的时间即为凝胶化时间(Tgel)。当体系的海藻酸钠为0 g/L时,不加吐温-80的Tgel为1 295 s,加入吐温-80后,Tgel延后为1 428 s,这是因为吐温-80作为非离子型表面活性剂,可以与酪蛋白发生疏水相互作用,干扰酪蛋白聚集,导致凝胶形成略微缓慢[31]。然而,在2种方法制备的复合乳液凝胶中,Tgel均随海藻酸钠质量浓度的增加而明显缩短。原因主要归结于两点:其一,海藻酸钠质量浓度增加时,复合体系中总聚合物的浓度也增加,更容易形成凝胶网络;其二,随着海藻酸钠质量浓度的增加,酪蛋白与海藻酸钠之间的分子排斥力更显著,促进了酪蛋白聚集,利于凝胶形成[33]。

图5 复合乳液凝胶的流变特性时间扫描结果Fig. 5 Time sweep results of rheological behavior of emulsion gels注:网络版为彩图。
采用CLSM对复合乳液凝胶形成过程中的微观结构变化进行观察,结果如图6所示。可以看出,在加入GDL后,纯酪蛋白乳液凝胶(对照组)的结构均匀,酪蛋白充满整个区域,油滴分散于酪蛋白主导的凝胶网络中。对于方法一制备的复合乳液凝胶,随着酸化时间的延长,其微观结构很快出现相分离。该现象也在方法二制备的复合乳液凝胶中观察到,但当方法二中的海藻酸钠质量浓度为2 g/L时,乳滴粒径明显增大。造成上述现象的原因可能是方法二中使用了海藻酸钠与吐温-80的混合体系作为乳化剂,乳液存在于海藻酸钠一相中,当海藻酸钠浓度较低时,海藻酸钠一相的黏度也较低,不能很好地阻止乳滴聚集和融合,导致乳滴粒径增大;而当海藻酸钠浓度增高时,海藻酸钠一相的黏度增大,可有效阻碍乳滴聚集和融合。因此,当海藻酸钠浓度高于4 g/L时,未观察到明显的乳滴融合现象。

图6 复合乳液凝胶结构演化的CLSM形貌Fig. 6 CLSM images of composite emulsion gel structure evolution注:网络版为彩图。
2.2.3 复合乳液凝胶的pH值变化
复合乳液凝胶pH值动态测定结果见图7。未添加GDL时,复合乳液的pH值为7.1,加入GDL后,复合体系的pH值立即下降至6.5~6.75。随着酸化过程的进行,pH值继续缓慢下降,60 min后,复合乳液凝胶的pH值仍高于酪蛋白的等电点(约为4.6)。该结果表明,在加入GDL后的60 min内,酪蛋白和海藻酸钠均携带有负电荷,分子间静电斥力是主要作用力。在分子间斥力的作用下,海藻酸钠和酪蛋白会发生相分离,该结论与图6中的结果一致。在室温下平衡12 h后,测得所有凝胶的pH值均在3.50~3.59之间。在此pH值范围内,海藻酸钠与酪蛋白之间存在静电引力,但由于在添加GDL 60 min内乳液已经形成了凝胶网络,因此静电引力并未引起凝胶网络的明显变化。
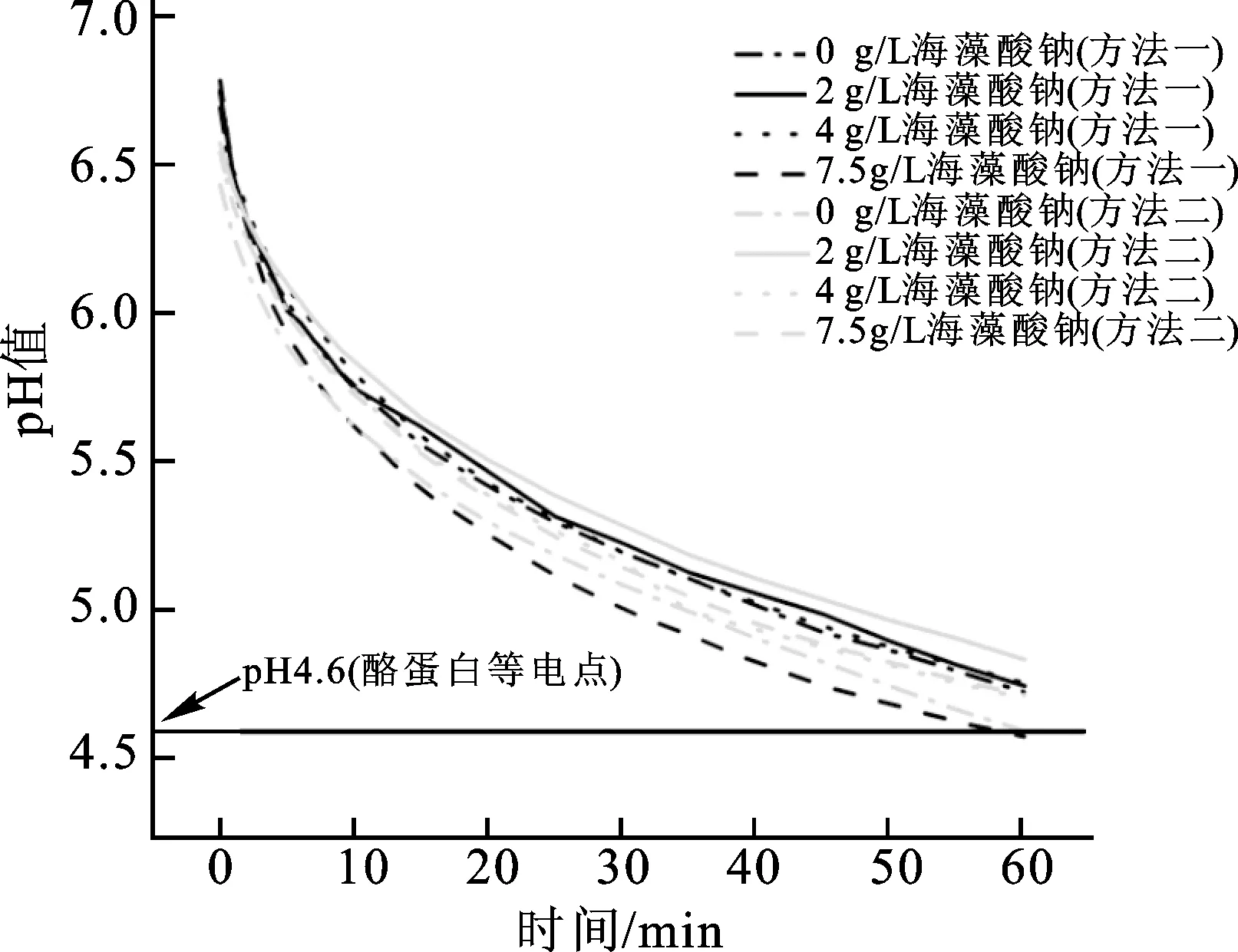
图7 加入GDL后复合乳液凝胶的pH值Fig.7 pH of the composite emulsion gels after GDL addition
2.3复合乳液凝胶的形成机制
本文以海藻酸钠和酪蛋白复合体系为模型,制备了多糖-蛋白质复合乳液凝胶。在制备乳液时,既可选择酪蛋白为乳化剂(方法一),也可选择海藻酸钠为乳化剂(方法二)。由于海藻酸钠属于亲水性较强的多糖,疏水官能团含量低,因此乳化性较差[34]。为了获得稳定性良好的乳液,在方法二中采用了吐温-80和海藻酸钠的混合溶液作为乳化剂。2种方法制备的复合乳液凝胶形成机制略有不同。
如图8所示,采用方法一制备乳液时,酪蛋白为乳化剂,吸附于油滴表面稳定乳液,继续和海藻酸钠溶液混合后,体系的pH值为7.1,此时海藻酸钠和酪蛋白均携带负电荷,在静电斥力的作用下复合体系随海藻酸钠浓度的不同出现不同的相行为。当海藻酸钠质量浓度由低至高增加时(小于4 g/L),复合体系由单一网络结构转变为“水包水”型乳液结构,此时海藻酸钠为分散相,酪蛋白为连续相。当海藻酸钠的质量浓度增加至7.5 g/L时,凝胶结构转变为由酪蛋白与海藻酸钠共同组成的双连续相结构。由于乳滴由酪蛋白稳定,因而乳滴总是存在于酪蛋白连续相中。添加GDL后,体系pH值降低,酪蛋白溶解度不断下降,最终引起分子聚集,从而形成凝胶。在这一过程中,复合体系逐渐固化,保留了最初的相分离状态。
方法二中,采用海藻酸钠和吐温-80的混合溶液做乳化剂制备乳液。由于吐温-80的分子量较小且乳化性能优良,因此在制备乳液时,吐温-80优先吸附于乳滴表面,而海藻酸钠存在于连续相中增加黏度,进一步稳定乳液。将乳液和酪蛋白混合后,复合体系仍然会在分子间静电斥力的作用下发生相分离,但由于海藻酸钠并未吸附至乳滴表面,因而发生相分离时乳滴未存在于海藻酸钠一相中,而是与海藻酸钠一相混合存在。需要指出的是,尽管方法一和方法二制备的复合乳液凝胶结构特性非常相似,但在方法一中,乳滴表面由酪蛋白稳定,而在方法二中,乳滴表面由吐温-80稳定,二者的乳滴界面层有所差别。
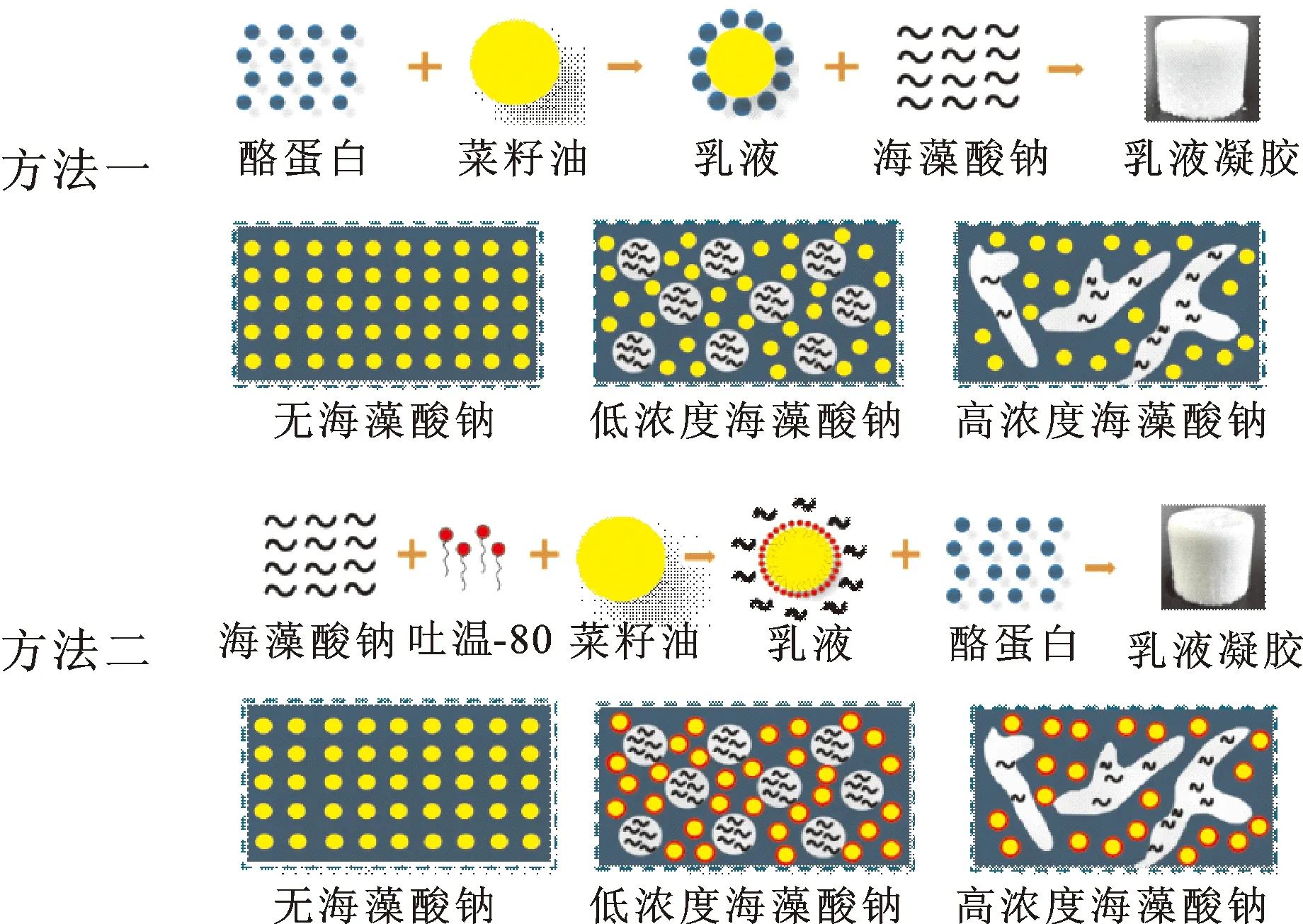
图8 复合乳液凝胶形成机制示意图Fig.8 Schematic diagram of formation mechanism for the composite emulsion gels注:网络版为彩图。
3 结论
本文采用2种方法制备海藻酸钠-酪蛋白复合乳液凝胶,比较了不同制备方法和海藻酸钠浓度对复合乳液凝胶CLSM微观结构及流变学特性的影响,并探讨了复合乳液凝胶的形成机制。研究表明,在80 g/L固定酪蛋白条件下,随着海藻酸钠浓度的增加,体系从酪蛋白主导的单一相逐渐转变为酪蛋白为连续相、海藻酸钠为分散相的“水包水”型乳液结构。当海藻酸钠质量浓度继续增加至7.5 g/L时,形成了双连续相结构。油滴的加入并未改变海藻酸钠-酪蛋白体系发生相分离的趋势。虽然2种制备方法所选用的乳化剂不同,但油滴总是均匀地分布于酪蛋白为主体的网络结构中。酸化过程中,凝胶化点出现于GDL添加后的60 min内,此时乳液凝胶中酪蛋白和海藻酸钠的分子间静电斥力是引起混合乳液凝胶相分离的关键原因。2种制备方法对乳液凝胶结构特性的影响有限,但方法一较为简单,制备的乳液凝胶乳滴粒径较小,且在海藻酸钠质量浓度为4 g/L时形成的乳液凝胶质地较好。本研究结果为理解多糖-蛋白质复合乳液凝胶结构提供了理论依据,但在实际开发相关凝胶类食品时,仍需考虑风味、口感等指标。

