鼠李半乳糖醛酸聚糖Ⅰ的结构特性及分离检测研究进展
虞诚潇,陈健乐,2,叶兴乾,2,陈士国,2*
(1 浙江大学 生物系统工程与食品科学学院,智能食品加工技术与装备国家地方联合工程实验室,浙江大学馥莉食品研究院,浙江 杭州 310058;2 浙江大学 宁波研究院,浙江 宁波 315100)
果胶是一类广泛存在于高等植物细胞初生壁和细胞中间片层的杂多糖[1],1825年由法国药剂师Bracennot从胡萝卜中首次提取得到,并被命名为“pectin”。随着对果胶结构的深入研究,同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(rhamnogalacturonan Ⅰ,RG-Ⅰ)、鼠李半乳糖醛酸聚糖Ⅱ(rhamnogalacturonan Ⅱ,RG-Ⅱ)、木糖聚半乳糖醛酸聚糖(xylogalacturonan,XG)等不同结构域陆续出现[2]。其中,RG-Ⅰ的概念于1980年出现,用于描述果胶聚合物中富含鼠李糖的部分[3]。之后Komalavilas等获得了大量重复的→2)-α-L-鼠李糖-(1→4)-α-D-半乳糖醛酸-(1→ 结构双糖,表明包含鼠李糖半乳糖醛酸主链的二糖具有相当严格的重复序列[4],首次证明了RG-Ⅰ的主链由以α-1,4糖苷键相连的鼠李糖和半乳糖醛酸构成。
RG-Ⅰ果胶多糖广泛存在于日常饮食中,是人体肠道菌群的主要能量来源,具有多种生物学活性,如改善慢性代谢综合征等。然而,以往研究对RG-Ⅰ的重视程度不足,甚至会刻意在提取过程中排除凝胶性弱的RG-Ⅰ组分,致使RG-Ⅰ在概念、提取、分离纯化、检测等方面不够完善,存在诸多欠缺。迄今为止,RG-Ⅰ仍没有统一的概念,例如半乳聚糖和阿拉伯聚糖是否属于RG-Ⅰ仍存在质疑,而概念模糊又导致RG-Ⅰ的提取和分离纯化受到不同程度的影响。虽然RG-Ⅰ的活性已经受到关注[5],却普遍存在RG-Ⅰ精细结构不清晰、构效关系不明确的问题,继而对RG-Ⅰ的检测和结构解析手段提出了新挑战(图1)。基于此,本文对RG-Ⅰ果胶多糖的概念、分子结构、生物活性、提取纯化以及检测方法进行了系统归纳和总结,旨在为RG-Ⅰ果胶多糖的深化研究和后续开发应用提供基础资料。
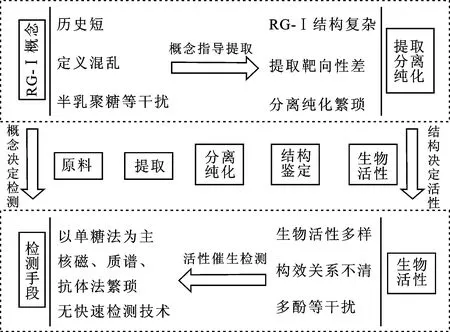
图1 RG-Ⅰ果胶多糖在概念、分离纯化、生物活性和检测手段方面存在的问题Fig.1 Problems existed in concept, separation and purification, biological activity and detection methods of RG-Ⅰ
1 RG-Ⅰ果胶多糖的分子结构及生物活性
RG-Ⅰ果胶多糖的结构-功能活性关系是果胶研究的前沿与热点。当前,部分研究中对RG-Ⅰ的概念和结构仍不清晰,阻碍了对RG-Ⅰ精细结构及其结构-功能活性关系的研究。因此,本章主要介绍RG-Ⅰ果胶多糖的概念、分子结构和生物活性。
1.1 RG-Ⅰ果胶多糖的概念
RG-Ⅰ最初是在悬浮培养的梧桐细胞壁中提取得到的一种果胶样多糖,其主链由2-L-鼠李糖和4-D-半乳糖醛酸残基依次相连构成,显著区别于传统结构,因此被命名为RG-Ⅰ[3]。十余年后,RG-Ⅰ的概念开始和多聚半乳糖醛酸聚糖(polygalacturonic acid,PGA)成对出现,推测PGA、RG-Ⅰ可能是构成果胶的主要结构域[6-7];其中,RG-Ⅰ是主链由鼠李糖和半乳糖醛酸以α-1,4糖苷键依次相连的酸性果胶样多糖,其鼠李糖残基可连接中性糖侧链[6]。此概念至今仍是RG-Ⅰ的主流定义。Yapo认为RG-Ⅰ骨架由重复的双糖基→2)-α-L-鼠李糖-(1→4)-α-D-半乳糖醛酸-(1→结构组成,在鼠李糖的O-4或O-3位可连接(1→5)-α-L-阿拉伯聚糖、(1→4)-β-D-半乳聚糖、阿拉伯半乳聚糖Ⅰ和阿拉伯半乳聚糖Ⅱ[8]。由上述RG-Ⅰ的概念描述可以看出,(1→5)-α-L-阿拉伯聚糖、(1→4)-β-D-半乳聚糖、阿拉伯半乳聚糖Ⅰ和阿拉伯半乳聚糖Ⅱ等应该被纳入RG-Ⅰ结构域。除基于RG-Ⅰ果胶多糖结构对其概念进行定义外,RG-Ⅰ还被定义为一种主要的植物初生细胞壁中的果胶样成分[9]、果胶中由鼠李糖醛酸聚糖组成的高度鼠李糖化的“多毛”区域[10]等。
1.2 RG-Ⅰ果胶多糖的分子结构
RG-Ⅰ是果胶的主要结构域之一,一般认为和HG、RG-Ⅱ等共同构成果胶的主体,在果胶多糖中占比为20%~35%[11]。果胶多糖的主要结构及RG-Ⅰ的主要结构分别如图2、图3所示。RG-Ⅰ的结构特征主要体现在2个方面:(1)主链含有鼠李糖,由鼠李糖和半乳糖醛酸以α-1,4糖苷键依次相连,而其余结构域中均无鼠李糖存在。(2)鼠李糖残基上可连接中性糖侧链,绝大部分侧链由半乳糖或阿拉伯糖构成;而构成RG-Ⅱ侧链的单糖种类远多于RG-Ⅰ侧链,包括阿拉伯糖、半乳糖、岩藻糖、芹菜糖、鼠李糖、葡萄糖醛酸等[12]。研究表明RG-Ⅰ的聚合度大约为2 000,约有一半的鼠李糖残基在O-4位上连接有侧链,目前共发现有7种直接与鼠李糖

图2 果胶多糖结构示意图Fig.2 Schematic structure of the pectin polysaccharide注:参考自文献[12]。网络版为彩图。
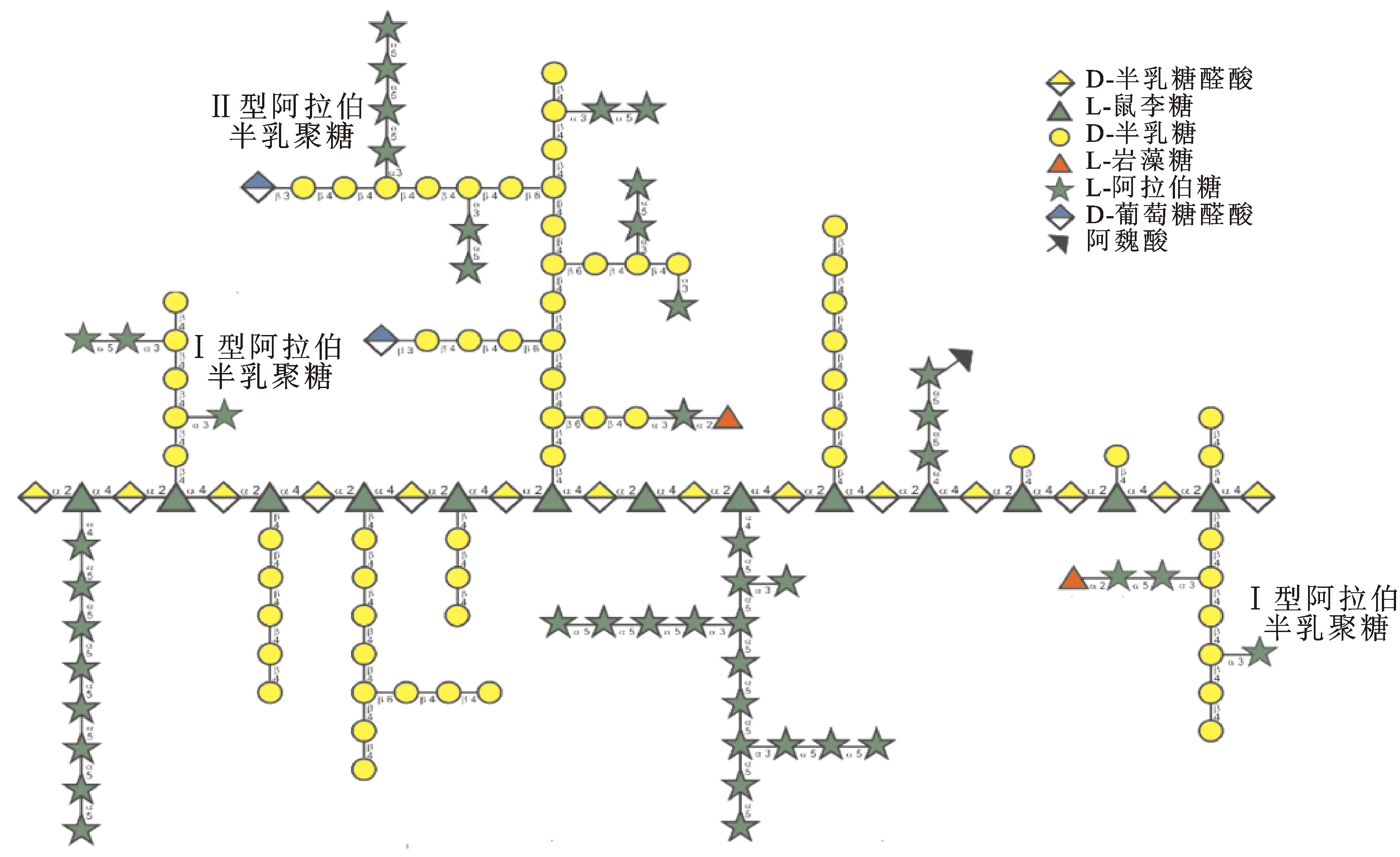
图3 RG-Ⅰ果胶多糖结构示意图Fig.3 Schematic structure of RG-Ⅰ pectic polysaccharide注:网络版为彩图。
O-4位相连的糖残基,分别为5-L-阿拉伯糖、T-D-半乳糖、3-D-半乳糖、4-D-半乳糖、6-D-半乳糖、3,6-D-半乳糖和2,6-D-半乳糖[13],揭示了RG-Ⅰ侧链的复杂性,同时也说明RG-Ⅰ侧链主要由阿拉伯糖和半乳糖构成。以上结构信息为RG-Ⅰ的后续含量检测提供了理论依据。
1.3 RG-Ⅰ果胶多糖的生物活性
RG-Ⅰ果胶多糖广泛存在于日常膳食的果蔬中,已被证实具有多种生物活性,如控糖、抗炎、提高免疫力、肠道益生等(表1)。Sun等发现口服10 mg/kg的人参RG-Ⅰ多糖可有效降低链脲佐菌素诱导的糖尿病小鼠的血糖,增加胰岛素水平和肝糖原生成[14]。秋葵RG-Ⅰ果胶能够显著降低血糖水平和葡萄糖耐量[15]。在改善高血脂方面,RG-Ⅰ通过减少肝脏脂肪堆积、改善脂肪酸代谢、促进丁酸盐产生、促进白色脂肪棕色化等途径降低血脂水平[16-18]。在改善肥胖方面,Zhu等指出RG-Ⅰ果胶可以通过逆转高脂饮食引起的肠道菌群失衡、促进白色脂肪棕色化而改善肥胖,其效果优于HG果胶,并推测了上述过程的构效机制:HG 果胶结构单一,在盲肠处会快速发酵导致盲肠肠道菌群紊乱,而结肠处菌群缺少必要的发酵底物致使菌群失衡,RG-Ⅰ果胶中性糖含量丰富,能充分刺激益生菌的生长[19]。在改善结肠炎方面,RG-Ⅰ的中性糖侧链是改善肠道炎症的关键结构,其可能的机制是中性糖能够更有效地结合Toll样受体,从而下调各种促炎因子的分泌;此外,RG-Ⅰ果胶还可以增强肠紧密连接蛋白的表达[20]。
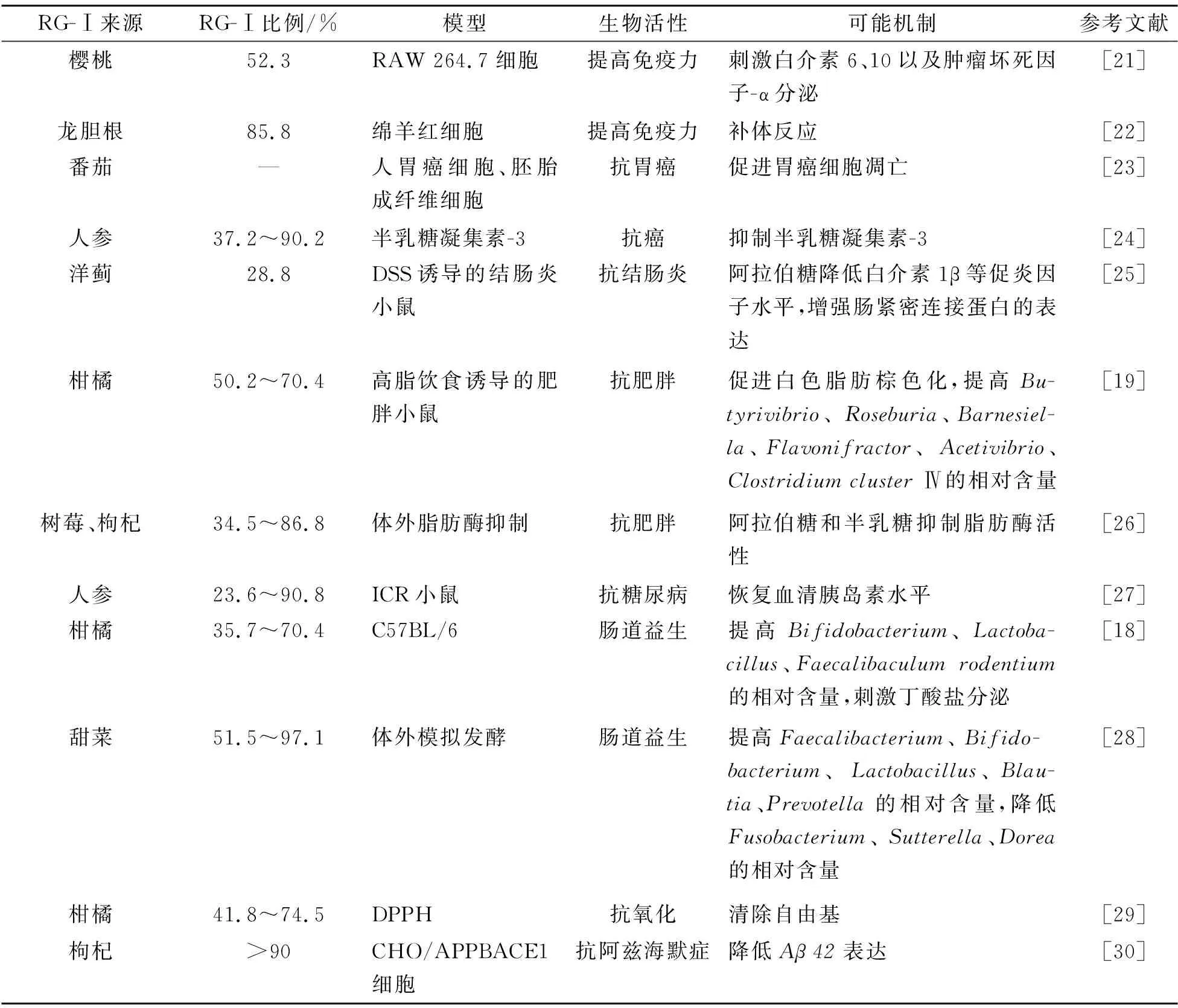
表1 RG-Ⅰ果胶多糖的生物活性Tab.1 The bioactivities of RG-Ⅰ pectic polysaccharide
2 RG-Ⅰ果胶多糖的提取及分离纯化
RG-Ⅰ果胶多糖提取是研究其结构和活性的基础,相较于HG,RG-Ⅰ的占比及结构稳定性受果胶来源和提取方法的影响更大,需要针对不同提取原料设计适宜的提取方法。此外,RG-Ⅰ粗多糖的快速分离纯化对RG-Ⅰ的精细结构解析也至关重要。下面重点介绍现有的RG-Ⅰ果胶多糖提取和分离纯化方法。
2.1 RG-Ⅰ果胶多糖的提取
果胶最常见的提取方法是高温酸法,但长时间的加热和酸环境会促进HG主链降解,导致果胶品质下降及RG-Ⅰ侧链丢失。这是因为在强酸(pH<2)、高温(65 ℃以上)条件下,GalA-Rha比GalA-GalA的稳定性弱,Ara、Gal、Rha等中性糖也呈现出酸不稳定性。基于上述原因,有机酸、螯合剂、低浓度碱是提取RG-Ⅰ果胶多糖的理想溶剂(表2)。Kurita等在65 ℃条件下使用0.05~1 mol/L的柠檬酸提取柑橘皮中的RG-Ⅰ果胶,发现0.5 mol/L柠檬酸提取的果胶中RG-Ⅰ比例最高(57.5%),且所提取RG-Ⅰ果胶的分子量分布范围很大(50~2 000 kDa),说明柠檬酸不会降解果胶[31]。与苛刻的高温酸条件相比,Zhang等采用质量分数为0.6%的NaOH溶液在32 ℃条件下提取柑橘皮中的RG-Ⅰ果胶,获得了82.5%的RG-Ⅰ组分(酸法提取仅44%),并发现提取的RG-Ⅰ果胶侧链呈高度分支化[32],这是由于在稀碱条件下RG-Ⅰ侧链的Ara和Gal均稳定。强碱环境不适用于RG-Ⅰ果胶多糖的提取,Ara和Gal侧链在强碱作用下会被降解[33],同时木糖和葡萄糖含量会显著升高,说明强碱环境下有半纤维素或纤维素出现[34]。Li等先后采用水、螯合剂、碳酸钠、1 mol/L KOH、4 mol/L KOH提取番茄细胞壁多糖,发现在1 mol/L KOH条件下体系中即可出现半纤维素组分[34]。Kostlov等分别采用水、螯合剂、稀盐酸、不同浓度的碱提取南瓜果胶,发现各溶剂所提取果胶中RG-Ⅰ的比例由高到低依次为低浓度碱(49.6%)、高浓度碱(39.3%)、水(28%)、稀盐酸(6.8%)和螯合剂(1.4%)[35],说明强碱环境破坏了RG-Ⅰ果胶多糖的结构。
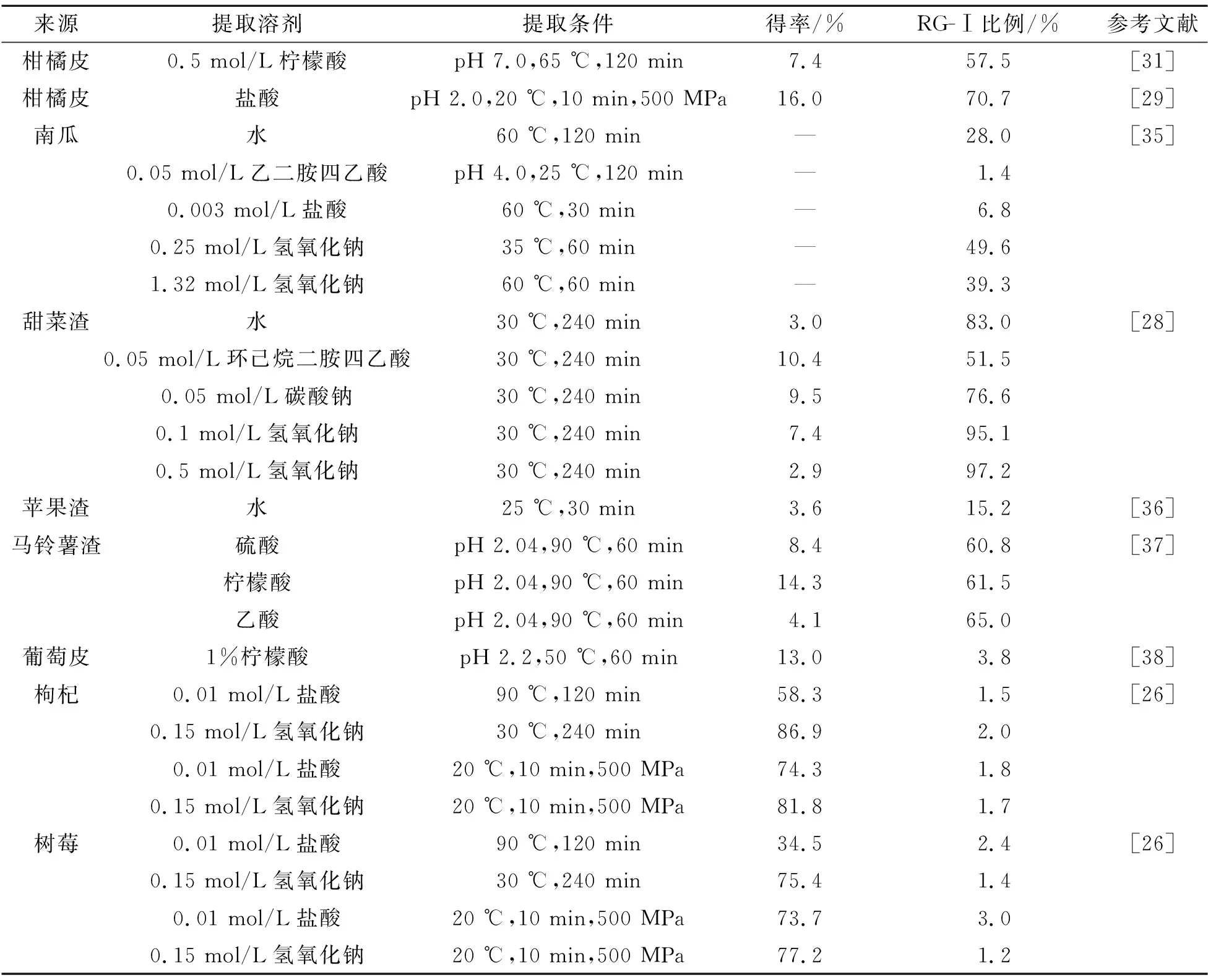
表2 RG-Ⅰ果胶多糖的提取方法Tab.2 The extraction methods of RG-Ⅰ pectic polysaccharide
除传统溶剂提取,一些新型提取技术如酶辅助、超声、超高压等也逐渐被应用于RG-Ⅰ果胶提取,其原理均是加速细胞壁裂解,打断RG-Ⅰ果胶与蛋白、半纤维素、纤维素之间的连接以释放RG-Ⅰ。常用于RG-Ⅰ提取的酶包括蛋白酶、α-淀粉酶、纤维素酶、半纤维素酶、果胶酯酶和内聚半乳糖醛酸酶等,酶提取法具有可定向提取高纯度RG-Ⅰ、保留完整RG-Ⅰ果胶结构、消除恶劣提取条件等优点,但也存在耗时长、低底物浓度等缺点[39]。超声提取RG-Ⅰ果胶时,在溶液中施加的负压超过拉伸强度后,气泡会形成、生长直到坍塌,产生“空化”效应,有助于溶剂破坏细胞壁进入细胞,从而释放果胶[40]。但超声处理会严重影响RG-Ⅰ果胶的结构,甚至会导致RG-Ⅰ果胶降解[41]。超高压提取技术因耗时短、环境友好、得率高等优点,也逐渐被应用于RG-Ⅰ果胶提取。在超高压提取的第一阶段,外部压力迅速上升,会加速细胞壁破裂和溶液渗透;在第二阶段维持高压,便于提高回收率;在第三阶段急剧泄压,致使细胞壁趋于膨胀,一些非共价键被破坏,易于RG-Ⅰ果胶提取[42]。超高压提取会使RG-Ⅰ果胶的分子量、酯化度、中性糖侧链量有不同程度的下降[2]。
2.2 RG-Ⅰ果胶多糖的分离纯化
果胶的分离纯化方法有沉淀法、盐析法和柱层析法,其中阴离子交换层析分级是最常用的方法。果胶的分离纯化一般使用阴离子交换填料柱分离系统(按带电量进行分离),包括 DEAE 或 Q(季铵型)填料[43]。果胶是酸性糖,当体系的pH值高于其等电点(3.38)时,果胶带负电,其携带的酸性基团越多吸附能力越强,通过不断增加洗脱液的离子强度,可将吸附的多糖从低电荷到高电荷梯度洗脱。Li等利用DEAE-纤维素柱分离柑橘罐头加工水中的果胶,其通过0~0.3 mol/L的氯化钠洗脱液获取了中性糖组分和酸性糖组分,但二者的分子量分布非常宽,无法进行下一步的凝胶柱分离[44]。果胶经过阴离子交换层析分级后只是根据带电量分成了若干组分,还需要利用凝胶柱进行后续分离纯化。凝胶层析的原理是大分子无法通过凝胶孔状结构而先于小分子析出凝胶柱,从而实现基于分子量对多糖的分离。Zhang等先采用DEAE-纤维素柱分离得到5种柑橘果胶馏分,再对4种酸性馏分进行后续Sepharose CL-6B柱分离,继而获得了8种分子量相对均一的馏分[45]。
3 RG-Ⅰ果胶多糖的检测
RG-Ⅰ果胶多糖的结构分析和活性探究需要多种检测方法支撑。目前,RG-Ⅰ果胶多糖的检测方法主要有单糖法、核磁法、质谱法和抗体法,4种方法分别存在各自的短板:单糖法不适用于阿拉伯聚糖或半乳聚糖,核磁法解析困难,质谱法需要先将RG-Ⅰ降解成寡糖,抗体法成本高。上述弊端导致目前缺少检测RG-Ⅰ果胶多糖的标准方法。下面对4种现有RG-Ⅰ检测方法的原理及其应用进行综述。
3.1 基于单糖组成的RG-Ⅰ检测方法
3.1.1 检测原理
在单糖组成方面,相比于HG,RG-Ⅰ增加了主链特有的鼠李糖及侧链独有的阿拉伯糖和半乳糖中性糖(无糖醛酸结构的单糖)。目前,仅发现有7种可以直接与鼠李糖O-4位相连的糖残基,且认为RG-Ⅰ侧链只有阿拉伯糖、半乳糖2种单糖,在忽略RG-Ⅱ存在的情况下,可近似认为n(RG-Ⅰ)=2n(Rha)+n(Ara)+n(Gal)。但当半乳聚糖或阿拉伯聚糖存在时,运用上述公式可能会出现RG-Ⅰ比例超过100%的情况,这也是单糖法存在的主要问题。表3总结了近年来依据上述公式计算RG-Ⅰ含量的文献。鉴于RG-Ⅰ、HG在单糖组成上的差异,也有文献使用n(GalA)/n(Rha)表征果胶多糖中RG-Ⅰ和HG的比例[46],使用n(Ara+Gal)/n(Rha)表征RG-Ⅰ的侧链程度,使用n(Rha)/n(Ara+Gal)表征RG-Ⅰ的支链程度[19]。

表3 基于单糖组成的RG-Ⅰ检测Tab.3 RG-Ⅰ detection based on monosaccharide composition
3.1.2 单糖法在RG-Ⅰ检测方面的应用
现有基于单糖组成的RG-Ⅰ测定方法很多,主要有气相色谱法(GC)、高效液相色谱法(HPLC)、高效阴离子交换色谱法(HPAEC)等。GC法面临的主要问题是:糖挥发性弱,需要适当的乙酰化、硅烷化或甲基化进行衍生以增强挥发性,且不同单糖的衍生效果不同。目前研究者已致力于简化衍生步骤、增加衍生物回收率、稳定衍生物、减少杂峰出现等研究[61]。Msakni 等利用三甲基氯硅烷将冰叶日中花叶多糖硅烷化,测定了Ara、Rha、Gal 3个中性糖的含量,结合间羟基联苯法测得的GalA含量,计算出RG-Ⅰ占比为33.7%~39%[47]。HPLC法的主要问题是:多种单糖的性质类似且在紫外下缺乏足够区分的特征官能团,导致紫外检测器不能进行单糖的直接测定。目前,解决这一问题的常用方法是对单糖进行柱前衍生,1-苯基-3-甲基-5-吡唑啉酮(PMP)是最常用的单糖衍生剂[62]。Zheng等采用三氟乙酸水解联合PMP衍生及HPLC法测定了柑橘罐头水中果胶的单糖组成,发现其富含阿拉伯糖(43.27%),RG-Ⅰ占比达62.70%[57]。HPAEC法能够将中性糖和糖醛酸以氧阴离子的形式分开,无需对样品进行柱前衍生, 这在很大程度上减少了单糖的检测步骤和时间,但HPAEC法一直存在鼠李糖和阿拉伯糖峰重叠、木糖和甘露糖峰重叠的问题[63]。该问题的解决方法是先对柱子进行强NaOH加载以分离鼠李糖和阿拉伯糖,再降低NaOH浓度以分离木糖和甘露糖。Ahmadi等通过先用18 mmol/L NaOH洗脱柱子15 min,再用18 mmol/L NaOH联合100 mmol/L乙酸钠洗脱的方式,测定出树莓和枸杞果胶中RG-Ⅰ的占比为34.5%~86.9%[26]。
3.2 基于核磁共振技术(NMR)的RG-Ⅰ检测方法
3.2.1 检测原理
1H NMR可以提供异头氢信息,确定糖苷键的α或β类型,但RG-Ⅰ结构复杂,致使1H NMR在3.0~5.0相对化学位移的信号严重重叠,糖苷键类型无法被区分。13C NMR可以提供异头碳信息,确定某些特定基团,但RG-Ⅰ分子量大、溶解度低,在进行13C NMR测试时需要高磁场、高耗时以获取强信号。RG-Ⅰ区别于HG的主要结构是主链的→2)-α-L-鼠李糖-(1→4)-α-D-半乳糖醛酸-(1→结构以及侧链的→5)-α-阿拉伯糖-(1→、→3,5)-α-阿拉伯糖-(1→、→4)-β-半乳糖-(1→等结构,因此从糖苷键的种类可以区分RG-Ⅰ与HG,此时需要二维核磁来确定果胶的糖苷键。1H -1H COSY谱是定性证明核之间耦合常数存在的有效方法。当存在广泛的二阶耦合时,采用TOCSY谱进行补充和验证;NOESY谱可提供糖苷键的连接顺序;HSQC谱可给出直接相连的碳氢关系信息;HMBC谱可将1H核与远程耦合的13C核关联,提供分子骨架结构信息。NMR可用于RG-Ⅰ果胶的精细结构解析,其在分析单糖组成的同时也可获得链构型、糖苷键等信息。NMR在使用中通常需要结合单糖组成信息及降解、甲基化等辅助手段,所需样品纯度高且数据采集和分析步骤繁琐,一般不适用于快速的RG-Ⅰ检测和定量。
3.2.2 核磁共振技术在RG-Ⅰ检测方面的应用
相比于传统的糖分析方法,如HPLC、LC-MS、GC-MS等,NMR具有穿透性强、适用性广、非破坏性等优点,已被广泛应用于RG-Ⅰ果胶多糖的结构解析。Yao等对RG-Ⅰ果胶在NMR中常见信号峰的化学位移进行了综述[64]。Zhang等通过对采用酸法、碱法提取的果胶进行1H NMR检测,发现采用碱法提取的果胶在5.10~5.20相对化学位移内出现了3种不同的阿拉伯糖,另有归属于半乳糖的信号峰出现,提示碱法提取果胶的RG-Ⅰ侧链构型比酸法提取果胶更复杂,且RG-Ⅰ含量高于酸法提取果胶[32]。Zheng等在使用α-1,5-阿拉伯糖酶去除柑橘果胶中的阿拉伯糖侧链后,利用1H NMR对果胶样品进行检测,发现酶切后果胶中阿拉伯糖的信号峰强度减弱,而其余单糖的信号峰强度没有明显改变[57]。Dourado等对杜仲多糖进行了COSY、HSQC、HMBC谱测定,推测杜仲多糖为一种阿拉伯聚糖样果胶,其中,n(T-阿拉伯糖)∶n(1,5-阿拉伯糖)∶n(1,3,5-阿拉伯糖)∶n(1,2,3,5-阿拉伯糖)=3∶2∶1∶1[65]。Shen等对楤木叶果胶多糖进行了DEPT、HSQC、HMBC、COSY、NOESY和TOCSY谱测定,推测楤木叶果胶的主链由RG-Ⅰ和HG构成且n(RG-Ⅰ)∶n(HG)=1∶1,而RG-Ⅰ侧链由直链阿拉伯聚糖和带有阿拉伯糖的半乳聚糖构成,侧链中有54.1%的鼠李糖残基[66]。
3.3 基于质谱技术的RG-Ⅰ检测方法
3.3.1 检测原理
质谱法能够先将样品转化为运动的气态离子,再按质荷比大小进行样品分离并记录样品信息。一级质谱可以提供果胶寡糖的分子量信息,串联质谱可以测定果胶寡糖的糖苷键、糖基化位置、连接顺序等信息。基于质谱技术对果胶多糖进行分析需要先获得大分子果胶的寡糖片段,找到可能的结构片段以排除替代物。根据质谱高级断裂中不同断裂碎片与糖苷键之间的关系,能够推测出果胶寡糖中不同糖残基的糖苷键。GalA寡糖的一般裂解模式已经被测定,其在MALDI-PSD-TOF-MS正模式下可以给出Bi-、Ci-、Yi-系列,在ESI-IT-MS/MS负模式下主要产生C、Z系列离子,这使得甲基酯化可以被定位,并允许对聚合度小于10的部分甲基酯化低聚半乳糖进行测序。
3.3.2 质谱在RG-Ⅰ检测方面的应用
Schols等早在1994年就对苹果来源的RG-Ⅰ寡糖进行了HPAEC-MS分析,测定出(Rha)2-(GalA)2、(Rha)2-(Gal)1-(GalA)2、(Rha)2-(Gal)2-(GalA)2、(Rha)3-(GalA)3、(Rha)3-(Gal)2-(GalA)3、(Rha)3-(Gal)3-(GalA)3等不同寡糖结构[67]。一级质谱(MS)存在无法准确测定半乳糖残基连接方式的问题,二级质谱(MS/MS)的应用弥补了一级质谱对半乳糖残基测定的局限性。Coenen等通过二级质谱测定出苹果的RG-Ⅰ寡糖结构为(Rha)2-(Gal)3-(GalA)2,其中半乳糖醛酸还原端的第一个鼠李糖连接二聚半乳糖,第二个鼠李糖连接单体半乳糖[68]。当前已有研究利用MSn对含有阿魏酸的阿拉伯寡糖和半乳糖寡糖进行结构鉴定。Quéméner等采用带有离子阱或四级飞行时间质谱的电喷雾电离质谱分析对比了2-O-反式阿魏酰基-L-阿拉伯吡喃糖、5-O-反式阿魏酰基-L-阿拉伯呋喃糖、O-(2-O-反式阿魏酰基-L-阿拉伯呋喃酰基)-1,5-L-阿拉伯呋喃糖、O-(反式阿魏酰基-D-半乳吡喃基)-1,4-D-半乳吡喃糖之间的差异,发现四级飞行时间质谱的酯键断裂离子更丰富,推测阿魏酰基连接在阿拉伯糖残基的O-2、O-5位或半乳糖残基的O-6位[69]。
虽然质谱法在解析RG-Ⅰ果胶多糖时具有所需样品量少、允许以混合物形式检测、能够提供RG-Ⅰ序列信息等优点,但样品测定前需要先经过酶解、化学降解等途径获得大分子果胶的寡糖片段。采用酶解方式获取RG-Ⅰ寡糖碎片时需要利用多种酶进行顺序降解,所需酶浓度高且降解不彻底。针对该问题,已有研究采用化学降解法破坏糖苷键来降解多糖,如利用受控的氧化反应产生自由基,此方法成本低、降解彻底,不会对糖单元造成明显的结构改变[46],但如何使用质谱进行后续检测仍有待深入探索。
3.4 基于单克隆抗体的RG-Ⅰ检测方法
3.4.1 检测原理
RG-Ⅰ在1980年代曾被用于产生多克隆抗体血清,研究人员将纯RG-Ⅰ果胶与甲基化的牛血清白蛋白混合皮下注射到兔体内,反复刺激12周后获得了抗RG-Ⅰ抗体,虽然滴度很低(10),仍证明RG-Ⅰ结构具有免疫原性,抗体与特定RG-Ⅰ表位的特异性结合过程属于血清学反应[70]。1990年代,Puhlmann等将悬浮培养的悬铃木细胞壁RG-Ⅰ果胶多糖和牛血清蛋白腹腔注射到小鼠体内,首次得到了稳定、能分泌抗RG-Ⅰ的杂交瘤细胞系,并获得了抗RG-Ⅰ结构的抗体CCRC-M1,发现α-1,2连接的末端岩藻糖基是CCRC-M1识别RG-Ⅰ表位的关键结构,但配体竞争实验表明CCRC-M1与1种半纤维素多糖的结合也非常紧密,说明CCRC-M1并非特异性识别RG-Ⅰ结构域[71]。后续研究人员经过不断改进,逐渐形成了2类抗RG-Ⅰ抗体,分别为特异性识别半乳聚糖侧链和阿拉伯聚糖侧链的抗体(表4)。2类抗体的制备方法大同小异。Jones等在1997年将番茄RG-Ⅰ多糖和甲基化的牛血清白蛋白混合注射到大鼠体内,将脾脏淋巴细胞与IR983大鼠骨髓瘤细胞融合,杂交瘤细胞分泌LM5抗体[72]。LM5识别(1→4)-β-D-半乳聚糖中线性四糖的非还原端,与(1→3)-β-D-半乳聚糖或(1→6)-β-D-半乳聚糖无交叉反应[73];LM26识别(1→4)-β-D-半乳聚糖中的(1-6)-半乳糖基取代,且不识别线性(1→4)-β-D-半乳聚糖[74];LM6识别(1→5)-α-L-阿拉伯聚糖中的线性五糖,但并非特异性识别,且与阿拉伯树胶无反应[75];LM16识别与阿拉伯糖相关的表位,可通过阿拉伯呋喃糖苷酶的作用及阿拉伯糖基残基的丢失产生,LM16结合对半乳糖苷酶作用敏感,表位可能涉及RG主链上的半乳糖残基[76];LM9识别阿魏酰化的(1→4)-β-D-半乳聚糖,该表位是苋菜科和藜科植物果胶的特征结构,与其他聚合物无反应[77];LM13识别(1→5)-α-L-阿拉伯聚糖中的线性表位,该抗体与果胶阿拉伯糖的1个特定亚群结合,与1,5-连接的阿拉伯糖基残基的更长片段结合,这些残基在未分支的阿拉伯糖中可能更丰富[78]。
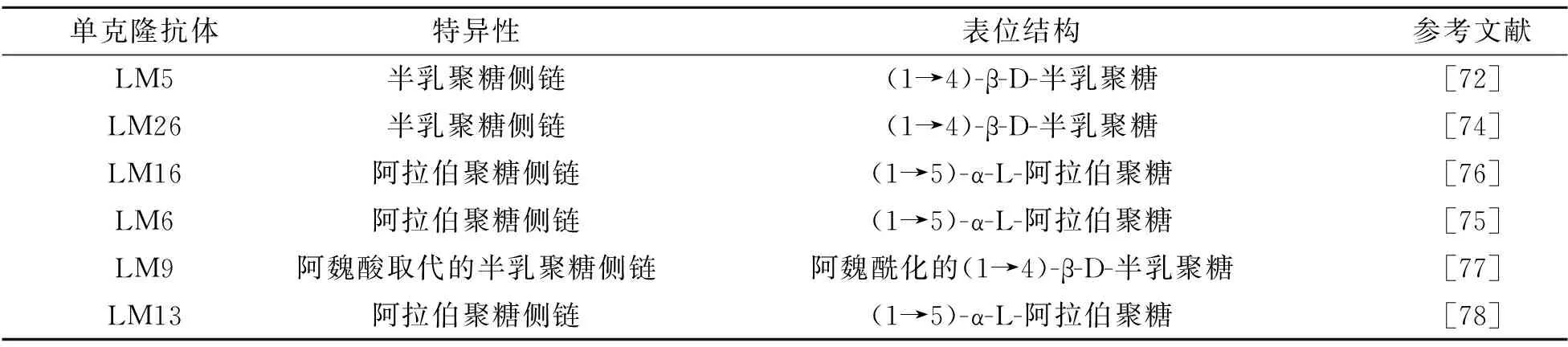
表4 与RG-Ⅰ特异性结合的单克隆抗体Tab.4 Monoclonal antibodies specifically binding to RG-Ⅰ
3.4.2 单克隆抗体在RG-Ⅰ检测方面的应用
抗体检测可在不破坏细胞壁的情况下检测细胞壁中的RG-Ⅰ含量和分布,是一种原位可视化分析技术,多用于植物生理学领域[79]。目前用抗体检测法定量RG-Ⅰ 的研究较少。Yu等对分离得到的2种富含RG-Ⅰ的人参根多糖组分进行了LM16结合能力测定,发现RG-Ⅰ能响应LM16,但是人参根细胞壁中普遍存在多糖表位掩蔽现象,导致与LM16的结合能力减弱[80]。Leszczuk等采用免疫组织化学技术和免疫金标记技术,结合LM16抗体,定量分析了阿拉伯聚糖在细胞壁-质膜中的分布[81]。Torode等发现LM26可以与拟南芥、芒属、甜菜等植物的韧皮部结合,可识别β-1,6-半乳糖基取代的β-1,4-半乳聚糖,通常需要3个以上主链残基进行优化识别;该分支半乳聚糖结构已经在大蒜鳞茎中发现,且大蒜鳞茎细胞壁已被用于确认LM26表位与细胞壁果胶鼠李糖乳糖醛酸Ⅰ之间的关联[74]。Rongkaumpan等分别利用LM5、LM26、LM6-M、LM13、LM16抗体定量了香蕉、芒果细胞壁及提取的细胞壁多糖中的半乳聚糖、支链半乳聚糖、阿拉伯聚糖、直链阿拉伯聚糖含量[82]。
4 结语与展望
RG-Ⅰ果胶多糖结构高度复杂,在传统果胶制备工艺中往往被酸去除,其结构和功能的研究程度远低于传统HG果胶,学界当前对RG-Ⅰ果胶多糖的界定及检测方法仍不清晰。本文系统综述了RG-Ⅰ果胶多糖的概念、分子结构、生物活性、提取纯化及检测方法,其重点关注内容及相应的RG-Ⅰ未来发展方向可参考以下几个方面。
在RG-Ⅰ界定方面,总结指出RG-Ⅰ是一类主链由鼠李糖和半乳糖醛酸以α-1,4糖苷键依次相连的酸性果胶样多糖,其鼠李糖残基可连接中性糖侧链。后续研究应进一步明确RG-Ⅰ果胶多糖的定义,将阿拉伯糖侧链、半乳糖侧链等纳入RG-Ⅰ结构域。
在RG-Ⅰ提取纯化方面,RG-Ⅰ的提取方法较多,包括酸碱提取、酶法提取及超声、微波、超高压辅助提取等,当前应用最广泛的为碱提取法,该方法操作简单,RG-Ⅰ提取量高。果胶的分离纯化研究较少,当前多利用阴离子交换填料进行纯化,少量采用凝胶柱进行纯化。未来可探索针对RG-Ⅰ的提取纯化方法以服务RG-Ⅰ研究。偏碱性条件的顺序提取可能是RG-Ⅰ的理想提取方法,而阴离子交换层析分级结合凝胶柱层析法可获得不同电荷、不同分子量的RG-Ⅰ组分,可能是RG-Ⅰ的理想分离纯化方法。
在RG-Ⅰ检测方面,单糖法操作简单、成本低、检测方式多样、重复性好、适用性广,但存在如下问题:(1)鼠李糖、阿拉伯糖、半乳糖并不只存在于RG-Ⅰ中,RG-Ⅱ中也可能存在,检测中无法排除RG-Ⅱ的干扰;(2)阿拉伯聚糖和半乳聚糖的存在使RG-Ⅰ的测定含量偏高;(3)不同多糖无法采用统一的水解条件,水解过程中可能降解不完全或过度降解。NMR法操作简单、不破坏糖结构,但成本高、分析难、需结合糖的基本信息进行解析。质谱法可测得RG-Ⅰ的精确结构,但需要先将RG-Ⅰ多糖降解为寡糖,目前仍没有直接采用质谱技术精确计算RG-Ⅰ含量的报道。抗体法对RG-Ⅰ结构的针对性强,可在细胞壁中完成RG-Ⅰ含量、分布的可视化分析,但也存在如下问题:(1)成本高,不利于大规模检测;(2)操作复杂且重复性差;(3)目前无针对鼠李糖的检测抗体。未来可考虑建立RG-Ⅰ果胶的系统检测方法,主要检测依据为单糖组成,同时结合核磁、质谱、抗体等手段进行辅助验证。基于DNA杂交的探针型芯片技术可能是今后RG-Ⅰ结构检测的努力方向。

