线虫在轨液体培养荧光观测关键参数研究
王 巍, 元姝棋, 邱 辉, 卢盈宇, 张 普, 钟润涛, 孙野青*
(1.大连海事大学环境科学与工程学院环境系统生物学研究所, 大连 116026;2.北京大学医学部基础医学院, 北京 100089)
1 引言
秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)个体小,其成虫体长仅1 mm,全身透明,以细菌为食,全身共有不到1000 个细胞,性别为雌雄同体或雄性,繁殖周期短,既可以在固体线虫生长培养基(Nematode Growth Medium,NGM)上生长,也可以在液体培养基(C. elegansMaintenance Medium,CeMM)中生长。 野生型N2 线虫在固体培养基上发育至成虫(经历L1、L2、L3、L4 四个时期)仅需2~3 d,在液体培养基中发育至成虫只需6~7 d[1]。 线虫的一些组织可用基因工程手段融合荧光蛋白来进行荧光标记,例如用荧光标记线虫的体壁肌肉组织、中枢神经系统、生殖系统等,这些荧光标记的线虫可以用来进行针对性的研究。 线虫对于空间辐射和微重力的感知与人类及一些哺乳动物在细胞水平相似[2],并且在空间环境中具有耐受性好、生保需求少、样品收集简单、易于观察等优点。 由此可见,秀丽隐杆线虫是用来研究空间生物学效应的一种理想模式生物。
从1992 年的航天飞机(Space Transportation System,STS)计划到2004 年的首次线虫国际飞行实验(InternationalCaenorhabditis elegansExperiment First Flight,ICE-FIRST)以及中国的神舟八号和实践十号飞行任务已进行多次空间线虫搭载实验,但样品都为L1 期线虫幼体或道尔期线虫,实验结束后线虫样品返回时已为世代混合状态或未发育的道尔期状态,未实现单条线虫在轨完整的生命周期观察。 为了在中国空间站实现单线虫在轨发育的全周期培养和观测,本研究团队设计了利用微流控芯片对线虫进行基于液体培养体系的自动化无菌培养方案[3]。 选用了CeMM 来培养线虫,建立了固体培养转为液体培养的方法[1],驯化了来源为固体NGM 生长的N2 野生型线虫,驯化后的线虫可在完全无菌的状态下生长繁殖,明确了野生型线虫在CeMM 中的生长环境以及生长发育指标测量的方法。 为了避免出现线虫在发射上行和在轨实验等待过程中无法有效观测发育和产卵等情况,前期实验也明确了利用12 ℃低温进行在轨前线虫发育控制,在轨实验时再转移至20 ℃正常观测的方案[1]。
空间的复杂环境尤其是辐射和微重力对线虫的DNA 损伤、细胞凋亡、肌肉和神经损伤的影响在发育过程中的动态变化过程,有必要进一步在空间开展分子水平的观测和验证。 这些研究需要实现线虫的长期在轨自动化培养以及对线虫相关通路荧光标志物的观察。 空间在轨的荧光观测实验由于技术限制等因素结果较少,Lei 等[4]在实践十号空间研究中搭载了一种带有可编程控制温度、自动显微照相和样品固定的小鼠胚胎微型培养箱,可以对小鼠的胚胎细胞分裂进行在轨观测。目前还没有在轨对线虫组织层面荧光观测的相关研究,需要在平台上实现硬件的构建,因此构建荧光观测的方法和实验条件都需要地面实验来进行验证。
本文筛选代表性的荧光标记线虫,并建立在CeMM 中驯化荧光标记线虫和获取荧光成像指标的方法。 实验分别在12 ℃和20 ℃下测量荧光线虫发育过程的体长、体宽、寿命、产卵周期和泳动频率,获得荧光线虫在发育时期的荧光观测条件和数据,为利用线虫进行空间站在轨培养及观测的硬件设计和技术要求提供输入条件。
2 材料与方法
2.1 线虫材料和筛选
秀丽隐杆线虫品系均购自美国线虫遗传中心(CaenorhabditisGenetics Center,CGC)。
针对在轨发育的线虫主要进行辐射和微重力协同效应的分析,除野生型线虫外,可以利用微重力感受或辐射感受关键基因荧光标记位点的定性和定量分析进行效应的观测。 为了建立荧光线虫培养和观测的方法,调研了对微重力与辐射产生响应并携带荧光标记位点的线虫。 目前利用线虫进行微重力效应的研究主要集中在肌肉萎缩、运动神经系统与寿命方面[5-7]。 利用线虫进行辐射损伤效应研究主要集中在基因组突变[8-9]、细胞凋亡[10]、免疫水平[11]、氧化胁迫[12]等方面。 对参与以上通路的十几种关键基因具有荧光标记的线虫进行筛选(全身或局部大范围组织能观测到荧光),并利用CeMM 进行长期(≥4 个月)的驯化得到本文所用2 种荧光标记线虫AM141和CZ13799。
2.2 CeMM 配制
CeMM 是多次用在国际空间站进行线虫培养和观察的标准培养基,无菌无嗅,包含线虫生长所需的全部营养元素,主要成分包括维生素、无机盐、氨基酸、核苷酸、脂质和葡萄糖等。 配制采用Szewczyk 等[13]的化学定义线虫培养基配制方法。
2.3 CeMM 培养线虫的驯化及同步化
为了得到适应CeMM 液体生存环境的线虫,需要从NGM 上将线虫转移至CeMM 并进行驯化。驯化过程主要包括同步化得到虫卵、将虫卵转移至小体系CeMM 中除菌培养、初代成虫获取、多次连续同步化和培养直至线虫培养体系稳定不染菌,线虫发育过程稳定在固定期间内。 获取到驯化成功的线虫后,可使用CeMM 进行大体系培养[1]。 线虫同步化采用氢氧化钠/次氯酸钠裂解法[1]。
2.4 CeMM 培养线虫发育过程生理指标分析
测量生长发育过程指标包括从幼虫发育至成虫的体长和体宽的增长、产卵周期和寿命,为微流控芯片尺寸设计提供参考支持。 测量体长时选取线虫身体的中间位置,测量体宽时选取线虫咽部位置利用画线法测量。 测量产卵周期时选取单条线虫每天连续跟踪观察,从出现子代幼虫起至子代产卵为止。 寿命测量使用5-氟尿嘧啶(FudR,5-fluoro-2′-deoxyuridine) 抑制产卵,选取单条线虫每天连续跟踪观察线虫是否存活,绘制存活曲线[1]。 实验分别在20 ℃和12 ℃两种温度下测量。
2.5 CeMM 培养线虫发育过程中泳动频率测量
线虫在CeMM 中的运动状态呈现为头部和身体的随机快速左右摆动,而非在固体培养基上的正弦曲线摆动。 因此通过泳动频率即每分钟左右各摆动一次的数目来体现线虫在液体培养基中的运动能力。 泳动频率将直接体现线虫受到空间微重力影响的效应。 线虫同步化后得到L1 期幼虫,在PCR 管内分装培养,管内个体数大于5 条,分为两组(12 ℃和20 ℃),黑暗培养。 每天从每组中取5 条线虫进行视频录制,统计线虫每10 s的泳动次数(线虫左右弯曲1 次计为1 次泳动),共测量5 次。 计算5 次泳动次数的平均值,将该数值乘以6,即为线虫每分钟的泳动频率。 统计至线虫生长为成虫并且产卵后不能区分当代和子代为止。
2.6 荧光测量及分析方法
2.6.1 荧光成像
线虫同步化后得到L1 期幼虫并分装培养(同2.5 节),测量时将线虫吸取至载玻片,使用灼烧法固定,荧光显微镜测定荧光表达水平(激发波长488 nm,发射波长510 nm)。 曝光时间为300 ms 或600 ms,4×及10×物镜放大,对线虫个体荧光成像跟踪至线虫发育为成虫。
2.6.2 荧光数据分析方法
利用Image-Pro Plus 6.0 软件,将荧光图转化为灰度图,选择需要测量的区域,测量荧光成像图片的累积光密度(Integrated Optical Density,IOD)。
3 结果与讨论
3.1 荧光线虫的筛选、驯化
通过筛选并利用CeMM 进行长期(≥4 个月)驯化后,选定了2 种参与微重力响应通路的关键分子(unc-54 和unc-25)上带有YFP(Yellow Fluorescent Protein)或GFP(Green Fluorescent Protein)荧光标记的线虫AM141 和CZ13799(表1),作为本文用于建立荧光标记线虫在轨培养观测方法的初步样品。

表1 荧光标记线虫特征Table 1 Characteristics of fluorescent labeled C.elegans
AM141[rmIs133 (unc-54p::Q40::YFP)][14]为肌球蛋白重链unc-54 基因荧光标记线虫,在unc-54 基因后连入了40 个poly Q 重复片段构建而成。 随着发育,poly Q 在体壁肌肉层聚集,引起线虫肌肉蛋白功能丧失,产生运动障碍从而出现运动能力减退现象。 poly Q 片段后融合了YFP,因而可以在荧光显微镜下观察到线虫体壁荧光。该品系线虫通常被用来研究微重力对肌肉系统的影响,Qiao 等[15]利用AM141、HA759 等微重力敏感品系在神舟八号飞行和地面模拟微重力条件下对线虫的运动能力和生殖能力进行了研究,但未发现空间飞行对线虫产生显著性影响。
CZ13799[juIs76 (unc-25p::GFP) +lin-15(+)]为谷氨酸脱羧酶unc-25 基因荧光标记线虫,即GABA 生物合成酶[16],在该基因后融合GFP,使荧光在GABA 能神经元中表达。 研究者通常使用该基因进行运动神经系统的研究。 Xu等[17]研究发现维持谷氨酸能和γ-氨基丁酸能(GABAergic)系统之间的平衡可以减轻小鼠尾悬吊(模拟微重力效应)引起的认知和神经缺陷。
将购置于CGC 线虫品系库的AM141 和CZ13799 线虫从NGM 固体培养基上进行了扩繁和同步化培养,将L1 幼虫进行了CeMM 驯化。通过20 次(不短于4 个月)的连续驯化和无菌筛选,AM141 和CZ13799 线虫可以适应CeMM 并稳定正常生长及传代(图1)。 驯化后的线虫在CeMM 中的发育周期(从卵至成虫)稳定,AM141的发育周期为(10±1)d,CZ13799 的发育周期为(8±1)d(图2)。
图1 适应CeMM 的AM141 和CZ13799 线虫生存状态Fig.1 Survival status of AM141 and CZ13799 adapted to CeMM
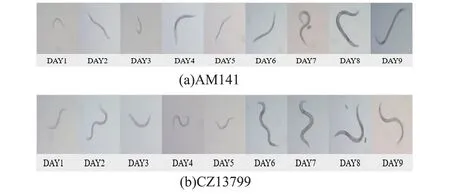
图2 驯化后的线虫在CeMM 中的发育过程Fig.2 Development process of the domesticated nematode in CeMM
3.2 发育指标分析
3.2.1 体长与体宽
在得到驯化成功的荧光线虫后,跟踪了CeMM 培养的野生型线虫(N2)及两种荧光线虫(AM141,CZ13799)在20 ℃和12 ℃温度下发育过程的体长和体宽的变化情况。 从L1 期开始记录,进行至线虫生长为成虫为止。 每天统计线虫个数不等,最少为8 条,统计结果见图3、图4。
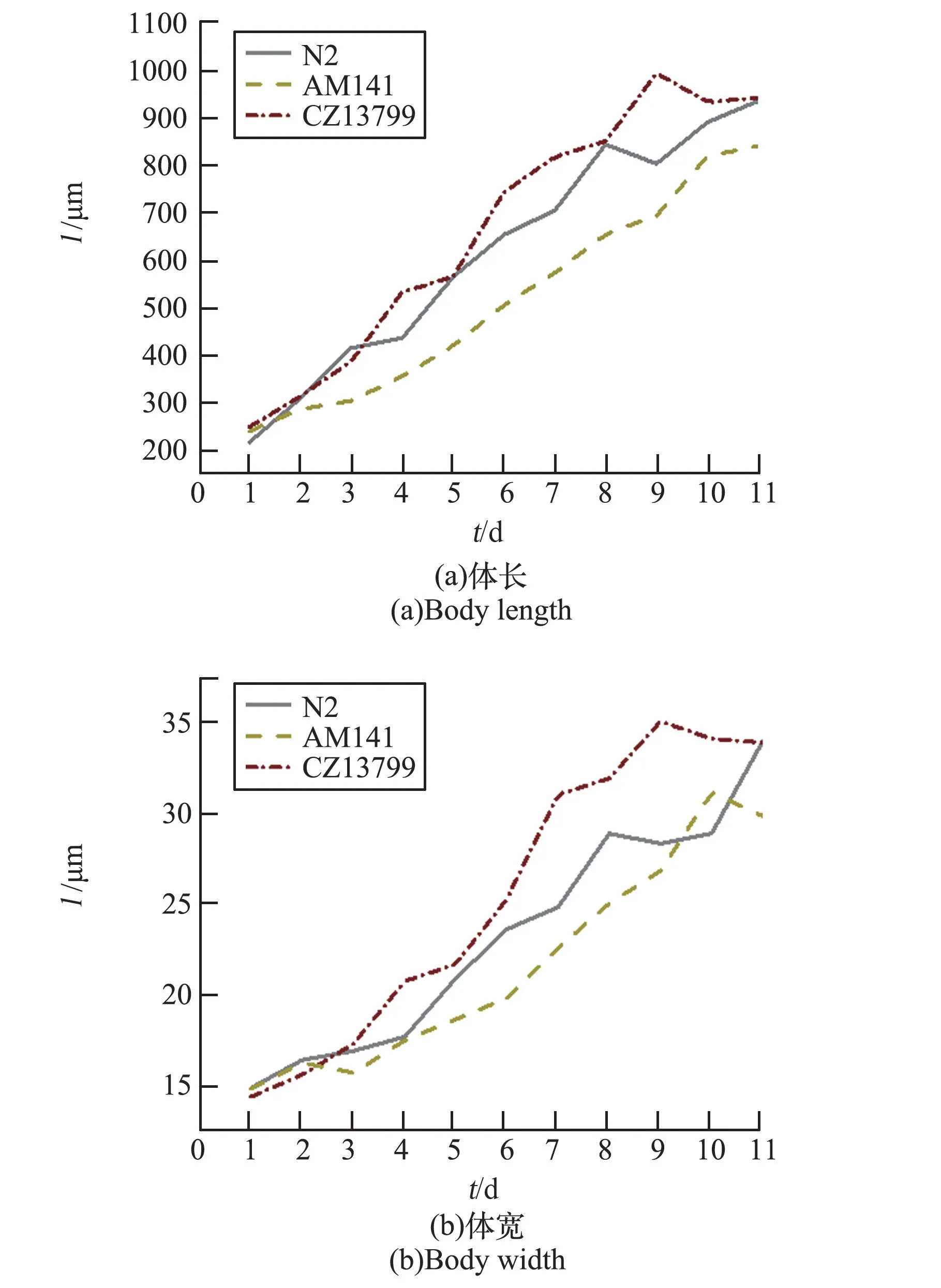
图3 野生型线虫和AM141、CZ13799 荧光线虫在20 ℃下发育的体长体宽对比Fig.3 Comparison of body length and body width of N2 and AM141, CZ13799 nematodes under 20 ℃

图4 野生型线虫和AM141、CZ13799 荧光线虫在12 ℃下发育的体长、体宽对比Fig.4 Comparison of body length and body width of N2 and AM141, CZ13799 nematodes under 12 ℃
从3 种线虫的体长、体宽发育趋势数据可以发现:20 ℃下,N2 和CZ13799 两种线虫的平均发育时间为8 d,而AM141 的平均发育时间较长,达到了10 d。 12 ℃下,N2 和CZ13799 两种线虫的平均发育时间为18 d,而AM141 的平均发育时间较长,达到了21 d。 两种温度下线虫发育至成虫后的尺寸比较为CZ13799 >N2 >AM141。 相比于20 ℃,在12 ℃低温下N2 和CZ13799 两种线虫发育至成虫的体长、体宽减少,而AM141 成虫的体长和体宽却增加。
从野生型和两种荧光标记线虫的体长体宽发育趋势中可以看到,线虫在20 ℃和12 ℃两种温度下都可以发育到成虫,但环境温度为12 ℃时线虫从L1 期至成虫的发育时间明显延缓了10 d以上。
3.2.2 产卵周期
对于产卵量(表2),20 ℃下N2 与AM141 数量接近,CZ13799 显著性多于前两品系;12 ℃下N2 产卵量与AM141 相较于20 ℃时没有显著性减少,但CZ13799 线虫产卵量减少一半以上。

表2 野生型线虫和AM141、CZ13799 荧光线虫在两个温度下的产卵量对比Table 2 Comparison of egg yield of N2 and AM141,CZ13799 nematodes under two temperatures
对于产卵周期每天统计线虫个数不等,最少为10 条,统计结果见图5。 由图可以看出,20 ℃下AM141 的产卵起始(第8 天) 晚于N2 和CZ13799(第6 天),并且产卵的持续时间明显延长;12 ℃下所有线虫产卵开始的时间后移1 周左右,并且AM141 的产卵起始仍晚于 N2 和CZ13799,并一直延长至第36 天。
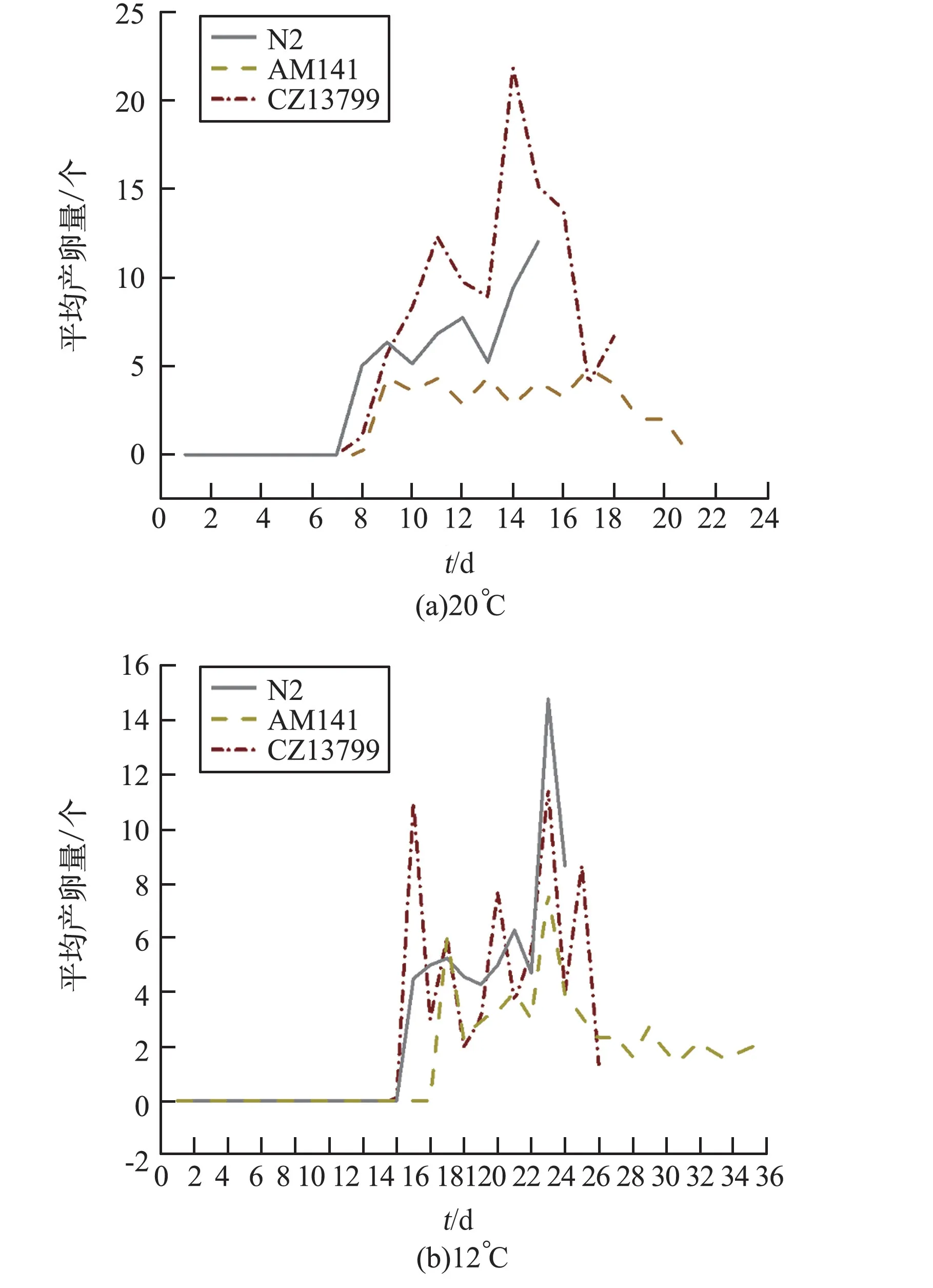
图5 野生型线虫和AM141、CZ13799 荧光线虫在两个温度下产卵情况对比Fig.5 Comparison of egg laying of N2 and AM141,CZ13799 nematodes under two temperatures
3.2.3 线虫寿命
若要在CeMM 中对线虫进行长期连续的寿命跟踪,就需要排除子代生长对母代的干扰,所以本文实验利用五氟尿嘧啶来抑制线虫产卵[18]。
在20 ℃状态下,N2 平均寿命为48 d,CZ13799 平均寿命为43 d,AM141 平均寿命为41 d;在12 ℃状态下,N2 平均寿命为69 d,CZ13799 平均寿命为62 d,AM141 平均寿命为60 d。
从3 种线虫的存活曲线可以发现(每个采样点统计线虫条数不少于100,见图6):20 ℃状态下,3 种线虫的平均寿命都在1 个月以上,最长可达70 ~80 d;N2 线虫寿命要长于CZ13799 和AM141。 12 ℃状态下,野生型和荧光线虫的平均寿命都可达到2 个月以上,最长可达100 ~120 d;3 种线虫的平均寿命在低温下延长约20 d 左右,低温环境在延缓线虫发育的同时,线虫的寿命也相应增长,N2 线虫寿命长于CZ13799 和AM141,AM141 平均存活时间最短。
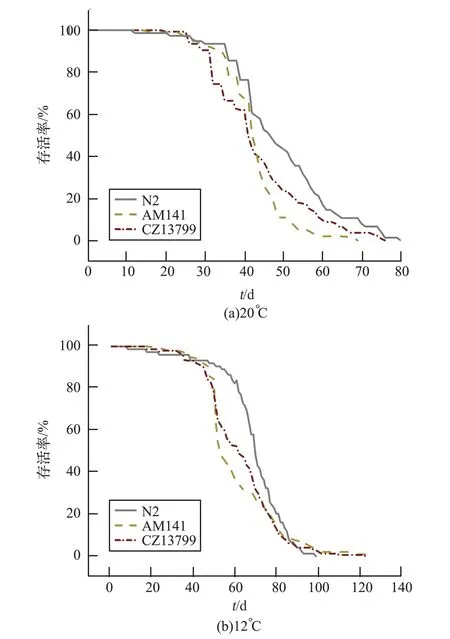
图6 野生型线虫和AM141、CZ13799 荧光线虫在两个温度下寿命对比Fig.6 Comparison of longevity of N2 and AM141,CZ13799 nematodes under two temperatures
3.2.4 泳动频率
在20 ℃和12 ℃下,分别对野生型线虫和荧光线虫进行平均泳动频率统计,从线虫L1 期开始,至发育至成虫结束(表3)。 由表中可以看出,20 ℃和12 ℃下,野生型线虫的平均泳动频率均高于2 种荧光线虫,综合比较为N2 >AM141 >CZ13799。 3 种线虫在20 ℃下的平均泳动频率都高于12 ℃状态下的平均泳动频率,低温条件降低了线虫的运动水平。

表3 野生型线虫和AM141、CZ13799 荧光线虫在2 个温度下的平均泳动频率对比(n=5)Table 3 Comparison of average swimming motility of N2 and AM141, CZ13799 nematodes under two temperatures (n=5) 次/min
对每一种线虫在20 ℃和12 ℃下的发育指标的分析可以发现:相对于20 ℃常规培养温度,12 ℃低温下线虫也能够正常存活和发育并完成生命周期。 但在12 ℃下,线虫的发育周期延长,从L1 幼虫至成虫可以持续2 ~3 周,这个过程中没有卵的产出和子代的发育,利用微流控芯片培养时不会对芯片通道造成影响和阻碍,因此可以作为空间在轨实验前如发射场等待、上行、在轨对接等过程的保持温度。
不同的荧光线虫发育时期的体长、体宽、产卵、寿命与野生型相比都有一定区别,因此在轨的换液频率与观测时间与野生型相比需要不同的流程。 目前两种荧光标记线虫的体长、体宽与野生型相比变化范围在10%左右,在微流控芯片设计角度需要进一步考虑该问题。
3.3 荧光线虫的荧光指标及发育过程中的变化
3.3.1 荧光标记线虫的荧光状态
利用光源为激发波长488 nm、发射波长510 nm 的荧光显微镜进行荧光成像,两种荧光线虫的荧光状态如图7 所示。 在10 倍物镜放大下可清晰看到AM141 线虫体壁的荧光点分布,该荧光点即为融合了黄色荧光蛋白的unc-54p::Q40 聚集点。 CZ13799 线虫也可观察到神经网的分布。
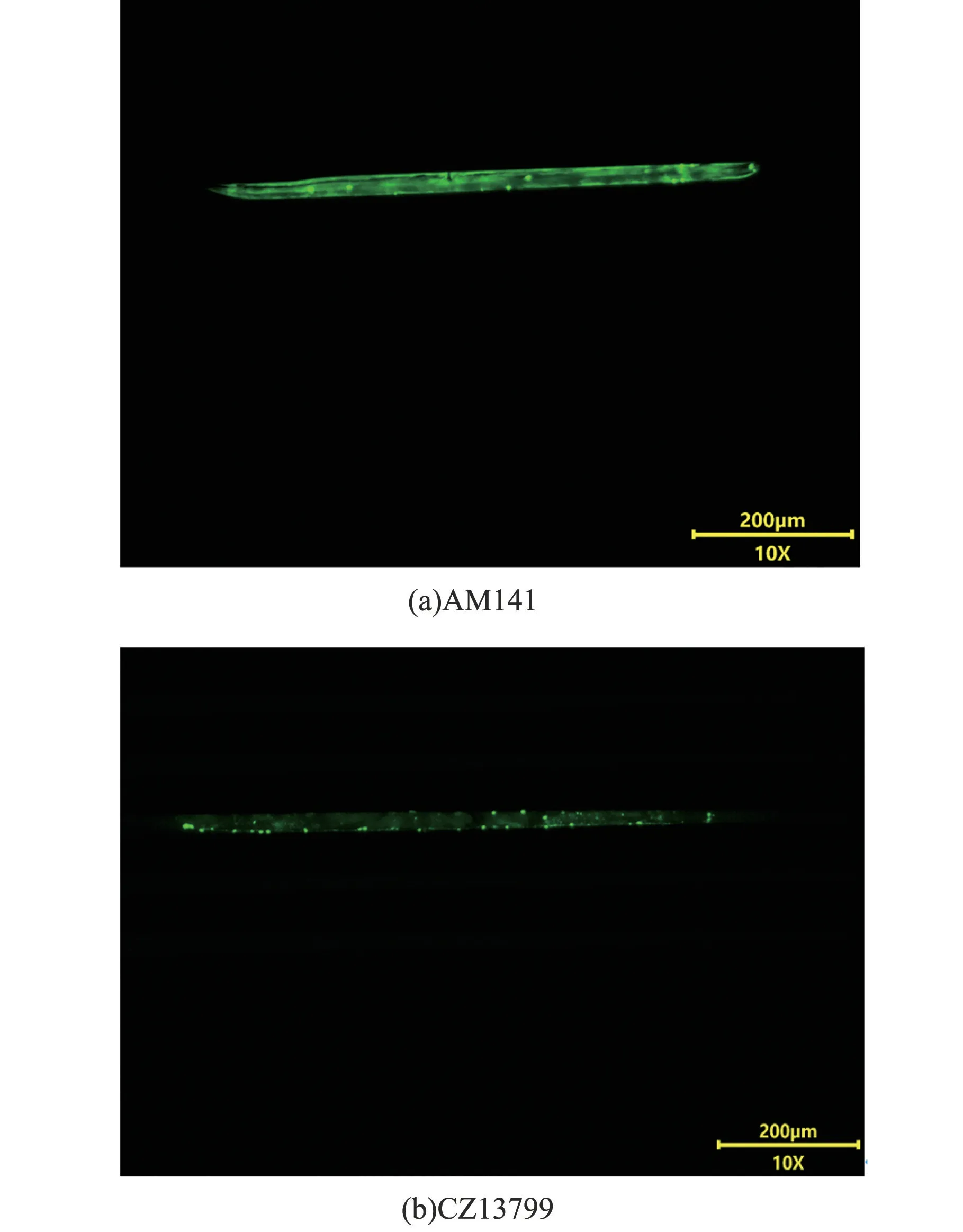
图7 AM141、CZ13799 两种线虫荧光状态(10×)Fig.7 Fluorescence status of AM141 and CZ13799 nematode (10×)
根据在轨实验装置荧光成像技术指标的要求,装置实际的物镜放大倍数在1.7 ~2.5 倍左右,因此利用实验室最低物镜4 倍(换算实际放大倍数为2.66 倍)进行成像,曝光时间分别设定为300 ms 和600 ms。 最终明确600 ms 的成像曝光时间能够基本满足2 种荧光线虫的在轨发育过程成像需求(图8),能够实现线虫荧光强度的测量。

图8 AM141、CZ13799 两种线虫荧光状态(4×)Fig.8 Fluorescence status of AM141 and CZ13799 nematode (4×)
AM141 和CZ13799 线虫在20 ℃和12 ℃下从L1 至成虫发育过程中的荧光状态如图9、10所示。

图9 AM141 线虫在20 ℃和12 ℃发育过程荧光成像(4×)Fig.9 Fluorescence imaging of AM141 during development under 20 ℃and 12 ℃( 4×)
在20 ℃和12 ℃两种温度下,AM141 和CZ13799 线虫在发育过程中基本可实现荧光成像。 20 ℃时,由于前两天线虫体型较小,AM141和CZ13799 线虫的荧光点在4 倍时较为模糊,在第3 天后可以观察清楚;12 ℃时则为第11 天以后可观察清楚。 此结果可以作为在轨线虫加载和荧光观测时间节点限制的输入条件。 在20 ℃和12 ℃下,4 倍成像均可实现发育过程中荧光强度的测量。
3.3.2 线虫发育过程的荧光强度变化
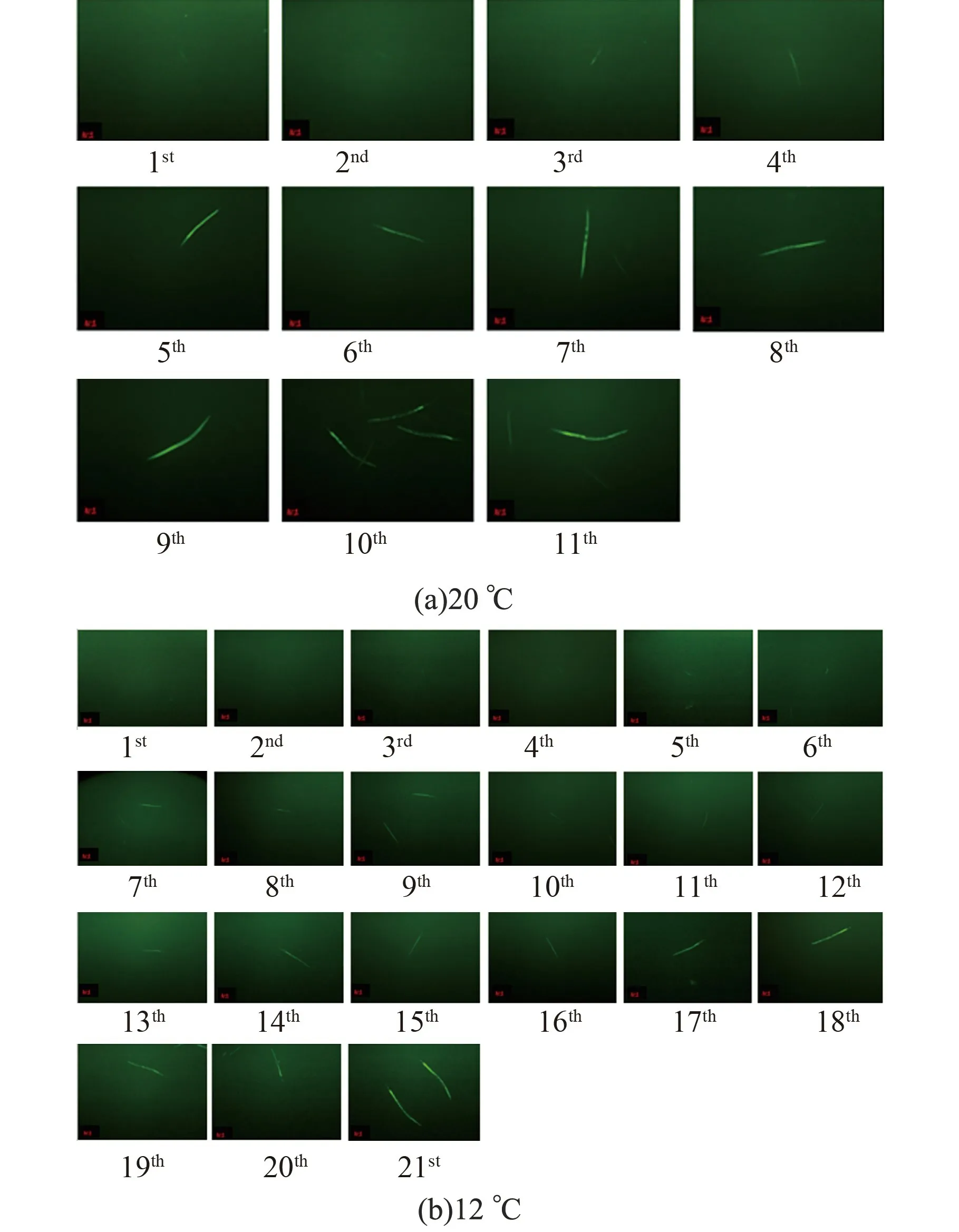
图10 CZ13799 在20 ℃和12 ℃发育过程荧光成像(4×)Fig.10 Fluorescence imaging of CZ13799 during development under 20 ℃and 12 ℃(4×)
为了进一步验证低倍显微放大能否分析出线虫发育过程中的荧光强度的变化,对荧光线虫累积光密度进行测量,物镜放大倍数选择为4 倍。 初步能够得到AM141 与CZ13799 两种荧光线虫在两种温度下发育过程中的荧光强度累积光密度(IOD)变化,绘制散点图并添加趋势线,如图11、12 所示(线虫每天统计条数为3)。

图11 两种温度下AM141 发育过程中的荧光强度变化Fig.11 Changes in fluorescence intensity of AM141 during development under two temperatures
由以上两种线虫发育过程中全身荧光强度的散点图可以看出,在20 ℃和12 ℃两种温度条件下,两种线虫的荧光强度都随着时间的增长而增强,说明4 倍成像可以对两种荧光线虫发育过程中的全身荧光变化进行监测。
对于AM141 来说,12 ℃低温对发育到成虫的线虫荧光表达没有明显的影响(成虫平均荧光强度均在3×106量级);而对于CZ13799 线虫,12 ℃低温对成虫的荧光表达产生了影响(由20 ℃的3.5×106降低到12 ℃的2×106),说明CZ13799 线虫的神经发育状态可能会被低温所抑制。
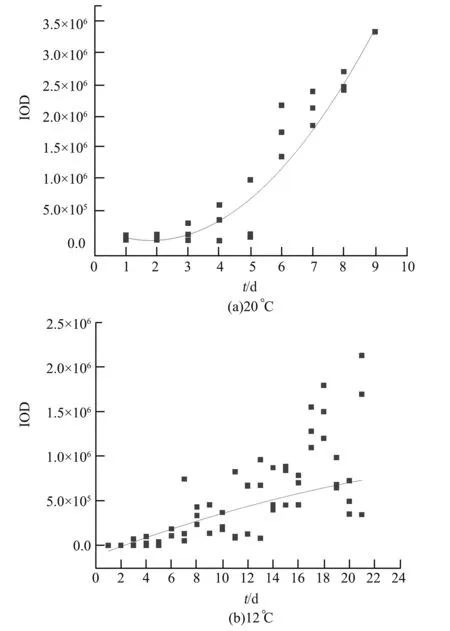
图12 两种温度下CZ13799 发育过程中的荧光强度变化Fig.12 Changes in fluorescence intensity of CZ13799 during development under two temperatures
4 结论
本研究基于中国空间站微流控芯片培养并监测线虫的需求,建立了筛选空间环境敏感荧光标记线虫和荧光成像分析的方法,并研究不同线虫品系在发育过程中的生理指标差异,为在轨液体培养和荧光观测提出关键参数:
1)本文研究筛选具有微重力感受或辐射感受关键基因荧光标记位点的荧光线虫,线虫需全身或局部大范围组织能产生荧光,并能通过CeMM 进行长期(≥4 个月)的驯化,筛选出两种荧光标记线虫AM141 和CZ13799。
2)不同荧光标记线虫的体长、体宽与野生型相比变化范围在10%左右,在微流控芯片通道设计需要考虑该变化;不同的荧光线虫发育时期的产卵、寿命与野生型相比均有区别,因此在轨的换液频率与观测时间与野生型相比需要不同的观测流程。
3)AM141、CZ13799 两种线虫荧光参考观测的激发波长为488 nm、曝光时间为600 ms,4 倍低倍物镜可以监测荧光线虫发育过程中的全身荧光强度变化。
4)12 ℃温度环境可以延长野生型线虫及荧光线虫的发育周期,延缓产卵起始时间和寿命,可以作为空间在轨实验前如发射场等待、上行、在轨对接等过程的保持温度。

