圣草酚对DSS诱导的大鼠溃疡性结肠炎的改善作用及机制探讨①
杨舒钧 梁红亮 滕 俊 魏 娜 谢 锐(三六三医院消化内科,成都 610041)
溃疡性结肠炎(ulcerative colitis,UC)是以肠道炎症性细胞浸润、肠黏膜受损为主要表现的病变,疾病发展后期会波及大段肠腔,引发中毒性结肠炎、肠外并发症,甚至结肠癌,严重威胁人们的生命[1-2]。目前,对于UC的治疗药物主要以糖皮质激素、生物制剂及免疫抑制剂为主,具有一定的疗效,但其毒副作用不容忽视。研究显示天然有效成分对治疗UC效果明显、副作用小,如芍药苷、原花青素、白藜芦醇等。因此,寻找安全有效的天然药物对治疗UC具有重要意义。
圣草酚又名北美圣草素(eriodictyol),是一种天然的类黄酮化合物,广泛存在于药用植物、水果蔬菜中,具有良好的抗氧化、抗炎、抗肿瘤活性[3-4]。BAI等[5]的报道指出,圣草酚可抑制高糖诱导的细胞外基质积累、氧化应激和人类肾小球系膜细胞的炎症。王茹等[6]研究显示,圣草酚对小鼠结肠炎可以起到缓解作用,可能与激活Nrf2/HO-1通路发挥抗氧化、抗炎作用有关。但圣草酚对UC的具体作用机制仍不清楚,因此,本研究拟建立葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的大鼠UC模型,探讨圣草酚对DSS诱导的大鼠UC损伤的作用及机制。
1 材料与方法
1.1.1 实验动物50只雄性SPF级Wistar大鼠,体质量180~220 g,由北京维通利华实验动物有限公司提供,实验动物生产许可证号:SCXK(京)2016-0011。动物实验遵循我国《实验动物福利伦理审查指南(GB/T 35892-2018)》原则与要求。
1.1.2 药物与试剂DSS购自上海阿拉丁生化科技股份有限公司;诱导型一氧化氮合酶试剂盒(iNOS)、TNF-α试剂盒、IL-1β试剂盒、IL-10试剂盒购自上海纪宁实业有限公司;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒购自南京建成生物工程研究所;乳酸脱氢酶(LDH)试剂盒、谷胱甘肽(GSH)试剂盒购自上海酶联生物科技有限公司;苏木素-伊红染色(HE)试剂购自北京雷根生物技术有限公司;TUNEL凋亡试剂盒购自美国R&D Systems公司;Bax、Bcl-2、p65等相关抗体购自上海艾博抗有限公司。
1.1.3 主要仪器DNM-9602酶标分析仪,DG3090自动洗板机购自上海精密仪器仪表有限公司;TGL16M高速冷冻离心机购自湖南凯达科学仪器有限公司;BD-SW3002生物显微镜购自深圳博视达光学仪器有限公司;Biosafer-20TA纯水仪购自南京赛飞生物科技有限公司。
1.2 方法
1.2.1 动物分组与造模 将50只雄性Wistar大鼠适应性饲养1周后,随机分为5组:健康对照组、模型组(DSS)及3个不同浓度剂量组(DSS+圣草酚10、20、40 mg/kg)。除健康对照组饮用纯净水外,其余各组大鼠饮用4%DSS溶液7 d,继续饮用纯净水3 d后,3个剂量组给予相应浓度药物,而健康对照组与模型组给予相同剂量的羧甲基纤维素钠(CMC-Na),1次/d,连续灌胃10 d。末次给药后,采用10%水合氯醛进行麻醉,用采血针腹主动脉取血,离心后取上清液待测;取各组大鼠肛门2 cm以上的全部结肠,将结肠肠管纵行剖开,取部分结肠组织用4%多聚甲醛溶液固定,石蜡包埋,剩余结肠用生理盐水处理,制备10%的结肠匀浆,置于-80℃冰箱保存,待测。
1.2.2 疾病活动指数评分(DAI)在实验期间,每日称大鼠体质量、观察大鼠粪便性状、检测大鼠粪便隐血情况,并记录结果,参照文献[7]根据表1评分标准进行疾病指数统计,计算公式:DAI=(体质量下降指数+粪便性状+粪便隐血)/3。

表1 疾病活动指数评分标准Tab.1 Disease activity index scoring criteria
1.2.3 评估结肠黏膜损伤指数(CMDI)剖取大鼠肛门至盲肠末端的结肠段,清理肠系膜及粘连组织,沿肠系膜纵轴剪开,冰生理盐水反复冲洗干净,平铺于滤纸上,参照文献[8]按表2进行结肠黏膜损伤程度评分。
妇产科急腹症常见于宫外孕、黄体破裂以及卵巢囊肿蒂扭转等。具体的诊断要结合其病史以及尿妊娠试验进行鉴别。

表2 结肠膜损伤评分标准Tab.2 Colonic membrane injury score criteria
1.2.4 HE染色观察病理形态 取蜡块包埋的结肠组织,组织切片机切片。经水浴展平、置载玻片烘干、二甲苯脱蜡后,进行HE染色,封片后在显微镜下观察。
1.2.5 结肠组织病理学评分(HS)石蜡切片常规HE染色后光学显微镜下观察评分。参照文献[9]按照表3进行结肠组织病理学评分。
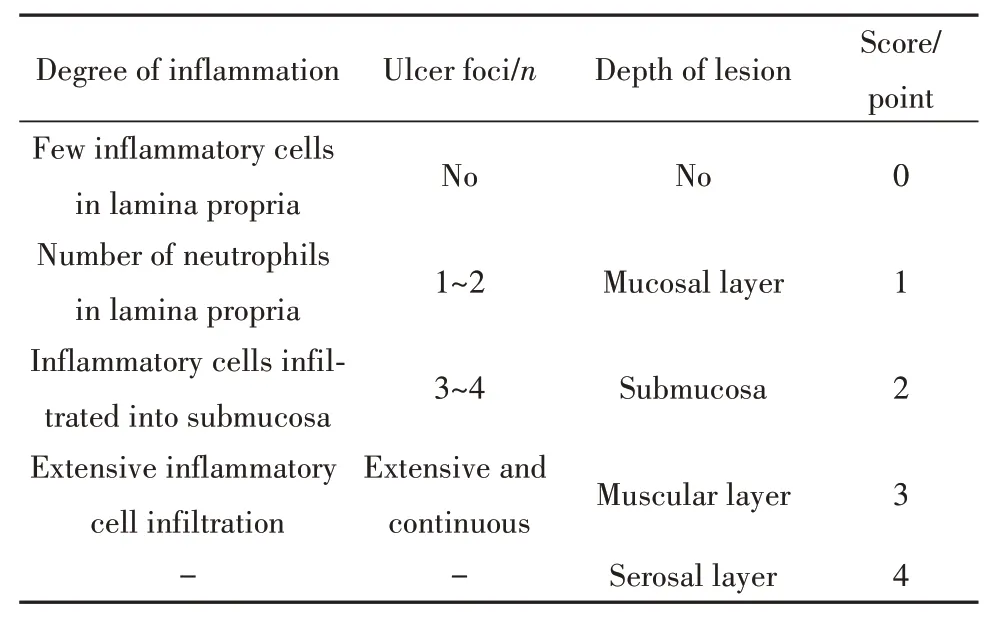
表3 结肠组织病理学评分标准Tab.3 Colon histopathology score criteria
1.2.6 ELISA检测炎症因子的含量 取1.2.1制备的血清,分别按照iNOS、TNF-α、IL-1β、IL-10试剂盒说明书操作,用酶标仪进行检测。
1.2.7 Western blot检测炎症因子相关蛋白的表达 取1.2.1制备的结肠匀浆液,加入RIPA裂解液,冰浴30 min后,离心取上清,用BCA试剂盒测定蛋白浓度,加入上样缓冲液,煮沸使蛋白变性,获得上样样本。采用SDS-PAGE分离蛋白并转膜,进行脱脂奶粉封闭后,分别加入iNOS、IL-10相关一抗,在4℃下孵育过夜,TBST冲洗,加入二抗孵育1 h,TBST冲洗3次,ECL显影后分析灰度值,实验重复3次。
1.2.8 TUNEL观察结肠组织凋亡情况 根据TUNEL试剂盒说明进行相应操作,在光学显微镜下观察结肠组织凋亡细胞并拍摄。
1.2.9 Western blot检测凋亡相关蛋白的表达 采用Bax、Bcl-2、Caspase 3等相关一抗,根据1.2.7的操作进行。
1.2.10 试剂盒检测氧化应激标志物水平 采用SOD、MDA、LDH、GSH试剂盒,按照相关说明书进行操作。
1.2.11 Western blot检测结肠组织中AKT/NF-κB通路的相关蛋白表达 采用AKT、P65等相关一抗,根据1.2.7进行操作。
1.3 统计学方法 采用SPSS21.0软件进行数据分析,多组数据用单因素方差分析(One-Way ANOVA),计量资料用±s表示,P<0.05为差异具有统计学意义。
2 结果
2.1 圣草酚对DSS诱导的大鼠结肠炎损伤程度的影响 健康对照组大鼠无体质量降低、粪便松软、便血等症状,毛发光亮,状态良好;结肠黏膜无粘连、溃疡等症状;大鼠黏膜上皮完整,表面光滑,细胞形态正常,排列整齐,黏膜下层、肌层、浆膜层结构清晰,未见炎症细胞浸润。模型组大鼠精神萎靡、活动量和进食量减少,体质量增长缓慢甚至减轻,大便松散,逐渐出现腹泻、便血的症状;大鼠结肠与周围组织有不同程度粘连,肠腔扩张,纵行剖开多见溃疡;大鼠黏膜上皮坏死脱落,大面积溃疡形成,腺上皮细胞增生,黏膜层、黏膜下层充血水肿,大量的炎症细胞浸润。
除DSS+圣草酚10 mg/kg组状态与模型组相似外,DSS+圣草酚20、40 mg/kg组大鼠结肠无粘连及肠腔扩张,纵行剖开后少见溃疡,局部充血,黏膜下层轻度充血水肿,见少量炎症细胞浸润,未见明显溃疡(图1A),状态均优于模型组,有不同程度的改善。统计DAI、结肠黏膜CMDI、结肠组织HS。结果显示,与健康对照组相比,模型组DAI、CMDI、HS评分明显升高;与模型组相比,除DSS+圣草酚10 mg/kg组无显著性差异,DSS+圣草酚20、40 mg/kg组DAI、CMDI、HS评分均明显降低,且具有一定的剂量依赖性(图1B~D)。

图1 圣草酚对DSS诱导的大鼠UC损伤程度的影响Fig.1 Effect of eriodictyol on damage degree of DSSinduced UC rats
2.2 圣草酚对DSS诱导的大鼠UC炎症因子水平的影响ELISA检测结果显示:与健康对照组相比,模型组促炎因子iNOS、TNF-α、IL-1β含量明显升高,抗炎因子IL-10含量明显降低;与模型组相比,除DSS+圣草酚10 mg/kg组差异无统计学意义,DSS+圣草酚20、40 mg/kg组iNOS、TNF-α、IL-1β含量均明显降低,IL-10含量明显升高,且具有一定的剂量依赖性(图2)。

图2 圣草酚对DSS诱导的大鼠UC炎症因子水平的影响Fig.2 Effect of eriodictyol on levels of inflammatory factors in DSS-induced UC rats
2.3 圣草酚对DSS诱导的大鼠UC凋亡水平的影响TUNEL检测结果显示:细胞核中有棕黄色着染者为凋亡细胞,被染上棕色的细胞呈典型的凋亡细胞形态学改变,肝细胞变小、变圆、核固缩;而正常细胞的胞核不着染。健康对照组大鼠结肠组织中凋亡细胞数目极少,细胞排列整齐;模型组大鼠凋亡细胞明显增加,而模型组阳性细胞在肝小叶内多为散在分布,也有成簇分布,凋亡细胞呈圆形或椭圆形,呈现棕褐色阳性染色。与模型组相比,各给药组大鼠的凋亡状态有不同程度的减轻。数据统计显示,与健康对照组相比,模型组的凋亡率明显升高;与模型组相比,除DSS+圣草酚10 mg/kg组差异无统计学意义,DSS+圣草酚20、40 mg/kg组的凋亡率明显降低(图3A)。
Western blot检测结果显示:与健康对照组相比,模型组Bax/Bcl-2、cleaved cas3/cas3的表达量明显升高;与模型组相比,除DSS+圣草酚10 mg/kg组差异无统计学意义,DSS+圣草酚20、40 mg/kg组Bax/Bcl-2、cleaved cas3/cas3的表达量明显降低,且具有一定的剂量依赖性(图3B)。TUNEL与Western blot的检测结果相符。

图3 圣草酚对DSS诱导的大鼠UC凋亡水平的影响Fig.3 Effect of eriodictyol on apoptosis level of DSSinduced UC rats
2.4 圣草酚对DSS诱导的大鼠UC氧化应激标志物水平的影响 与健康对照组相比,模型组MDA、GSH、LDH含量明显升高,抗氧化酶SOD活性明显降低;但与模型组相比,除DSS+圣草酚10 mg/kg组差异无统计学意义,DSS+圣草酚20、40 mg/kg组MDA、GSH、LDH含量明显降低,SOD活性明显升高,且具有一定的剂量依赖性(图4)。
2.5 圣草酚对DSS诱导的大鼠UC AKT/NF-κB磷酸化的影响 与健康对照组相比,模型组p-AKT/AKT、p-P65/P65的蛋白表达量明显上调;与模型组相比,除DSS+圣草酚10 mg/kg组差异无统计学意义,DSS+圣草酚20、40 mg/kg组p-AKT/AKT、p-P65/P65的蛋白表达量明显下调,且具有一定的剂量依赖性(图5)。
3 讨论
UC临床表现为持续腹痛、腹泻、黏液脓血便,病情反复,患者备受折磨。目前的治疗药物在临床使用上有一定的局限性。中药具有多层次、多角度、多靶点等优势,因此,从传统中药或天然成分出发,寻找安全有效的方法具有重要意义。此前有研究证明,圣草酚具有良好的抗炎活性,对关节炎、免疫性脑脊髓炎等疾病具有良好的改善作用,但未见圣草酚对UC的影响[10-11]。因此,本研究探讨圣草酚对DSS诱导的大鼠UC的作用及机制。
目前,评估DAI、CMDI等反映UC的严重程度。此外,细胞因子的产生及表达与UC密切相关,是炎症反应的重要指标,包括IL、IFN、TNF-α家族等。其中,抑制TNF-α通常作为临床上治疗炎症性肠病的标准,IL-1β、IL-6、IL-8等促炎因子异常产生,会导致肠道上皮细胞大量死亡[12]。ZHANG等[13]的报道指出,HLJ2作为UC的潜在治疗药物,有效降低大鼠体质量减轻、结肠挛缩、DAI、CMDI、HI,降低炎症细胞因子TNF-α、IL-1和IL-6的产生;ZHU等[14]的研究显示,小檗碱通过抑制IL-1、IL-1β、IL-6、TNF-α的表达,上调IL-4和IL-10的表达,发挥抗炎效应,缓解UC的炎症程度。本研究显示,用DSS诱导的大鼠UC模型出现体质量减轻、腹泻、血便等现象,观察显示结肠粘连,大面积溃疡,炎症细胞浸润,与人体UC组织病理学变化相一致,而给予圣草酚的各组病理状况得到改善,DAI、CMDI、HS评分也明显降低。此外,圣草酚抑制促炎因子合成,促进抗炎因子释放,与上述研究一致。提示圣草酚能够缓解DSS诱导的大鼠UC组织损伤程度,改善炎症水平及免疫紊乱。
研究表明,在UC发病过程中,肠道细胞凋亡速率增加,分化中的结肠细胞大量死亡,未成熟隐窝细胞的过度增殖,严重破坏肠道屏障,致使炎症、溃疡、肠道功能紊乱的发生。其中Bax基因促进细胞凋亡,而Bcl-2基因抑制细胞凋亡,两者通常以二聚体的形式发挥作用,Bax/Bcl-2决定细胞凋亡的发展进程[15]。此外,Caspase蛋白家族在细胞凋亡过程中也发挥着重要作用,其激活与过表达可能直接导致细胞凋亡,其中Caspase3处于凋亡有序级联反应的下游,是细胞凋亡的执行者,当细胞接受凋亡刺激时,被系列反应激活,进而诱导细胞发生凋亡[16]。本研究采用TUNEL与Western blot两种方法检测凋亡情况,结果显示圣草酚通过减少细胞凋亡率,降低Bax/Bcl-2、cleaved cas3/cas3表达,改善DSS诱导的大鼠UC程度。
氧化应激是UC的发病机制之一[17]。其中,丙二醛(MDA)是自由基发生过氧化反应的产物[18],可通过检测MDA来判断结肠黏膜氧自由基的水平及脂质过氧化反应的强度、组织损伤程度;乳酸脱氢酶(LDH)是生物体内糖酵解途径中至关重要的氧化还原酶,当细胞损伤时,LDH上升,细胞膜通透性增高,故LDH水平可作为肠上皮细胞的损伤监测指标;超氧化物歧化酶(SOD)是重要的抗氧化金属酶,当SOD含量降低时,氧自由基清楚能力降低可组织细胞损伤。此外,NF-κB是调节免疫的关键。WANG等[19]的报道指出,圣草酚通过抑制小鼠炎症性COX-2/NLRP3/NF-κB途径改善脂多糖诱导的急性肺损伤;AMIRSHAHROKHI等[20]研究显示,非布索坦可通过抑制小鼠中的NF-κB、促炎症细胞因子和氧化应激来缓解UC。本研究显示圣草酚能够减少MDA、GSH、LDH水平,提高SOD活性,下调p-AKT/AKT、p-P65/P65的蛋白表达。提示,圣草酚能够提高大鼠抗氧化能力,改善组织过氧化程度,降低DSS诱导的大鼠UC氧化应激反应,通过下调AKT/NF-κB通路相关蛋白磷酸化表达,缓解DSS诱导的大鼠UC程度。
综上所述,圣草酚能够有效缓解DSS诱导的大鼠UC损伤程度,其机制可能与下调AKT/NF-κB通路相关蛋白的磷酸化表达,改善炎症水平,减少细胞凋亡,提高大鼠抗氧化能力,缓解氧化应激反应等有关。

