新疆阿魏雄性不育的细胞形态学研究
何 爽, 谭敦炎
( 1. 新疆大学 生命科学与技术学院, 乌鲁木齐 830046; 2. 新疆农业大学 草业学院, 乌鲁木齐 830052; 3. 新疆草地资源与生态重点实验室, 乌鲁木齐 830052; 4. 西部干旱荒漠区草地资源与生态教育部重点实验室, 乌鲁木齐 830052 )
植物雄性不育(male sterility,MS)是指被子植物有性繁殖过程中两性花因花粉败育、无法产生花粉而丧失雄性功能的遗传现象。在显花植物中雄性不育广泛存在,现已在43科162属320种、617品种/杂种中被发现(Kaul, 1988; 郝岗平等,2003),常由遗传物质变异、营养缺乏、环境刺激等内/外部因素引起(李泽福等,2000)。能够引发植物雄性不育的因素多种多样,因而对于雄性不育的分类也就有多种方式。目前,研究成果较丰富、实际应用价值较高的植物雄性不育分类系统是按照导致雄性不育的基因型组成来进行划分,将植物雄性不育分为细胞质雄性不育(cytoplasmic male sterility,CMS)和细胞核雄性不育(nucleus male sterility,NMS)两种类型。其中,细胞质雄性不育也称为核质互作雄性不育,是由来源于细胞核与细胞质的两套基因相互作用而产生植物的不育性;与之相对的是细胞核雄性不育,它由细胞核的不育基因所控制。细胞质雄性不育属于母性遗传,因其易于保存而在杂种优势利用的实践活动中广泛应用,在作物的育种和选种工作中取得了理想的生产效益(黄晋玲和杨素英,1998;范彦君等,2017;石凤岩等,2018;王文然等,2019),具有广阔的理论研究意义和应用推广价值。
新疆阿魏(Ferulasinkiangensis)是伞形科(Umbelliferae)阿魏属(FerulaL.)一种多年生一次结实的草本植物,是我国新疆的特有种,仅分布于新疆伊宁县拜什墩农场附近海拔750~1 200 m的蒿属荒漠上(中国科学院《中国植物志》编委会,1992)。作为药用阿魏植物之一,新疆阿魏植株分泌的具有特殊葱蒜样臭味的油胶树脂是药材市场上必不可少的中药“阿魏”,具有截疟、消积、解毒等功效,可用于治疗胃病、风湿病、消化不良等,具有重要的药用价值。同时,它还是新疆西部早春草场上的牧草之一,具有一定的饲用价值(沈观冕,1986;何爽和谭敦炎,2002)。正是由于新疆阿魏重要的药用价值和经济价值,多年来人们大肆采挖和过度放牧,导致其资源储量急剧减少,被列为国家Ⅱ级重点保护野生植物(国家林业和草原局 农业农村部,2021)。因此,大力开展新疆阿魏的资源现状调查、加强种质资源保护及人工繁育已经迫在眉睫。
课题组在新疆伊宁县拜什墩农场及其周边的山前荒漠上对新疆阿魏花期居群进行观察时发现,居群中除了伞形科植物中典型的雄全同株个体(植株上同时具有雄花和两性花的两性个体)以外,不同居群中都具有少量雄性不育的雌株(由雄蕊败育、雌蕊发育正常的功能性雌花构成的单性个体),约占开花植株总量的2.0%(n=600,1997年)、4.2%(n=947,2019年)。这些雄性不育的单性植株促进了居群的杂种优势作用,提高了雌性适合度和居群生产效率,是新疆阿魏种质资源培育的理想材料,在改善其濒危现状方面具有重要作用。因此,为了探究新疆阿魏的雄性不育现象及雄蕊败育的关键制约因子,本文从细胞形态学角度对新疆阿魏雄性不育植株上功能性雌花的形态特征及其不育雄蕊的花药发育过程进行了比较性研究,分析了雄蕊发育异常的部位和发生败育的时期,探讨了功能性雌花小孢子败育的主要影响因素,以期为后续深入开展新疆阿魏雄性不育的遗传学和分子机制研究、性系统变异演化机制研究奠定基础,为新疆阿魏资源保护、人工繁殖驯化和优良种质资源培育等生产实践提供借鉴。
1 材料与方法
1.1 雌株、功能性雌花的形态特征
随机标记雌株、雄全同株个体各10~20株。记录植株大小、基生叶大小等特征,包括株高、直径、一级分支数目、叶长、叶宽等;记录植株上的花序结构特征,包括花序大小、花朵组成及其数目,以及功能性别分化特征。盛花期时,在雌株和雄全同株个体上随机采集功能性雌花和两性花各30朵(1~2朵花/每株),观察记录花的形态特征,包括花萼、花瓣、雄蕊和雌蕊等的颜色、形态和大小,比较不同性别功能花的结构差异,制作图版。同时,采集盛开的雌花序,保存在FAA固定液中,对雌花进行生物学绘图。
1.2 花药败育过程的细胞学观察
采集雌株上不同发育时期的花序,保存在FAA固定液中。采用常规石蜡切片技术、爱氏苏木精染色,制备雌花发育过程的石蜡切片。切片厚度5~10 um,加拿大树胶封片。Olympus BH-2型光学显微镜下观察花期不同时段花药的发育情况,与两性花雄蕊的发育过程(何爽和谭敦炎,2011)相比较,分析功能性雌花的花药败育过程。
2 结果与分析
2.1 雌株、功能性雌花的形态特征
休眠芽于每年3月底开始萌动,长出新叶;进入繁殖生长的植株于4月初在基生叶的中央长出繁殖枝;4月中旬进入花期,5月底果实成熟。雌株的物候期与雄全同株个体相同。
盛花期时,雌株基生叶的叶长(33.41±11.63) cm、叶宽(24.47±8.60) cm,与雄全同株个体[叶长(34.13±8.84) cm、叶宽(24.76±8.42) cm]在基生叶大小方面无显著差异(P>0.05)。雌株的平均高度(71.00±10.92) cm、直径(71.67±17.64) cm、一级分支数目(23.83±2.04),与雄全同株个体[平均高度(78.03±10.54) cm 、直径(71.69±17.97) cm、一级分支(25.56±4.38)]在植株大小方面也无差异(图1)(P>0.05)。
在雄全同株个体上,每个一级分支的顶端具有1个两性花序,其下方分布有3~6个雄花序(图1:A);果期时,仅一级分支顶端的两性花序可以形成果实。在雌株上,一级分支顶端及其下方的所有花序均由功能性雌花构成,各级分支上的花均可结实(图1:B)。

A. 雄全同株个体,红色箭头示两性花序,玫红色箭头示雄花序; B. 雌株。A. Andromonocious plant, red arrow indicates hermaphrodite umbel, and rose red arrow indicates male umbel; B. Female plant.图 1 新疆阿魏不同性别的植株Fig. 1 Plants of different sexes in Ferula sinkiangensis
雌花序的伞幅数/每复伞花序(13.22±4.70),每花序有(12.03±2.30)朵花,均高于两性花序[伞幅数/每复伞花序(10.79±3.60)、花数/每花序(11.15±2.11)]和雄花序[伞幅数/每复伞花序(11.05±2.03)、花数/每花序(11.13±2.61)](P<0.05)(图2)。因而,每个雌花序共有159.08朵花,大于两性花序(120.29)和雄花序(122.99)。
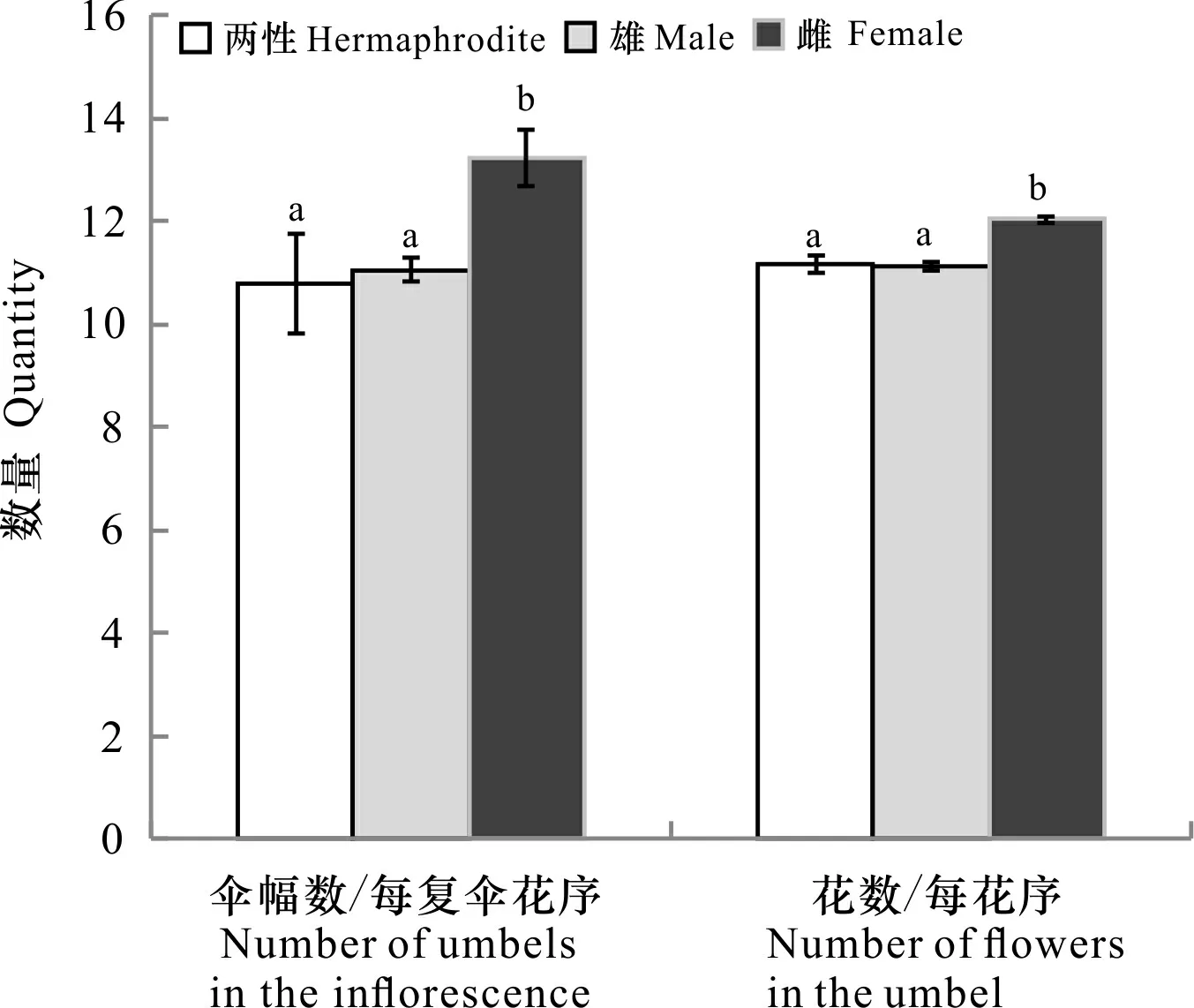
相同字母表示无显著差异(P>0.05); 不同字母表示差异显著(P<0.05)。The same letters indicate no significant differences (P>0.05); Different letters indicate significant differences (P<0.05).图 2 新疆阿魏不同性别花序统计Fig. 2 Statistics of different sexes of umbels in Ferula sinkiangensis
在雌花序中,花排列紧密,花间距小于两性花序和雄花序(图3)。开花时,功能性雌花的花瓣微微张开,雌蕊高举出花瓣,不育雄蕊从花瓣间隙中伸出;完全开放的两性花和雄花花瓣向下反折、雌/雄蕊完全暴露出来,在形态上与雌花明显不同(图3)。

1. 两性花; 2. 雄花。3, 4. 功能性雌花 3. 示雌花侧视; 4. 示雌花俯视。 a. 花药; b. 花丝; c. 雌蕊; d. 花瓣。1. Flowers of hermaphrodite; 2. Male flowers. 3, 4. Functional female flowers 3. Side view of the flowers; 4. Vertical view of the flowers. a. Anther; b. Filament; c. Pistil; d. Petal.图 3 新疆阿魏不同性别的花Fig. 3 Flowers of different sexes in Ferula sinkiangensis
在花萼和花瓣的形态上,功能性雌花、两性花和雄花之间无差异。其花萼很小、淡绿色、卵形,花瓣均为黄色、椭圆形、外面被毛,顶端向内弯曲,中脉处向内微凹。但在花瓣大小方面,不同性别花之间差异较大,其中,雌花花瓣最小[长(1.79±0.39) mm、宽(1.10±0.21) mm],两性花最大[长(2.49±0.32) mm、宽(1.63±0.23) mm],雄花较大[长(2.08±0.32) mm、宽(1.31±0.18) mm](P<0.01)。雌花的雌蕊形态及其大小均与两性花相同,均为花柱2,分离,基部扁平圆锥状,边缘增宽、波状,柱头增粗呈头状,子房下位(图4)。雌花所产果实的形态和大小均与两性花相同,结实很高(图1: B),其雌蕊可育。两性花和雄花的雄蕊均由蝶形的花药、棒状的花丝构成,雄蕊长度分别为(4.61±0.61) mm、(4.01±0.52) mm(P>0.05);花开放后花丝伸展,雄蕊直立,花药开裂、散粉(图3)。功能性雌花的5枚雄蕊形态相同,均为匙形,短棒状花丝上部稍膨大的部分为退化的花药(图3,图4)。雌花的雄蕊长度(0.6~1.3 mm)远小于两性花和雄花,其花药形态异常,不开裂,无花粉,为雄性功能丧失的退化雄蕊。
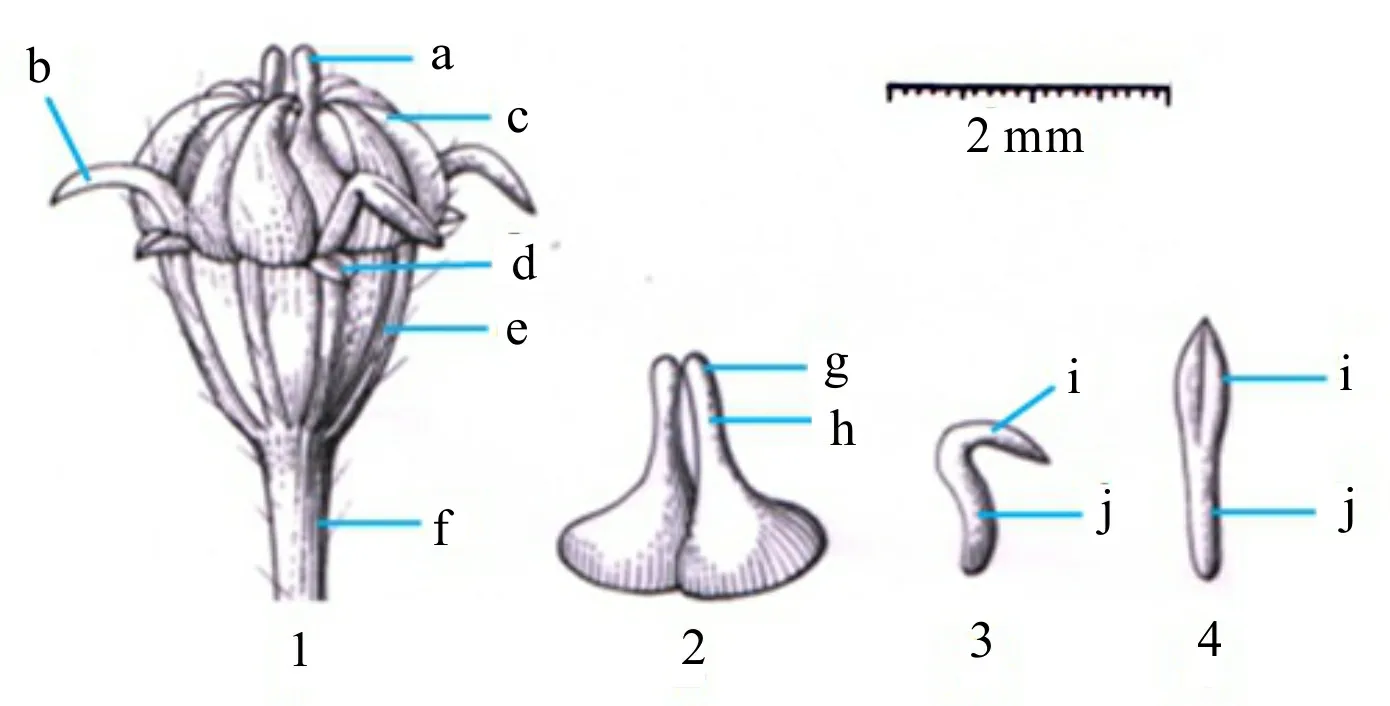
1. 功能性雌花; 2. 雌蕊。3,4. 退化雄蕊 3. 退化雄蕊的侧面观; 4. 退化雄蕊的正面观。a. 可育雌蕊; b. 退化雄蕊; c. 花瓣; d. 花萼; e. 子房; f. 花梗; g. 柱头; h. 花柱; i. 形态异常的花药; j. 极短的花丝。(谭黎霞绘图)1. Functional female flower; 2. Pistil. 3,4. Degenerated stamen 3. Side view of degenerated stamen; 4. Front view of degenerated stamen. a. Normally developed pistil; b. Degenerated stamen; c. Petal; d. Calyx; e. Ovary; f. Pedicel; g. Stigma; h. Style; i. Abnormal anthers; j. Short filaments. (Drawn by TAN Lixia)图 4 新疆阿魏功能性雌花的形态结构Fig. 4 Morphological structures of functional female flower in Ferula sinkiangensis
2.2 雌花花药败育过程的细胞学观察
两性花可育雄蕊的花药有4个小孢子囊(图版Ⅰ:1)。在每个小孢子囊中,花药壁分化为表皮、药室内壁、中层、绒毡层4层结构,小孢子正常发育(图版Ⅰ:2)。随着中层、绒毡层相继解体,雄配子体进一步发育。散粉前,药室内壁细胞的径向壁木质化,药壁仅存表皮和纤维层两层结构(图版Ⅰ:3)。
功能性雌花的5个雄蕊均发生败育(图版Ⅰ:4)。败育雄蕊的花药有2~4个小孢子囊(图版Ⅰ:5)。在花药的发育过程中,所有小孢子囊均出现异常现象,都不能形成与可育雄蕊相同的花药室,都不能产生发育完全的雄配子体,最终使整个花药空瘪、无花粉(图版Ⅰ:6)。雌花的5枚雄蕊都不能产生花粉,其败育程度一致。
2.2.1 花药室发育异常 在花药发育的早期阶段,雌花败育雄蕊的药壁组织表现出与两性花可育雄蕊相同的发育过程。孢原细胞时期,表皮细胞呈径向延长的矩形,细胞排列紧密,胞质较浓厚,染色较深,细胞核大而明显(图版Ⅰ:7)。在四棱形、幼小花药的角隅处,表皮下分化出一个孢原细胞。孢原细胞经平周分裂,生成外层的初级花药壁细胞和内层的初级造孢细胞。造胞细胞时期,初级药壁细胞经多次平周和垂周分裂后,形成3~4层比表皮细胞小、呈多边形、近等径、胞质染色较浅、核较小的次级药壁细胞(图版Ⅰ:7-8)。其中,靠近表皮的1层次级药壁细胞进一步分化,细胞径向延长,体积增大,形成药室内壁的细胞层(图版Ⅰ:1-2、9)。
药室内壁形成后,雌花败育雄蕊的花药壁发育过程与两性花可育雄蕊明显不同。可育雄蕊的花药在1层药室内壁细胞的内侧,还分化出了中层和绒毡层。随后,在小孢子母细胞时期,中层逐渐解体,形成了由表皮、药室内壁、绒毡层3层细胞共同构成的花药壁(图版Ⅰ:1-2)。随着小孢子产生、雄配子体形成,绒毡层逐渐解体,药室内壁细胞的径向壁纤维化加厚,形成了由表皮和纤维层构成的花药壁结构(图版Ⅰ:3)。但是,在败育雄蕊的花药中,药壁组织的进一步分化出现了异常。败育花药在药壁的整个发育过程之中,始终都没有发生中层和绒毡层的分化(图版Ⅰ:7-9)。到了小孢子母细胞时期,药室内壁之内的其他各层药壁细胞相继解体(图版Ⅰ:10-11)。之后,在小孢子母细胞、小孢子解体时,药室内壁细胞发生了径向壁的纤维化加厚,形成了由表皮和纤维层构成的两层花药壁(图版Ⅰ:12)。
伴随着花药壁的异常发育和生殖细胞的解体,小孢子囊之间的药隔组织出现了降解(图版Ⅰ:13-15)。首先是细胞核降解(图版Ⅰ:13),随后整个原生质体全部解体(图版Ⅰ:14),仅留下了细胞壁,形成大量“巢穴状”的空腔(图版Ⅰ:15)。此后细胞壁也随之解体,其残留物连接在一起,共同构成一个染色较深的区域(图版Ⅰ:4)。最终花药室发生收缩、变形,形成仅由一层表皮构成的异常结构。
2.2.2 小孢子发育异常 在早期四棱形花药原基的角隅处,其表皮下的孢原细胞经有丝分裂形成初级造孢细胞,继而分化为次级造孢细胞(图版Ⅰ:7)。在雌花败育雄蕊和两性花可育雄蕊的发育过程中,均能观察到孢原细胞到次级造胞细胞的正常发育阶段。
次级造孢细胞形成之后,功能性雌花与两性花呈现了不同的发育特征。在两性花的花粉囊中,次级造胞细胞进一步分化为小孢子母细胞。伴随着药壁组织分化出分泌型绒毡层(图版Ⅰ:2),小孢子母细胞减数分裂,形成小孢子四分体。随后,小孢子四分体的胼胝质鞘被酶解,释放出小孢子。随着绒毡层的逐渐解体,小孢子继续发育为二核花粉, 直至散粉前发育为三核花粉。而在雌花的花药上,次级造孢细胞在其进一步发育的过程中出现了异常,表现为以下两种情形:(1)次级造孢细胞解体。雄配子体发育停滞。因而,在小孢子囊中形成了无花粉的空腔(图版Ⅰ:8-9)。(2)次级造孢细胞继续发育至小孢子母细胞阶段,但是,小孢子母细胞未能完成减数分裂而在形成小孢子四分体之前发生了解体(图版Ⅰ:10-12),即小孢子母细胞发生解体,或者形成小孢子二分体后解体。最终,使得次级造孢细胞不能继续发育而生成小孢子。
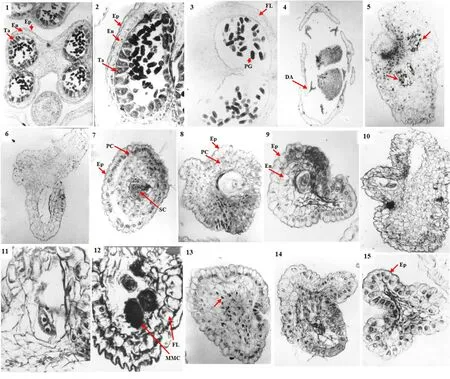
1-3. 可育雄蕊,小孢子囊的完整结构,示绒毡层和药室内壁 1. ×100; 2. ×400; 3. 纤维层 ×200。4-6. 败育雄蕊 4. 功能性雌花,示退化花药 ×40; 5. 两个小孢子囊均败育 ×132; 6. 小孢子囊空腔,无花粉 ×132。7-9. 败育雄蕊,造孢细胞时期 7. 次级药壁细胞和次级造孢细胞 ×200; 8. 次级药壁细胞和解体的次级造孢细胞 ×200; 9. 药室内壁分化,无明显的中层和绒毡层 ×200。10-12. 败育雄蕊,小孢子母细胞时期,药室内壁以内的药壁细胞解体 10. ×200; 11. ×400; 12. 小孢子母细胞解体 ×400。13-15. 败育雄蕊,药隔薄壁组织解体 13. 细胞核解体 ×264; 14. 原生质体解体 ×264; 15. 仅剩细胞壁的“巢穴状”空腔 ×400。 Ta. 绒毡层; En. 药室内壁; Ep. 表皮; SC. 造孢细胞; PC. 药壁细胞; MMC. 小孢子母细胞; FL. 纤维层; PG. 花粉粒; DA. 退化花药。1-3. Fertile stamen, structure of well developed microsporangium, indicating tapetum and endothecium 1. ×100; 2. ×400; 3. Fibrous layer ×200. 4-6. Sterile stamen 4. Functional female flower, indicating degenerated anther with arrow ×40; 5. Abortion in both of the two microsporangia ×132; 6. No pollen grain produced in the microsporangium ×132. 7-9. Sterile stamen, sporogenous cell stage 7. Secondary parietal cells and sporogenous cells ×200; 8. Secondary parietal cells and aborted secondary sporogenous cell ×200; 9. Parietal cells differiation with endothecium but no middle layer and tapetum ×200. 10-12. Sterile stamen, microspore mother cell stage, parietal cells degradation except for endothecium 10. ×200; 11. ×400; 12. Aborted microspore mother cell ×400. 13-15. Sterile stamen, aborted connective tissue 13. Nucleus degradation ×264; 14. Protoplast degradation ×264; 15. Only cell walls left ×400. Ta. Tapetum; En. Endothecium; Ep. Epidermis; SC. Sporogenous cell; PC. Parietal cell; MMC. Microspore mother cell; FL. Fibrous layer; PG. Pollen grain; DA. Degenerated anther.图版 Ⅰ 新疆阿魏功能性雌花退化花药的发育过程Plate Ⅰ Development of degenerated anther on the functional female flower in Ferula sinkiangensis
由此,随着花粉囊中的造孢细胞、药壁细胞相继解体,以及药隔组织的退化解体,花药收缩变形,最终形成空瘪、无花粉的畸形花药。
3 讨论与结论
3.1 新疆阿魏雄性不育与雄全同株的关联
新疆阿魏在与其生境相适应的进化历程中,形成了种群特有的资源利用和能量分配模式,建立了独特的性系统类型。在其种群中,雄性不育植株与雄全同株个体的植株大小和叶片大小相似,能够为植物繁殖提供相近的营养供给。功能性雌花的雌蕊形态及其结实情况与两性花相同,其繁殖力相同。但是,雌花产生的种子均为具有杂种优势的异交后代,对新疆阿魏种群雌性适合度的提高具有较大贡献。为了达到营养和能量的最优配置,减少资源浪费,雄性不育植株降低了对雄性器官的资源分配(Van der Hulst et al., 2004)。新疆阿魏雄性不育植株通过功能性雌花的花药败育减少了对雄蕊的资源投入,而将植株能量用于形成雌蕊,产生更多的雌花,以生产更多的异交后代。这种雌株与雄全同株个体共存的性系统反映了该植物特有的资源配置模式。然而,雄性不育的雌株在雄全同株性系统变异与演化过程中的作用如何,它是否代表了性系统进化的方向,这些问题都有待于进一步研究,并加以验证。
3.2 雄蕊发育异常的部位
Kolreuter在1763年首次观察报道了植物的雄性不育现象(Ernst, 1986)。随后,学者们在对雄性不育材料的细胞学研究中多次报道了药壁发育异常和雄性生殖细胞的发育异常(Overman & Warmke, 1972; 徐树华,1980;Jain et al., 1982; 耿三省等,1994;郭东林等,2005;胡静静等,2010;李彬等,2015;范彦君等,2016;王文然等,2019)。与新疆阿魏雄全同株个体上两性花可育雄蕊的花药发育过程(何爽和谭敦炎,2011)相比较,雄性不育植株上功能性雌花的花药壁组织没有绒毡层和中层的分化,致使其药壁的结构发生异常,以及次级造孢细胞在向小孢子四分体发育的过程中逐渐败育、解体,阻断了小孢子的生成过程,不能产生成熟的花粉。因而,在新疆阿魏雄性不育植株上,雄蕊因其花药在结构上和生理性的改变而丧失了雄性的功能,最终形成了功能性的雌花。这些功能性雌花的花药异常发育的部位与前人对于其他雄性不育植物材料的研究结果基本一致。
3.3 花粉败育的时期及原因
新疆阿魏雄性生殖细胞的败育表现为次级造孢细胞、小孢子母细胞、小孢子二分体等结构的败育解体。因而,其花粉的败育过程是发生在次级造孢细胞至小孢子母细胞阶段,或是小孢子母细胞至四分体阶段。这一结果符合前人对于双子叶植物雄性生殖细胞的败育发生在造孢细胞时期至四分体时期的相关描述(Laser & Lerstern, 1972;Cbauban,1990;谢潮添等,2004;孙帅等,2016)。
在导致雄性不育的影响因素研究中,小孢子败育与绒毡层异常发育之间关系的研究一直备受关注。多数学者认为,由于绒毡层异常,导致了小孢子异常发育或营养不良而败育(Brooks & Chien, 1966; Vasil, 1967; Narkhede, 1968; 潘坤清,1979;高鸿善等,1992;张英涛等,1996;Tsvetova & Elkonin, 2003; Liu et al., 2016)。但也有人认为绒毡层异常正是小孢子败育的结果(孙蒙祥和王灶安,1991)。在新疆阿魏功能性雌花的幼小花药中,孢原细胞分化形成药壁细胞和造孢细胞以后,药壁组织异常发育,没有形成绒毡层。此时,次级造孢细胞发育正常。但在随后的发育过程中,次级造孢细胞或小孢子母细胞发生了败育。鉴于新疆阿魏败育花药的绒毡层异常发育早于次级造孢细胞或小孢子母细胞的败育,因而,其次级造孢细胞及小孢子母细胞的败育均与绒毡层的异常发育有直接关系。造孢细胞至小孢子四分体的发育时期正是细胞生理活动活跃的时期,DNA复制、转录以及蛋白质合成最旺盛,对能量合成和营养物质的需求量最大,极易受遗传因素及各种生理条件变化的影响(王伟等,1998;李泽福等,2000)。绒毡层作为紧邻雄性生殖细胞的花药壁最内一层结构,是雄蕊储存营养的主要部位以及雄性生殖细胞获得营养物质的重要枢纽(胡适宜,1982;Pacini, 1997; 何爽等,2011)。新疆阿魏早期花药发育的次级造孢细胞分化,小孢子母细胞减数分裂,直至小孢子四分体形成过程中所需的大量营养物质和能量,都依赖于在其双核的分泌型绒毡层细胞中合成与贮存,并释放到小孢子囊中,再传递给它们。而绒毡层的缺失,会导致该发育时期的营养和能量供给无法保障。新疆阿魏功能性雌花的不育雄蕊中始终都没有绒毡层的结构,直接导致小孢子囊中营养物质、能量供应和输送受阻,从而引起次级造孢细胞或小孢子母细胞因营养不良、发育停滞而败育解体,并最终造成了小孢子败育的结果。因此,绒毡层的缺失,是导致新疆阿魏花粉败育的最主要影响因素。那么,新疆阿魏绒毡层细胞发育的分子机理如何,其雄性不育的类型及调控的分子机制是怎样的。对于这些问题的回答,将有待于今后进一步开展该植物雄性不育的遗传学和分子机制研究,并以此为新疆阿魏雄性不育系诱导、种质资源保护与拯救等生产实践提供理论指导与借鉴。
综上所述,在新疆阿魏雄性不育植株上,功能性雌花的雄蕊形态变为匙形,花药严重收缩、空瘪。雄蕊的败育主要体现在药壁组织和雄配子体的异常发育。雄性生殖细胞的败育发生在造孢细胞至小孢子四分体时期。药壁细胞的异常发育,尤其是绒毡层的缺失,导致了小孢子因营养缺乏而发生败育。

