CXCL9/10在头颈鳞状细胞癌中的表达及其与临床病理特征、HPV16感染的相关性▲
常晓荆 胡 媛
(1 武汉市第六医院耳鼻咽喉头颈外科,湖北省武汉市 430014; 2 华中科技大学同济医学院附属协和医院耳鼻咽喉头颈外科,湖北省武汉市 430022)
头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)又称为头颈癌,好发于鼻腔、鼻窦、嘴唇、口腔、唾液腺及喉部等部位[1],其预后良好,治愈率高[2]。有研究显示,头颈部肿瘤的发生与遗传、吸烟、病毒感染等多种因素有关,吸烟和饮酒是HNSCC发生的两大危险因素,且人乳头瘤病毒(human papillomavirus,HPV)16感染也与HNSCC的发生密切相关[3]。趋化因子属于小分子细胞因子家族蛋白[4]。其中,C-X-C基序趋化因子配体(C-X-C motif chemokine ligand,CXCL)9/10对T淋巴细胞有趋化作用,可促进T淋巴细胞黏附于内皮细胞,在肿瘤血管形成过程中发挥重要作用[5]。本研究探讨CXCL9/10在HNSCC中的表达情况及其与临床病理特征、HPV16感染的相关性。
1 资料与方法
1.1 临床资料 收集2015年3月至2016年3月武汉市第六医院病理科存档的60例HNSCC组织标本和30例相应癌旁组织标本(其余30例相应癌旁组织标本不可用,故未纳入分析)。纳入标准:(1)HNSCC均经病理检查确诊;(2)HNSCC患者的临床资料完整;(3)HNSCC患者入组前均未接受过放化疗等抗癌治疗。排除标准:(1)合并其他部位恶性肿瘤者;(2)合并脑部疾病者;(3)复发的HNSCC患者。60例HNSCC患者中,男性40例、女性20例,年龄18~<60岁者35例、60~80岁者25例,有淋巴结转移者22例、无淋巴结转移者38例,组织分化程度为:高分化13例、中分化24例、低分化23例;根据2018年美国国立综合癌症网络诊治指南与美国癌症分期联合委员会第8版TNM分期新标准进行临床分期[6],Ⅰ~Ⅱ期共31例,Ⅲ~Ⅳ期共29例。本研究经过武汉市第六医院医学伦理委员会审批同意。
1.2 方法
1.2.1 实时荧光定量PCR检测HNSCC组织和癌旁组织中CXCL9/10 mRNA表达水平:取适量HNSCC组织和癌旁组织,使用TRIzol试剂(上海杰美基因医药科技有限公司,批号:GMS12279)提取总RNA,用反转录试剂盒(上海信裕生物科技有限公司,批号:60906-10)将RNA反转录为cDNA后进行实时荧光定量PCR扩增。CXCL9上游引物序列为5′-AGGGTCGCTGTTCCTGCATC-3′,下游引物序列为5′-TTCACATCTGCTGAATCTGGGTTTA-3′;CXCL10上游引物序列为5′-CTTTCTGACTCTAAGTGGCATTC-3′,下游引物序列为5′-CACCCTTCTTTTTCATTCTAGCAA-3′;GAPDH(内参)上游引物序列为5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物序列为5′-GCCATCACGCCACAGTTTC-3′。PCR反应体系包括cDNA模板2.5 μL、Taq酶0.3 μL、上下游引物各1 μL、SYBR Premix Ex Taq 5 μL、用双蒸水补充至25 μL。PCR反应条件为95 ℃、10 min,95 ℃、15 s,60 ℃,30 s,72 ℃、15 s,共35个反应循环。采用PCR仪(济南欧莱博技术有限公司,型号:LEIA-X4)自动分析得出循环阈值(Ct值),通过2-ΔΔCt法计算HNSCC组织和癌旁组织中CXCL9 mRNA、CXCL10 mRNA相对表达水平。
1.2.2 免疫组化分析及结果判定:取适量HNSCC组织和癌旁组织,经石蜡包埋后用切片机以4 μm的厚度连续切片,随后用二甲苯对石蜡切片进行脱蜡处理10 min,采用枸橼酸缓冲液进行抗原修复,蒸馏水反复冲洗后加入3%过氧化物酶,浸泡30 min,以消除内源性过氧化物酶的活性。然后用PBS冲洗3次,3 min/次;分别加入CXCL9、CXCL10兔抗人单克隆抗体25 μL(英国Abcam公司,批号:ab290643、ab283681;稀释比例均为1 ∶100),室温环境下孵育过夜,PBS冲洗5次,3 min/次;加入30 μL通用型二抗(上海威奥生物科技有限公司,批号:WB6030;稀释比例为1 ∶500),室温环境下孵育30 min,PBS冲洗5次,3 min/次;使用二氨基联苯胺试剂盒(上海吉至生化科技有限公司,批号:DA1010-10 ml)显色,PBS反复冲洗后用苏木素复染3 min,最后脱水处理,二甲苯透明,并用中性树脂封片。在显微镜(上海无陌光学仪器有限公司,型号:WMS-1037)下随机选取5个高倍视野(×100)进行细胞染色强度评分,其中细胞不染色计0分,细胞着浅黄色计1分,细胞着黄褐色计2分,着浅黄色或黄褐色为阳性细胞。并按阳性细胞所占百分比进行评分,阳性细胞百分比为<5%、5%~25%、26%~50%、51%~75%、>75%分别计0、1、2、3、4分。细胞染色强度评分和阳性细胞所占百分比评分的乘积即为总分。总分≥1判定为表达阳性(+),总分<1分判定为表达阴性(-);总分≥2分定义为高表达,总分<2分定义为低表达。
1.2.3 单管实时荧光定量PCR检测HNSCC组织HPV16阳性率:取适量HNSCC组织,提取总RNA与合成cDNA的方法与1.2.1一致。采用HPV16荧光检测试剂盒(无锡市申瑞生物制品有限公司,批号:20140928)进行HPV16检测。PCR反应体系(45 μL)包括cDNA模板2 μL、HPV16反应混合液40 μL、Taq DNA聚合酶3 μL。上游引物序列为5′-CCACCCAGAAAGTTACCACA-3′,下游引物序列为5′-TGCAACAAGACATACATCGA-3′。PCR扩增条件为37 ℃ 5 min; 94 ℃ 1 min,95 ℃ 5 s,60 ℃ 30 s,共44个反应循环。采用PCR仪自动分析得出Ct值,Ct值≤37为阳性,Ct值>37为阴性。
1.3 统计学分析 采用SPSS 25.1软件进行统计学分析。计量资料以(x±s)表示,比较采用t检验;计数资料以例数或百分比表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 HNSCC组织和癌旁组织中CXCL9/10 mRNA表达水平的比较 HNSCC组织中的CXCL9、CXCL10 mRNA表达水平均高于癌旁组织(均P<0.05),见表1。
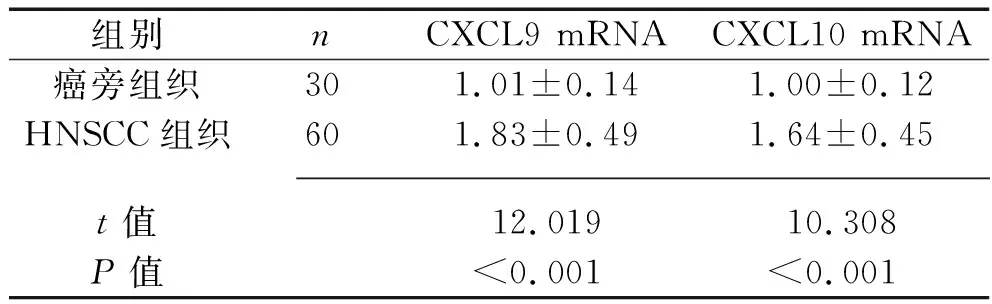
表1 HNSCC组织和癌旁组织中CXCL9/10 mRNA相对表达水平的比较(x±s)
2.2 HNSCC组织和癌旁组织中CXCL9/10的阳性表达情况 免疫组化染色结果显示,CXCL9、CXCL10主要位于细胞质,见图1。CXCL9、CXCL10在HNSCC组织中的阳性表达率均高于癌旁组织(均P<0.05),见图1和表2。
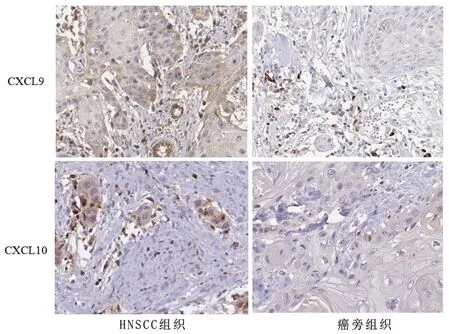
图1 免疫组化染色结果(×100)
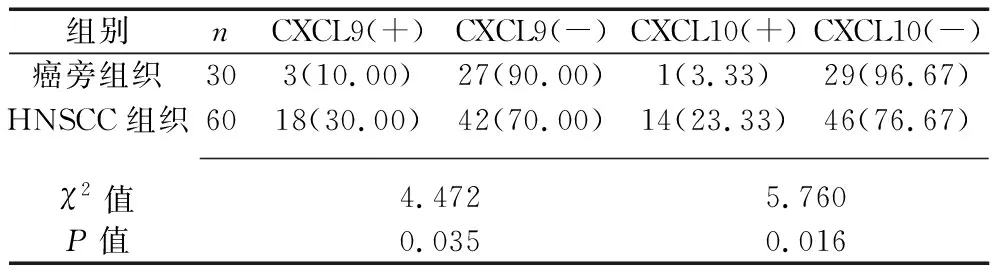
表2 HNSCC组织和癌旁组织中CXCL9/10的阳性表达情况[n(%)]
2.3 CXCL9/10表达水平与HNSCC患者临床病理特征、HPV16感染情况的关系 CXCL9、CXCL10高表达患者中,TNM Ⅲ~Ⅳ期、淋巴结转移及HPV16阳性的患者比例均高于CXCL9、CXCL10低表达患者(均P<0.05)。CXCL9、CXCL10表达水平与HNSCC患者的年龄、性别、分化程度均无关(均P>0.05)。见表3。
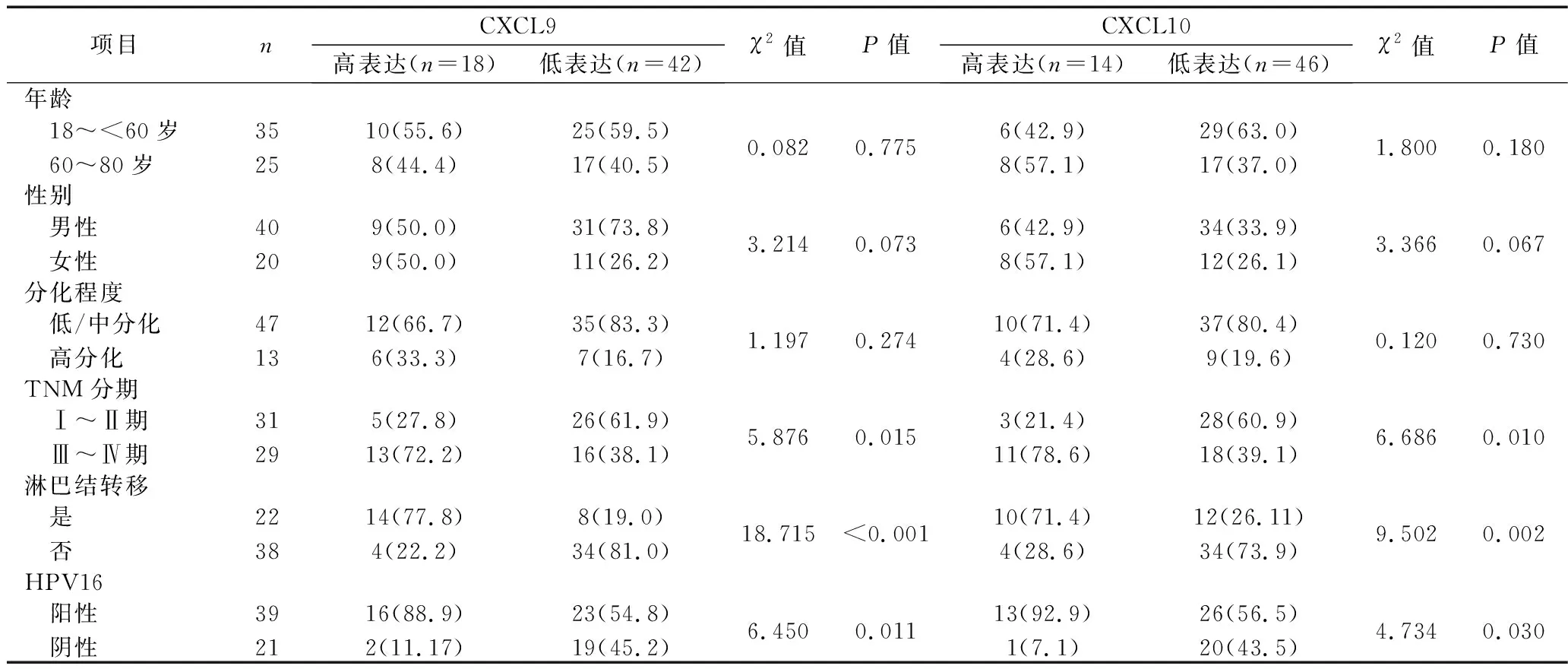
表3 CXCL9/10表达水平与HNSCC患者临床病理特征、HPV16感染情况的关系[n(%)]
3 讨 论
大多数HNSCC起源于头颈部黏膜鳞状上皮细胞,是不同组织学级别的鳞状细胞癌[7]。据统计,2017年全球约有89万例新发HNSCC患者,患者总数较1990年增加了1倍以上,且死亡患者总数约有50.7万例[8]。流行病学调查显示,2010年美国口腔HPV感染率约为6.9%,其中HPV16感染率约为1%[9]。口腔感染HPV与口咽癌病情的加重密切相关[10]。越来越多的证据表明,HPV感染是导致HNSCC发生的重要原因[11]。HPV感染机体后侵入黏膜组织,感染鳞状上皮基底层细胞,进而造成两个关键的细胞周期调节因子(细胞周期素依赖激酶和细胞周期素)失活,导致细胞周期检查点失控、细胞增殖异常及病毒基因组扩增[12]。持续感染HPV的细胞会不受控制地增殖,这容易造成DNA损伤和染色体异常,从而增加致癌风险[13]。
趋化因子是与G蛋白偶联受体的子集相互作用的小蛋白质[14],在诱导T淋巴细胞趋化、促进白细胞分化和增殖、引起组织外渗等方面起着关键作用[15]。CXCL9、CXCL10均属于趋化因子CXC亚族,二者表达不仅与肿瘤微环境中的免疫细胞迁移、分化有一定关系,还参与调节肿瘤细胞生长、凋亡,在肿瘤进展中发挥促癌作用[16-17]。例如,宋雪等[16]报告,肝内胆管癌患者血清CXCL9表达水平较健康人高,CXCL9表达异常升高与TNM分期、淋巴结转移及肿瘤分化程度密切相关,且CXCL9高水平患者的生存率更低;高建等[17]研究发现,乳腺浸润性导管癌组织中CXCL10 mRNA的相对表达水平高于乳腺良性组织,CXCL10参与乳腺浸润性导管癌的进展。还有研究表明,CXCL9/10主要调节免疫细胞迁移、分化和激活,通过募集免疫细胞(如细胞毒性淋巴细胞、自然杀伤细胞和巨噬细胞)诱发免疫反应[18]。
本研究结果显示,HNSCC组织中的CXCL9、CXCL10 mRNA表达水平及阳性表达率均高于癌旁组织(均P<0.05),提示两者可能与HNSCC的发生有关,检测HNSCC患者癌组织中的CXCL9/10表达水平或阳性表达情况有助于诊断HNSCC。本研究结果还显示,CXCL9、CXCL10高表达患者中TNMⅢ~Ⅳ期、淋巴结转移及HPV16阳性的患者比例均高于低表达患者(均P<0.05),说明CXCL9、CXCL10高表达患者的TNM分期晚,可能伴有淋巴结转移且感染HPV16的风险更高,临床可通过检测CXCL9、CXCL10表达水平评估HNSCC患者病情,有利于制订更合适的治疗方案,从而改善HNSCC患者的预后。
综上所述,CXCL9/10在HNSCC组织中呈高表达,且CXCL9/10高表达患者的TNM分期更晚,可能伴有淋巴结转移且感染HPV16的风险更高。这两个指标或可为临床上诊治HNSCC提供了新思路。

