鼠尾草酸基于TLR4/NF-κB/NLRP3通路对脓毒血症所致急性肾损伤大鼠肾脏及血管内皮的保护作用▲
商健茹 黄光庆 赵 旭 柏 勇 刘 杰
(湖北医药学院附属十堰市人民医院急危重症中心重症医学科,湖北省十堰市 442000)
脓毒血症是指一种因感染性因素而导致的全身性炎症反应综合征,其中有42%的脓毒血症患者会出现急性肾损伤(acute kidney injury,AKI)[1]。脓毒血症合并AKI患者的病死率高达70%以上,是单纯AKI或单纯脓毒血症患者的5倍[2]。AKI的主要病理机制是缺血或肾毒性因素而导致肾小管急性坏死[3]。研究表明,血管内皮细胞的损伤可减少血管灌注及肾小管上皮细胞供氧和营养物质的输送,加重肾脏的缺氧缺血,从而导致肾功能损伤[4]。目前,尚缺乏治疗AKI的有效方案。因此,寻找治疗AKI的有效药物具有重要意义。鼠尾草酸是迷迭香的主要活性成分,具有抗氧化、抗炎、神经保护等药理作用[5]。研究表明,鼠尾草酸可抑制核因子κB(nuclear factor kappa-B,NF-κB)信号通路,改善糖尿病导致的肾损伤[6]。但鼠尾草酸对脓毒血症所致AKI的作用,目前尚未见到相关报告。本研究采用盲肠结扎穿刺法构建脓毒血症AKI大鼠模型,并采用鼠尾草酸进行干预,观察鼠尾草酸对脓毒血症所致AKI大鼠模型的肾脏和血管内皮细胞的保护作用,探讨鼠尾草酸对Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB/NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)信号通路的影响,以期为鼠尾草酸的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:50只无特定病原体级SD雄性大鼠由广州市旭生生物科技有限公司提供[SCXK(粤)2019-0045],12周龄,体质量200~220 g,每笼5只,饲养于(22±2)℃恒温、50%~60%湿度且无特殊病原体的环境中,水和食用饲料均经灭菌后由大鼠自由摄入。所有动物实验均通过本院医学伦理委员会批准。
1.1.2 主要试剂和仪器:鼠尾草酸(≥97%)购自上海阿拉丁生化科技股份有限公司(批号:C117958);戊巴比妥钠购自青岛捷世康生物科技有限公司(批号:191109);HE染色液、ECL试剂盒购自北京索莱宝科技有限公司(批号:G1120、PE0010);SDS-PAGE、RIPA裂解液、PVDF膜均购自上海碧云天生物技术有限公司(批号:P0690、P0013C、FFP32);血肌酐和血尿素氮ELISA试剂盒购自上海吉泰依科赛生物科技有限公司(批号:02161、07531);二喹啉甲酸(bicinchoninic acid,BCA)试剂和牛血清白蛋白(bovine serum albumin,BSA)购自美国Thermo Fisher Scientific有限公司(批号:23225、23209);兔抗鼠NF-κB、NF-κB抑制蛋白(inhibitor of NF-κB,IκB)α、TLR4、NLRP3、血管性血友病因子(von Willebrand factor,vWF)和β-actin单分子抗体及山羊抗兔二抗均购自英国Abcam公司(批号:ab239882、ab18450、ab217274、ab263899、ab6994、ab199553、ab150077)。CX43型电子显微镜购自日本Olympus公司;SAF-680T型酶标仪购自上海巴玖实业有限公司;Experion型电泳仪购自美国Bio-Rad公司。
1.2 模型建立与干预 采用随机数字表法将实验大鼠分为健康对照组、模型组、鼠尾草酸低剂量组(50 mg/kg)、鼠尾草酸中剂量组(100 mg/kg)和鼠尾草酸高剂量组(200 mg/kg),每组10只。除健康对照组外,其他4组大鼠参照文献[7]建立脓毒血症所致AKI模型:给予大鼠经腹腔注射30 mg/kg戊巴比妥钠1.4 mL进行麻醉,体温维持在36.5 ℃~37.5 ℃。麻醉成功后,将大鼠侧卧固定于操作台,腹部脱毛,碘附消毒后铺孔巾,腹部正中线做一2 cm切口,暴露盲肠,在回盲瓣1.5 cm的盲肠末端用4-0线结扎,接着在盲肠远端用18号针头刺穿2次。挤压盲肠,挤出肠腔内少许粪便后将盲肠放入腹腔内,用3-0线缝合腹腔。健康对照组大鼠经腹腔注射30 mg/kg戊巴比妥钠1.4 mL进行麻醉,剖腹探查后再以3-0线缝合腹腔。所有大鼠术后6 h皮下注射1 mL生理盐水改善循环。
给药剂量参考文献[8],以羧甲基纤维素钠溶解鼠尾草酸,配制浓度为50、100、200 mg/kg的鼠尾草酸药液。在盲肠结扎穿刺术后3 d,分别给予鼠尾草酸低、中、高剂量组大鼠灌胃50、100、200 mg/kg的鼠尾草酸药液,给予健康对照组、模型组灌胃等量的生理盐水,1次/d,持续4周。
1.3 样本处理 于末次干预后24 h,采用30 mg/kg戊巴比妥钠腹腔注射麻醉所有大鼠后对其进行腹部解剖,经腹主动脉采血8 mL,常温静置30 min后,4 ℃下3 000 r/min离心15 min收集血清,用于检测肌酐、尿素氮水平。然后处死大鼠,经腹主动脉反复灌注预冷的PBS,当肾脏颜色转为白色后取出左侧肾脏,去除包膜,滤纸吸干后沿着肾门沿冠状面破开,一半放入10%多聚甲醛中固定,常规脱水、浸蜡、包埋及切片,用于观察肾脏病理形态,另一半放入液氮中冻存备用。
1.4 肾脏病理形态学检测 将固定于10%多聚甲醛的大鼠肾脏组织制作成5 μm石蜡切片,将切片烤干后进行脱蜡处理,之后顺序置入不同浓度的酒精中脱水3 min,使用苏木精染色5 min后流水清洗3次,使用盐酸酒精分化处理30 s,充分清洗之后使用0.5%伊红液染色5 min后,在光学显微镜下观察各组大鼠肾组织的病理学变化。采用半定量评分规则评价肾损伤程度[9]:肾小管有无损伤、肾小管上皮细胞有无凋亡及刷毛缘有无减少(无=0分,有=1分),肾小管腔内有无扩张(无=0分,有=1分),肾间质或肾小球毛细血管有无充血情况(无=0分,有=1分),肾间质有无管型(无=0分,有=1分),肾间质有无炎症浸润(无=0分,有=1分)。计算总分0分为无明显病变,评分越高表明肾损伤程度越重。
1.5 ELISA检测血清肌酐和尿素氮水平 根据ELISA说明书,将标准品梯度稀释后,依次加入100 μL样品,孔板覆膜后于37 ℃下进行孵育。孵育1 h后,弃去上清液,依次加入抗体工作液和酶结合液,覆膜后37 ℃孵育30 min。加入显色液,避光孵育10 min,加入终止液,于酶标仪450 nm波长处检测各孔吸光度值。每组设置5个复孔。
1.6 Western blot检测相关蛋白表达量 取冻存于液氮中的大鼠肾脏组织0.5 mg,采用低温匀浆仪匀浆30 s,蛋白裂解混悬裂解液[RAPI ∶苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF) ∶磷酸蛋白酶抑制剂体积比为100 ∶1 ∶1]缓冲液裂解蛋白后提取各样品的总蛋白。采用BCA试剂检测蛋白质的总浓度后,将其变性并储存于-20 ℃。通过SDS-PAGE分离蛋白后将其转移到PVDF膜,采用3% BSA常温封闭膜2 h,TBST洗涤3次,10 min/次。将膜分别放入一抗NF-κB、IκBα、TLR4、NLRP3、vWF和β-actin中(抗体 ∶稀释液=1 ∶1 000),4 ℃孵育过夜。TBST洗涤3次,10 min/次,放入二抗混悬液(二抗 ∶3% BSA=1 ∶4 000)中,室温孵育2 h。TBST洗涤3次,10 min/次,使用ECL孵育1~3 min,放入化学发光成像仪进行显影。通过ImageJ软件分析灰度值,以β-actin为内参计算目的蛋白的相对表达量。
1.7 统计学分析 采用GraphPad Prism 7软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肾脏组织病理形态学的比较 健康对照组大鼠肾脏组织结构清晰,形态完整,无损伤。模型组大鼠肾组织水肿,可见炎性细胞浸润,肾小球皱缩,内皮细胞肿胀,肾小管管腔变窄。与模型组比较,鼠尾草酸低、中、高剂量组大鼠肾脏组织结构和形态趋于完整,炎性细胞浸润减少,存在轻度肾组织水肿现象,肾小球皱缩恢复,内皮细胞结构趋于正常,肾小管管腔变大,肾脏组织病理损伤不同程度减轻,其中高剂量组减轻程度最为明显。模型组肾脏组织病理损伤评分高于健康对照组(P<0.05);与模型组比较,鼠尾草酸低、中、高剂量组肾脏组织病理损伤评分均降低,且呈剂量依赖性(均P<0.05)。见表1。
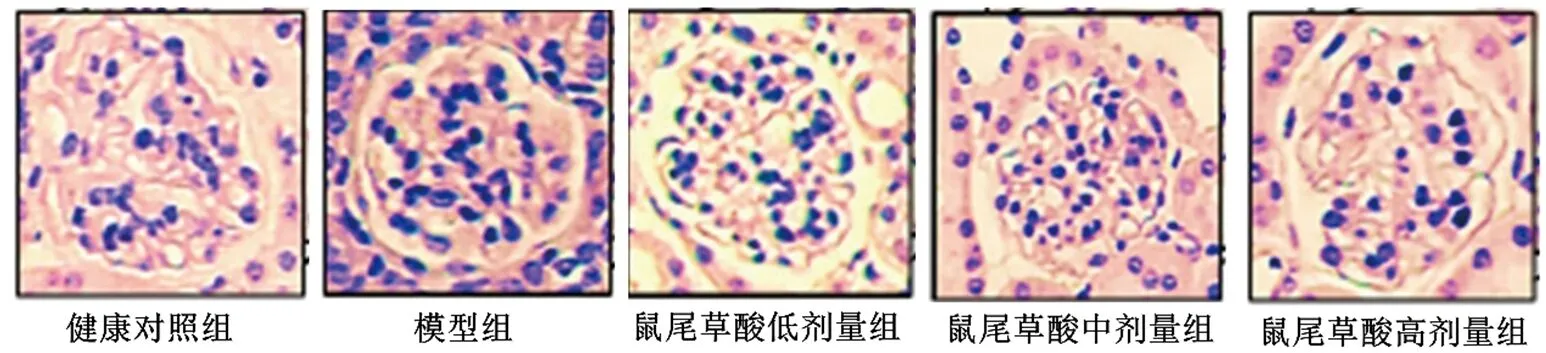
图1 各组大鼠肾脏HE染色结果(×200)
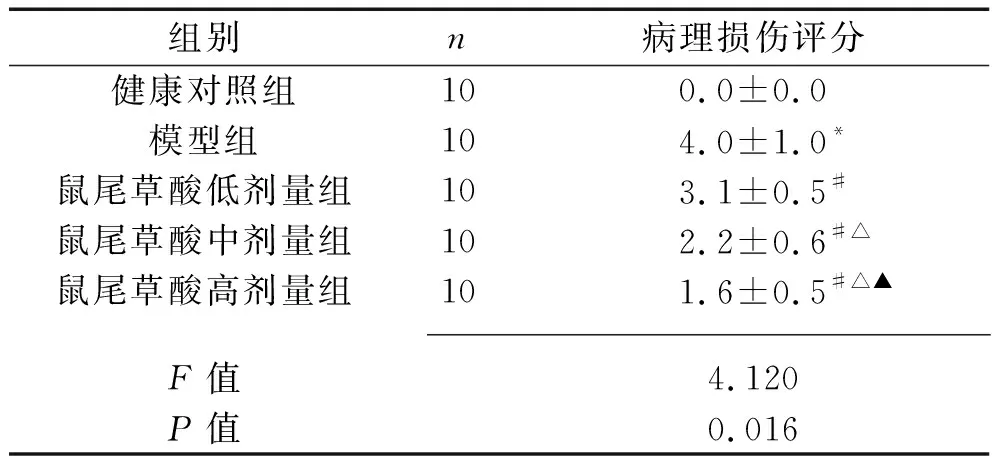
表1 各组大鼠肾脏病理损伤评分的比较(x±s,分)
2.2 各组大鼠肾组织中vWF表达量的比较 与健康对照组比较,模型组大鼠肾组织中vWF表达量增加(P<0.05)。与模型组比较,鼠尾草酸低、中、高剂量组vWF表达量均降低(均P<0.05),但各剂量鼠尾草酸组vWF蛋白表达量差异无统计学意义(均P>0.05),见表2和图2。
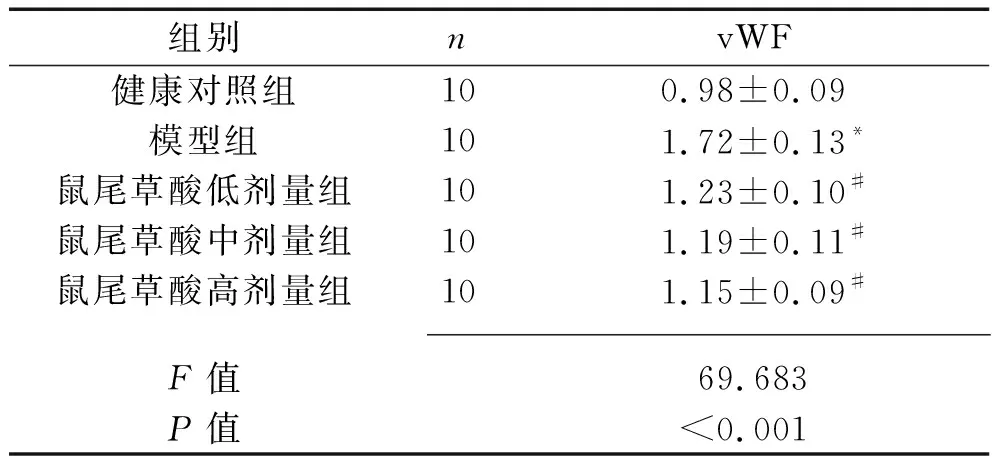
表2 各组大鼠肾组织中vWF蛋白相对表达量的比较(x±s)

图2 各组大鼠肾组织中vWF蛋白的表达情况
2.3 各组大鼠血清肌酐和尿素氮水平的比较 与健康对照组比较,模型组血清肌酐和尿素氮水平增加(P<0.05)。与模型组比较,鼠尾草酸低、中、高剂量组血清肌酐和血尿素氮水平均降低,且呈剂量依赖性(均P<0.05)。见表3。
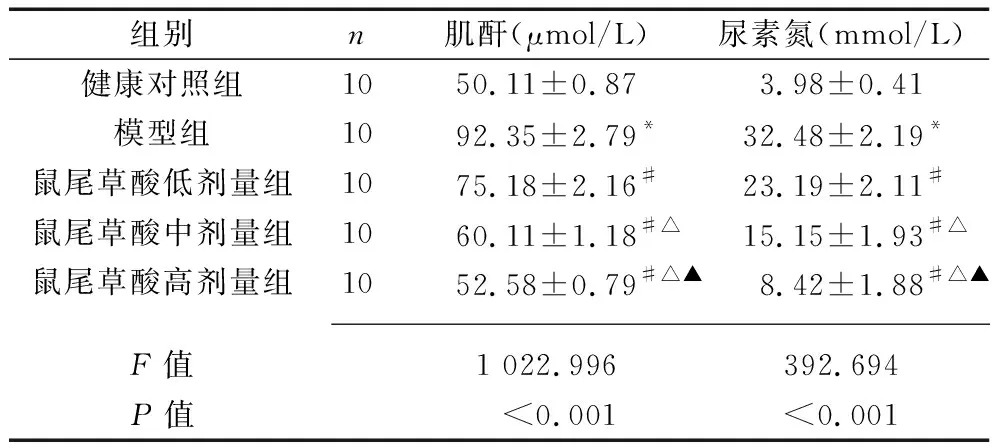
表3 各组大鼠血清肌酐和尿素氮水平的比较(x±s)
2.4 各组大鼠肾组织中TLR4、NF-κB、NLRP3、IκBα蛋白表达量的比较 与健康对照组比较,模型组大鼠肾组织中TLR4、NF-κB和NLRP3蛋白表达量均增加(均P<0.05),IκBα蛋白表达量降低(P<0.05)。与模型组比较,鼠尾草酸低、中、高剂量组TLR4、NF-κB和NLRP3蛋白表达量均降低(均P<0.05),IκBα蛋白表达量均增加(P<0.05),但鼠尾草酸各剂量组的NF-κB、IκBα、TLR4和NLRP3表达量比较差异无统计学意义(均P>0.05),见表4,图3。
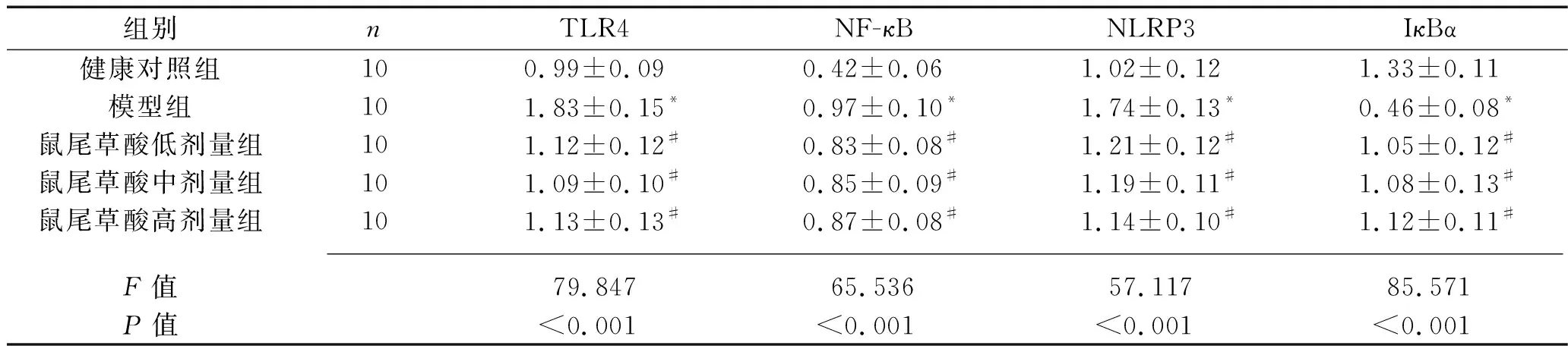
表4 各组大鼠肾组织中TLR4、NF-κB、NLRP3、IκBα蛋白表达量的比较(x±s)
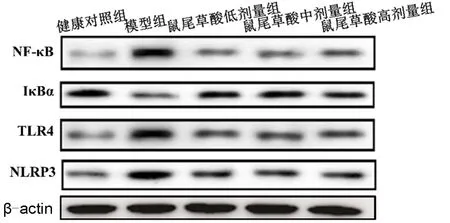
图3 各组大鼠肾组织中TLR4、IκBα、NF-κB、NLRP3蛋白表达情况
3 讨 论
AKI的主要临床症状是尿量减少、肾小球滤过率降低、血清肌酐和尿素氮水平增加、肾小管上皮损伤,在短时间内可诱发包括肾脏等多器官功能衰竭[10]。AKI病情发展迅速,病死率高,预后差[11]。脓毒血症是诱发AKI的主要原因之一[12]。目前认为脓毒血症引起AKI的主要因素是炎性介质释放增加、凝血功能异常、肾缺血再灌注、内毒素释放和细胞坏死,而血管内皮细胞的活化是脓毒血症致AKI发生的重要血液动力学因素,主要机制是内皮细胞受损、血管扩张因子减少、血管内壁结构完整性被破坏导致肾微循环功能障碍[13]。
盲肠结扎穿孔法制备的脓毒血症模型是目前公认的与临床相关性较强的脓毒血症急性肾损伤模型。本研究根据相关文献[7]采用盲肠结扎穿孔法制备脓毒血症模型,结果显示,与健康对照组比较,模型组大鼠肾组织水肿,可见炎性细胞浸润,肾小球皱缩,内皮细胞肿胀,肾小管管腔变窄。血清肌酐和尿素氮水平明显增加,说明模型组大鼠的肾功能受损。vWF在止血和血栓形成过程中有重要作用,血管内皮细胞损伤后,机体产生大量vWF,形成微血栓,导致微循环障碍[14]。因此,vWF可作为血管内皮细胞损伤的标志物。本研究结果显示,与健康对照组比较,模型组大鼠肾组织中vWF蛋白表达量增加(P<0.05),与以往研究结果[15]相似,上述结果说明本研究的脓毒血症所致AKI大鼠模型构建成功。
鼠尾草酸是酚型二萜类化合物,是迷迭香的强氧化剂[16]。研究表明,鼠尾草酸可降低庆大霉素诱导的AKI大鼠血清中肌酐和尿素氮水平,改善肾脏损伤[8]。此外,鼠尾草酸还可减轻顺铂诱导的大鼠肾脏损伤[17]。但鼠尾草酸对脓毒症所致AKI的影响目前尚不清楚。本研究使用鼠尾草酸干预脓毒血症致AKI大鼠模型,结果显示,鼠尾草酸能减轻脓毒血症致AKI大鼠模型的肾脏损伤,下调其血清肌酐、尿素氮及vWF蛋白的水平,说明鼠尾草酸对脓毒血症致AKI大鼠模型具有积极的治疗作用,可以抑制缺血缺氧引起的内皮细胞损伤,从而发挥保护血管内皮细胞的作用。本研究结果还显示,鼠尾草酸对脓毒血症致AKI大鼠模型肾组织损伤及血清肌酐、尿素氮水平的改善作用具有剂量依赖性,高剂量鼠尾草酸的干预效果更明显。而随着鼠尾草酸剂量的增加,脓毒血症致AKI大鼠模型肾脏组织中的vWF蛋白表达量降低,但各剂量间差异无统计学意义(P>0.05),说明低剂量的鼠尾草酸即可有效减轻脓毒症AKI大鼠肾血管内皮细胞的损伤。这些研究结果为鼠尾草酸保护血管内皮细胞提供了理论依据。
TLR4/NF-κB/NLRP3信号通路是机体调节细胞增殖和凋亡、氧化应激及免疫炎症等的主要信号通路,在AKI的发生、发展过程中具有重要的调控作用[18]。TLR4的激活可促进NF-κB蛋白向细胞核内转移[19]。在正常情况下,细胞质中的NF-κB蛋白二聚体与IκBα结合形成复合物,当IκBα磷酸化失活后,NF-κB被活化并移位至细胞核,诱导NLRP3炎症小体的表达[20]。研究表明,NLRP3在脓毒血症AKI模型中起着非常重要的作用,其通过激活NF-κB信号通路进一步促进炎症反应,加重脏器损伤,可成为治疗肾损伤的新靶点[21]。本研究结果显示,与模型组比较,鼠尾草酸低、中、高剂量组TLR4、NF-κB和NLRP3蛋白表达量均降低(均P<0.05),IκBα蛋白表达量增加(P<0.05),说明鼠尾草酸可以抑制TLR4、NF-κB和NLRP3蛋白的表达,促进IκBα的表达,提示鼠尾草酸可通过阻碍TLR4/NF-κB/NLRP3信号通路的传导,减轻血管内皮损伤,从而保护肾脏功能。但鼠尾草酸各剂量组NF-κB、IκBα、TLR4和NLRP3蛋白表达量差异无统计学意义(均P>0.05),由此可见低剂量鼠尾草酸即可发挥调节TLR4/NF-κB/NLRP3信号通路的作用,但高剂量鼠尾草酸对肾的保护作用更具优势。
综上所述,鼠尾草酸对脓毒血症致AKI大鼠模型具有较好的肾脏保护作用,其主要机制可能与改善血管内皮细胞损伤,以及抑制TLR4/NF-κB/NLRP3信号通路有关。本研究还存在一定不足,后续需深入研究鼠尾草酸干预脓毒血症致AKI的药理机制及相关剂量关系。

